Фотохимические реакции. Радиационно-химические реакции
СОДЕРЖАНИЕ: СОДЕРЖАНИЕ ВВЕДЕНИЕ ….. …. 4 1 РАСЧЁТНЫЕ МЕТОДЫ ПОСТРОЕНИЯ КРИВЫХ ЛИКВИДУСА . 5 1.1Методы расчета .. 5
СОДЕРЖАНИЕ
ВВЕДЕНИЕ…………………………………………………..……………. 4
1 РАСЧЁТНЫЕ МЕТОДЫ ПОСТРОЕНИЯ КРИВЫХ ЛИКВИДУСА …………………………………………………………. 5
1.1Методы расчета …………………………………………………….. 5
1.2Расчет кривых ликвидуса по данным температур и теплот плавления веществ в системе «Ga – Zn»………………………..…. 9
1.3Сравнительный анализ экспериментальных и рассчитанных диаграмм………………………………………………………….….. 12
2 ФОТОХИМИЧЕСКИЕ РЕАКЦИИ………………………………….…13
2.1Общие сведения о фотохимических реакциях……….……………13
2.2 Фотосинтез……………………………………………….………….21
2.3 Люминесценция……………………………………………….…….23
3 Радиационная химия…………….……………………………26
3.1Общие сведения……………………………………………………...26
3.2 Три стадии радиационных процессов ……………………………27
3.3 Дозиметрия ионизирующих излучений…………………………..28
3.4 Радиационная стойкость некоторых материалов……………….. 29
ЗАКЛЮЧЕНИЕ ……………………………………………………………32
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ…………………………33
ВВЕДЕНИЕ
Задачей курсовой работы является расчет кривых ликвидуса по данным температур и теплот плавления веществ в системе «Ga - Zn» методом Шредара – Ле-Шателье и методом Эпстейна – Хоуленда, и по полученным данным построить диаграмму состояния двухкомпонентной системы.
Диаграммы состояния позволяют решать технологические задачи, связанные с производством стекла, керамики и технологии вяжущих материалов.
Фотохимия изучает химические процессы, идущие при воздействии на вещество света или же сопровождающиеся свечением. Фотохимические реакции взникают под влиянием видимого света, инфракрасных и ультрафиолетовых лучей. Данный раздел физической химии имеет большое прикладное значение, так как фотохимические реакции часто встречаются в окружающем нас мире.
1 РАСЧЕТНЫЕ МЕТОДЫ ПОСТРОЕНИЯ КРИВЫХ ЛИКВИДУСА
1.1 Методы расчета
Диаграммы состояния позволяют решать технологические задачи, связанные с производством стекла, керамики и технологии вяжущих материалов, например оценивать плавкость систем, устанавливать температурные интервалы кристаллизации, составы эвтектик, планировать фазовый состав материала и т. д. Экспериментальные данные для построения диаграмм состояния получают с помощью динамического метода кривых нагревания и охлаждения либо статистического метода (метода закалки). Поскольку в ряде случаев экспериментальные данные по системам отсутствуют, а диаграммы состояния не построены, прибегают к расчетным методам.
Относительно простым расчетным методом можно определить температуру ликвидуса оксидных систем и построить их диаграммы состояния, используя законы термодинамики. Для двухкомпонентных диаграмм состояния можно рассчитать температуры ликвидуса, а также температуру и состав эвтектики. Для многокомпонентных систем расчетным методом можно определить минимальную температуру эвтектики, но для этого предварительно вычисляются температуры ликвидуса частных двухкомпонентных систем и устанавливаются их температуры эвтектики. Расчетный метод применим только для систем, в которых между компонентами не образуются химические соединения.
1)Расчет кривых ликвидуса по уравнению Шредера-Ле-Шателье.
В основу расчета кривых ликвидуса двухкомпонентных систем положено уравнение Шредера-Ле-Шателье:

или
T=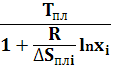 (1.1)
(1.1)
где Т — температура ликвидуса, К;![]()
![]() — температур плавления i-го компонента, К;
— температур плавления i-го компонента, К;
R — универсальная газовая постоянная, равная 8,314 Дж/(моль• К);![]()
![]() энтропия плавления i-го компонента, Дж/(моль-К);
энтропия плавления i-го компонента, Дж/(моль-К);
![]() молярная доля i-го компонента (
молярная доля i-го компонента (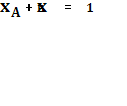 ).
).
Для исследуемых компонентов (например, A и В), если известны величины теплот плавления ![]() , уравнение Шредера - Ле-Шателье будет иметь вид
, уравнение Шредера - Ле-Шателье будет иметь вид


или

 (1.2)
(1.2)
где ![]() и
и ![]() — температуры плавления компонентов А и В, K;
— температуры плавления компонентов А и В, K;
![]() и
и ![]() — теплоты плавления компонентов А и В, кДж/(моль
— теплоты плавления компонентов А и В, кДж/(моль![]() К);
К);
 — молярная доля компонентов А и В;
— молярная доля компонентов А и В;![]()
![]() и
и ![]() — температуры ликвидуса соответственно при добавлении к компоненту А компонента В и наоборот.
— температуры ликвидуса соответственно при добавлении к компоненту А компонента В и наоборот.
По уравнению (1.2) строятся диаграммы плавкости двухкомпонентных систем, близкие к диаграммам состояния, построенным на основании экспериментальных данных.
2)Расчет кривых ликвидуса по уравнению Эпстейна - Хоуленда.
При отсутствии значений используется допущение Эпстейна - Хоуленда, выражающее зависимость между энтропией плавления соединения и числом атомов в молекуле:
 (1.3)
(1.3)
![]() берется со знаком плюс. Подставив выражение (1.3) в формулу (1.2), получим уравнение для расчета бинарных систем:
берется со знаком плюс. Подставив выражение (1.3) в формулу (1.2), получим уравнение для расчета бинарных систем:

 (1.4)
(1.4)
где ![]() и
и ![]() — число атомов в молекулярной формуле компонентов А и В соответственно.
— число атомов в молекулярной формуле компонентов А и В соответственно.
Вычислив  для заданных значений
для заданных значений  , можно рассчитать ориентировочные значения
, можно рассчитать ориентировочные значения ![]() .
.
3)Расчет по методу С. А. Суворова.
Приближенный расчет температур ликвидуса, состава и температуры эвтектики двухкомпонентной системы можно выполнить, используя эмпирические уравнения Суворова, в основе которых лежит учет соотношений между числом атомов и молекулярной формуле обоих компонентов.
Исходными данными для расчета являются температуры плавления чистых компонентов А и В, число атомов в молекулярной формуле компонентов А и В и сумма числа атомов N, равная сумме nА и ![]() .
.
Достаточно надежные данные по составу эвтектики можно получить, используя для расчетов следующие формулы:
1) при 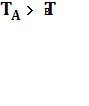 и nА
и nА ![]() (например, в системе MgOMg
(например, в системе MgOMg![]() ):
):
 (1.5)
(1.5)
где 
2) при 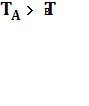 и nА
и nА ![]() (например, Ni
(например, Ni![]() ):
):
 (1.6)
(1.6)
3) при nА =![]() в системе из простых оксидов (например,MgOCaO):
в системе из простых оксидов (например,MgOCaO):
![]() (1.7)
(1.7)
4) при nА =![]() в системе из более сложных соединений (например, Mg
в системе из более сложных соединений (например, Mg![]()
 (1.8)
(1.8)
Для ориентировочных расчетов температуры эвтектики можно использовать уравнение
 ,
,
где К — отношение молярных концентраций компонентов системы в эвтектике, т.е. К = .С большим приближением температуру плавления эвтектики можно вычислить по формуле
.С большим приближением температуру плавления эвтектики можно вычислить по формуле 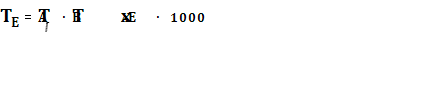 .
.
Вычислив 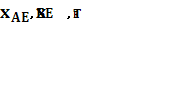 и подставив эти значения в уравнения (1.2), можно рассчитать значения
и подставив эти значения в уравнения (1.2), можно рассчитать значения
![]()
По полученным данным для рассчитывается температура ликвидуса для различных значений . После расчета данные сводятся в таблицу и оформляются графически.[1]
1.2 Расчет кривых ликвидуса по данным температур и теплот плавления веществ в системе «Ga – Zn»
Исходные данные:
![]() ;
;
![]()
![]() ;
;
![]()
1) Расчёт кривых ликвидуса по уравнению Шрёдера – Ле-Шателье, данные приведены в таблице 1.1:
Таблица 1.1 – Расчётные данные
| 0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
|
|
|
148.48 |
175.39 |
196.18 |
214.20 |
230.63 |
246 |
260 |
275.06 |
289.02 |
302.76 |
|
|
240.89 |
299.74 |
349.71 |
396.62 |
442.68 |
489.09 |
536.67 |
586.04 |
637.80 |
692.52 |
Диаграмма, построенная по расчётным данным, приведена на рисунке 1.1.
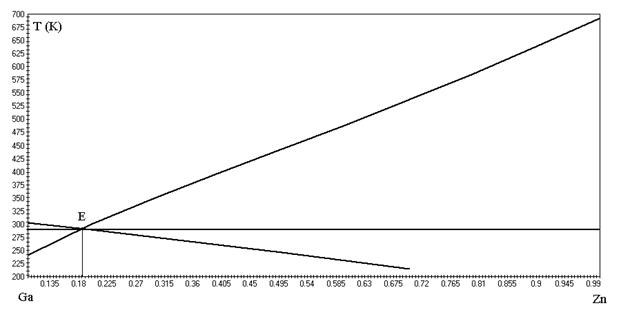
Рисунок 1.1 - Диаграмма состояния системы «Ga – Zn»
Тэвт. =291 К
(Zn 19%, Ga 81%)
2)Расчет кривых ликвидуса по уравнению Эпстейна — Хоуленда, данные приведены в таблице 1.2:
Таблица 1.2
| 0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
|
|
|
70.39 |
140.14 |
137.59 |
157.65 |
179.11 |
200.46 |
222.57 |
248.11 |
275.18 |
302.7 |
|
|
161.05 |
266.36 |
314.79 |
360.69 |
409.78 |
458.63 |
509.21 |
567.65 |
629.57 |
692.53 |
Диаграмма, построенная по расчётным данным, приведена на рисунке 1.2.
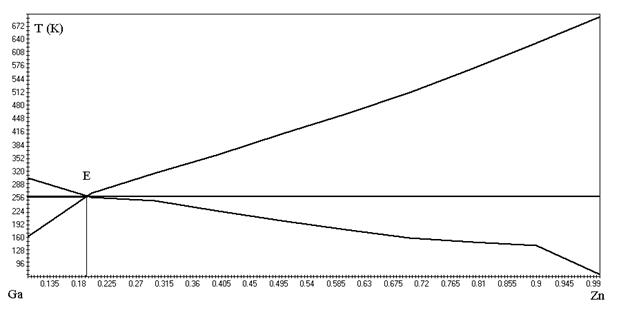
Рисунок 1.2 - Диаграмма состояния системы «Ga – Zn»
Тэвт. =266 К
(Zn 19%, Ga 81%)
1.2 Сравнительный анализ экспериментальных и рассчитаных диаграмм
На рисунке 1.3 представлена диаграмма состояния «Ga – Zn», построенная на основе обобщения данных термического анализа и измерения электросопротивления сплавов.
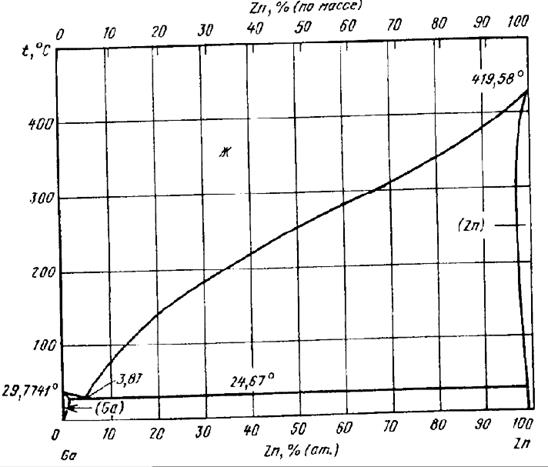
Рисунок 1.3 – Диаграмма состояния «Ga – Zn»,взятая из справочника
На диаграмме, построенной по методу Шредера – Ле-Шателье получили температуру плавления эвтектики равную 291 К и состав (Zn 19%, Ga 81%). На диаграмме, построенной по методу Эпстейна — Хоуленда получили температуру плавления эвтектики равную 266 К и состав (Zn 19%, Ga 81%).
На диаграмме, взятой из справочника температура плавления эвтектики 297,67 К и состав (Zn 3,81%, Ga 96,19%).
Сделав сравнительный анализ определили, что более точным методом определения состава и температуры плавления эвтектики является метод Шредера – Ле-Шателье.
2 ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
2.1 Общие сведения о фотохимических реакциях
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Кинетику элементарных фотохимических процессов можно наблюдать с помощью импульсных методов исследования (импульсная флуориметрия, импульсный фотолиз), позволяющих следить за концентрацией возбужденных молекул и короткоживущих промежуточных продуктов.
Исследуя фотохимические реакции при стационарном облучении, мы определяем квантовый выход реакции, который является вероятностью протекания того или иного процесса. Квантовый выход в свою очередь определяется соотношением элементарных констант скорости различных процессов гибели возбуждённых молекул. Говоря о кинетике и кинетических закономерностях фотохимических реакций, мы будем понимать под ними связь квантового выхода реакции с константами скорости элементарных процессов.
Рассмотрим для некоторых простейших реакций связь кинетических параметров системы с квантовым выходом. Для простоты не будем детализировать возможные пути дезактивации возбуждённых молекул.
Пусть продукт фотохимической реакции образуется из синглетного возбуждённого состояния, как показано на рисунке 2.1.
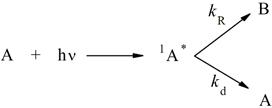
Рисунок 2.1 – Образование продукта фотохимической реакции
где ![]() и
и ![]() - константы скорости фотохимической реакции и дезактивации возбуждённой молекулы.
- константы скорости фотохимической реакции и дезактивации возбуждённой молекулы.
Такая упрощённая схема может быть справедлива, в частности, для реакций фотоизомеризации и фотодиссоциации.
В условиях стационарности получаем выражение для квантового выхода образования продукта B:
(2.1)
где ![]() - время жизни возбуждённых молекул А.
- время жизни возбуждённых молекул А.
В общем случае для реакций, протекающих из синглетного возбуждённого состояния, можно записать, что квантовый выход образования продукта реакции есть отношение константы скорости его образования из возбуждённой молекулы исходного соединения к сумме всех констант скорости процессов превращения синглетных возбуждённых молекул:
(2.2)
Это выражение можно переписать как:
(2.3)
Часто фотохимические реакции протекают из триплетного состояния возбуждённых молекул. Рассмотрим простейшую схему такой реакции, приведённой на рисунке 2.2:
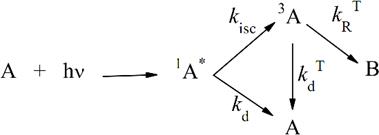
Рисунок 2.2 – Простейшая схема фотохимической реакции, которая протекает из триплетного состояния возбуждённых молекул
где ![]() и
и ![]() – константы скорости интеркомбинационной конверсии в триплетное состояние и дезактивации синглетно - возбуждённых молекул;
– константы скорости интеркомбинационной конверсии в триплетное состояние и дезактивации синглетно - возбуждённых молекул; ![]() и
и ![]() – константы скорости фотохимической реакции образования продукта из триплетного состояния исходного вещества и дезактивации триплетных молекул.
– константы скорости фотохимической реакции образования продукта из триплетного состояния исходного вещества и дезактивации триплетных молекул.
В этом случае квантовый выход реакции равен:
(2.4)
где ![]() - квантовый выход образования триплетных молекул.
- квантовый выход образования триплетных молекул.
При большой длине цепи квантовый выход может оказаться больше единицы. В некоторых случаях он достигает ![]() . В общем случае при малых величинах
. В общем случае при малых величинах ![]() и для цепных реакций величина квантового выхода может быть меньше единицы. В связи с этим вывод о том, что фотохимическая реакция не является цепной при квантовом выходе меньше единицы не верен.
и для цепных реакций величина квантового выхода может быть меньше единицы. В связи с этим вывод о том, что фотохимическая реакция не является цепной при квантовом выходе меньше единицы не верен.
Следует отметить, что для мономолекулярных реакций элементарную константу скорости можно определить по квантовому выходу и времени жизни реагирующего состояния:
(2.5)
Для бимолекулярных реакций связь элементарной константы скорости с квантовым выходом более сложная, поскольку в этом случае квантовый выход зависит от концентрации реагентов. При протекании бимолекулярной реакции возбуждённая молекула взаимодействует с реагентом, давая продукт реакции. В зависимости от того, в каком возбуждённом состоянии протекает реакция, мы можем наблюдать изменение стационарной концентрации возбуждённых молекул по изменению интенсивности флуоресценции возбуждённых синглетных молекул или по изменению концентрации триплетных молекул в присутствии реагента.
Порядок химической реакции определяется по виду уравнения, выражающего зависимость скорости реакции от концентраций реагирующих веществ. Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентраций реагирующих веществ. Реакции разделяются на реакции первого порядка, второго порядка, третьего порядка (реакции более высоких порядков не встречаются). Кроме того, известны так называемые реакции нулевого порядка и некоторые реакции, порядок которых выражается дробным числом.
Количественно скорость химической реакции принято характеризовать изменением концентрации реагирующих веществ в единицу времени. По существу безразлично, концентрацию какого из реагирующих веществ рассматривать. Концентрации исходных веществ будут уменьшаться, а получаемых – возрастать.
Обычно скорость данной химической реакции при постоянных внешних условиях не остаётся постоянной, а изменяется во времени. По мере израсходования исходных веществ, скорость процесса уменьшается. Поэтому численные значения скорости реакций будут различными в зависимости от того, для какого момента или промежутка времени мы рассматриваем изменение концентраций.
Определить истинную скорость реакции в данный момент как производную от концентрации по времени можно следующим образом:
![]() (2.6)
(2.6)
Константа скорости химической реакции численно равна скорости реакции в условиях, когда концентрации каждого из исходных веществ равны единице.
В отношении кинетики химические реакции разделяют или по признаку молекулярности реакции, или по признаку порядка реакции. Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется акт химического превращения. По этому признаку реакции разделяются на одномолекулярные ( или мономолекулярные), двухмолекулярные ( или бимолекулярные) и трёхмолекулярные (или тримолекулярные).
К одномолекулярным реакциям относятся некоторые реакции разложения молекул и внутримолекулярных перегруппировок,например газовая реакция:
Для простых одномолекулярных реакций
![]() (2.7)
(2.7)
К двухмолекулярным реакциям относятся такие, в которых взаимодействие происходит при столкновении двух молекул различного или одинакового вида:
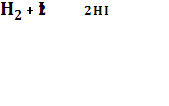
Для простых двухмолекулярных реакций
![]() (2.8)
(2.8)
К трёхмолекулярным реакциям должны быть отнесены реакции, в которых для взаимодействия необходимо одновременное столкновение трёх молекул одного или различных видов. В общем случае уравнение скорости простых трёхмолекулярных реакций имеет вид:
![]() (2.9)
(2.9)
Примером трёхмолекулярной реакции может служить указанная выше реакция

Фотохимия изучает химические процессы, идущие при воздействии на вещество света или же сопровождающиеся свечением. Фотохимические реакции называются фотолизом; они могут совершаться в твёрдых, жидких и газообразных телах. Фотохимические реакции возникают под влиянием видимого света, инфракрасных и ультрафиолетовых лучей с длинами волн от 1000 до 10000. Энергия этих квантов равна от 120 до 1200 кДж/моль или от 1,2 до 12 эв. Поглощение энергии электромагнитных колебаний усиливает вращательное движение молекул или колебания атомов и атомных групп, составляющих молекулу, и может приводить к возбуждению электронов наружных оболочек атомов и появлению активных частиц. Под действием света протекают многие химические процессы.
Эйнштейн и Штарк на основе представления о квантовой природе света и строения молекул установили закон фотохимической эквивалентности, согласно которому каждая молекула, реагирующая под действием света, поглощает один квант радиации, вызывающей реакцию. Из этого закона следует, что в фоточувствительной системе, находящейся под воздействием излучения с частотой , на каждый поглощённый квант излучения h приходится одна активированная молекула. По закону Эйнштейна и Штарка количество энергии РР, поглощаемой одной грамм – молекулой вещества, определяется по уравнению
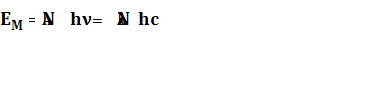 (2.10)
(2.10)
где ![]() - число Авогадро;
- число Авогадро; ![]() - постоянная Планка;
- постоянная Планка; ![]() - частота; с – скорость света;
- частота; с – скорость света; ![]() - длина волны.
- длина волны.
Если в предыдущее уравнение подставить численные значения постоянных ![]() ,
, ![]() и c, то
и c, то
Большими энергией и химической активностью обладают колебания с меньшей длиной волны. В видимом свете наиболее активными являются фиолетовые лучи с =4000 ; для них E=297 кДж/моль. Наименее активна красная часть спектра, где =7500 ; для неё E=159 кДж/моль.
Число молей вещества, которое в единицу времени в единице объёма активируется под действием радиации и может участвовать в первичной фотохимической реакции, в соответствии с первым уравнением можно рассчитать по формуле
![]() (2.11)
(2.11)
где E – световая энергия, которая поглощается единицей объёма системы в единицу времени.
При опытной проверке закона фотохимической эквивалентности Эйнштейна – Штарка часто обнаруживается расхождение между числом частиц, которое активируется под действием радиации (числом поглощённых квантов), и числом прореагировавших молекул.
Сложность общего течения фотохимических реакций зависит от последующих вторичных реакций, идущих без воздействия света, в связи с чем для характеристики фотохимических процессов введено понятие квантового выхода , который равен отношению числа действительно прореагировавших молекул к числу поглощённых квантов.
Таким образом, скорость фотохимической реакции определяется по уравнению
![]() (2.12)
(2.12)
Поглощённую энергию E можно выразить через другие величины. По закону Ламберта – Бера интенсивность I светового потока после прохождения через слой вещества толщиной l равна
(2.13)
где ![]() - начальная интенсивность светового потока радиации; c – концентрация вещества, поглощающего свет; – молекулярный коэффициент поглощения. Отсюда поглощенная энергия E равна
- начальная интенсивность светового потока радиации; c – концентрация вещества, поглощающего свет; – молекулярный коэффициент поглощения. Отсюда поглощенная энергия E равна
(2.14)
Подставляя формулы, получим наиболее общее выражение для скорости фотохимической реакции:
![]() (2.15)
(2.15)
Фотохимические реакции могут быть весьма различными. К ним относятся и реакции фотосинтеза углеводов, осуществляемые растениями под действием солнечного света, и реакции, лежащие в основе фотографического процесса, и явления люминесценции, и выцветание красок и т.д.
Одними из разновидностей фотохимических реакций является фотосинтез и люминесценция.
2.2 Фотосинтез
Фотосинтез, уникальный физико-химический процесс, осуществляемый на Земле всеми зелеными растениями и некоторыми бактериями и обеспечивающий преобразование электромагнитной энергии солнечных лучей в энергию химических связей различных органических соединений. Основа фотосинтеза — последовательная цепь окислительно-восстановительных реакций, в ходе которых осуществляется перенос электронов от донора — восстановителя (вода, водород) к акцептору — окислителю (![]() , ацетат) с образованием восстановленных соединений (углеводов) и выделением
, ацетат) с образованием восстановленных соединений (углеводов) и выделением ![]() , если окисляется вода.
, если окисляется вода.
Интенсивность, или скорость процесса фотосинтеза в растении зависит от ряда внутренних и внешних факторов. Из внутренних факторов наиболее важное значение имеют структура листа и содержание в нем хлорофилла, скорость накопления продуктов фотосинтеза в хлоропластах, влияние ферментов, а также наличие малых концентраций необходимых неорганических веществ. Внешние параметры – это количество и качество света, попадающего на листья, температура окружающей среды, концентрация углекислоты и кислорода в атмосфере вблизи растения.
Скорость фотосинтеза возрастает линейно, или прямо пропорционально увеличению интенсивности света. По мере дальнейшего увеличения интенсивности света нарастание фотосинтеза становится все менее и менее выраженным, и, наконец, прекращается, когда освещенность достигает определенного уровня 10000 люкс. Дальнейшее увеличение интенсивности света уже не влияет на скорость фотосинтеза. Область стабильной скорости фотосинтеза называется областью светонасыщения. Если нужно увеличить скорость фотосинтеза в этой области, следует изменять не интенсивность света, а какие-либо другие факторы. Интенсивность солнечного света, попадающего в ясный летний день на поверхность земли, во многих местах нашей планеты составляет примерно 100000 люкс. Следовательно, растениям, за исключением тех, которые растут в густых лесах и в тени, падающего солнечного света бывает достаточно для насыщения их фотосинтетической активности (энергия квантов, соответствующих крайним участкам видимого диапазона – фиолетового и красного, различается всего лишь в два раза, и все фотоны этого диапазона в принципе способны осуществить запуск фотосинтеза).
В случае низких интенсивностей света скорость фотосинтеза при 15 и 25°С одинакова. Реакции, протекающие при таких интенсивностях света, которые соответствуют области лимитирования света, подобно истинным фотохимическим реакциям, не чувствительны к температурам. Однако при более высоких интенсивностях скорость фотосинтеза при 25°С гораздо выше, чем при 15°С. Следовательно, в области светового насыщения уровень фотосинтеза зависит не только от поглощения фотонов, но и от других факторов. Большинство растений в умеренном климате хорошо функционируют в интервале температур от 10 до 35°С, наиболее благоприятные условия - это температура около 25°С.
В области лимитирования светом скорость фотосинтеза не изменяется при уменьшении концентрации ![]() . Отсюда можно сделать вывод, что
. Отсюда можно сделать вывод, что ![]() участвует непосредственно в фотохимической реакции. В то же время при более высоких интенсивностях освещения, лежащих за пределами области лимитирования, фотосинтез существенно возрастает при увеличении концентрации
участвует непосредственно в фотохимической реакции. В то же время при более высоких интенсивностях освещения, лежащих за пределами области лимитирования, фотосинтез существенно возрастает при увеличении концентрации ![]() . У некоторых зерновых культур фотосинтез линейно возрастал при увеличении концентрации
. У некоторых зерновых культур фотосинтез линейно возрастал при увеличении концентрации ![]() до 0,5%. (эти измерения проводили в кратковременных опытах, поскольку длительное воздействие высоких концентраций
до 0,5%. (эти измерения проводили в кратковременных опытах, поскольку длительное воздействие высоких концентраций ![]() повреждает листы). Высоких значений скорость фотосинтеза достигает при содержании
повреждает листы). Высоких значений скорость фотосинтеза достигает при содержании ![]() около 0,1%. Средняя концентрация углекислоты в атмосфере составляет от 0,03%. Поэтому в обычных условиях растениям не хватает
около 0,1%. Средняя концентрация углекислоты в атмосфере составляет от 0,03%. Поэтому в обычных условиях растениям не хватает ![]() для того, чтобы с максимальной эффективностью использовать попадающий на них солнечный свет. Если помещенное в замкнутый объем растение освещать светом насыщающей интенсивности, то концентрация
для того, чтобы с максимальной эффективностью использовать попадающий на них солнечный свет. Если помещенное в замкнутый объем растение освещать светом насыщающей интенсивности, то концентрация ![]() в объеме воздуха будет постепенно уменьшаться и достигнет постоянного уровня, известного под названием «
в объеме воздуха будет постепенно уменьшаться и достигнет постоянного уровня, известного под названием «![]() компенсационного пункта». В этой точке появление
компенсационного пункта». В этой точке появление ![]() при фотосинтезе уравновешивается выделением
при фотосинтезе уравновешивается выделением ![]() в результате дыхания (темнового и светового). У растений разных видов положения компенсационных пунктов различны.
в результате дыхания (темнового и светового). У растений разных видов положения компенсационных пунктов различны.
2.3 Люминесценция
Люминесценция (от латинского lumen - свет и -escent - суффикс, означающий слабое действие), излучение, представляющее собой избыток над тепловым излучением тела и продолжающееся в течение времени, значительно превышающего период световых колебаний. Первая часть определения отделяет люминесценцию от теплового равновесного излучения и показывает, что понятие люминесценции применимо только к совокупности атомов (молекул), находящихся в состоянии, близком к равновесному, так как при сильном отклонении от равновесного состояния говорить о тепловом излучении или люминесценции не имеет смысла. Тепловое излучение в видимой области спектра заметно только при температуре тела в несколько сотен или тысяч градусов, в то время как люминесцировать оно может при любой температуре. Люминесценция поэтому часто называется холодным свечением. Вторая часть определения (признак длительности) была введена С. И. Вавиловым, чтобы отделить люминесценцию от различных видов рассеяния света, отражения света, параметрического преобразования света, тормозного излучения и Черенкова - Вавилова излучения. От различных видов рассеяния люминесценция отличается тем, что при её присутствии между поглощением и испусканием происходят промежуточные процессы, длительность которых больше периода световой волны. В результате этого при люминесценции теряется корреляция между фазами колебаний поглощённого и излученного света.
Явления люминесценции - северное сияние, свечение некоторых насекомых, минералов, гниющего дерева - были известны с очень давних времён, однако систематически изучать люминесценцию стали с конца 19 века.
Люминесценция можно классифицировать по типу возбуждения, механизму преобразования энергии, временным характеристикам свечения. По виду возбуждения различают фотолюминесценцию (возбуждение светом); радиолюминесценцию (возбуждение проникающей радиацией), частными случаями которой являются рентгенолюминесценция (возбуждение рентгеновскими лучами), катодолюминесценция (возбуждение электронным пучком), ионолюминесценция (возбуждение ускоренными ионами), альфа-люминесценция (возбуждение альфа-частицами) и так далее; электролюминесценцию (возбуждение электрическим полем); триболюминесценцию (возбуждение механическими деформациями); хемилюминесценцию (возбуждение в результате химических реакций); кандолюминесценцию (возбуждение при рекомбинации радикалов на поверхности).
По длительности свечения различают флуоресценцию (быстро затухающую люминесценция) и фосфоресценцию (длительную люминесценция). Деление это условное, так как нельзя указать строго определённой временной границы: она зависит от временного разрешения регистрирующих приборов.
По механизму элементарных процессов различают резонансную, спонтанную, вынужденную и рекомбинационную люминесценции. Элементарный акт люминесценции состоит из поглощения энергии с переходом атома (молекулы) из основного состояния в возбуждённое состояние, безызлучательного перехода на новый уровень и излучательного перехода в основное состояние. В частном случае излучение может происходить при переходе атома (молекулы) с уровня на уровень. В этом случае люминесценцию называют резонансной. Резонансная люминесценция наблюдается чаще всего в атомных парах (Hg, Cd, Na и других), в некоторых простых молекулах, примесных кристаллах.
Яркость люминесценции кристаллов зависит от наличия в них примесей (так называемых активаторов), энергетические уровни которых могут служить уровнями поглощения, промежуточными или излучательными уровнями. Роль этих уровней могут выполнять также энергетические зоны (валентная и проводимости).
3 РАДИАЦИОННАЯ ХИМИЯ
3.1 Общие сведения
Радиационная химия как новая научная дисциплина возникла после открытия рентгеновских лучей В. Рентгеном в 1895 году и радиоактивности А. Беккерелем в 1896 году, которые первыми наблюдали радиационные эффекты в фотопластинках. Первые работы по радиационной химии были выполнены в 1899-1903 годах супругами М. Кюри и П. Кюри. В последующие годы наибольшее число исследований было посвящено радиолизу воды и водных растворов, что обусловлено интересом к биологическим эффектам радиации. Мощный стимул радиационная химия получила в связи с развитием ядерной энергетики и производством ядерного оружия. Надо было изучить радиационную стойкость ядерного топлива, различных конструкционных материалов, химические превращения теплоносителей и замедлителей в ядерных реакторах, а также вещества на всех этапах ядерного топливного цикла, начиная с производства и заканчивая переработкой отработанного ядерного топлива, хранением и захоронением радиоактивных отходов. К настоящему времени изучены основные стадии взаимодействия различных видов ионизирующих излучений с веществом (физическая, физико-химическая, химическая), природа промежуточных активных продуктов радиолиза, измерены тысячи констант скоростей реакций в газовой, жидкой и твердой фазах неорганических и органических соединений, накоплены огромные количественные данные о продуктах радиолиза, закономерностях изменений эксплуатационных свойств различных металлических и неметаллических материалов, которые обобщены в многочисленных монографиях и справочниках.
3.2 Три стадии радиационных процессов
Последовательность процессов в веществе, развивающихся после поглощения энергии излучений, условно принято делить на физическую, физико-химическую и химическую стадии. Физическая стадия происходит за время ![]() –
– ![]() с и включает процессы поглощения, перераспределения и деградации поглощенной энергии. В результате ионизации и возбуждения молекул образуются ионы (М+), возбужденные ионы (М+*), электроны, возбужденные состояния молекул (М*), сверхвозбужденные состояния молекул (М**) с энергией, превышающей первый потенциал ионизации молекул, а также плазмоны, представляющие собой коллективное сверхвозбужденное состояние ансамбля молекул. Молекулярная система находится в энергетически неравновесном состоянии с негомогенным распределением активных частиц. Общий радиационный выход первичных заряженных и возбужденных частиц составляет 7-10 частиц/100 эВ. На физико-химической стадии за время
с и включает процессы поглощения, перераспределения и деградации поглощенной энергии. В результате ионизации и возбуждения молекул образуются ионы (М+), возбужденные ионы (М+*), электроны, возбужденные состояния молекул (М*), сверхвозбужденные состояния молекул (М**) с энергией, превышающей первый потенциал ионизации молекул, а также плазмоны, представляющие собой коллективное сверхвозбужденное состояние ансамбля молекул. Молекулярная система находится в энергетически неравновесном состоянии с негомогенным распределением активных частиц. Общий радиационный выход первичных заряженных и возбужденных частиц составляет 7-10 частиц/100 эВ. На физико-химической стадии за время ![]() -
- ![]() с протекают реакции заряженных и возбужденных частиц, процессы передачи энергии и молекулярная система переходит в состояние теплового равновесия. На химической стадии в шпорах, блобах и коротких треках протекают реакции образовавшихся ионов, электронов, свободных радикалов друг с другом и с молекулами среды. В жидкой фазе за время порядка
с протекают реакции заряженных и возбужденных частиц, процессы передачи энергии и молекулярная система переходит в состояние теплового равновесия. На химической стадии в шпорах, блобах и коротких треках протекают реакции образовавшихся ионов, электронов, свободных радикалов друг с другом и с молекулами среды. В жидкой фазе за время порядка ![]() с происходит выравнивание концентраций продуктов радиолиза по объему. В твердых матрицах сложно разделять негомогенные процессы, протекающие в треках, и гомогенные в объеме. Поэтому радиационно-химические выходы позволяют делать лишь общую оценку эффективности процесса радиолиза. Именно такие количественные данные содержатся в справочниках.
с происходит выравнивание концентраций продуктов радиолиза по объему. В твердых матрицах сложно разделять негомогенные процессы, протекающие в треках, и гомогенные в объеме. Поэтому радиационно-химические выходы позволяют делать лишь общую оценку эффективности процесса радиолиза. Именно такие количественные данные содержатся в справочниках.
3.3 Дозиметрия ионизирующих излучений
Единицей СИ энергии ионизирующего изучения является Джоуль (Дж). В радиационной химии в качестве единицы энергии ионизирующего излучения принимается электрон-вольт (эВ): 1эВ = 1,6 * ![]() Дж.
Дж.
Для характеристики энергии ионизирующих излучений применяют килоэлектрон-вольт (кэВ, 103 эВ) и мегаэлектрон-вольт (МэВ, 106 эВ).
Количество радиационно-химических превращений в любой системе находится в прямой зависимости от величины энергии ионизирующего излучения, поглощенного системой. В радиационной химии часто используют термин радиолиз, понимая под ним любое химическое превращение вещества. Количественной характеристикой радиолиза является радиационно-химический выход (G), который равен числу молекул, активных частиц, образующихся или расходуемых при поглощении энергии ионизирующего излучения в количестве 100 эВ. Другой часто используемый термин - поглощенная доза Д = dE / dm, где dE - энергия, переданная веществу в элементарном объеме; dm - масса этого объема. Единицей СИ измерения поглощенной дозы ионизирующего излучения является Грей (Гр). До недавнего времени наиболее распространенной единицей измерения дозы был рад. Соотношение между Гр, рад и эВ/г следующее:
1 Гр = 100 рад = 6,24 * 1015 эВ/г
Единицей СИ измерения мощности поглощенной дозы ионизирующего излучения является Гр/с.
В радиационной химии, дозиметрии и радиационной технологии диапазон исследуемых и применяемых на практике поглощенных доз весьма широк (![]() -
-![]() Гр). С регистрацией сравнительно малых доз приходится иметь дело специалистам, которые занимаются вопросами индивидуальной дозиметрии, радиационной безопасности и защиты. Измерение указанных доз осуществляется с помощью различных физических и химических методов: ионизационный, колориметрический, химический, люминесцентный, сцинтилляционный, твердотельный, трековый. Наиболее часто дозиметрию проводят химическими методами, которые основаны на определении химических и физико-химических изменений, происходящих в веществе при облучении. Для измерений доз в диапазоне 4-400 Гр широко используют ферросульфатную дозиметрическую систему (дозиметр Фрикке). Мерой поглощенной дозы служит концентрация соли трехвалентного железа, в которую при облучении водного раствора переходит соль двухвалентного железа. Применяются также цериевый, бихроматный, хлорбензольный, щавелевокислотный, глюкозный и другие дозиметры на основе жидкостей. Широко применяют дозиметры на основе полимерных материалов, которые разделяются на пленочные дозиметры на основе прозрачных пластмасс (диапазон 5 102-107 Гр), на основе окрашенных пластмасс (103-105 Гр), радиохромные пленочные дозиметры (102-106 Гр), цветовые визуальные индикаторы дозы (103-3 104 Гр). В последнее время для дозиметрии в широком диапазоне доз (10-105 Гр) используется образование свободных радикалов в аланине, которые измеряются методом электронного парамагнитного резонанса (ЭПР).
Гр). С регистрацией сравнительно малых доз приходится иметь дело специалистам, которые занимаются вопросами индивидуальной дозиметрии, радиационной безопасности и защиты. Измерение указанных доз осуществляется с помощью различных физических и химических методов: ионизационный, колориметрический, химический, люминесцентный, сцинтилляционный, твердотельный, трековый. Наиболее часто дозиметрию проводят химическими методами, которые основаны на определении химических и физико-химических изменений, происходящих в веществе при облучении. Для измерений доз в диапазоне 4-400 Гр широко используют ферросульфатную дозиметрическую систему (дозиметр Фрикке). Мерой поглощенной дозы служит концентрация соли трехвалентного железа, в которую при облучении водного раствора переходит соль двухвалентного железа. Применяются также цериевый, бихроматный, хлорбензольный, щавелевокислотный, глюкозный и другие дозиметры на основе жидкостей. Широко применяют дозиметры на основе полимерных материалов, которые разделяются на пленочные дозиметры на основе прозрачных пластмасс (диапазон 5 102-107 Гр), на основе окрашенных пластмасс (103-105 Гр), радиохромные пленочные дозиметры (102-106 Гр), цветовые визуальные индикаторы дозы (103-3 104 Гр). В последнее время для дозиметрии в широком диапазоне доз (10-105 Гр) используется образование свободных радикалов в аланине, которые измеряются методом электронного парамагнитного резонанса (ЭПР).
3.4 Радиационная стойкость некоторых материалов
Приведем несколько примеров радиационной стойкости материалов, наиболее употребляемых в атомной энергетике. Вода и водные растворы широко используются в активной зоне ядерных реакторов, бассейнах-хранилищах отработанного ядерного топлива, при переработке отработанного ядерного топлива. При радиолизе воды образуются такие продукты, как водород, кислород и перекись водорода. Образование водорода создает проблему предотвращения возможного взрыва смеси водорода и кислорода. В водной среде в условиях действия радиации ускоряются процессы коррозии конструкционных материалов, что может повлиять на ядерную и радиационную безопасность работы атомных электростанций.
В оборудовании атомных электростанций полимерные материалы широко используют в качестве изоляционных и защитных материалов проводов и кабелей, а резины - в качестве уплотнителей. При облучении в полимерах происходят сшивание (образование поперечных межмолекулярных связей), деструкция (разрывы связей в главной цепи и боковых группах), изменение химической ненасыщенности (исчезновение и образование двойных связей различного типа), окисление, газовыделение. При сшивании линейный полимер превращается в пространственный и его молекулярная масса возрастает. При деструкции молекулярная масса полимера уменьшается. Обычно сшивание и деструкция протекают одновременно. Соотношение скоростей этих процессов сильно зависит от химической структуры полимера, его физического строения, условий облучения. Полимеры разделяются на преимущественно сшивающиеся и преимущественно деструктирующие. Радиационно-химические выходы сшивания лежат в интервале 0,02-3, деструкции 0,01-10. Предельные дозы для полимерных электроизоляционных материалов лежат в широких пределах от 0,02-0,2 (для некоторых фторсодержащих полимеров) до 10 (радиационно-сшитый полиэтилен) и 100 МГр (полиимиды).
Поскольку металлы представляют собой остов из положительных ионов, погруженных в электронный газ, то возбуждение и ионизация, произведенные излучением, не оказывают никакого влияния на свойства металлов. Существенное воздействие на свойства металлов оказывают дефекты, возникающие при упругих соударениях. Облучение нейтронами приводит к увеличению объема металла (радиационное распухание), которое может достигать 10-20%. Проходящее при облучении упрочнение металлов и сплавов приводит к снижению их пластичности и в результате к охрупчиванию.
ЗАКЛЮЧЕНИЕ
В задании 1 данной работы произвели расчёт кривых ликвидуса по данным температур и теплот плавления веществ в системе «Ga – Zn» методом Шрёдера – Ле-Шателье и методом Эпстейна – Хоуленда, и по полученным данным построили диаграмму состояния двухкомпонентной системы. Построенные диаграммы сравнили с диаграммами приведёнными в справочнике. Выявили несовпадения теоретической и практической модели опыта. Полученное несоответствие вызвано погрешностью математической модели теоретического построения диаграмм.
В задании 2 рассмотрели фотохимические реакции, а именно: механизм, термодинамику и кинетику. Изучили фотохимические реакции различных порядков и зависимость скорости реакции от различных факторов. Рассмотрели виды фотохимических реакций. Так же изучили радиационно – химические реакции, их принцип и основные свойства. Область применения и основные стадии данных процессов.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Стромберг А. Г., Семченко Д. П. Физическая химия. Под. ред. А. Г. Стромберга. Учеб. пособие для вузов. М., «Высш. школа», 1973.
2 Киреев В. А. Краткий курс физической химии. Изд. 5 – е, стереотипное. – М.: Химия, 1978.
3 Мельников М. Я., Иванов В. Л. Экспериментальные методы химической кинетики. Фотохимия. Учебное пособие. – М.: Изд – во Моск. ун – та, 2004.
4 Пшежецкий С. Я. Механизм и кинетика радиационно – химических реакций. М., Издательство «Химия», 1968 г.