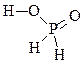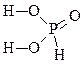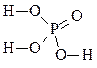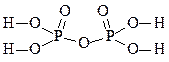Информационно-методическое письмо «Региональная олимпиада по химии 2011: особенности проведения, анализ заданий, результаты, рекомендации»
СОДЕРЖАНИЕ: Забайкальский краевой институт повышения квалификации и профессиональной переподготовки| Министерство образования, науки и молодежной политики Забайкальского края (Минобразования Забайкальского края) Государственное образовательное учреждение дополнительного профессионального образования «Забайкальский краевой институт повышения квалификации и профессиональной переподготовки работников образования» (ЗабКИПКРО) Фрунзе ул., д.1, Чита, 672007 тел\факс 41-54-29 E-mail: zabkipkro@ mail.ru 23.05.2011 № 300 на № __________ от ____________ |
Руководителям МОУО,ОУ |
Информационно-методическое письмо
« Региональная олимпиада по химии 2011: особенности проведения,
анализ заданий, результаты, рекомендации»
Химические олимпиады школьников являются одной из важных форм внеклассной работы по химии. Они дают учащимся возможность проверить свои знания в обстановке соревнований, сопоставить их со знаниями своих сверстников. Олимпиады позволяют выявить учащихся, проявляющих к химии определенный интерес, развить их способности, способствуют осознанному выбору профессий.
Что необходимо школьнику для успешного участия в этом нелегком интеллектуальном состязании?
Учитывая особенности химии как теоретической и экспериментальной науки, можно выделить три составляющие такого успеха:
· химический кругозор, знание свойств достаточно большого круга веществ, способов их получения, областей применения;
· умение решать химические задачи, владение необходимым для этого логическим мышлением и математическим аппаратом;
· практические умения и навыки, знание основных приемов проведения химических реакций, очистки веществ и разделения смесей, идентификации веществ, проведение измерений в ходе химического эксперимента.
Региональный этап олимпиады по химии проводился на базе Читинского государственного университета 1-2 февраля 2011 г. В региональном туре олимпиады принимало участие 74 школьника из 17 районов Забайкальского края и школ города Читы (21 – 9 класс; 27- 10 класс; 26 – 11класс). Наибольших успехов добились среди девятых классов - Намагуруева Ирина Вячеславовна МОУ «Агинская окружная гимназия», п. Агинское, учитель Анандаева А. Б.; Будаева Цындыма Будаевна МОУ «Агинская средняя общеобразовательная школа № 1», п. Агинское, учитель Балданова Т.Ц., занявшие II и III места соответственно. Среди десятых классов - Шмелев Никита Юрьевич МОУ «Средняя общеобразовательная школа № 19», г. Чита, учитель Попыкина О.А.; Рымарева Юлия Михайловна МОУ«Средняя общеобразовательная школа № 30», г. Чита, учитель Данилова Л.А., также занявшие II и III места соответственно.
В одиннадцатых классах, к сожалению, призовых мест не было, но отмечены работы учеников - Елгина Ивана Игоревича, Полякова Александра Вячеславовича (ГОУ школа-интернат «Забайкальский краевой лицей-интернат», г. Чита) учитель Ельцова Э.В. и Ляпунова Александра Константиновича (МОУ «Средняя общеобразовательная школа № 9», г. Чита) учитель Ковалик Е.П.
Региональная олимпиада традиционно проходила в два тура - теоретический и экспериментальный. Длительность каждого тура составляла 5 астрономических часов. Во время теоретического тура учащиеся должны были работать с пятью заданиями из различных разделов химии для каждой возрастной параллели участников. Система оценивания задач теоретического тура строилась, как и в прошлом году, на поэлементном анализе возможного решения задачи. Максимальная оценка за каждую задачу – 20 баллов.
Задание экспериментального тура было построено как мини-научное исследование. В ходе его выполнения учащиеся должны были проявить умения работать с химической посудой, приборами и реактивами, использовать знания о качественном и количественном анализе, предсказывать результаты химических реакций и др. Максимальная оценка за полностью и правильно выполненный эксперимент составила 25 баллов.
Кратко проанализируем выполнение учащимися олимпиадных заданий регионального тура химической олимпиады 2010 – 11 уч.г..
9 класс
Теоретический тур
1. Условия первой задачи представляют собой историческую «выжимку» из работы М.В. Ломоносова, посвященную «крепкой купоросной водке». «Когда в густой крепкой купоросной водке, с которой четыре доли воды смешано, влитую в узкогорлую стклянку, положены будут железные опилки, тогда выходящий пар от свечного пламени загорается… Иногда случается, что загоревшийся пар стклянку с великим треском разрывает» (М. В. Ломоносов, Полное собрание сочинений, – М.: 1953, т. 1, стр. 474).
В целом, с задачей большинство учащихся справились, у них не возникло проблем с инициализацией серной кислоты и с определением массовой доли растворенного вещества. Не все правильно привели уравнения реакций, которые могут протекать при взаимодействии железных опилок с раствором «купоросной водки» в зависимости от ее концентрации. А у многих вызвало затруднение определение соотношения объёмов разбавленного раствора «купоросной водки» и «выходящего пара» при нормальных условиях.
2. Вторая задача олимпиады посвящена качественным реакциям. Ребятам предлагалось определить по предложенной схеме, что представляют собой зашифрованные соединения.
|
|
AgNO3 |
Pb(NO3 )2 |
Hg(NO3 )2 |
| KX1 |
жёлтый осадок |
жёлтый осадок |
красно-оранжевый осадок |
| KX2 |
белый осадок |
белый осадок |
изменений нет |
| KX3 |
изменений нет |
белый осадок |
изменений нет |
| KX4 |
светло-жёлтый осадок |
светло-жёлтый осадок |
белый осадок |
Большинство школьников (70%) определили, что зашифрованные соединения представляют собой галогены. Кроме того, ими правильно приводились уравнения взаимодействия бинарных солей элементов X1, X2, X3 и X4 с нитратами серебра, свинца и ртути. Малое количество учащихся написали уравнения взаимодействия твёрдых бинарных солей калия элементов X1, X2, X3 и X4 с концентрированной серной кислотой, в особенности, с KI:
2KI + 3H2 SO4 2KHSO4 + I2 + SO2 + 2H2 O
6KI + 7H2 SO4 6KHSO4 + 3I2 + S + 4H2 O
8KI + 9H2 SO4 8KHSO4 + 4I2 + H2 S + 4H2 O
3 . В третьей задаче нужно было определить вещество Х , которое образует большое количество кислородсодержащих кислот. Не все заполнили правильно пропуски в предложенной таблице.
| Кислота |
Формула кислоты |
Название |
Основность |
Степень |
|
| молекулярная |
графическая (структурная) |
||||
| 1 |
Н3 PO2 |
|
Фосфорноватистая кислота |
1 |
+1 |
| 2 |
Н3 PO3 |
|
Фосфористая кислота |
2 |
+3 |
| 3 |
Н3 PO4 |
|
Фосфорная кислота |
3 |
+5 |
| 4 |
Н4 P2 O7 |
|
Пирофосфорная кислота |
4 |
+5 |
Нужно обратить внимание, что особые проблемы возникли с написанием структурных формул кислот и названием кислот, в особенности пирофосфорной. По – прежнему, вызывает затруднение написание окислительно-восстановительных реакций.
4. Четвертая задача представляет собой, так называемую задачу головоломку, решаемую на основе установления логических связей между описанными веществами и превращениями (Никифорова Е. И. Подготовка учащихся к химической олимпиаде. Методические рекомендации в помощь учителю химии. - Чита, ЗабКИПКРО, 2010. - 91 с.)
Газы, широко применяющиеся в медицине, в том числе в качестве компонента смеси для анестезии, а так же для наркоза, большинство учащихся определили верно. Ни один из учеников не представил уравнения с кислородом:
5O2 + P4 = P4 O10
O2 + PtF6 = [O2 ][PtF6 ]
10N2 O + P4 = P4 O10 + 10N2
5N2 O + 2P = P2 O5 + 5N2
5N2 O + 2KMnO4 + 3H2 SO4 = 10NO + 2MnSO4 + K2 SO4 +3H2 O
5 . К пятой задаче теоретического тура практически никто не преступал. Задача связана с определением молярной массы гемоглобина при условии, что раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7,52·10–3 атм при 25 °C. Для определения теплового эффекта реакции связывания кислорода с гемоглобином 100 мл водного раствора, содержащего 5,00 г дезоксигенированного гемоглобина, насыщали кислородом в теплоизолированном сосуде. Таким образом нужно было рассчитать тепловой эффект реакции на моль кислорода, учитывая, что 1 моль гемоглобина способен присоединить 4 моль кислорода и определить повысилась или понизилась температура раствора, если после полного насыщения гемоглобина кислородом температура раствора изменилась на 0,031 °C.
Данная задача оказалась самой трудной, поэтому стоит обратить на такие задачи пристальное внимание и усилить подготовку по данному разделу, посвященному термохимическим уравнениям, расчету тепловых эффектов и т.п.
10 класс
Теоретический тур
1. Первая задача для десятого класса, так же как и в девятом классе имеет историческую составляющую. К ней приступили практически все ученики, максимальный балл, набранный за ее решение, составил 8 баллов.
В целом, задача нетрудная, некоторые сложности в решении связаны с приведением правильных уравнений ядерных реакций образования изотопа 14 С в атмосфере и его радиоактивного распада, а так же расчетом во сколько раз уменьшается содержание 14 С в изолированном образце горной породы за 28500 лет.
2. Вторая задача вызвала определенные трудности, к ней либо не приступали, либо заработали всего от 1,5 до 2 баллов. Средний балл составил всего 0,4. В задаче нужно было определить состав пирофорного нанопорошка, но идентификация веществ по описанию превращений давалась большим трудом.
3 . Третья задача довольно интересна. В качестве помощи в тексте задачи предложена сводная таблица описанных в задаче действий.
| Реакция |
Мольное соотношение газов |
Плотность газовой смеси по водороду |
Объём раствора KOH ( = 1,092 г/мл, = 10 %), пошедший на полное поглощение газовой смеси (t = 40 °C) |
||
| A |
B |
C |
|||
| 1 |
1 |
– |
– |
33,75 |
20,51 мл |
| 2 |
– |
1 |
– |
35,50 |
184,62 мл |
| 3 |
2 |
– |
1 |
29,83 |
61,53 мл |
Нужно было расшифровать формулы газов А , B , C и подтвердить ответ расчётами, привести реакции искомых веществ с требуемыми веществами и т.д.
К задаче приступили практически все ученики, средний балл за задачу составил 4,5 балла.
4 . Данная задача из раздела органической химии с элементами физической и неорганической химии. Можно отметить, что некоторые затруднения с ответами вызвал вопрос насколько изомер пентадиен-1,3, содержащий сопряжённую систему двойных связей, стабильнее, чем изомер пентадиен-1,4 c изолированными двойными связями. Затруднения также вызвала расшифровка, приведенной схемы превращений.
Пентадиен-1,3, и пентадиен-1,4 можно получить из пиперидина, используя превращения, показанные на приведённой ниже схеме. Именно таким путём Гофман впервые установил строение пиперидина.
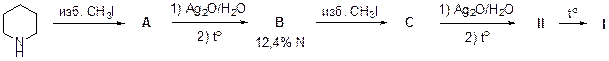
5 . Пятая задача принесла мало баллов ученикам десятых классов. Большая часть школьников получили 0 баллов, хотя практически все попробовали её решать. Задача посвящена определению неизвестного минерала по описанию его свойств, внешнего вида и представленным массовым долям элементов в его составе. Кроме того, задача требует знания элементов термохимии, а результаты показывают пробелы в знаниях в данной области у школьников.
11 класс
Теоретический тур
Все пять задач теоретического тура в одиннадцатом классе не остались без внимания школьников, ученики потратили все время, выделяемое для проведения этого этапа. Первая задача была точно такой же, как и задача, номер два для десятых классов. Если сравнить результаты, то ученики одиннадцатых классов справились чуть лучше: большее число учащихся к ней приступило и средний балл составил уже 1, а не 0,4 как в десятых классах.
2.
Условия второй задачи основаны на реальных исследованиях количественного содержания в водах мирового океана урана в виде уранил-иона ![]() . В 2010 году американские учёные предложили использовать для этого 2,6-терфенилкарбоксилат ион, который селективно координирует уранил-ион, образуя устойчивый, малорастворимый в воде комплекс. Объёмные фенильные группы закрывают уранил-ион в виде капсулы, таким образом, вытесняя воду из внутренней сферы и усиливая прочность комплекса:
. В 2010 году американские учёные предложили использовать для этого 2,6-терфенилкарбоксилат ион, который селективно координирует уранил-ион, образуя устойчивый, малорастворимый в воде комплекс. Объёмные фенильные группы закрывают уранил-ион в виде капсулы, таким образом, вытесняя воду из внутренней сферы и усиливая прочность комплекса:
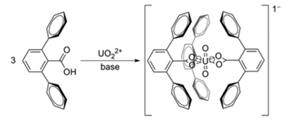
Составители задач для олимпиад подхватили эту интересную и актуальную тематику и предложили написать сокращённые ионные уравнения реакций образования комплекса и его разрушения раствором азотной кислоты, а также рассчитать молярную концентрацию уранил-иона в морской воде. Кроме того, ученикам предлагалось оценить через сколько лет следует ожидать истощения месторождений урановой руды, а также, предполагая, что после этого уран будет добываться из океана, и что скорость потребления останется неизменной, оценить количество воды, которое нужно будет перерабатывать в мире ежедневно, чтобы удовлетворить потребность в уране. Таким образом, был осуществлен прием синтеза химической и экономической составляющих. Данная задача оказалась одной из сложных, мало кто представил логичное и обоснованное решение.
3 . В третьей задаче предлагалось определить зашифрованное органическое вещество по описанию физических и химических свойств. Анализ олимпиадных задач этого года по всем классам показал, что именно этот тип задач в меньшей степени вызывает затруднения у учащихся.
4 . В четвертой задаче нужно было по предложенной схеме определить некоторые вещества и указать реагенты для проведения химических реакций при превращении веществ D , F и H в А , а Е , G и I в В .
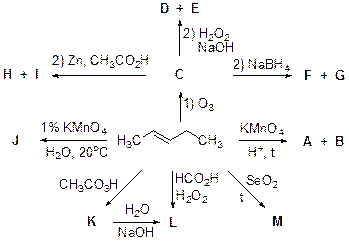
Из 26 учеников предоставили решение всего шесть учеников, набрав при этом не высокие баллы (от 0, 5 до 3). Проблемы были как с указанием реагентов, так и с расстановкой коэффициентов в уравнениях реакций.
5 .В пятой задаче был использован известный всем принцип Ле-Шателье, и, казалось, что данная задача не должна вызывать какие-либо сложности. Тем не менее, ученики, написав выражение для константы равновесия Kx , затруднялись написать, в какую сторону сместится равновесие при изменении условий реакции.
Экспериментальный тур олимпиады прошел как обычно более успешно. Ребята с удовольствием демонстрировали практические навыки, большая часть учеников предоставляла правильные схемы эксперимента и допускалась к выполнению опытов. Поэтому традиционно данный этап соревнований принес большее количество баллов в общую «копилку» рейтинга.
Заканчивается учебный год. В следующем году будет новая химическая олимпиада, новые задания, решать которые совсем не просто. С начала следующего учебного года следует начинать подготовку к олимпиадам. Уже в сентябре предметно – методическим комиссиям предстоит готовить тексты для школьного этапа химической олимпиады, поэтому ниже предлагаем несколько олимпиадных заданий с решениями (были подготовлены центральной предметной методической комиссией: Лунин В.В, Тюльков И.А., Архангельская О.В. Методические рекомендации по разработке заданий для школьного и муниципального этапов всероссийской олимпиады школьников по химии в 2010/2011 учебном году).
Примеры заданий.
Задача 1.
При пропускании паров воды через оксид кальция масса реакционной смеси увеличилась на 9,65%. Определите процентный состав полученной твердой смеси.
РЕШЕНИЕ.
1. Запишем уравнения химической реакции:
СаO + H2 O = Са(OH)2
2. На основании анализа условия задачи следует, что:
· конечная смесь является твердым веществом и состоит из оксида и гидроксида кальция;
· вода прореагировала полностью и прирост массы реакционной смеси равен массе прореагировавшей воды.
3. Проведем расчеты:
пусть исходное количество оксида кальция равна х моль, тогда:
m( H2 Oпрореаг. ) = (40+16)х 0,0965= 5,4х,
![]() ( H2
Oпрореаг..
) = 5,4х/18 = 0,3х =
( H2
Oпрореаг..
) = 5,4х/18 = 0,3х = ![]() ( СаO прореаг..
) =
( СаO прореаг..
) =![]() ( Са(OH)2, обрзов..
)
( Са(OH)2, обрзов..
)
m(СаO оставш. ) = 0,7х (40+16) = 39,2х,
m(Са(OH)2, обрзов. ) = (40+32+2). 0,3х = 22,2х,
m(смеси) = 61,4х
w(СаO) = 3920х/ 61,4х = 63,84% w(Са(OH)2 ) = 2220х/61,4х = 36,16%
Ответ: w(СаO) = 63,84% w(Са(OH)2 ) = 36,16%
Задача 2.
После растворения смеси хлорида бария и сульфата натрия в воде, масса образовавшегося осадка оказалась в 3 раза меньше массы солей в фильтрате. Определите массовые доли солей в исходной смеси, если известно, что в фильтрате отсутствуют хлорид ионы
РЕШЕНИЕ:
| Молярная масса |
142 |
208 |
233 |
58,5 |
| Na2 SO4 + |
BaCl2 |
= BaSO4 |
+ 2NaCl |
|
| Было, моль |
х |
y |
0 |
0 |
| Прореагировало, моль |
y |
y |
||
| Осталось/Образовалось, моль |
x–y |
0 |
y |
2y |
233. 3y = 142x–142y + 117y;
699y = 142x – 142y + 117y
724y = 142x
y =0,2x
mисх.см. = 142x + 0,2. 208x = 142x + 41,6x = 183,6x
![]() (Na2
SO4
) = 14200x/183,6x = 77,3%
(BaCl2
) = 4160x /183,6x = 22,7%
(Na2
SO4
) = 14200x/183,6x = 77,3%
(BaCl2
) = 4160x /183,6x = 22,7%
Ответ: (Na2 SO4 ) = 77,3% (BaCl2 ) = 22,7%
*В журнале «Химия в школе», №5, 2008 г. Е.И. Миренковой дано очень изящное альтернативное решение этой задачи.
Задача 3.
Задача на распознавание веществ, находящихся в пронумерованных пробирках. Такого типа задачи имеются в комплекте Всероссийской олимпиады школьников по химии за любой год. Однако оригинальность предлагаемой задачи заключается в том, что для ее решения требуется мысленный эксперимент. В решениях таких задач обычно представлена таблица, иллюстрирующая возможность взаимодействия между веществами попарно, уравнения химических реакций и, иногда, отдельные комментарии. Для 3-4 этапов такое схематическое решение вполне достаточно. Однако на школьном и районном этапах, особенно для восьмиклассников, необходимо разобрать полный, подробный ход решения с логическими умозаключениями и выводами. Это полезно, как для педагога-наставника, так и для самостоятельной работы школьника.
В четырёх пронумерованных пробирках находятся растворы хлорида бария, карбоната натрия, сульфата калия и хлороводородная кислота. В вашем распоряжении имеется необходимое число пустых пробирок. Не пользуясь никакими другими реактивами, определите содержимое каждой из пробирок.
Решение
Проведём мысленный эксперимент. Рассмотрим содержимое пробирок. Вещества визуально неразличимы – это бесцветные прозрачные растворы.
Составим таблицу возможных попарных взаимодействий веществ (табл. 2), в результате которых мы будем (или не будем) наблюдать определённые признаки реакций .
Таблица 2
| BaCl2 |
Na2 CO3 |
K2 SO4 |
HCl |
|
| BaCl2 |
выпадает осадок белого цвета |
выпадает осадок белого цвета |
без изменений |
|
| Na2 CO3 |
выпадает осадок белого цвета |
Без изменений |
выделяется газ без цвета и запаха |
|
| K2 SO4 |
выпадает осадок белого цвета |
Без изменений |
Без изменений |
|
| HCl |
Без изменений |
Выделяется газ без цвета и запаха |
Без изменений |
Уравнения реакций:
BaCl2 + Na2 CO3 = BaCO3 + 2NaCl; (1)
BaCl2 + K2 SO4 = BaSO4 + 2KCl; (2)
Na2 CO3 + 2HCl = 2NaCl + CO2 + H2 O. (3)
Возьмём пробирку 1. Из остальных пробирок отольём примерно по 2 мл растворов в три пустые пробирки и добавим в каждую из них по 5–6 капель раствора из пробирки 1.
Рассмотрим 4 возможных варианта (см. табл. 2). Для наглядности в каждом случае приведены схемы распознавания веществ. В решении изображать схему не обязательно.
Вариант 1
В двух пробирках выпали белые осадки, в третьей признаков реакции не наблюдается (первая строка табл. 2). Это означает, что в пробирке 1 находится хлорид бария. В этом случае в той из пробирок, где нет признаков химической реакции, находится соляная кислота. Осадки в двух пробирках представляют собой карбонат и сульфат бария. Прильём в пробирки с осадками по несколько капель кислоты. Там, где осадок растворяется с выделением газа, изначально находился раствор карбоната натрия, там имели место реакции (1) и (3). В пробирке, где при прибавлении кислоты осадок не растворяется (BaSO4 не растворяется в кислотах), изначально находился сульфат калия и протекала только реакция (2).
Вариант 2
При добавлении нескольких капель из пробирки 1 в одной из трёх пробирок выпал белый осадок, в другой выделился газ, в третьей нет признаков реакции (вторая строка табл. 2). В этом случае в пробирке 1 находился карбонат натрия. Там, где выпал белый осадок, находился хлорид бария, где выделился газ – соляная кислота, где не было признаков реакции – сульфат калия.
Вариант 3
При добавлении нескольких капель из пробирки 1 в одной из трёх пробирок выпал белый осадок, в двух других нет признаков реакции (третья строка табл. 2). В этом случае в пробирке 1 находился сульфат калия. Там, где выпал белый осадок, находился хлорид бария. В две пробирки с исходными растворами, которые не прореагировали с сульфатом калия, добавляем хлорид бария. Выпадение белого осадка (BaCO3 ) указывает, что первоначально в этой пробирке находился карбонат натрия. В пробирке, где вновь нет признаков реакции, находился раствор кислоты.
Вариант 4
При добавлении нескольких капель из пробирки 1 в одной из трёх пробирок выделяется газ, в двух других нет признаков реакции (четвертая строка табл. 2). В этом случае в пробирке 1 находилась хлороводородная кислота. Там, где выделился газ, находился карбонат натрия. В две пробирки с исходными растворами, которые не прореагировали с кислотой, добавляем карбонат натрия. Выпадение белого осадка (BaCO3 ) указывает, что первоначально в этой пробирке был хлорид бария. В пробирке, где вновь нет признаков реакции, первоначально находился раствор сульфата калия.
Задачу при необходимости можно упростить, взяв два или три вещества, и усложнить, предложив более четырёх веществ.
Трудности при решении задач часто связаны с некими стереотипами, которые сложились у школьников в процессе изучения химии. Например, учащиеся привыкают, что в условиях задач на газовые законы даны объёмные доли веществ, а в задачах на нахождение молекулярной формулы – массовые. Однако автор задачи имеет полное право использовать в любой задаче объёмные, массовые или мольные доли компонентов смесей.
Задача 4.
Трудности при решении задачи часто связаны с некими стереотипами, которые сложились у школьника в процессе изучения химии. Например, учащиеся привыкли, что при решении задач на газовые законы, в условии задач даны объемные проценты, а в задачах на нахождение молекулярной формулы – массовые. Однако автор задачи имеет полное право давать в любой задаче как объемные, так и массовые или мольные проценты.
Массовые доли азота и оксида углерода (II) в трехкомпонентной газовой смеси равны, соответственно, 10,00% и 15,00%. Объемная доля третьего компонента равна 72,41%. Определите неизвестный компонент газовой смеси и среднюю молярную массу смеси (Mср. ).
РЕШЕНИЕ:
Примем массу смеси за 100 г. Тогда в ней содержится 10/28 + 15/28 = (10+15)/28 = 0,893 моль N2 и CO, и (100-25)/ Мх =75/ Мх моль третьего компонента.
Из закона Авогадро следует, что объемные проценты компонентов газовой смеси (![]() ) равны мольным ()
) равны мольным ()
Внесем дополнительные обозначения: ![]() х
–объемная доля третьего компонента, х
– мольная доля третьего компонента, см.
– число моль газов в смеси, х
– число моль третьего компонента.
х
–объемная доля третьего компонента, х
– мольная доля третьего компонента, см.
– число моль газов в смеси, х
– число моль третьего компонента.
![]() х
= х
= х
/см.
=
х
= х
= х
/см.
= ![]() , решая это уравнение , получаем
, решая это уравнение , получаем
М х = 32 г/моль. Такую молярную массу имеет кислород (О2 ) или гидразин (N2 H4 ).
![]()
Ответ: Третий компонент газовой смеси – кислород или гидразин. Mср. =30,89моль/л.
Задача 5.
В газовой смеси содержится метан (CH4 =) ( 40%, w = 48,5%), оксид азота (II =) ( 20%) и некий третий компонент.
Проведя расчеты, установите название третьего компонента газовой смеси.
РЕШЕНИЕ:
Для удобства расчетов составим таблицу:
| Газ |
М, г/моль |
V, л (на 100 л смеси) |
m (газа), г |
|
| СН4 |
16 |
0,40 |
40 |
40/22,4 16 = 28,57 |
| NO |
30 |
0,20 |
20 |
20/22,4 30 = 26,78 |
| Х |
х |
0,40 |
40 |
40/22,4 х = 1,79х |
Т.к. известна массовая доля метана в смеси, то
![]() ,
,
откуда х = 2 г/моль.
Газом с молярной массой 2 г/моль может быть только водород Н2 .
Ответ: водород.
Задача 6.
К 158,19 мл 10% раствора нитрата алюминия (плотностью 1,081г/мл) прилили 210,80 мл 3,3% раствора едкого натра (плотностью 1,035г/мл). Определите % концентрацию веществ в полученном растворе.
РЕШЕНИЕ:
![]()
![]()
Для полного осаждения алюминия в виде гидроксида:
Al(NO3 )3 + 3NaOH = Al(OH)3 + 3NaNO3
Потребуется 0,05. 3 = 0,15 моль NaOH. Поскольку гидроксида натрия больше 0,15 моль, то осадок начнет растворяться, до тех пор, пока не израсходуется вся щелочь:
| Молярная масса |
78 |
40 |
118 |
| Al(OH)3 + |
NaOH |
= NaAl(OH)4 |
|
| Было, моль |
0,05 |
0,03 |
|
| Прореагировало, моль |
0,03 |
0,03 |
|
| Осталось/Образовалось, моль |
0,02 |
0 |
0,03 |
В результате двух реакций:
1. В растворе будет только алюминат натрия, который может быть записан в виде: Na[Al(OH)4 ] , Na[Al(OH)4 (H2 O)2 ] или Na3 [Al(OH)6 ], но никак не в виде NaAlO2 , который образуется только при сплавлении реактивов. В данном решении взята наиболее употребимся формула комплексной соли.
2. Осадок гидроксида алюминия растворится лишь частично и это необходимо будет учесть при определении массы раствора.
m(раствора) = 158,19. 1,081 + 210,80. 1,035 – 0,02. 78 = 387,62 г
w(NaAl(OH)4 ) = m(NaAl(OH)4 )/m(раствора) = 0,03. 118.100/387,62 = 0,91%
Ответ: (NaAl(OH)4 ) = 0,91%
Задача 7.
Очень часто школьники не решают задачи правильно из-за несоблюдения размерности величин при расчетах.
Какова масса 5 мл оксида азота (II) при 25о С и давлении 1,2 атм.?
РЕШЕНИЕ:
Решение этой задачи сводится к элементарным расчетам по уравнению Менделеева-Клайперона: ![]()
Несмотря на важность использования универсальной газовой постоянной при решении различных типов расчетных задач, ее применение вызывает большие затруднения у школьников, абитуриентов, поступающих в ВУЗы и даже у части студентов. Основная трудность заключается в том, что учащиеся не соблюдают соответствия между размерностями газовой постоянной и размерностями физических величин данной конкретной задачи.
Известно, что универсальная газовая постоянная входит в уравнение состояния идеального газа: pV=nRT, где n-число молей газа (n=m/M), а p, V и T - соответственно - давление, объем и абсолютная температура газа. Это уравнение носит еще название уравнения Менделеева-Клапейрона.
Таким образом, для одного моля газа: R=pV/T. Температура в этом уравнении всегда выражается в Кельвинах. Давление же и объем можно выразить в различных единицах. В зависимости от выбора этих единиц, значения R будут иметь то или иное значение . В любом случае R легко рассчитать, используя следующее следствие закона Авогадро: при нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л. (Напомним, что при нормальных условиях Р = 760 мм рт. ст. = 1атм.=.101325 Па и Т = 273К) В системе СИ значение R = 8,31 Дж/моль К. В этом случае объем газа выражается в м , давление в Па и температура в К. Это значение R рассчитывается следующим образом:
![]()
Напомним, что
Па=Н/м2 и Дж = Н. м, отсюда: Па. м3 /(м2 К. моль)=Н м /(К моль) = Дж/(К моль).
Однако R можно выразить и в других единицах, используемых на практике:
![]()
![]()
![]() и т. д.
и т. д.
Если пользоваться принятой в школе величиной R = 8,314 Дж /К. моль = 8,314 Па. м3 /К. моль , то давление, данное в атм. надо перевести в Па, объем в м3 . Но можно вместо двух расчетов произвести один, а именно выразить R в атм.. мл/К. моль:
R = PVМ /T. При 273К и 1 атм. , VМ = 22400 мл.
Тогда R = 1. 22400/273 = 82,05атм. мл/К. моль
MNO = 14 + 16 = 28 (г/моль)
![]()
Ответ: 0,008 г.
Кроме перечисленных типов задач на школьный и муниципальный этапы можно предложить задачи на :
1. приготовление растворов с заданной концентрацией ( w, c);
2. растворимость;
3. цепочки превращений по неорганике (9 класс), органике (10 класс) и комбинированная (11 класс);
4. расчеты по уравнениям химических реакций (с использованием понятий выход продукта, массовая доля примесей, избыток и недостаток);
5. задачи по физической химии (элементарные термохимические расчеты).
Для подготовки к олимпиадам любого уровня можно использовать интернет – ресурсы, которые позволяют найти множество примеров олимпиадных задач с решениями, прочитать интересные факты о веществах и процессах, глубоко изучить сложные теоретические вопросы химии, без знания которых невозможно успешно участвовать в олимпиаде, принять участие в обсуждении актуальных вопросов олимпиадного движения и др.
Интернет-ресурсы
http://lyceum-syz.narod.ru/
http://festival.1september.ru/articles/529470/
http://botaniks.ru/ximiya.php
http://himiavmeste.narod.ru/zadachi1.html
http://chem-solution.narod.ru/example_offline_book_10.html
http://www.alleng.ru/edu/chem2.htm
http://moupschool1.narod.ru/himia.htm
http://www.chem.msu.su/rus/elibrary/zadachi_olimpiad.html
http://www.eidos.ru/olymp/index.htm.
http://works.tarefer.ru/94/100126/index.html.
http://mou22vd.edusite.ru/p77aa1.html.
http://www.himhelp.ru/section23/section5/section37/.
http://techemy.com/sis_tasked/.
http://www.kristallikov.net/page34.html.
http://www.log-in.ru/books/17101/.
http://chemistry.ucoz.org/.
http://chemie.ucoz.ru/index/primery_reshenija_zadach/0-8.
http://gymn22.narod.ru/Systems/Chemist/.
http://www.zomber.ru/chemistry_lec/Index73.php.
http://lib.repetitors.eu/himiya/159-2010-07-16-04-14-33/2033-------9-.
http://www.chem.msu.su/rus/olimp/.
http://olympics.chemport.ru/.
http://olimp.distant.ru/.
http://chem.olymp.mioo.ru/login/index.php.
http://ru.wikipedia.org/wiki/Всероссийская_олимпиада_школьников_по_химии.
http://www.olimpiada.ru/.
http://www.icho39.chem.msu.ru/html/russian/Olympiades/RossChemOlymp.htm.
http://him.1september.ru/2003/40/1.htm.
http://www.muctr.ru/entrant/shag_v_bud.php.
http://chemworld.narod.ru/olimp/index.html.
http://www.olymp74.ru/index.php?razd=0page=eventid=70.
http://chimia24.ucoz.ru/load/15.
http://www.kontren.narod.ru/lttrs/to_Oli.htm.
http://www.school.edu.ru/catalog.asp?cat_ob_no=5ob_no=12699oll.ob_no_to=.
http://maratakm.narod.ru/index.files/tr1.htm.
http://www.chemistry.narod.ru/inform/knigi.htm.
http://papshuli.narod.ru/predmet/Himiya_links.htm.
Литература
1. Бенеш П., Пумпт В., Свободова М., Мансуров Г. Н. 111 вопросов по химии … для всех / Кн. для учащихся. – М.: Просвещение, 1994. – 191 с.
2. Всероссийская химическая олимпиада школьников: кн. для учителя. / П. А. Оржековский, Ю. Н. Медведев, А. В. Чуранов, С. С. Чуранов. Под ред. Лисичкина. – М.: Просвещение, 1996. – 192 с.
3. Дайнеко В. И. Как научить школьников решать задачи по органической химии: кн. для учителя. – М.: Просвещение, 1987. – 160 с.
4. Дмитров Е. Н. Познавательные задачи по органической химии и их решения / Пособие для учителей и учащихся. – Тула, «Арктоус», 1997. – 86 с.
5. Зубович Е.Н., Асадник В.Н. Химия. Решение задач повышенной сложности: Справочное пособие. – Мн.: Книжный дом, 2004. – 224 с.
6. Кузьменко Н. Е., Магдесиева Н. Н. Еремин В. В. Задачи по химии для абитуриентов: Курс повышенной сложности с компьютерным приложением. / Под ред. Кузьменко Н. Е. М.: Просвещение, 1992. – 191 с.
7. Кузьменко Н., Еремин В., Попков В. Химия. Для школьников старших классов и поступающих в вузы: Учебное пособие. – М.: Дрофа, 1997. – 528 с.
8. Лабий Ю. М.. Решение задач по химии с помощью уравнений и неравенств: кн. для учителя. – М.: Просвещение, 1987. – 80 с.
9. Лунин В.В. Химия. Всероссийские олимпиады. Вып.I/ В.В. Лунин, О.В. Архангельская, И.А. Тюльков; под ред. В.В. Лунина. – М.: Просвещение, 2010. – 191 с.
10. Николаенко В. К. Решение задач повышенной сложности по общей и неорганической химии: Пособие для учителя; / Под ред. Г. В. Лисичкина. - Киев: Радяньска школа, 1990. - 160 с.
11. Оржековский П. А., Давыдов В. Н., Титов Н. А. Экспериментальные творческие задания и задачи по неорганической химии: Кн. для учащихся. – М.: АРКТИ, 1998. – 48 с.
12. Свитанько И. В. Нестандартные задачи по химии. – М.: МИРОС, 1995. – 80 с.
13. Слета Л.А., Чёрный А.В., Холин Ю.В. 1001 задача по химии с ответами, указаниями, решениями. – М.: Илекса, 2005. – 368 с.
14. Сорокин В.В., Загорский В.В., Свитанько И.В. Задачи химических олимпиад, изд-во МГУ, 1989. – 256 с.
15. Степин Б.Д. Занимательные задания и эффектные опыты по химии / Б.Д. Степин, Л.Ю. Аликберова. – М.: Дрофа, 2002. – 432 с.
16. Ушкалова В.Н., Иоанидис Н.В. Химия: конкурсные задания и ответы: Пособие для поступающих в Вузы. – М.: Просвещение, 2000. – 224 с.
17. Химия: сборник олимпиадных задач. Школьный и муниципальный этапы: учебно – методическое пособие / Под ред. В.Н. Доронькина. – Ростов н/Д:Легион, 2009.- 253 с.
18. Чмиленко Ф. А., Виниченко И. Г., Чмиленко Т. С. Подготовка к экзамену по химии с контролем на ЭВМ. – М.: Школа – Пресс, 1994. – 144 с.
19. Чуранов С. С. Химические олимпиады в школе. – М.: Просвещение, 1982. – 191 с.
20. Школьные олимпиады: биология, химия, география. 8 – 11 классы / Серия «Здравствуй, школа!». Ростов н/Д: Феникс, 2004. – 192 с.
Проректор Л.К.Портнова
Никифорова Елена Ивановна
(3022)26-35-31
Салогуб Е.В., зам. зав. каф. химии ЧитГУ