«Информационные технологии для обработки люминесцентных изображений биологических объектов»
СОДЕРЖАНИЕ: Теоретические основы обработки люминесцентных изображений биологических объектов 5БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Выпускная работа по
«Основам информационных технологий»
3ФР64
Магистрант факультета радиофизики и электроники
кафедры системного анализа
Лисица Евгения Владимировна
Руководители:
доцент Яцков Николай Николаевич,
доцент Кожич Павел Павлович
Минск – 201 0 г.
Оглавление
Раздел 1 Теоретические основы обработки люминесцентных изображений биологических объектов. 4
1.2 Люминесцентная микроскопия. 4
1.3 Цифровая обработка изображений. 5
1.4 Обзор существующего программного обеспечения. 6
Раздел 2 Разработка алгоритмов анализа изображений и моделирования. 7
2.1 Сегментация изображения. 7
2.2 Экспериментальные изображения клеток раковой опухоли. 9
3.1 Сегментация экспериментальных изображений. 10
3.2 Программный пакет CellAnalyser. 13
Предметный указатель к реферату. 18
Интернет ресурсы в предметной области исследования. 19
Действующий личный сайт в WWW... 21
Тестовые вопросы по Основам информационных технологий. 23
Презентация магистерской диссертации. 24
Список литературы к выпускной работе. 25
Реферат
«Информационные технологии для обработки люминесцентных изображений биологических объектов»
Введение
В основе большинства методов исследований изображений срезов тканей и клеток лежит метод люминесцентной микроскопии [1]. В структуре клетки, цитоплазме или ядре, находится люминесцирующий на определенной длине волны биомаркер – белок связанный с изучаемым биологическим процессом. В данном методе регистрируется интенсивность биомаркера в ядрах и цитоплазмах клеток. Информативность и достоверность биомедицинских изображений определяются качеством подготовки и окрашивания биологических образцов, правильно выбранным набором экспериментальных условий регистрации изображений. Для обработки биомедицинских изображений разработано множество специальных и универсальных алгоритмов, среди которых можно выделить пороговые, градиентные, водораздельные методы и методы, в основе которых лежит вычислительная геометрия. Данные алгоритмы анализа и обработки изображений реализованы в свободно распространяемых пакетах программного обеспечения CellProfiler и ImageJ [2,3]. В то же время применение разработанных алгоритмов для анализа изображений клеток раковых опухолей ограничено по ряду причин, связанных прежде всего с нестабильностью и неустойчивостью работы методов в условиях большого объема набора данных (более 10 Гб информации), неопределенностью и неоднородностью популяций раковых клеток, высокими статистическими шумами и экспериментальными погрешностями [4].
Целью данной работы является:
· Реализация наиболее эффективных алгоритмов обработки изображений.
· Разработка и программная реализация специализированных алгоритмов сегментации ядер и цитоплазм клеток на основе люминесцентных изображений.
· Анализ экспериментальных данных.
· Разработка программного средства для обработки трёхканальных люминесцентных изображений.
Раздел 1 Теоретические основы обработки люминесцентных изображений биологических объектов
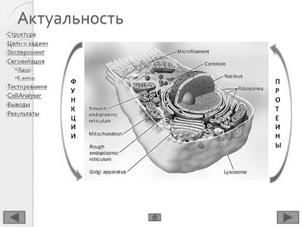
1.1 Биологические объекты
Ферментные процессы, протекающие в клетке, координируются системами регуляции, поэтому они строго разграничены в пространстве в специальных структурных элементах клетки и чётко распределены так же во времени [5]. Возможности спектрального анализа связаны, прежде всего, с тем обстоятельством, что многие молекулы, входящие в состав функциональных механизмов клетки, обладают характерными спектрами поглощения. В ряде случаев эти спектральные характеристики подвергаются значительным изменениям, отражая изменения в структуре данной молекулы и её окружения, которые служат физико-химической основой биологической функции [5]. В зависимости от типа люминесценции выделяют флуоресценцию, фосфоресценцию и медленную флуоресценцию.
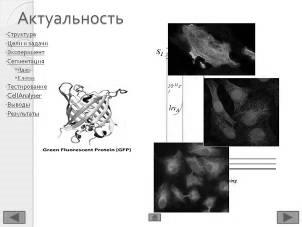
Протеины, участвующие в ферментных процессах, называются биомаркерами. Если биомаркер не люминесцирует – используют специальные молекулы-красители. В цитоплазмах раковых клеток регистрируются процессы с участием протеина цитокератина (CK), в ядрах раковых клеток содержится протеин рецептор эстрогенов (ER), во всех ядрах, содержится протеин, который маркируется красителем 4,6-диамидино-2-фенилиндол дигидрохлорид (DAPI).
1.2 Люминесцентная микроскопия
Метод оптической микроскопии основан на использовании различий в интенсивности и цвете люминесценции, характеризующей биологические объекты в клетке и тканях в комбинации с анализом морфологических признаков [1]. Люминесцентная микроскопия комбинирует в себе различные методы физики, биологии и химии, поэтому проведение одного эксперимента данным методом является многоступенчатым: приготовление образца [5,6], настройка параметров конфокального микроскопа [4,6,7], получение изображения [4], предварительная обработка изображения [4,7], обработка изображения [7,8], вычисление численных характеристик идентифицированных объектов, проверка точности результатов анализа [7,8], статистический анализ и интерпретация результатов.
1.3 Цифровая обработка изображений
Преобразование цветного изображения в полутоновое изображение
При работе в RGB [7,8] системе для построения полутоновых изображений часто используются: раздельная обработка цветов, когда каждый слой изображения обрабатывается независимо; псевдоцвета, когда формирование палитры проводится путём анализа распределения цветов изображения; либо одновременная обработка цветов, когда цветовые координаты рассматриваются параллельно.
Линейная пространственная фильтрация
Одним из удобных способов сгладить изображение и уменьшить количество локальных экстремумов является линейная пространственная фильтрация. Например, для этого можно использовать свёртку изображения с гауссовским низкочастотным фильтром [8], задаваемого формулой
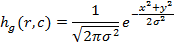
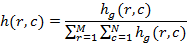
где ![]() и
и ![]() - размеры маски;
- размеры маски;
![]() - среднеквадратическое отклонение распределения Гаусса.
- среднеквадратическое отклонение распределения Гаусса.
Пороговая обработка
Если изображение ![]() содержит исследуемый объект достаточно однородной яркости на фоне другого однородного объекта, тогда изображение
содержит исследуемый объект достаточно однородной яркости на фоне другого однородного объекта, тогда изображение ![]() , которое получается в результате этого порогового преобразования, определяется следующим образом [8]
, которое получается в результате этого порогового преобразования, определяется следующим образом [8]
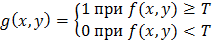
где, T – пороговое значение.
Для определения порогового значения в работе использовались два метода: метод Оцу (Otsu[9]), когда алгоритм предполагает наличие в изображении двух классов пикселей (текстовые и фоновые) и ищет оптимальный порог, разделяющий эти два класса так, чтобы их внутриклассовая дисперсия была минимальна; и метод суммирования нормальных распределений[10], когда алгоритм представляет итоговое распределение интенсивностей пикселей изображения в виде суммы нормальных распределений, например соответствующих распределению фона, объекта и промежуточному распределению. Метод суммирования нормальных распределений требует предварительной оценки коэффициентов составляющих распределений.
Методы математической морфологии
Теория морфологии рассматривает двоичное изображение в виде множества его пикселей переднего плана (со значениями один), которое лежит в пространстве ![]() , где
, где ![]() - множество целых чисел[11]. Наиболее часто используемыми методами математической морфологии для обработки изображений, являются эрозия, дилатация и метод водораздела [8,12].
- множество целых чисел[11]. Наиболее часто используемыми методами математической морфологии для обработки изображений, являются эрозия, дилатация и метод водораздела [8,12].
Методы вычислительной геометрии
Задача наращивания вторичных объектов на основе первичных объектов может быть успешно решена, используя диаграмму Вороного, которая представляет такое разбиение плоскости, при котором каждая область этого разбиения образует множество точек, более близких к одному из элементов множества S, чем к любому другому элементу множества [13]. В работе использовался метод распространения, который строит диаграмму Вороного на основе первичных объектов, используя Римановскую метрику, зависящую от локальных свойств изображения[14].
1.4 Обзор существующего программного обеспечения
В настоящее время для обработки изображений активно используется коммерческое программное обеспечение (ПО) и бесплатное открытое ПО.
К достоинствам коммерческого ПО можно отнести: 1) надежность – алгоритмы разработаны под конкретный вид решаемых задач, 2) высокую точность результатов – достигается вследствие внедрения коммерческих патентов на методы сегментации, 3) простоту в использовании – дружественный интерфейс для работы. Недостатками коммерческого ПО являются высокая стоимость, отсутствие универсальности: в случае изменения технологии, необходимо менять программное обеспечение, отсутствие доступа к коду со стороны пользователя, использование специальных форматов данных [15].
Альтернативой к коммерческому программному обеспечению выступает открытое бесплатное программное обеспечение, в основном предназначенное для академического использования. Для бесплатного ПО характерны: универсальность, общедоступность, возможность модификации кода под специализированную задачу. Большинство бесплатных пакетов не обладает интерфейсом и рассчитано на пользователей имеющих навыки программирования. Наиболее распространенные пакеты бесплатного программного обеспечения представлены в таблице 1 [16].
Таблица 1 – Пакеты бесплатного программного обеспечения
| Пакет |
Описание |
Интернет ресурс |
| ImageJ |
Обработка изображений |
http://rsbweb.nih.gov/ij |
| OME |
Базы данных изображений |
www.openmicroscopy.org |
| Bio-Formats |
Библиотека обмена метаданными |
www.loci.wisc.edu/omel |
| CellProfiler |
Автоматическое вычисление характеристик клеток |
www.cellprofiler.org |
| VisBio |
Многофакторный анализ изображений |
www.loci.wisc.edu/visbio |
| Bisque |
База данных для семантического анализа |
www.bioimage.ucsb.edu |
Раздел 2 Разработка алгоритмов анализа изображений и моделирования
2.1 Сегментация изображения
2.1.1 Общие этапы алгоритмов сегментации объектов на изображении
Построение трёх масок изображения имеет общие этапы (Рисунок 1).
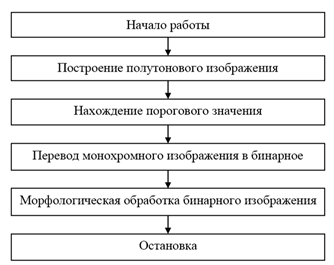
Рисунок 1 – Этапы построения масок
При построении монохромного изображения используются цветовые компоненты, соответствующие цвету испускаемому красителем, маркирующего исследуемый объект. Пороговое значение находиться по необработанному монохромному изображению. Построение бинарного изображения осуществляется на необработанном или на сглаженном гауссовским фильтром монохромном изображении и если необходимо, оно наращивается, используя метод распространения. Размер фильтра определялся как минимальный диаметр исследуемого объекта, умноженный на 3.5/3. На заключительном этапе происходит морфологическая обработка изображения.
Входные параметры необходимые для сегментации изображения: image – файл обрабатываемого изображения; TumorMinDiameter – минимальный размер области опухоли; TumorMaxDiameter – максимальный размер области опухоли; NucleuMinDiameter – минимальный размер ядра; NucleuMaxDiameter – максимальный размер ядра; CellMinDiameter – минимальный размер клетки; CellMaxDiameter – максимальный размер клетки.
2. 1.2 Построение маски опухоли
Так как информация о цитоплазме содержится в зелёной компоненте, то для построения монохромного изображения использовалась только зелёная компонента. Пороговое значение находилось по методу Оцу. Построение маски опухоли строилась на неслаженном изображении. Затем на полученном бинарном изображении заполнялись пустоты меньшие размеров ядер, так как эти пустоты соответствуют областям, не содержащим красителя цитоплазмы, из-за наличия ядра клетки в них.
2 .1.3 Построение маски ядер
Информация об интенсивности красителей ядер содержится в красной и синей компонентах, поэтому для построения полутонового изображения использовалась сумма двух этих компонент. Затем находилось пороговое значение по методу суммирования нормальных распределений. Оценки части изображения занятой ядрами (nuclei_part) строилась как отношение:
nuclei_part=N** Rсреднее 2 / image_square ,
где N – количество локальных максимумов на изображении,
Rсреднее=0.5*(NucleuMaxDiameter+NucleuMinDiameter), image_square – площадь изображения.
Затем найденный порог применялся к сглаженному изображению. На бинарном изображении слившиеся ядра разделялись водораздельным методом на основе интенсивностей. И с разделённого бинарного изображения удалялись объекты, площадь которых меньше минимальной площади ядер[17].
2. 1.4 Построение маски клеток
Информация об интенсивности красителей цитоплазмы содержится в зелёной компоненте, которая использовалась как полутоновое изображение. Пороговое значение находилось по методу суммирования нормальных распределений, где часть изображения занятая цитоплазмой считалась, как 0.8 части изображения занятой ядрами. Найденный порог применялся к сглаженному изображению. Полученное изображение наращивалось по методу распространения, используя маску ядер. На бинарном изображении слившиеся клетки разделялись водораздельным методом на основе интенсивностей. И с разделённого бинарного изображения удалялись объекты, площадь которых меньше минимальной площади клеток.
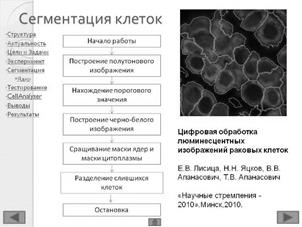
2.2 Экспериментальные изображения клеток раковой опухоли
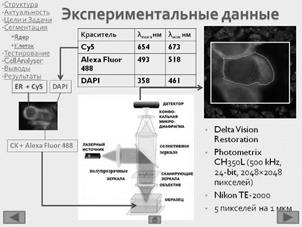
Биологический образец – опухоль рака груди. В цитоплазме раковых клеток протекают реакции с участием цитокератин 8 (CK8), который маркируется красителем Alexa Fluor 488 (lпоглощения = 493 нм , lиспускания = 518 нм). В ядрах раковых клеток находится протеин рецептор эстрогенов ER, для маркировки которого используется краситель Cy5 (lпоглощения = 654 нм , lиспускания = 673 нм), Для маркировки ядер используется краситель DAPI (lпоглощения = 358 нм , lиспускания = 461 нм) [17].
Три изображения получены при помощи конфокального микроскопа компании Delta Vision Restoration, с использованием камеры Photometrix CH350L (500 kHz, 24-bit, 20482048 пикселей), диапазон возможных значений интенсивности от 0 до 255. В системе установлен микроскоп Nikon TE-2000, встроенный в Delta Vision System. Оптические срезы тканей получены последовательным фотографированием с шагом 0.5 мкм вдоль оси z. с параметрами объектива – Nikon, Plan Fluor, NA 1.4 линзами. Флуоресценция регистрировалась стандартом Delta Vision для DAPI, FITC, TexasRed. Размер изображения составляет 2048 пикселей на 2048 пикселей в каждом из трех каналов, разрешающая способность: 5 пикселей на 1 мкм. На Рисунок 2 приведен пример изображения системы.
На этапе предварительной обработки проводилась нормировка гистограммы интенсивностей пикселей в зависимости от времени облучения образца.
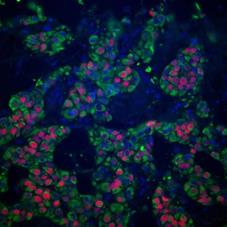
Рисунок 2 – Пример исследуемого изображения
Раздел 3 Результаты
3.1 Сегментация экспериментальных изображений
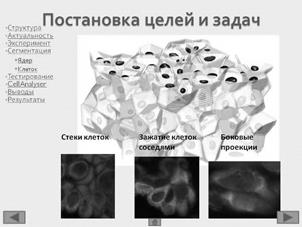
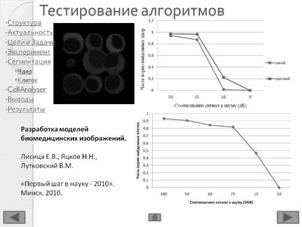
В ходе работы выполнен анализ трех изображений, с площадью покрытия клетками окна среза 80%; и 40%, а также наличия размытых границ клеток (Рисунок 3).
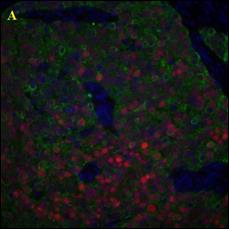
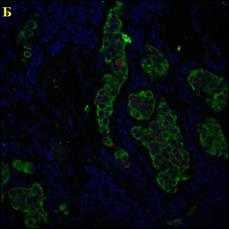
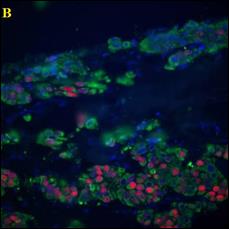
Рисунок 3 – Примеры обрабатываемых изображений. А – площадь покрытия клетками окна среза 80%; Б – площадь покрытия клетками окна среза 40%; В – наличия размытых границ клеток. Далее – изображения 1, 2, 3, соответственно
Для сравнения качества сегментации использовались маски ядер и клеток. Маски, полученные при помощи разработанного алгоритма, показаны на Рисунок 4.


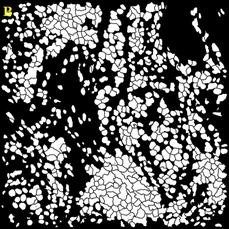
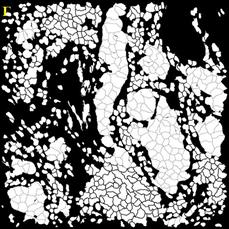
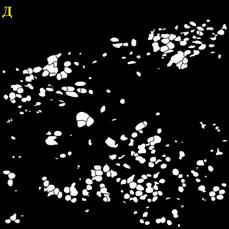

Рисунок 4 – Результаты обработки изображений А – маска ядер изображения 1; Б – маска клеток изображения 1; В – маска клеток изображения 2; Г – маска клеток изображения 2; Д – маска ядер изображения 3; Е – маска клеток изображения 3
Разработанные алгоритмы показали хорошее качество сегментации для изображений с большим и малым количеством клеток. Однако алгоритм сегментации требует доработки при работе с нечёткими изображениями. В этом случае маска клеток содержит искаженные границы клеток для большинства ядер.
Количество клеток на первом изображении составляет 848, на втором 229, на третьем 218. Количество пропущенных либо раздробленных ядер и клеток не превышает 5% от общего числа клеток.
В результате анализа экспериментальных изображений для каждого набора данных сохраняются три файла содержащие электронные таблицы интегральных и дифференциальных характеристик биологических объектов. На Рисунок 5 приведены примеры выходных файлов.
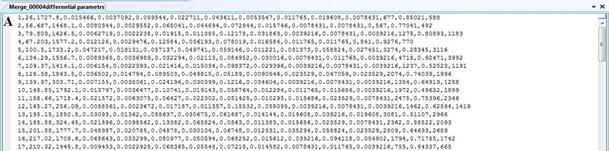
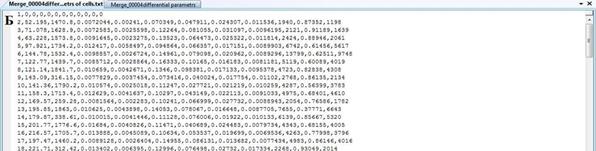
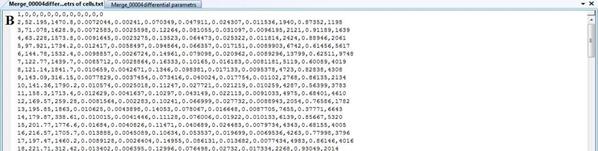
Рисунок 5 – Выходные файл. А – дифференциальные характеристики ядер; Б – дифференциальные характеристики изображения клеток; В – интегральные характеристики биологических объектов
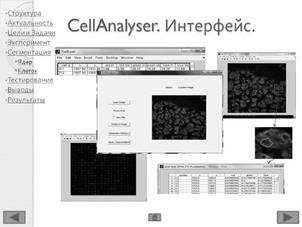
3.2 Программный пакет CellAnalyser
В ходе анализа люминесцентных изображений с помощью программы CellAnalyser (см. Рисунок 6) не требуется введения каких-либо параметров сегментации, так как разработанные алгоритмы автоматически определяют все необходимые параметры (например, по автоматически оцененной площади занимаемой ядрами и клетками). По нажатию кнопки OpenImage открывается окно для загрузки изображения, где пользователь выбирает изображение для последующего анализа.
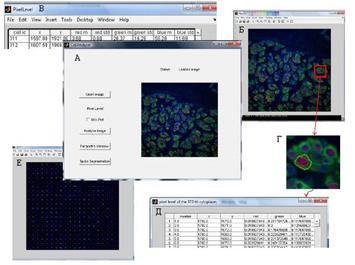
Рисунок 6 – Программный пакет CellAnalyser. А – главное окно Б – интерактивный уровень В – таблица объектов Г – границы ядра и клеток Д – таблицы пикселей Е – матрица спотов
При нажатии кнопки AnalyzeImage происходит построение масок биологических объектов (маски сохраняются в виде файлов с расширением .tif, включая изображения, соответствующее маскам опухоли, ядер и клеток). Затем создаются выходные txt-файлы, содержащие дифференциальные и интегральные характеристики биологических объектов: два файла содержат дифференциальные характеристики объектов и один файл – интегральное характеристики по всему изображению. Файлы автоматически сохраняются в рабочею папку (из которой было загружено изображение).
Информация на пиксельном уровне изображения объектов представляется в виде двух взаимосвязанных окон. На первом окне отображается исследуемое изображение (см. Рисунок 6Б). Нижняя панель содержит параметры выделенного ядра: номер ядра, координаты центра ядра, среднее значение и среднеквадратическое отклонение в красном, зелёном и синем каналах. Если курсор не указывает на ядро, параметры обнуляются.
В результате выделения ядра в таблице объектов (Рисунок 6В, Г), соответствующие ядру границы подсвечиваются на изображении. Автоматически создаются таблицы содержащие информацию о пикселях ядра и цитоплазмы клетки (Рисунок 6Д).
В случае если внутренне окно было закрыто или возникает необходимость очистки изображения – обновление окна осуществляется нажатием кнопки ParametrsWindow (см. Рисунок 6А)
Для дальнейшей работы с найденными клетками и ядрами реализована функция построения матрицы клеток или ячеек (см. Рисунок 6Е). Ячейка – область найденной клетки с определенными границами цитоплазм и ядер. Для обозначения границ клеток используется зелёный цвет, для границ ядер – красный цвет. Если границы ядер и цитоплазм совпадают – используется жёлтый цвет.
Заключение
В ходе данной работе разработаны алгоритмы сегментации опухоли, ядер и цитоплазм раковых клеток на основе трёхканальных люминесцентных изображений. Отличительная черта предложенных алгоритмов состоит в том, что для сегментации ядер и цитоплазм клеток производится автоматическое построение оценки занятой площади ядрами (клетками) для метода суммирования нормальных распределений.
Выполнен анализ экспериментальных изображений раковых клеток. Количество пропущенных либо раздробленных ядер и клеток не превышает 5% от общего числа клеток.
Разработанные алгоритмы легли в основу программного обеспечения CellAnalyser. Особенностью разработанного программного обеспечения является возможность интерактивного анализа биологических объектов на пиксельном уровне. CellAnalyser обладает простым и удобным интерфейсом, выходные результаты представляются в виде масок изображений, в электронных таблицах сохраняются дифференциальные и интегральные характеристики биологических объектов.
Полученные в ходе работы результаты докладывались на трех научных конференциях и были включены в сборники трудов:
· Международной научно-практической конференции “Информационные технологии, электронные приборы и системы (ITEDS’2010)”, БГУ, Минск, 6-7 апреля 2010 г.
· Международном форуме студенческой и учащейся молодежи «Первый шаг в науку – 2010», 3 – 6 мая 2010 г., Минск. Работа награждена дипломом III-ей степени.
· 69-ой научно-практической конференции студентов и аспирантов БГУ, 18-20 мая 2010 г., Минск.
· Республиканской молодёжной научно-практической конференции «Научные стремления – 2010», 1 – 3 ноября 2010 г., Минск. Работа награждена дипломом II-ой степени.
Литература
1. Феофанов, А. В. Спектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях/ А.В. Феофанов// Успехи биологической химии. т. 47. –2007. –С. 371-410.
2. Lamprecht, M. R. CellProfiler: free, versatile software for automated biological image analysis/ M. R. Lamprecht, David M. Sabatini, and Anne E. // Carpenter BioTechniques. – 2007. – Vol. 42. – P.71-75.
3. Abramoff , M.D. Image processing with ImageJ/ M.D. Abramoff, P.J. Magalhaes, and S.J.Ram// Biophotonics International. – 2004. – Vol. 11. – P. 36-42.
4. Ronneberger, O. Spatial quantitative analysis of fluorescently labeled nuclear structures: Problems, methods, pitfalls/ O. Ronneberger [et al.]// Chromosome Research. – 2008. – Vol. 16. – P.523-562
5. Карнаухов , В.Н. Люминесцентный анализ клеток/ В.Н. Карнаухов. – Пущино: «Аналитическая микроскопия», 2002. – 131 с.
6. Штейн, Г. И. Конфокальная микроскопия: мифы и реальность / Г. И. Штейн// Школа-семинар «Конфокальная микроскопия в биологии и медицине», – Москва 2005.
7. Абламейко, С.В. Обработка изображений: технология, методы, применение / С.В. Абламейко, Д.М. Лагуновский. – Минск: «Амалфея», 2000. – 304 с.
8. Гонсалес, Р. Обработка изображений в среде MATLAB/ Р. Гонсалес, Р. Вудс, С. Эддинс. – Москва: Техносфера, 2006. – 616 с.
9. Liao, P.S. A Fast Algorithm For Multilevel Thresholding / P.S. Liao [et al.] //Journal of Informational Science and Engineering. – 2001. – Vol. 17, – P. 713-727.
10. Bishop, C . M. Pattern recognition and Machine Learning/ C. M. Bishop, – Springer, 2006. 735 pp.
11. Гилевский, С.В. Теория вероятностей и математическая статистика / Гилевский С.В., Малофеев В. М. – Минск: БГУ, 2003. – 174 c.
12. Vincent, L. Watersheds in Digital Spaces: An Efficient Algorithm Based on Immersion / L. Vincent and P. Soille. //IEEE Transaction on Pattern Analysis and Machine Intelligence. – 1991. – Vol. 13, – P.583-598.
13. Пpепаpата, Ф. Вычислительная геометрия: Введение/ Ф. Пpепаpата, М.Шеймос. – Москва: Мир, 1989, – 481 с.
14. Jones, T. R. Voronoi-Based Segmentation of Cells on Image Manifolds / T. R. Jones// CVBIA, 2005.– P.535-543.
15. Carpenter, A. E. CellProfiler: image analysis software for identifying and quantifying cell phenotypes/ A. E. Carpenter [et al.]// Genome Biology. 2006. – Vol. 7. – P.100.1-100.10
16. Swedlow, J. R. Open source bioimage for cell biology/ J. R. Swedlow and Kevin W.Eliceiri// Trend Cell Biology. – 2009.– Vol. 19. – P. 656-660.
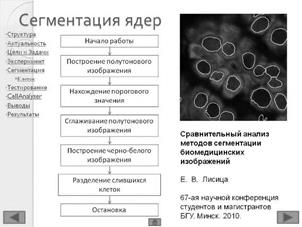
17. Лисица, Е. В. Сравнительный анализ методов сегментации биомедицинских изображений/ Е. В. Лисица// Сборник материалов 67-ой науч. конф. студентов и магистрантов БГУ. Минск. 2010.
Предметный указатель к реферату
В
вычислительная геометрия, 6
Л
люминесцентная микроскопия, 4
М
математическая морфология, 6
О
обработка изображения, 5
П
полутоновое изображение, 5, 8, 9
пороговая сегментация
Otsu, 6, 9
определение, 5
суммирование нормальных распределений, 6, 9
Программное обеспечение
CellAnalyser, 14
бесплатное открытое, 7
коммерческое, 7
С
сегментация
биологических объектов, 8
клеток, 9
опухоли, 9
ядер, 9
Ф
фильтрация
линейная пространственная, 5, 8, 9, 10
Интернет ресурсы в предметной области исследования
1. http://vac.org.by – сайт Высшей аттестационной комиссии Республики Беларусь. Здесь собраны все нормативные акты, касающиеся оформления и защиты диссертаций.
2. http://pubmed.org – текстовая база данных медицинских публикаций на английском языке, на основе раздела биотехнология национальной медицинской библиотеки США (National Library of Medicine, NLM). База данных была разработана национальным центром биотехнологической информации (National Center for Biotechnology Information, NCBI). PubMed является бесплатной версией базы данных MEDLINE.
3. http://rsbweb.nih.gov/ij – общедоступная, основанная на Java программа для анализа и обработки изображений, разработанная в National Institutes of Health. ImageJ был создан с открытой архитектурой которая обеспечивает расширяемость при помощи плагинов Java, а также записываемых макросов. Архитектура плагинов ImageJ и встроенная в программу система разработки делает эту платформу весьма популярной для работы и преподавания анализа и обработки изображений.
4. http://cellprofiler.org – общедоступная, основанная на Python программа для анализа и обработки изображений, использование которой не требует навыков программирования либо знаний о технологии обработки изображений. CellProfiler предназначен для широкого круга пользователей от разработчиков программного обеспечения до биологов.
5. http://www.mathworks.com – сайт разработчика программного обеспечения в области численных вычислений и компьютерного моделирования. Программный пакет MatLab предоставляет пользователю большое количество (несколько сотен) функций для анализа данных, покрывающие практически все области математики.
6. http://www.itlab.anitex.by/bioscan – это универсальная система редактирования, обработки и анализа изображений. Недостатки: отсутствует список опубликованных работ, подтверждающих качество реализованных алгоритмов; нет demo-версии.
7. http://ieee.org/index.html – сайт Института инженеров по электротехнике и радиоэлектронике (The Institute of Electrical and Electronics Engineers, IEEE). В настоящее время в IEEE самое большое всемирное техническое общество учёных и исследователей, профессионально связанных с электротехникой, радиоэлектроникой, компьютерами. Главная цель IEEE – информационная и материальная поддержка специалистов для организации и развития научной деятельности в электротехнике, электронике, компьютерной технике и информатике, приложение их результатов для пользы общества, а также профессиональный рост членов IEEE. Институт IEEE публикует почти треть всей мировой технической литературы, ежегодно издаёт почти 140 журналов и 400 сборников трудов конференций. Главное достоинство материалов IEEE – высокое качество.
8. http://www.bioinformatix.ru – сайт содержащий информацию о биоинформатике, геномике, протеомике, анализе медицинских и биологических изображений, биософте. Недостаток: сайт ориентирован на освещение событий на территории Российской Федерации.
9. http://cran.r-project.org – сайт посвящённый языку программирования R для статистической обработки данных и работы с графикой, а также свободная программная среда вычислений с открытым исходным кодом в рамках проекта GNU. Статистические возможности R полностью покрывают возможности MatLab.
Действующий личный сайт в WWW
http://eugenia-lisitsa.narod.ru
Граф научных интересов
магистранта Лисицы Е.В. факультета радиофизики и электроники
Специальность радиофизика
| Смежные специальности
|
Основная специальность
|
Сопутствующие специальности
|
Тестовые вопросы по Основам информационных технологий
question type=close id=064
text1 Какой из перечисленных ниже атрибутов устанавливает положение таблицы по отношению к полям документа/text
answers type=request
answer id=1 right=0 WIDTH /answer
answer id=2 right=0 BORDER /answer
answer id=3 right=1 ALIGN /answer
answer id=4 right=0 CELLSPACING /answer
/answers
/question
question type=close id=564
text 2 Основные отличия ImageJ от других пакетов бесплатного программного обеспечения/text
answers type=request
answer id=1 right=1 Возможность внедрения пользовательских плагинов /answer
answer id=2 right=0 Не требует навыков программирования для разработки плагинов/answer
answer id=3 right=1 Возможность написания пользовательских макросов /answer
answer id=4 right=0 Открытая лицензия, позволяющая распространять как платно так и бесплатно разработанные плагины. /answer
/answers
/question
Презентация магистерской диссертации
Презентацию магистерской диссертации можно скачать по ссылке в Интернете или посмотреть в приложении .
Список литературы к выпускной работе
1. Феофанов, А. В. Спектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях/ А.В. Феофанов// Успехи биологической химии. т. 47. –2007. –С. 371-410.
2. Lamprecht, M. R. CellProfiler: free, versatile software for automated biological image analysis/ M. R. Lamprecht, David M. Sabatini, and Anne E. // Carpenter BioTechniques. – 2007. – Vol. 42. – P.71-75.
3. Abramoff, M.D. Image processing with ImageJ/ M.D. Abramoff, P.J. Magalhaes, and S.J.Ram// Biophotonics International. – 2004. – Vol. 11. – P. 36-42.
4. Ronneberger, O. Spatial quantitative analysis of fluorescently labeled nuclear structures: Problems, methods, pitfalls/ O. Ronneberger [et al.]// Chromosome Research. – 2008. – Vol. 16. – P.523-562
5. Карнаухов, В.Н. Люминесцентный анализ клеток/ В.Н. Карнаухов. – Пущино: «Аналитическая микроскопия», 2002. – 131 с.
6. Штейн, Г. И. Конфокальная микроскопия: мифы и реальность/ Г. И. Штейн// Школа-семинар «Конфокальная микроскопия в биологии и медицине», – Москва 2005.
7. Абламейко, С.В. Обработка изображений: технология, методы, применение/ С.В. Абламейко, Д.М. Лагуновский. – Минск: «Амалфея», 2000. – 304 с.
8. Гонсалес, Р. Обработка изображений в среде MATLAB/ Р. Гонсалес, Р. Вудс, С. Эддинс. – Москва: Техносфера, 2006. – 616 с.
9. Liao, P.S. A Fast Algorithm For Multilevel Thresholding / P.S. Liao [et al.] //Journal of Informational Science and Engineering. – 2001. – Vol. 17, – P. 713-727.
10. Bishop, C. M. Pattern recognition and Machine Learning/ C. M. Bishop, – Springer, 2006. 735 pp.
11. Гилевский, С.В. Теория вероятностей и математическая статистика/ Гилевский С.В., Малофеев В. М. – Минск: БГУ, 2003. – 174 c.
12. Vincent, L. Watersheds in Digital Spaces: An Efficient Algorithm Based on Immersion / L. Vincent and P. Soille. //IEEE Transaction on Pattern Analysis and Machine Intelligence. – 1991. – Vol. 13, – P.583-598.
13. Пpепаpата, Ф. Вычислительная геометрия: Введение/ Ф. Пpепаpата, М.Шеймос. – Москва: Мир, 1989, – 481 с.
14. Jones, T. R. Voronoi-Based Segmentation of Cells on Image Manifolds/ T. R. Jones// CVBIA, 2005.– P.535-543.
15. Carpenter, A. E. CellProfiler: image analysis software for identifying and quantifying cell phenotypes/ A. E. Carpenter [et al.]// Genome Biology. 2006. – Vol. 7. – P.100.1-100.10
16. Swedlow, J. R. Open source bioimage for cell biology/ J. R. Swedlow and Kevin W.Eliceiri// Trend Cell Biology. – 2009.– Vol. 19. – P. 656-660.
17. Лисица, Е. В. Сравнительный анализ методов сегментации биомедицинских изображений/ Е. В. Лисица// Сборник материалов 67-ой науч. конф. студентов и магистрантов БГУ. Минск. 2010.
Приложение
Презентация магистерской работы
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|