Хімічна біотехнологія
СОДЕРЖАНИЕ: Ужгородський національний університет Біологічний факультет Реферат на тему: ХІМІЧНА БІОТЕХНОЛОГІЯ Виконавець: асп. каф. генетики, фізіології рослин і біотехнології,Ужгородський національний університет
Біологічний факультет
Реферат на тему:
ХІМІЧНА БІОТЕХНОЛОГІЯ
Виконавець:асп. каф. генетики,
фізіології рослин і біотехнології,
Біланич Михайло
Ужгород, 2007
ПЛАН
1. Протеїнази
2. Амілази і амілоглікозидази
3. Застосування інших ферментів в промисловості.
4. Технологія іммобілізованих ферментів.
1. Біотехнологія виробництва розчинників.
2. Виробництво органічних кислот.
3. Синтез амінокислот за допомогою біотехнологій і їх застосування.
4. Мікробіологічний синтез антибіотиків і алкалоїдів.
5. Виробництво і застосування стероїдів і вітамінів.
ВСТУП
Захоплюючий процес в біотехнології веде до росту кількості біотехнологічної продукції, яка використовується в різних галузях промисловості, особливо в фармацевтиці, сільському господарстві і виробництві хімікатів. Біологічні процеси іноді витісняють традиційні етапи хімічного синтезу розчинників, органічних кислот, антибіотиків і інших речовин, що значно понижує вартість їх виробництва і несприятливу дію на навколишнє середовище. А це в свою чергу сприяє застосуванню біопроцесів в виробництві.
Поступове збільшення долі біопроцесів добре видно на прикладі виробництва біополімерів, особливо пластмас, що розкладаються біологічно. (http://www.rccnews.ru/Rus/FinancialInstitution/?ID=46499). Є відомості, що до 2010 року біотехнологічна продукція, або продукція, вироблена в результаті використання біотехнологічних процесів, буде складати 30 відсотків півтора трильйонного ринку хімікатів. (http://www.rccnews.ru/Rus/ Pharmaceuticals /? ID =8062 ).
По даним ЮНЕСКО щорічно з надр Землі добувають близько 120 мільярдів тон руд, з яких за розрахунками академіка І. В. Петрянова-Соколова, тільки 2% природних матеріалів використовується в промисловому виробництві, а все інше перетворюється в відходи. За допомогою біотехнологій можливо домогтися ефективнішої і економічно вигіднішої переробки сировини.
На основі цього важливим є розвиток хімічної біотехнології. В її основі лежить здатність біологічних систем до пізнавання і виконання каталітичних функцій. Основними перевагами біотехнологічних методів при добуванні хімічних речовин є спрямована специфічна дія ферментів, яка дозволяє здійснювати надзвичайно тонкі перетворення органічних сполук з використанням простих систем, в той час, як аналогічні хімічні перетворення вимагають багатостадійних синтезів; легко відтворювані умови дії ферментів, оскільки вони звичайно функціонують в водних середовищах і при температурах не вище 80єС; невелика кількість побічних продуктів і шкідливих для біосфери відходів (В.Т.Емцов)
Потрібно пам’ятати, що хімічна біотехнологія лежить в основі промислової і енергетичної біотехнології, дає змогу вирішувати коло питань екологічної біотехнології.
В цьому розділі мова піде головним чином про принципи, перспективи і технології отримання хімічної продукції на основі біотехнології.
І.Застосування ферментів в промисловості.
Застосування ферментів в хімічній технології звичайно буває обумовлено їх високою вибірковістю і стереоспецифічністю, але ці властивості не завжди є бажаними. Наприклад, деколи необхідні ферменти з широкою субстратною специфічністю для виробництва аналогів основного продукту. Перевага технології на основі ферментів перед хімічними каталізаторами заключається в тому, що відносно в м’яких умовах можна досягти більш високих результатів. (Д.Бест биотехнология и химия). Також особливістю є невелика кількість шкідливих для біосфери відходів і побічних продуктів, що є в сьогоднішній час необхідним для збереження нормального екологічного стану навколишнього середовища.
На сьогоднішній день виявленобільше 3000 різнихвидівферментів. (http://www.lol.org.ua/ukr/showart.php)
Біотехнологи вважають за краще використовувати позаклітинні ферменти. Вони простіше піддаються перетворенням в промислові препарати, оскільки в них не потрібно руйнувати стінки мікробних клітин.
В промислових технологіях дуже популярними є гідролітичні ферменти. Яскраво виражена специфічність гідролаз дозволяє отримувати готові продукти високої чистоти.
Широке застосування ферменту ізомерази пояснюється тим, що він перетворює глюкозу в фруктозу, в результаті чого утворюється глюкозо-фруктозний сироп, який практично замінює цукор в ряді процесів харчової промисловості. Можна перечислити багато інших сфер застосування ферментів. Наприклад, в шкірній промисловості для пом’якшення шкір, вимочування льону, обезжирювання шовку-сирцю виробництво добавок для кормів, що є важливим для тваринництва, і т.д. (http://www.lol.org.ua/ukr/showart.php)
Особливо високі результати в виробництві різних речовин можливо отримати при за допомогою іммобілізованих ферментів.( В.Т.Емцев, Рубежи...)
Сьогодні в промисловості використовуються різні ферментні препарати. Розглянемо препарати, які створені на протеїназах, глюкозоізомеразі, амілазах і амілоглюкозидазах.
1.Протеїнази.
Спочатку їх виділяли з тварин. Сьогодні їх все більше заміщують мікробіальні протеїнази. Першим ферментом, який знайшов застосування в промисловості була -амілаза із Aspergillusorizae. Ці продукти містили значні домішки протеази і їх рекомендували використовувати як засоби, що сприяли травленню. Також на основі протеїназ створюють засоби для замочування білизни. Вперше такі засоби були у продажі вже в 1913 році. В кінці 60-х років приблизно 50 % всіх детергентів, які випускались в Європі і США, вже містили протеази. Ще одна галузь,0 де спостерігався бурний розвиток технологій на основі протеаз – це виробництво сиру. Тут всі зусилля були спрямовані на пошук замінників сичуга телять. Для вироблення протеаз в промисловому масштабі потрібні штами мікроорганізмів, що синтезують позаклітинні протеази з високим виходом.
Протеази поділяють на три групи: серинові, кислі і металопротеази. Серед серинових протеаз на першому місці стоїть субтилізин. Важливим є те, що серинові протеази не гідролізують білки до амінокислот.
В склад металопротеази входить атом металу, звичайно цинку, без якого фермент не активний. В промисловості металопротеази добувають за допомогою BacillusamiloliquefaciesiB.termoproteolyticus. Специфічність дії цих ферментів вища, ніж у серинових протеаз, але їх не можна використовувати як сичуг, так як рівень специфічності в них все ж високий.
Вони використовуються в пивоварінні, при гідролізі білків ячменю, так як серинові протеази інгібуються речовинами солоду. Видалення з їх допомогою солоду запобігає помутнінню пива, яке проходить при взаємодії білків з танінами при охолодженні.
Кислі протеїнази. Вони синтезуються грибами. По своїм властивостям вони схожі на травні ферменти тварин – пепсин і ренін. Застосовують їх для гідролізу білку при виробництві соєвого соусу, в хлібопекарній промисловості, як засоби, які сприяють травленню і т.д.
Деякі кислі протеази можна використовувати в виробництві сиру. Більшість протеаз викликає згортання молока, але сир виходить несмачним із-за глибокого гідролізу казеїну. Субстрат на специфічність кислих протеаз термофільних грибів, MucorpusillusiM. michei, вужча. Вони схожі на ферменти сичуга і широко застосовуються для сторожування молока. Вже отримана експресія гену реніну телят в мікроорганізмах і тепер кишкова паличка може синтезувати ці ферменти.
Протеази знаходять застосування в обробці шкір при видаленні шерстинок і пом’якшенні. Така обробка робить шкіру м’якшою і еластичнішою.
2.Амілази і амілоглюкозидази.
Використання ферментів в виробництві крохмалю дозволяє контролювати глибину його гідролізу і отримувати продукцію з бажаними властивостями: в’язкістю, осмотичним тиском, стійкістю до кристалізації. Гідроліз каталізується ферментами трьох різновидів: ендоамілазами, екзоамілазами і -1,6-глюкозидазами.
Ендоамілази – це -амілази. Які розщеплюють -1,4-глюкозидні зв’язки амілазі і амілопектині з утворенням олігосахаридів з різної довжини ланцюгами і -конфігурацією при С1 атомі глюкози. Для зрідження крохмалю при високій температурі використовують термостабільні -амілази. Наприклад амілази Bacilluslicheniformis температурний оптимум лежить при 92 єС. Для зрідження крохмаль диспергують у воді при нагріванні, для зменшення в’язкості і для запобігання осіданню крохмалю при охолодженні проводять частковий його гідроліз. При одностадійному розрідженні фермент добавляють на самому початку, до приготування суспензії, яке проводять при 150 єС на протязі 5 хвилин, після чого гідроліз ведуть 2 години при 95 єС.
При кисло-ферментному зрідженні фермент після желатинування крохмалю, викликаного нагріванням.
Сиропи, що добувають з крохмалю, містять багато мальтози (40-50%). Знаходять застосування в виробництві карамелі і заморожених десертів.
Екзоамілази розщеплюють -1,4-глюкозидні зв’язки, -глюкогенні амілази гідролізують -1,6-глюкозидні зв’язки в розгалужених молекулах олігосахаридів. Для промислових цілей Глюкоамілази отримують із Aspergillusniger або Risopussp. Це низько специфічні ферменти, які гідролізують зв’язки -1,3 і -1,6 повільніше ніж -1,4. Вони стабільні в широкому діапазоні рН і більш активні при 75 єС, хоча частіше функціонують при 65 єС. В препаратах цих ферментів присутні забруднюючі домішки трансглюкозилази, яка каталізує утворення олігомерів глюкози, що не зброджуються. Це може суттєво понижувати вихід глюкози.
Глюкоамілази застосовуються в основному в виробництві концентрованого сиропу (90-97% D-глюкоза), з якого отримують кристалічну глюкозу. Також вони застосовуються при виробництві сиропів з високою ступінню конверсії (35-43% глюкози, 30-37% мальтози і 8-13 % мальтотріози) для харчової промисловості.
3.Застосування інших ферментів, що важливі для комерції.
Сьогодні ферменти застосовуються найбільш широко для перетворення вуглеводів, які відіграють особливу роль в харчовій і молочній промисловості.
Глюкозоізомераза.Каталізує перетворення глюкози у фруктозу. Комерційні препарати її відомі під фірмовою назвою „Sweetyzyme“ або „Maxazyme”. Їх поява стала поштовхом для розвитку крупного виробництва фруктового соку. При високих концентраціях субстрату і нейтральних рН несолодка глюкоза з виходом 42-47 % ізомеризується ферментом в більш солодку фруктозу. Запатентовано багато способів іммобілізації і використання як самої ізомерази так і клітин, які її містять. Процес іде при 60-65 єС, при рН 7,0-8,5 в присутності іонів магнію.
Я-галактозидазу (лактазу) застосовують для гідролізу лактози в збираному молоці. Безлактозний продукт, що отримують, іде для харчування тих людей, організм яких не розщеплює лактозу.
Під дією лактази з сахарози отримують глюкозу. На комерційний рівень поставлено ферментативне розділення рацематних сумішей амінокислот і ефірів, які утворюються при хімічному синтезу.
Ряд ферментів грає роль i в медичній діагностиці. Так, холестериноксидаза дозволяє визначити рівень холестерину в сироватці крові,
а уреаза - рівень сечової кислоти. В дослідженнях генної інженеріївикористовують рестрикційні ендонуклеази, які розрізають ДНК, і лігази, які зшивають розрізані кінці ДНК.
Групі американських дослідників на чолі з Девісом (Медична школа Стенфордського університету) вдалося підвищити вихід лігази
в 500 разів за рахунок введення декількох копій лігазного гену в клітини Е. coli.
Пренатальну діагностику серповидноклітинної анемії можна здійснити, обробляючи рестрикційними ендонуклеазами ДНК зародкових клітин амніотичної рідини замість того, щоб відбирати проби крові зародка. Отримані мікробіологічним шляхом ферменти можуть також знайти важливе значення у виробництві пластмас.
4.Технологія іммобілізованих ферментів
В промисловості вже на початку 80 було реалізовано 4 широкомасштабні технології на основі іммобілізованих ферментів(глюкозоізомерази, аміноацилази, пеніцилази і лактази). Але ще на початку 20 століття було відомо, що деякі ферменти, якщо їх адсорбувати на твердому носії (такому, як вугілля або силікагель), зберігають свою каталітичну активність.
Іммобілізація – поняття досить широке. Воно означає просте зв’язування ферментів з нерозчинними в воді носіями, а також будь-яке обмеження ступенів свободи ферментних молекул і їх фрагментів. Наприклад лактазу іммобілізують на частках кремнезему, застосовують для конверсії лактози сироватки в глюкозу і галактозу.
В майбутньому будуть використовуватись іммобілізовані ферменти. Їх можна використовувати в наступних цілях: а ) холінестераза може застосовуватись для визначення пестицидів; б) інші ферменти аналогічним способом можуть застосовуватися для визначення токсичних речовин, наприклад, гексокіназа дуже чутлива до малих концентрацій ліндану; в)іммобілізована гепариназа може застосовуватись для запобігання тромбоутворень в апаратах штучного кровообігу; г) іммобілізована білірубіноксидаза може бути застосована для видалення білірубіну із крові новонароджених, які страждають на гепатит; д) іммобілізовані ферменти знайдуть подальше застосування в молочній промисловості. При виробництві сиру можуть використовуватись іммобілізовані білки, які згортують молоко – ренін пепсин; е) Можливо, вдасться створити системи із декількох іммобілізованих ферментів. Наприклад якщо заключити в мікро капсули три ферменти – уреазу, глутаматдегідрогеназу і глюкозодегідрогеназу, то їх можливо використати для видалення сечовини із крові хворих на ниркову недостатність; є) різноманітні іммобілізовані ферменти з часом знайдуть застосування в датчиках для швидкого аналізу. Особливо корисними із-за їх високої стабільності можуть виявитись ферменти термофілів.
Іммобілізація ферментів дає наступні переваги: зростання стабільності біотехнологічних процесів, оптимізацію рН для каталітичної активності, отримання більш чистої продуктів реакції, полегшення відновлення і повторного використання біокаталізаторів, пониження інгібування ферментів.
Іммобілізація також дозволяє зупинити реакцію на будь-якій стадії, отримати продукт очищений від ферменту, що дуже важливо в ряді харчових і промислових виробництв.
Як же проходить іммобілізація? Ферменти закріплюють в просторі по-різному, декількома способами. Їх можна адсорбувати на кераміці, склі, силікагелі, оксидах і гідроксидах металів, полісахаридах, органічних смолах і інших носіях. Адсорбція при цьому здійснюється фізичними або іонними силами взаємодії. Поширені також методи механічного включання ферментів в полімерні гелі, в напівпроникні полімерні мікро капсули, в повні волокна, в рідкі мембрани. Особливий інтерес мають способи, які дозволяють приєднувати ферменти до неорганічних носіїв за допомогою хімічних (ковалентних) зв’язків. Можливе таке прикріплення ферментів до нейлону, полістиролу, поліакриламіду, іонообмінних смол.
Після закріплення на поверхні носія ферменти необхідно стабілізувати. Справа в тому, що вони є поживою для мікроорганізмів. Тому ферменти захищають від них, наприклад стінками мікропористого носія. Існують і інші способи стабілізації ферментів, коли молекули білку попередньо зв’язують „поперечними містками”, а потім вже прикріплюють хімічними зв’язками до твердого матеріалу і механічно включають утворення що дістали в тісні пори носія. Зафіксований таким чином фермент може працювати в різних умовах, зберігаючи активність при підвищених температурах і в відносно агресивних середовищах.
Також ефективним методом є іммобілізація не тільки ферментів, але й мікроорганізмів. Використання таких іммобілізованих клітин дає ряд переваг: не потрібно виділяти і очищати ферменти, невеликі витрати на виділення і очистку продуктів реакції, можливе створення наполовину безперервних і автоматизованих процесів.
ІІ. Біотехнологія і виробництво хімічних речовин
1.Біотехнологія виробництва розчинників
До числа важливих виробництв розчинників на основі бродильних процесів відноситься добування ацетону і бутанолу. Вперше в промисловому масштабі вони були здійснені Вейсманом в місті Манчестері в роки першої світової війни. Низькоякісний ацетон виробляли з деревини, але коли став потрібен високоякісний ацетон, то був заснований бродильний процес на переробці крохмалю (концентрацією в 3,8 %) анаеробними спороутворюючими бактеріями Clostridiumacetobutilicum. Перетворенню підлягає до 30 % субстрату в результаті чого утворюється суміш розчинників (60% бутанолу, 30 % ацетону і 10-15 ізопропанолу, етанолу). Залишок субстрату перетворювався на вуглекислий газ і водень (рис.1).

Рис.1. Схема реакцій ацетон-бутанольного бродіння
Оскільки утворювались великі об’єми газів при великомасштабному виробництві перемішування не було потрібно. Головні проблеми заключались в гасінні піни. В залежності від штамів відношення ацетон : спирт дещо варіювало. Розчинники відокремлюють від середовища перегонкою.
Велике значення має виробництво бутанолу. Його використовують при добуванні широкого кола речовин, включаючи гальмівну рідину, пластифікатори, карбамідну смолу, речовини з властивостями екстракції і добавки до бензину.(Сассон Альбер )
Після війни бродильне виробництво цих речовин скоротилось, так як відносна вартість нафтопродуктів, порівняно з вуглеводами, була нижчою. В наш час знову з’являється зацікавленість до ферментативного виробництва цих речовин.
Також цікавим отримання бутилен-2,3-гліколю за допомогою мікробіологічної конверсії. Для цього можна використати молочну сироватку. Вона може бути джерелом вуглецю при утворенні бутиленгілколю бактеріями Klebsiellapneumoniae або Enterobacteraerogenes. Бутиленгліколь потім йде на виробництво каучуку.
2.Виробництво органічних кислот.
Однією з важливих органічних кислот є оцтова кислота. Вона використовується при виробництві багатьох хімічних речовин, включаючи каучук, пластмаси, волокна і інсектициди. В минулому основну її частину добували з етанолу шляхом мікробіологічного окислення. Мікробіологічне перетворення етанолу йде за допомогою Acetobacter і Gluconobacter в аеробних умовах і тому не являється процесом бродіння. Перетворення етанолув оцтову кислотуза допомогою бактерій економічно вигідним є лише при добуванні харчового оцту ( Сассон Альбер ).
Відомо, що термофільні бактерії мають властивість перетворювати целюлозу в оцтову кислоту тому є перспективними для використання їх в промисловому виробництві цієї речовини. Також можливо використовувати AcetobacteriClostridium для синтезу її з СО2 і Н2 .
Важливою також є молочна кислота. Її виробництво було одним з перших процесів з застосуванням часткової стерилізації середовищ нагріванням за участі мікроорганізмів з роду LactobacillusbulgaricusiL. leischmanii(XIXст.). Здійснювався цей мікроаерофільний процес при температурі 45-50 єС. В ньому використовуються речовини, що містять крохмаль. Їх попередньо обробляють ферментами або за допомогою кислотного гідролізу.
Бактерії Lactobacillusbulgaricus зброджують лактозу, тому можна використовувати як субстрат молоко. Також для субстрату можна використатисахарозу (концентрація 12-18%, маса/об’єм). Процес конверсії іде 3-4 доби. При цьому виділяється СО2 і створюються напіванаеробні умови.
Описані також способи конверсії 1,2-пропандіолу в молочну кислоту. Такі мікроорганізми, як Arthrobacteroxydans, Fusariumsolani, Alcaligensfaecalis, утворюють L(+) ізомер молочної кислоти, а Lactobacillusleischmanii синтезують D-ізомер.
Молочну кислоту використовують як добавку до безалкогольних напоїв, фруктових соків, джемів і сиропів, есенцій, в медицині, для декальцифікації шкір в дубильній промисловості. L(+)-форму молочної кислоти полімеризують в полілактат, який застосовують для виробництва пластикових обгорток.
Лимонна кислота. У цієї кислоти приємний смак і її широко використовують в харчовій, фармацевтичній і косметичній промисловості. Оскільки ця речовина зв’язує метали, її використовують для їх очистки.
Процес виробництва лимонної кислоти проходить за допомогою ферментації при участі грибів. Налагоджено його вперше в 1843 році. Основні проблеми цього процесу спочатку були зв’язані з мікробним забрудненням. Виявилось, що процес можна вести при низьких рН і в таких умовах утримувати стерильність простіше. За 1-2 тижні при високих концентраціях цукру, вихід лимонної кислоти становив 60 %. В 1950 році було освоєно глибинне культивування. Відомо, що стабільний процес глибинної ферментації можливий лише в тому випадку, якщо він здійснюється у дві стадії: на першій йде ріст міцелію, а на другій – утворення лимонної кислоти. Для цього процесу використовується сировина: меляса, крохмаль, глюкозний сироп.
Наявність іонів металів в вихідному середовищі приводить до різкого падіння виходу лимонної кислоти. Їх осаджують за допомогою гексаціаноферату, пропусканням через іонообмінні смоли, а також для ліквідації їх шкідливої дії цих домішок використовують метанол і інші спирти. В 60-х роках були запропоновані процеси для виробництва лимонної кислоти за допомогою штамів Corynebacterium, Arthrobacter, Brevibacterium, Candida.
В промисловому виробництві в основному використовують Aspergillusniger, A. wentii. Надлишок продукції лимонної кислоти являється реакцією відповіді на недостачу фосфату, але при вираженій нестачі металів, лімітуючим фактором не обов’язково являється фосфат. Оптимум рН складає 1,7-2,0. В більш лужному середовищі проходить утворення помітних кількостей щавлевої та глюконової кислот. Таким чином, контроль за культуральним середовищем дозволяє обійти регуляторні системи обміну і створює оптимальний фон для утворення лимонної кислоти. Очевидно в цих умовах стимулюється гліколіз і забезпечується необмежене надходження вуглецю в реакції проміжного метаболізму.
В промисловому виробництві лимонної кислоти застосовується декілька варіантів процесу. Традиційним твердофазним варіантом являється процес Коджі. Він має багато спільного з поверхневою ферментацією. Глибинна ферментація є періодичною і безперервною. Безперервна дає найбільший вихід продукції, але його застосування в промисловості поки, що малоймовірно.
На першому етапі утворюється значна кількість продукту. На другому етапі ріст відсутній, а гранична кількість продукту залежить від концентрації біомаси. В кінці ферментації масу міцелію відокремлюють фільтруванням і промивають. Потім при рН3,0 осаджують щавлеву кислоту в формі оксалату кальцію. Лимонну кислоту осаджують із рідкої фази в формі кальцієвої трьох заміщеної солі в комплексі з чотирма молекулами води. Осад відфільтровують, промивають і вільну кислоту отримують шляхом обробки сульфатом кальцію. Далі її очищають за допомогою активованого вугілля і іонообмінних смол. Можна також екстрагувати кислоту розчинником. (Бест Д., Химия и биотехнология. В кн.Биотехнология.)
Розроблений ряд процесів добування інших органічних кислот – глюконової, яблучної, виннокам’яної, саліцилової, янтарної, піровиноградної, коєвої. В сьогоднішніх умовах здебільшого, їх виробництво не вигідно економічно. D-глюконову кислоту добувають з глюкози за участю Aspergillusniger. В деяких країнах сходу для її виробництва використовують чайний гриб. Натрієва сіль глюконової кислоти використовується для вилучення металів. Оскільки в присутності їдкого натру вона може зв’язувати кальцій, то використовується в складі лужних препаратів для миття посуду. Кальцієві і залізовмісні солі глюконової кислоти застосовуються як пероральні і внутрівенні препарати в медицині, а чиста кислота – як миючий засіб в молочній промисловості.
Виннокам’яна кислота являється звичайно побічним продуктом виноробства. Її можливо дістати і шляхом мікробної трансформації 5-оксиглюконової кислоти. Штами, які здатні перетворювати глюкозу в 5-оксиглюконат через глюконат, можуть шляхом подальшої ферментації утворювати тартат. Для цього використовують мутанти AcetobacteriGluconobacter. Солі винної кислоти (тартати) знаходять застосування в харчовій промисловості, але методи біотехнології в її виробництві звичайно не використовуються.
Яблучну кислоту можна добувати з фумарової в харчовій промисловості за допомогою Paracolobactrum. Також можна її отримувати з н-парафінів за допомогою дріжджів і з етанолу за участю Schisophyllum commune.
Знафталіну за допомогою бактерій можливо синтезувати саліцилову кислоту і інші його похідні. Більшість диких штамів бактерій (Pseudomonas. Corynebacterium і ін.) які розщеплюють нафталін, рідко виробляють саліцилат в концентрації більшій за 1%. Але шляхом відбору штамів і зміни середовищ можна збільшити вихід цієї речовини. Для збільшення виходу саліцилової кислоти необхідні іони різних металів. Відомо також, що ферментація регулюється продуктом, що накопичується, тобто видалення саліцилату з середовища приводить до подальшого утворення його бактеріями.
3.Синтез амінокислот за допомогою біотехнологій і їх застосування.
Всі амінокислоти, з яких складаються білки, являються L--амінокислотами.
Вони знаходять застосування як харчові добавки, приправи, посилювачі смаку, як сировина в парфумерній та фармацевтичній промисловості.
Їх можна добувати з інших природних продуктів, головним чином при гідролізі білків рослин, так і шляхом хімічного мікробіологічного або ферментативного синтезу. Якщо хімічний синтез дає продукт-рацемат, який потребує дальшої обробки, то останні два дають можливість оптично чисті амінокислоти. В цьому і полягає перевага біотехнологічних методів над хімічними.
Особливістю більшості виробничих процесів за участі мікроорганізмів, являється зміна умов середовища. За рахунок цього досягається синтез надлишкової кількості бажаного продукту. В основному для цього змінюють рН розчину, концентрацію продукту, концентрацію субстрату або шляхом встановлення критичних рівнів домішок (іонів металів, органічних домішок) в середовищі.
Бактерії для виробництва амінокислот стали застосовуватись з початку 50-х років 20 ст. Утворювати амінокислоти здатні бактерії багатьох родів, наприклад Corynebacterium, Brevibacterium, Bacillus, Escherichia, Aerobacter. Вони настільки продуктивні, що виробництво є рентабельним, що в наш час дуже важливо. Corynebacterium або Brevibacterium, які вирощують на вуглеводному середовищі, ацетаті, етанолі, при наявності певної кількості біотину, здатні синтезувати до 30 грам на літр глутамату.
Різними методами впливу можливо змінювати вихід амінокислот. Наприклад, шляхом зміни умов середовища, процес ферментації, у ході якого утворюється L-глутамат, може бути переключений на синтез L-глутамiну або L-проліну. При високій концентрації біотину та іонів амонію складаються сприятливі умови для створення L-проліну, а при більшій концентрації іонів цинку і амонію в слабо кислому середовищі посилюється синтез L-глутаміну. Для регуляції синтезу АК можна використовувати ауксотрофні мутанти багатьох штамів.
Цікавим і дуже ефективним є утворення амінокислот з використанням іммобілізованих в поліакріламідний (ПААГ) гель мікроорганізмів. Клітини кишкової палички, іммобілізовані в ПААГ можуть здійснювати перетворення фумарової кислоти в аспарагінову.
![]()
![]() HOOC–CH=CH–COOH + NH3
HOOC–CH–CH2
–COOH
HOOC–CH=CH–COOH + NH3
HOOC–CH–CH2
–COOH
NH2
Фумарова кислота L-аспарагінова кислота
![]()
![]() Активність іммобілізованих клітин зберігалась при підвищеній температурі (37єС) в присутності іонів магнію (Mg2+
) на протязі 40 днів при швидкості протікання через колонку об’ємом 10·100 см 0,5 мілілітрів за годину, причому вихід аспартату становив 95% з 1 М розчину фумарової кислоти. При використанні такої колонки в промисловості щоденний вихід кислоти був 1900 кг, або 57,5 т на місяць. Інший приклад промислового застосування мікроорганізмів для біоконверсії органічних сполук – це добування L-яблучної кислоти за допомогою іммобілізованих клітин Brevibacteriumflavum. (Біотехнологія. А. Баев)
Активність іммобілізованих клітин зберігалась при підвищеній температурі (37єС) в присутності іонів магнію (Mg2+
) на протязі 40 днів при швидкості протікання через колонку об’ємом 10·100 см 0,5 мілілітрів за годину, причому вихід аспартату становив 95% з 1 М розчину фумарової кислоти. При використанні такої колонки в промисловості щоденний вихід кислоти був 1900 кг, або 57,5 т на місяць. Інший приклад промислового застосування мікроорганізмів для біоконверсії органічних сполук – це добування L-яблучної кислоти за допомогою іммобілізованих клітин Brevibacteriumflavum. (Біотехнологія. А. Баев)
Синтез амінокислот за допомогою ферментів.
Процеси застосування ферментів при синтезі АК бувають одно- і багатостадійними, а методи, які використовуються, різноманітними. В залежності від цього виділяють 5 класів ферментів:
1. Гідролітичні ферменти (гідролази). Наприклад 2-аміно-тіазолін-4-карбоксигідролаза яка відповідає за синтез L-цистеїну (рис2.), або L--аміно--капролактам-ліаза, яка відповідає за синтез L-лізину. Для використання неочищених ферментів, цілі клітини обробляють поверхнево-активними речовинами, що викликають зміни проникності і можуть використовувати мутантні штами, в яких продукт не використовується в обміні речовин.
![]()
![]()
![]()
![]()

Рис.2. Застосування гідролітичних ферментів для виробництва цистеїну
2. Ліази. Відповідають за реакції дезамінування. Для утворення L-аспартату із фумарату амонію може використовуватись аспартаза або L-аспартат–аміак-ліаза. В якості донорів амонію, крім цього, може виступати гідразин або гідроксиламін.
3. Ферменти, що містять пірідоксальфосфат. Це звичайні коферменти, що беруть участь в метаболізмі амінокислот. Вони каталізують багато реакцій: рацемалізацію, трансамінування, реакції заміщення і елімінації. Мабуть роль цих коферментів полягає в активації АК, що полегшує їх взаємодію з апоферментом. Наприклад L-тирозин–фенол-ліаза (-тирозиназа) каталізує реакцію -елімінації, в якій тирозин розпадається з утворенням піровиноградної кислоти, фенолу і аміаку. Цей фермент може синтезувати мікроорганізм Erwiniaherbicola. Прикладом широко поширеного в природі ферменту, який здійснює дезамінування, може служити L-триптофан–індол-ліаза (триптофаназа). Цей фермент характеризується широкою субстратною специфічністю. Каталізує реакції , -елімінації і -заміщення.
4. Дегідрогенази амінокислот, наприклад лейциндегідрогеназа і аланіндегідрогеназа. Каталізують оборотні реакції синтезу АК з кето-аналогів. Їх застосовують в неперервних реакціях синтезу АК із відповідних кето аналогів.
5. Глутамінсинтетаза. Каталізує АТФ-залежну реакцію амінування глутамату, яка спряжена з зброджуванням цукру дріжджами. Енергія, що звільняється йде на синтез глутаміну. АТФ, яка утворюється при розпаді фруктозо-6-дифосфату, необхідна для забезпечення енергією ендоергічної реакції, яка каталізується синтетазою.
4. Мікробіологічний синтез антибіотиків і алкалоїдів.
Антибіотики – група речовин мікробного походження, застосовуються як протимікробні й протипухлинні препарати.
Нині відомо більше 3000 речовин антибіотиків, виділених з різних організмів. Їх поділяють на класи згідно з хімічною структурою: пеніциліни, цефалоспорини, тетрацикліни, антрацикліни, аміноглікозиди, макролідні антибіотики тощо.
З їх допомогою контролюється ріст рослин і ведеться боротьба з хворобами.Майже всі антибіотики спроможні придушувати широке коло патогенів: гриби, бактерії і мікоплазми. Проводяться пошуки і антивірусних антибіотиків. В деякихкраїнах дозволено використовуватиантибіотикимедичногопризначенняабосинтезовані для захистурослин в чистому
виглядіабо в сумішізфунгіцидами.
Деякізарубіжніфірмивжевипускаютьпрепаратиантибіотиків
спеціально для захистурослин: бластоцидин, касугиміцин, поліоксин,
валідаміцин та інші. В нашійкраїнінайбільшпоширенішимиантибіотикамиєтрихотецин, фітобактеріоміцині фітолавін-100.
Всі антибіотики були виділені за рахунок мікроорганізмів, число їх було суттєво збільшено шляхом хімічної модифікації. Цілі модифікації:
1. Розширення спектра дії і підвищення ефективності антибіотиків.
2. Зниження токсичності і позбавлення їх побічної дії.
3. Створення аналогів, які стійкі до розщеплення мікробами.
4. Удосконалення способів їх введення.
Розглянемо комплекс біотехнологічних проблем, які безпосередньо зв’язані з процесом біосинтезу антибіотиків. Цикл розвитку продуцентів антибіотиків, як правило, складний. Більшість антибіотиків являється вторинними речовинами. В екологічному плані утворення антибіотиків розглядається як фактор адаптації: здатність до утворення антибіотиків важлива для продуцента не постійно, а лише коли виникають несприятливі умови для росту цих мікроорганізмів, наприклад при контакті з специфічними продуктами життєдіяльності іншого мікроорганізму.
Для налагодження виробництва антибіотиків за допомогою біотехнологій, потрібно знати про генетичну детермінацію утворення антибіотиків. Інформація про генетичний контроль біосинтезу важлива для розробки технологій, які дозволяють людині впливати на утворення антибіотиків на генетичному рівні. Відомо, що в утворенні антибіотиків може бути включено до 1% генів продуцента (наприклад в роду Streptomyces) і ця частина ДНК не втрачається під час селекції в природних умовах, хоч її експресія може затримуватись на тривалі періоди. Цим підкреслюється еволюційне значення антибіотиків. Також за синтез антибіотиків відповідають деякі плазміди. Але наявність в плазмідах структурних генів для ферментів біосинтезу антибіотику доведена лише для метиленоміцину. Тому в більшості випадків плазмідам приписується роль регуляторів процесів синтезу. При виробництві антибіотиків в ферментерах може відбуватись процес втрати плазмід міцелієм через механічні впливи на нього. Це призводить до зменшення утворення антибіотиків і швидкого росту непродуктивного міцелію в ферментерах. Але відомо також, що у ряду промислових продуцентів плазміди не знайдені.
Період ферментації на багатих поживними речовинам середовищах поділяються на трофофазу і ідіофазу. Відомо, що під час трофофази антибіотики у значних кількостях не утворюються. Це обумовлено або репресією ферментів їх синтезу, або ж посттрансляційним контролем. Але молекулярні механізми регуляції біосинтезу антибіотиків складом поживного середовища (вуглеводними, фосфорними та азотовмісними компонентами) ще далеко не вивчені. Дуже вірогідно, що майбутній прогрес в області біосинтезу може бути пов’язаний з використанням ще мало вивчених плейотропних біологічних регуляторів первинного метаболізму типу високо фосфорильованих нуклеотидів, від яких залежить інтенсивність синтезу макромолекул і відповідно рівень внутрішньоклітинного фонду низькомолекулярних метаболітів.![]()
Перейдемо до розгляду біотехнології виробництва антибіотиків. Існує декілька способів отримання нових антибіотиків. Вони базуються на модифікації антибіотиків ферментами мікроорганізмів.
Особливо успішно модифікація антибіотиків мікроорганізмами проходить в наступних процесах.
1. При ферментативному гідролізі пеніциліну з утворенням 6-амінопеніцмлланової кислоти (6-АПК), яка являється цінним вихідним продуктом при виробництві деяких напівсинтетичних, важливих для медицини аналогів пеніциліну. В промисловості 6-АПК, ядро молекули пеніциліну або бензилпеніциліну при участі штамів, які з високим виходом утворюють в ході ферментації пеніцилін азу. Для цієї ж цілі також використовують іммобілізовану пеніциліназу. На основі 6-АПК дістали біля 40000 напівсинтетичних пеніцилінів. Можливий також процес перетворення бензилпеніциліну в ампіцилін (рис.3). При цьому спочатку проводять гідроліз бензилпеніциліну здійснюють за допомогою мутантного штаму Kluyveracitrophila, після чого в ферментер вносять мутант Pseudomonasmelanogenumі метиловий ефір DL-фенілгліцину. В ролікаталізаторавиступаєацилаза, яка
утворюється мутантом P. Melanogenum. 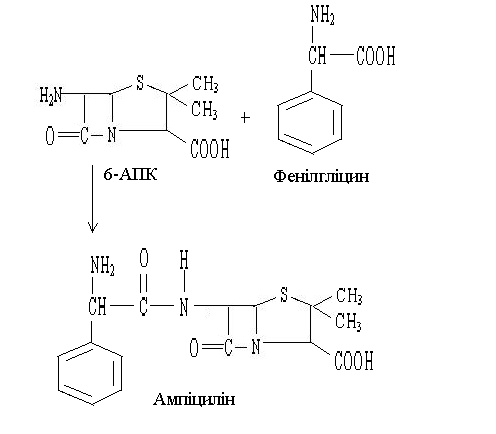
Рис.3. Синтез ампіциліну
2. У медицині широко застосовуютьсяаміноглікозидніантибіотики (стрептоміцин, неоміцин, канаміцин, гентаміцин). Бактерії, якіздатніїхінактивувати, були виділені не тількивідхворих, але й як самостійні штами, що утворюють антибіотики. Їх ферментативна активність може бути частиною механізму детоксикації, за допомогою якого продуценти захищають себе від шкідливої дії вироблених ними антибіотиків. Встановлення механізму модифікації дозволило планувати і здійснювати хімічний синтез нових аналогів, стійких до такої інактивації. Відомо, що при інактивації антибіотиків проходять модифікації, до числа яких відносяться N-ацетилування, О-фосфорилювання, О-нуклеотидування.
Інактивація антибіотиків по іншому механізму, включаючи гідроліз, гідроксилювання, епоксидування, фосфорилювання, або відновлення, звичайно призводить до утворення повністю, або частково неактивних похідних. Їх вивчення дозволяє синтезувати нові аналоги, виявити ті ділянки молекул, які відповідають за антибіотичну активність, а також створити раціональні основи „конструювання” антибіотиків і удосконалення їх виробництва. В деяких випадках отримати корисні попередники за допомогою бактерій не вдається. Так, при виробництві цефалоспорини в основному утворюється цефалоспорин С, який далі гідролізують до 7-аміноцефалової кислоти і її використовують як субстрат для добування нових цефалоспоринів.
3. В випадку прямої ферментації використовуються мікроорганізми, які використовують антибіотик для синтезу біологічно активних сполук в присутності деяких попередників або інгібіторів метаболізму. Наприклад, Penicilliumchrysogenum не тільки синтезує пеніцилін, але й включає феніл оцтову кислоту в бензилпеніцилін, а інші попередники – в аналоги пеніциліну. Цей принцип знаходить широке застосування, наприклад, при отриманні нових блеоміцинів шляхом додавання амінів до культури S. verticillus і нових актиноміцинів – шляхом додавання 4-метилпроліну до середовища для вирощування S. parvulus.
4. Мутантні мікроорганізми-продуценти іноді утворюють біологічно активні проміжні продукти якого-небудь визначеного шляху біосинтезу антибіотиків або сполуки, які можуть виявитись попередниками при створенні нових антибіотиків. „Блоковані” мутанти цього типу не здатні утворювати потрібний антибіотик, я що в середовищі відсутній метаболічний попередник, який в нормі утворюється при участі ферменту, який діє услід за блокованою ланкою метаболізму. Оскільки ферменти, які беруть участь у вторинному метаболізмі, часто володіють відносно низькою субстратною специфічністю, аналоги попередників антибіотиків можуть бути відносно легко перетворені мутантом в аналоги самого антибіотика. Цей процес називається мутаційним біосинтезом. Наприклад Nokardiamediterraneiсинтезує біля 20 різних рифаміцинів.
Крім антибіотиків, важливе значення для медицини та різних галузей народного господарства має біосинтез алкалоїдів. Алкалоїди представляють собою дуже важливу групу біологічно активних речовин, основу багатьох лікарських препаратів. До алкалоїдів відносять речовини природного походження, які, як правило, містять азот і мають достатньо складну структуру.
Алкалоїди синтезуються в основному рослинами, грибами, бактеріями і актиноміцетами. Велика увага приділяється саме мікроорганізмам, як джерелам цих речовин. Знання фізіолого-біохімічних особливостей мікроорганізмів-продуцентів, механізмів біосинтезу алкалоїдів дає можливість керувати процесом отримання алкалоїдів безпосередньо в ході їх синтезу. Методами селекції і генетики на основі диких штамів можуть бути отримані високоактивні продуценти алкалоїдів. Тобто є цілий ряд переваг отримання антибіотиків за допомогою мікроорганізмів в порівнянні зі способами добування їх з рослинного матеріалу.
Найбільший інтерес в якості продуцентів в зв’язку з перспективою їх використання в промисловості представляють гриби, і в першу чергу аскоміцети з родів Сlaviceps i Penicillum, які мають здатність синтезувати ергоалкалоїди.
Все більший інтерес до ергоалкалоїдів пояснюється унікальним спектром їх біологічної активності, який може різко змінюватись в залежності від структури. Якщо спочатку для в медицині використовували неочищені грубі екстракти алкалоїдів, то тепер все більш широке застосування знаходять напівсинтетичні похідні, в якості вихідних для яких виступають природні ергоалкалоїди. Такі похідні характеризуються меншою токсичністю, простотою синтезу і є більш ефективними.
Ергоалкалоїди і їх похідні використовують для профілактики і лікування мігрені, в якості препаратів, які регулюють кров’яний тиск, для лікування різних порушень гормонального обміну, наприклад хвороби Паркінсона.
В промисловості застосовують глибинне культивування Clavicepspurpurea(ріжки). Цей спосіб вперше був здійснений Абе з співробітниками і розвинений Чейном і іншими групами дослідників із різних країн.
Для ергоалкалоїдів характерна наявність тетрациклічної ерголенової або ерголінової системи (рис.4.).
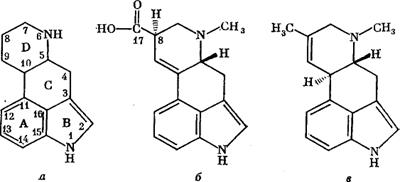
Рис.4. Типовіпредставники ергоалкалоїдів.
а— эрголін; б — лізергінова кислота; в — агроклавін
Механізм біосинтезу ергоалкалоїдів у різних культур може мати свої особливості, але основні його етапи являються для всіх вивчених продуцентів спільними. Попередниками ергоалкалоїдів являються триптофан і ,-диметилалліпірофосфат. Перша стадія біосинтетичного шляху - утворення 4-,-диметилаллітриптофану (ДМАТ) – каталізується ферментом ДМАТ-синтетазою. Наступна стадія – метилування ДМАТ з наступним декарбоксилуванням, модифікацією ізопреноїдного бічного ланцюга з замиканням кільця С.Кінцевим продуктом цих перетворень являється ханоклавін-1, із якого через ханоклавін-1-альдегід, агроклавін і елімоклавін утворюється лізергінова кислота, попередник алкалоїдів лізергінової кислоти – амідів лізергінової кислоти і пептидних ергоалкалоїдів. Попередниками інших клавінових алкалоїдів служать агроклавін і елімоклавін. Біосинтез
5.Виробництво і застосування стероїдів і вітамінів.
Людство протягом ряду століть одержувало метали збагатих руд іконцентратів. Вони в більшостівипадківхарактеризувалисяпорівняно простим хімічним складом. Однакіснуючатехнологіянайчастіше не вирішувалаі не вирішуєтакіпроблеми, як комплекснеіраціональневикористанняприроднихресурсів, охоронанавколишньогосередовищаі т.д.
Існуючатехнологія не дозволяєтакожекономічновигідноперероблятискладнірудиіконцентрати. Наприклад, існуютьродовища золота, олова, міді, цинку, марганцюй інших металів, добуванняякихз руд по традиційних схемах складне чинеможливо. Очевидним уже єі те, що в недалекому майбутньомукондиційнірудивзагалібудутьвиробленіітодіпостанепитання про видобутокметалів з бідних руд, різнихвідходівігірськихпорід. Тому теперпосталопитання про розробку більш досконалих технологічних схем отримання металів з руд, концентратів, гірськихпорідірозчинів, зокремагідрометалургійних. Одним зїхніхрізновидівємікробіологічнийспосіб.
На стикубіотехнології і хіміївиникаєбіогеотехнологіяметалів – наука про вилученняметалівіз руд, концентратів, гірськихпорід і розчинівпіддієюмікроорганізмів або їх метаболітів при нормальному тиску і температурі від 5 до 80 єС.
Підземне і купинчасте бактеріально-хімічне вилуговування міді із бідних руд і урану в промислових масштабах здійснюється в багатьох країнах світу. Вже в 80-х роках тільки міді добували сотні тисяч тон в рік. Собівартість такої міді була нижчою (часто в 2-3 рази), ніж вартість міді, що добували традиційним шляхом.(http :// www . allmetal . ru / info / dict / view . php ? i =149 ).
Також існують процеси чанового бактеріально-хімічного способу вилуговування, які застосовують для переробки складних мідних, цинкових, нікелевих, олово- та золотовмісних руд; технології неперервного бактеріально-хімічного способу добування золота і срібла, яка забезпечує вилучення золота і срібла більше 90%.
За допомогою бактерій можливо якісно очищувати різні концентрати від домішок, при чому ці домішки також можливо використовувати. Наприклад із свинцевих концентратів можливо практично повністю вилучити мідь, цинк і кадмій і при цьому концентрація Cu і Zn в розчині може сягати 50 і 100г/л відповідно. За допомогою бактеріально-хімічного способу можливо селективно переводити в розчин із металоколоїдних колективних мідно-цинкових концентратів до 90% цинку, а далі добути концентрати міді і кадмію при вилученні їх відповідно до 80 і 90%.
До нових тенденцій розвитку біотехнології або біогеотехнології металів належить віднести збагачення гірських порід і руд, наприклад, бокситів (вилуговуванням. Si), сульфідування окисленных руд, біосорбцію металівіз розчинів. Використаннябактеріально-хімічних. способівдозволяєрозширитисировинніресурси, забезпечитикомплексністьвикористаннясировини без утворенняскладнихгірничодобувнихкомплексів, автоматизувати процеси, підвищити продуктивність праці і культуру виробництва, вирішити багато проблем навколишнього середовища.
Література
1. Биотехнология / отв. ред. академик А.А. Баев – М: Наука, 1984, - 311с.
2. .Сассон Альбер, Біотехнологія: Свершения и надежды, - М: Мир,1987, 411с.
3. http://www.rccnews.ru/Rus/FinancialInstitution/?ID=46499
4. http://www.rccnews.ru/Rus/Pharmaceuticals/?ID=8062
5. В.Т. Емцов, Рубежибиотехнологии, - М: Агропромиздат,1986,159с.
6. Бест Д., Химия и биотехнология. В кн.Биотехнология. Принципы и применение. / под. ред. И. Хиггинса, Д. Баста, Дж. Джонса, - М: Мир, 1988, 479 ст.
7. http://www.allmetal.ru/info/dict/view.php?i=149
8. http://www.lol.org.ua/ukr/showart.php