Окиснювальне старіння пива та його стабілізація
СОДЕРЖАНИЕ: Фізико-хімічна характеристика пива. Вивчення ферментативних і неферментативних процесів окиснювального старіння пива та перевірка можливості його стабілізації, з застосуванням для цього газоволюмометричного та хемілюмінесцентного методів дослідження.МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ХІМІЧНИЙ ФАКУЛЬТЕТ
МАГІСТЕРСЬКА РОБОТА
на тему: Окиснювальне старіння пива та його стабілізація
Магістр: Левада Юрий Петрович
Спеціальність: 8.07301 “Хімія”
Керівник: к.х.н., доцент
Юраева Тетяна Анатоліївна
Донецьк-2005
Зміст
Вступ
1. Теоретична частина
1.1 Фізико-хімічна характеристика пива
1.2 Процеси окиснювального старіння пива та методи їх гальмування
1.2.1 Неферментативні процеси окиснення
1.2.2 Ферментативне окиснення
2. Експериментальна частина
2.1 Газоволюмометричний метод
2.2 Хемілюмінесцентний метод
2.3 Техніка безпеки
3. Окиснювальне старіння пива та його стабілізація
Висновки
Література
Вступ
Серед багатьох хімічних процесів, що ведуть до погіршення якості харчових продуктів, чи не найголовніше місце посідають окиснювальні процеси. Пиво у цьому відношенні є дуже вразливим, оскільки навіть незначний перебіг окиснювальних процесів у ньому призводить до суттєвого погіршення органолептичних якостей напою, які, як відомо, є найголовнішими критеріями якості для споживача. Такі процеси прийнято називати окиснювальним “старінням” чи органолептичним “старінням”[1].
Дуже важливим є те, що процеси окиснювального старіння не починаються лише при зберіганні напою. Вони супроводжують напій під час всієї технологічної схеми його виготовлення [1–3]. Наслідком перебігу таких процесів є накопичення у пиві великого спектру речовин, що негативно впливають на смак та аромат напою. Але найбільш небезпечними є карбонільні сполуки, що і отримали відповідну назву – “карбоніли старіння”. В наслідок низького порігового значення смаку та аромату ці речовини є особливо небезпечними [4].
Існує багато наукових робіт, що присвячені питанню окиснювального старіння пива. Всі автори приходили до висновку, що ці процеси є неминучими і єдине, що можна зробити, – вплинути на швидкість їх перебігу, тобто підвищити антиокиснювальну стійкість напою [4–6]. Було встановлено, що такі процеси йдуть за радикально-ланцюговим механізмом. Не дивлячись на такі успіхи, питання окиснювального старіння пива є й досі невирішеним.
Метою даної роботи стало вивчення процесів окиснювального старіння пива та перевірка можливості його стабілізації, з застосуванням для цього газоволюмометричного та хемілюмінесцентного методів дослідження.
1. Теоретична частина
1.1 Фізико-хімічна характеристика пива
Для осягнення всієї сукупності складних фізико-хімічних перетворень, які перебігають у пиві слід ознайомитись з хімічним складом цього природного об’єкту. Пиво має дуже складний хімічний склад. У залежності від сорту пива, технології його виготовлення та використаної сировини змінюється його кількісний та якісний склад. Для більшої зручності прийнято розділяти всі компоненти пива на головні та мінорні.
Головними компонентами пива є вода (91 – 93%), вуглеводи (1,5 – 4,5%), етиловий спирт (3,4 – 4,5%) та азотвмісні сполуки, які представлені, головним чином, амінокислотами та поліпептидами (0,2 – 0,65%). Переважна кількість вуглеводів пива (75 – 85%) складається з декстринів. На прості сахара (глюкоза, фруктоза, сахароза) припадає 10 – 15% від загальної кількості вуглеводів. І тільки 2 – 3% вуглеводів представлені складними сахарами (полісахариди та ін.). Пиво містить незначну кількість вищих спиртів (50 – 100мг/л), метиловий спирт практично відсутній .
Мінорними компонентами пива є мінеральні речовини, вітаміни, органічні кислоти, фенольні сполуки, гірки речовини, ароматичні речовини, біогенні аміни, естрогени.
У біологічно значимій кількості у пиві присутні іони калію, кальцію, магнію, фосфору, сірки, хлору. Також присутні іони заліза, міді, цинку та іони інших металів. У пиві багато вітамінів групи В, а саме В1 , В2 . Також присутній вітамін С, який іноді штучно додають до напою для запобігання процесів окиснення інших компонентів. Майже всі вітаміни присутні у пиві у фосфорельованій формі. Органічні кислоти представлені у пиві головним чином лимонною, піровиноградною, оцтовою, глюконовою, щавлевою кислотами. Цим і пояснюється те, що рН свіжого пива знаходиться у кислій області (рН = 5,1 – 5,4).
Загальний вміст фенольних сполук коливається в межах 150 – 300мг/л. Більш за все у пиві міститься антоцианидинів (лейкоцианидини, протоцианидини, лейкоантоцианидини). Всі гіркі речовини пива поділяють на мало- та високосмолисті. Малосмолисті речовини складаються з – кислот (гумулони), – кислот (лупулини) та інших сполук, які ще не ідентифіковані. На сьогодні ідентифіковано близько 70 компонентів, віднесених до класу ароматичних сполук пива. Всі ароматичні речовини поділяють на відновнену та окиснену фракції. Відновнена фракція включає у себе монотерпени (міріцен) і сескьютерпени (-каріофілін, гумулін, фарнісин та ін.). Окиснена фракція складається з терпенових спиртів (ліналуол, гераніол), інших спиртів, альдегідів, кетонів, ефірів та їх похідних. З біогенних амінів у пиві були ідентифіковані кадаверин, путресцин, гістамін, тирамін. Естрогени є речовинами ,що створюють чіткий гормональний вплив на людину. У пиві таких речовин не так багато.
Вміст головних та деяких мінорних компонентів пива можна виразити у вигляді таблиці (табл.1.1; 1.2).
Таблиця 1.1 – Вміст головних компонентів пива
| Компонент | Вміст (мг/л) | |
| 1 | Вода | 91-93% |
| 2 | Глюкоза, сахароза, фруктоза | 2,6-2,9 г/л |
| 3 | Полісахариди та фрагменти пектина | 0,52-2,08 г/л |
| 4 | Етиловий спирт | 30 г/л |
| 5 | Вищі спирти | 50-100 мг/л |
Таблиця 1.2 – Вміст деяких мінорних компонентів пива
| Клас речовин | Вміст (мг/л) | |
| Мінеральні речовини | ||
| 1 | К | 160-450 |
| 2 | Na | 120 |
| 3 | Ca, Mg | 80 |
| 4 | P | 140 |
| 5 | Fe, Cu, Zn | не перевищує 1 |
| Вітаміни | ||
| 1 | В1 | 0,005-0,15 |
| 2 | В2 | 0,3-1,3 |
| 3 | С | 20-50 |
| 4 | Нікотинова кислота | 5-20 |
| 5 | Фолієва кислота | 110 |
| 6 | В6, Пантотенова кислота | 0,4-1,7 |
| 7 | Біотин | 5 |
| Органічні кислоти | ||
| 1 | Лимонна кислота | 130 |
| 2 | Піровиноградна кислота | 60 |
| 3 | Оцтова кислота | 90 |
| 4 | Глюконова кислота | 30 |
| 5 | Щавлева кислота | 15 |
| Фенольні сполуки | ||
| 1 | Антоцианідини | 14-77 |
| 2 | Еллагікова, протокатехінова, ванілінова, саліцилова, п-оксібензойна кислоти |
не перевищує 1 |
| 3 | Фенол, ортокрезол, кумарини | не перевищує 1 |
| 4 | Катехіни | 5-55 |
| 5 | Епікатехіни | 9-24 |
| 6 | Рутин | 1-6 |
| 7 | Кверцетин | 5-125 |
| 8 | Хлорогенова кислота, Кофейна кислота | 2-20 |
| 9 | Кверцетрин, Мирицитрин | 1 |
| 10 | Куінова кислота | 1-5 |
| 11 | Ферулова кислота | 2-21 |
| 12 | Синапиковая кислота | 1-20 |
| 13 | Камферол | 5-20 |
| 14 | Галова кислота | 5-29 |
| Біогенні аміни | ||
| 1 | Кадаверин, Путресцин, Гістамін, Тирамін | 1-3 |
Оскільки сусло є попередником пива і окиснювальні процеси здатні зароджуватися вже у суслі, варто роздивитись хімічний склад і цього субстрату. Сусло практично не відрізняться від пива за якісним складом. Але кількісні склади цих субстратів сильно різняться між собою за вмістом головних та деяких мінорних компонентів пива (вуглеводи, етиловий спирт, азотвмісні сполуки, органічні кислоти та ін.). У порівнянні із пивом сусло містить значно більше сахарів, амінокислот, поліпептидів, органічних кислот, речовин ліпідної природи. Проте в суслі практично відсутні етиловий спирт, диацетил та інші продукти бродіння. Цією відмінністю і пояснюється різне відношення цих субстратів до окиснювальних процесів (у сусла дуже низька антиокиснювальна стабільність порівняно з пивом).
1.2 Процеси окиснювального старіння пива та методи їх гальмування
Існує великий об’єм емпіричних та теоретичних знань щодо процесів старіння пива. Найбільш добре відомий негативний вплив, що створює кисень протягом усієї технології виготовлення напою. Відповідальність за смак, що виникає у пива при його старінні, беруть на себе, у першу чергу, карбонільні сполуки, які у невеликих концентраціях сильно впливають і на аромат. При цьому кисень може додатково вплинути на утворення смаку, що виникає при старінні пива в результаті [7]:
утворення важливих, з точки зору старіння речовин, що впливають на аромат пива;
утворення речовин -“попередників” цих речовин;
зменшення вмісту антиоксидантів, в результаті чого пізніше кисень може призвести до протікання окиснювальних реакцій.
До реакцій старіння пива можна віднести багато процесів окиснювальної природи. Проте головний внесок у формування смаку та аромату старого пива роблять процеси окиснення вищих спиртів, окиснювальний розпад ізогумулонів, реакція Майяра та розпад Штреккера, автоокиснення жирних кислот, ферментативний розпад жирних кислот, фотоокиснення жирних кислот, вторинне автоокиснення альдегідів та інші процеси. Умовно ці процеси можна поділити на процеси ферментативного та неферментативного окиснення. Велика частина з перелічених вище реакцій ідуть за участю вільних радикалів, утворення яких підсилюється під впливом кисню і відбувається, у першу чергу, в результаті каталітичних реакцій, що викликаються іонами заліза та міді [4].
На даний момент існує багато методів підвищення антиокиснювальної здатності пива. Одним із хімічних методів є введення антиоксидантів та рослинних екстрактів, що містять такі речовини. Для цього використовують сполуки – солі сірчистої та тіосірчистої кислот, а також -аскорбінову та ізоаскорбінову кислоти та їх солі [3,7]. Але використання аскорбінової кислоти, що активно рекламується, як вже встановлено, призводить до утворення дигідроаскорбінової кислоти, присутність якої у пиві у високих кількостях небажано через негативний вплив на якість напою. У той же час використання у пивоварінні відновлюючих речовин на основі сірки у великих кількостях також небажано через помітне погіршення смаку при зберіганні пива [3]. Широко пропонується використання сбалансованої суміші сполук сірки з ерітроборатом натрію [3].
На даний момент часу проведено багато робіт по вивченню АОА рослинних екстрактів. При вивченні АОА екстракту деревини дуба, який використовується для виробництва вина, встановлено, що цей екстракт виявляє високу АОА у суспензіях клітин крові людини. За виявленим ефектом дубовий екстракт суттєво переважає деякі антиоксидантні біологічно активні добавки [8]. Варто підкреслити, що вивчений екстракт, пригноблюючи утворення активних форм кисню, запобігає цитотоксичним ефектам вільнорадикального окиснення на самих ранніх стадіях.
Виявлення АОА у екстрактів дуба в біологічних системах, отриманого за ГОСТ Р 51299-99, відкриває перспективу досліджень, що направлені на пошук шляхів його використання у складі харчових продуктів.
Екстракти з трави м’яти, листя підбілу, плодів горобини, трави чебрецю і звіробою, отримані згідно ТУ У 18.483-98, вже тестувалися на пиві. Було встановлено, що їх введення у середині технологічної схеми виготовлення напою не тільки підвищує смакову стабільність готового напою, а також позитивно впливає на збереження гірких речовин хмелю, що у кінцевому результаті покращує смак пива [9].
1.2.1 Неферментативні процеси окиснення
До цього класу можна віднести процеси старіння пива, що йдуть без участі ферментів. Одним із таких процесів є окиснення вищих спиртів. Вони були відкриті на модельних розчинах пива. Меланоідини при окисненні спиртів є окислювачами. Відбувається перенос атому водню гідроксильної групи спирту у карбонільну групу меланоідинів, причому із спирту утворюється відповідний альдегід. Молекулярний кисень не бере участі у цій реакції безпосередньо, але він здатний її прискорювати. Ця реакція інгібується ізогумулонами та поліфенолами. Окиснення вищих спиртів у темряві протікає дуже повільно і здатність спиртів вступати у реакцію із збільшенням вуглеводневого радикалу, зменшується [4]. Тому при умові правильного зберігання напою таким процесом можна знехтувати.
Окиснювальний розпад ізогумулонів також є небезпечним для смаку пива. Такий процес, особливо при підвищених температурах, призводить до суттєвого зменшення гіркоти напою [4]. Було встановлено, що при окиснювальному розпаді ізогумулонів утворюються пропан-2-он, 2-метилпропаналь, 3,4-диметил-2-он, а також 2-метил-3-бутил-2ол [4,10]. Меланоідини тут виступають у якості антиокисників [4].
Ще одним неферментативним процесом погіршення якості пива є реакція Майяра та розпад Штрекера. У цих процесах утворюються різні -дикарбонільні сполуки, які в рамках розпаду Штрекера здатні реагувати з амінокислотами. При цьому амінокислота у ході декарбоксилювання переводиться в альдегід, в якому на один атом вуглецю менше:
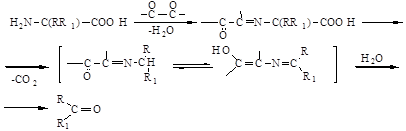
Цей процес каталізується у темряві за участю слідів іонів металів. На світлі розпад іде швидше, при цьому сприятливим фактором є присутність рібофлавіна, поліфенолів та спиртів [2,4].
Альдегіди, що утворюються в реакції Майяра та розпаді Штрекера, не належать до компонентів, що визначають “старіння” пива. Але розпад Штрекера вважається причиною формування хлібного смаку у пиві [11 – 13].
Автоокиснення ненасичених жирних кислот та їх ефірів відбувається чи не в кожному жировмісному харчовому продукті. Пиво не є виключенням.
У пиво потрапляє певна кількість жирних кислот із сировини (зерно та хміль).
Ячмінь вміщує близько 2% ліпідів, які представлені як тими, що вміщують, так і тими, що не вміщують гліцерин компонентами, а також вільними жирними кислотами.
Усі жирні кислоти, що входять до складу ліпідів, поділяють на дві групи: насичені, тобто ті, що не містять подвійних зв’язків, та ненасичені – ті, що містять подвійні зв’язки.
В ячменю, головним чином, містяться ненасичені жирні кислоти. У хмелю вміст ліпідів складає біля 3% сухої речовини, а вільні жирні кислоти – біля 20% його летких компонентів, що є досить значною величиною [2].
Саме ненасичені жирні кислоти та їхні етилові ефіри, що утворилися при бродінні, навіть при незначному потраплянні у пиво несуть у собі загрозу смаку напою. Тільки ненасичені жирні кислоти окиснюються досить швидко, щоб їх можна було вважати речовинами, які обумовлюють смак старого пива [11].
Так, ліноленова кислота окиснюється у 3 - 4 рази швидше порівняно з лінолевою, а остання, у свою чергу, - у 30 разів швидше масляної кислоти. На модельних розчинах пива було встановлено, що автоокиснення жирних кислот відбувається за радикальним механізмом [10].
При цьому радикал, у більшості випадків радикал пероксиду, відщеплює атом водню від молекули жирної кислоти. Новий радикал, що утворився, реагує з молекулярним триплетним киснем з утворенням радикалу пероксиду, який відщеплює атом водню у наступної молекули жирної кислоти та трансформується у гідропероксид жирної кислоти [4]. Оскільки лінолева кислота характеризується максимальним вмістом у ячменю порівняно з іншими ненасиченими жирними кислотами, тому доцільно роздивлятись автоокиснення на її прикладі.
Загальна схема процесу автоокиснення є такою:
RH + R O2 • R OOH + R•
R• + O2 RO2 •
RO2 • + RH ROOH + R•
(RH – лінолева кислота; R O2 • - пероксирадикал)
У випадку лінолевої кислоти радикал пероксиду атакує в паралельному до подвійного зв’язку положенні молекулу жирної кислоти, найчастіше у одинадцятого атома вуглецю, оскільки тут через можливу резонансну стабілізацію карбону через п’ять атомів вуглецю водень може бути відщеплений легше за все, але атака можлива і на атоми вуглецю 8 та 4, які також знаходяться поряд із подвійним зв’язком. У результаті утворюється ціла серія гідропероксижирних кислот, причому 9 та 13-гідропероксилінолева кислота характеризується найвищою концентрацією [4]. Утворені гідропероксижирні кислоти не є стабільними і тому здатні розщеплюватися. Саме в результаті цього процесу і утворюються карбоніли старіння. Схематично для гідропероксилінолевої кислоти такий розпад може мати вигляд:
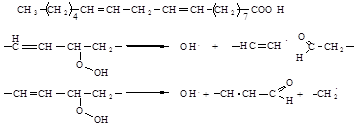 |
Тут зображено -розщеплення. Залежно від того, розщеплюється молекула за варіантом А чи Б, утворюються різні продукти.
Розщеплення з позиції Б енергетично вигідне. З одного боку, утворюється ненасичений альдегід, а з іншого, – жирна кислота, що складається з короткого ланцюгу. Радикал гідропероксиду (• ОН), що утворився, є надзвичайно активним і може відщеплювати водень практично від усіх органічних молекул, оскільки виграш в енергії у результаті утворення зв’язку ОН у будь-якому випадку більше енергії, яка необхідна на розщеплення зв’язку СН.
Іони важких металів створюють каталітичну дію на процеси окиснення. Окрім того, реакціям окиснення ненасичених жирних кислот сприяє підвищена температура, низьке значення рН та наявність окисників.
Можна роздивитись утворення радикалів у формі реакцій Фентона та Хабера- Вайса на прикладі пероксиду водню.
Реакція Фентона:
Fe2+ + H2 O2 Fe3+ + OH• + OH
Fe3+ + H2 O2 Fe2+ + O2 • + 2H+
Разом: 2H2 O2 OH• + OH + O2 • + 2H+
Реакція Хабера-Вайса:
Cu2+ + O2 • Cu+ + O2
Cu+ + H2 O2 Cu2+ + OH• + OH
Разом: O2 • + H2 O2 O2 + OH• + OH
Пероксид водню окислює іони заліза (II) до заліза (III), причому утворюється гідроксильний радикал та іон гідроксилу. Далі залізо (III) реагує з наступною молекулою пероксиду водню з утворенням двох протонів і одного супероксидного радикалу. Мідь (II) реагує з супероксидом з утворенням міді (I) та кисню.
Мідь (I) розщеплює молекулу пероксиду водню на іон гідроксила та гідроксильний радикал. Радикали, що утворилися, є надзвичайно активними та можуть призвести до зародження нових ланцюгів окиснення.
Поряд із автоокисненням ненасичених карбонових кислот іде процес фотоокиснення цих речовин. У фотоокисненні збуджений сенсибілізаторами синглетний кисень реагує, не потребуючи каталізаторів. Цей процес майже не залежить від температури. Продуктами цих процесів є гідропероксикислоти та альдегіди, що утворюються при розкладі таких кислот [3]. Ця реакція залежить тільки від кількості кисню в субстраті та від наявності сенсибілізаторів, таких як рибофлавін (вітамін В2 ), хлорофіл, похідні порфірину та інші барвники. Взаємодія із синглетним киснем відбувається набагато швидше реакції з триплетним киснем, тому захисту пива від світла придають велике значення.
Було встановлено у пиві утворення різних насичених, а також однократно та двократно ненасичених альдегідів при фотоокисненні олеїнової та лінолевої кислот [14].
Ненасичені альдегіди, що утворюються при окисненні ненасичених жирних кислот, здатні окиснюватися далі. Так, при вторинному автоокисненні ненасичені альдегіди переводяться у насичені з більш коротким вуглеводневим радикалом. Було встановлено, що, наприклад, з транс-2-ноненалу можуть утворитися пентанал, гексанал, гептанал та октанал [10]. Цим пояснюються повідомлення різних авторів про те, що концентрація транс-2-ноненалу, який утворюється на початку старіння, при глибокому окисненні поступово зменшується [4].
Усі вищеперелічені неферментативні окиснювальні процеси можуть бути зароджені металами змінної валентності. Ці процеси на даний момент широко вивчені. Оскільки залізо присутнє майже в усіх природних об’єктах, тому розгляд більш доцільно проводити на прикладі залізоініційованого окислення. Так залізо сприяє зародженню ланцюгів за схемою [15]:
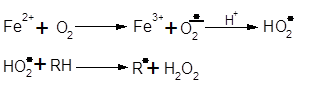 |
У випадку наявності у системі відновників з підходящим редокс-потенціалом (аскорбінова кислота та ін.) відбувається регенерація Fe3+ до Fe2+ за схемою:
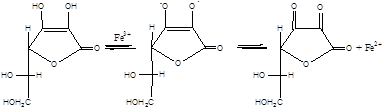 |
Відновлене залізо знову здатне зароджувати ланцюги окиснення.
1.2.2 Ферментативне окиснення
Окиснювальні процеси не починаються у готовому пиві, вони вже відбуваються при виробництві солоду та сусла. Ячмінь містить складну ферментативну систему. Активність цих ферментів сильно зростає при пророщуванні зерна. У цей час відбувається часткове розщеплення ліпідів під дією ліпаз. Дія ліпаз спрямована на складноефірну групу між гліцерином та високомолекулярними жирними кислотами. Утворені вільні карбонові кислоти здатні окиснюватися набагато легше, ніж їхні ефіри. Ферментом, що зумовлює окиснення ліпідів, є ліпоксигеназа. Під дією цього ферменту у присутності кисню повітря ненасичені жирні кислоти (олеїнова, лінолева, ліноленова) перетворюються у гідропероксиди, які здатні розпадатися на різних стадіях виробництва пива з утворенням карбонілів[2,4]. Так, під дією ліпоксигенази утворюється такий діальдегід, як нонадінал, що відповідає за появу “огіркового” запаху солоду. Оптимальна умова дії ліпоксигенази рН=6,0 та температура 28 – 300 С. Під час виготовлення сусла ліпоксигеназа активується і при значній кількості кисню відбувається активне утворення продуктів окиснення жирних кислот.
На стадії бродіння дріжджі відновлюють утворені карбоніли та гідроперекиси у відповідні спирти, які є безпечними для смаку напою. При розпаді гідроксикислот після бродіння утворені карбонільні речовини залишаються у пиві та погіршують його смак. Окрім ферментативних процесів окиснення з безпосередньою участю ферментів можна виділити процеси, де ініціаторами є метали змінної валентності (Fe), а ферменти виконують допоміжну роль. Як вже було описано у неферментативних процесах, залізо ініціює ланцюги окиснення за вищенаведеною схемою.
У випадку наявності у системі ферментів, де коферментом є НАДФН2, іони заліза відновлюються ланцюгом переносу електронів за наступною схемою [16,17]:
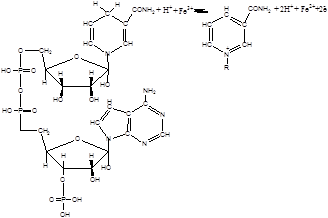 |
2. Експериментальна частина
2.1 Газоволюмометричний метод
Одним із простих і розповсюджених методів вивчення кінетики рідиннофазних реакцій окиснення органічних речовин є метод вимірювання кількості поглиненого кисню. Газоволюмометричний (ГВ) метод дозволяє вимірювати швидкість окиснення з великим ступенем точності при малих глибинах перетворення, коли впливом продуктів окиснення на кінетику реакції можна знехтувати.
Існують різні варіанти газоволюмометричних установок. Загальний принцип їхньої дії полягає у вимірюванні швидкості поглинання кисню при постійному тиску. Визначення кінетичних параметрів процесу інгібованого окиснення: період індукції, швидкість реакції з пероксильними радикалами, та ряд інших кінетичних характеристик проводили на установці для автоматичної реєстрації та запису поглинання кисню Кулон-1 з фотоелектронним датчиком заводу Інституту хімічної фізики РАН (рис.2.1).
Установка складається з реакційної судини (1), зануреної у термостатовану комірку (2), термостатованої газової бюретки (3), електролітичної комірки з платиновими електродами (електроліт - насичений розчин щавлевої кислоти) (4), регулятора тиску (5), заповненого ундеканом і манометра (6), фотоелектроннного датчика (8), підсилювача датчика (9), стабілізатора струму (10). Перед початком досліду бюретка, регулятор тиску і реакційна судина з речовиною, що окиснюється, заповнюються до атмосферного тиску киснем. Для проведення окиснення реакційна судина нагрівається до певної температури за допомогою термостата при безперервному перемішуванні, після двоххвилинного прогріву зєднується з бюреткою і регулятором тиску. Фотоелектронний датчик через стабілізатор струму зєднаний з електролітичною коміркою. Під час реакції кисень з бюретки надходить у реакційну судину, при цьому тиск у системі падає, і у звязку з цим вмикається електролітична комірка. Газ, що виділився з комірки, підвищує тиск у термостатованому обємі і піднімає рівень ундекану в бюретці, в результаті чого тиск у системі вирівнюється. Швидкість просування меніска ундекана в бюретці пропорційна швидкості реакції.
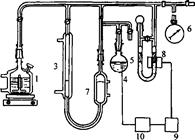
Рис. 2.1 Схема газоволюмометричної установки: 1 - реакційна судина; 2- термостат; 3 - газова бюретка; 4 - електролітична комірка; 5 - регулятор тиску; 6 - манометр; 7 - термостатований обєм; 8 – фотоелектронний датчик; 9 - підсилювач датчика; 10 - стабілізатор струму.
Сила струму на електролізері складала 0.2 А. Установка дозволяє вимірювати швидкість поглинання кисню від 10-7 -10-8 мольл-1 с-1 і більше. Обєм реакційної суміші дорівнює 5 мл, частота перемішування – 50-60 с-1 . Вимірювання проводили в кінетичній області при тиску кисню 1 атм і температурі 313К та 343К.
2.2 Хемілюмінесцентний метод
Одним з методів вивчення кінетики хімічних реакцій може бути вимірювання хемілюмінесценції, тобто світіння, яке супроводжує хімічні процеси. Хемілюмінесценція (ХЛ) виникає в екзотермічних елементарних актах реакцій, тому її характеристики закономірно пов’язані з характеристиками реакцій. Детальне вивчення закономірностей хемілюмінесценції в реакціях, які йдуть за участю вільних радикалів, показало, що світіння виникає в елементарних актах рекомбінації вільних радикалів за схемою:
|
RO2 • + RO2 • [ROOOOR] R=O* + O2 R=O + h
Як видно, світіння виникає при квадратичній рекомбінації пероксирадикалів і його інтенсивність (І) пропорційна швидкості цього процесу:
I = 6 k6 [RO2 • ]2 ,
де 6 – квантовий вихід світіння, тобто ймовірність перетворення енергії, що виділилася у результаті рекомбінації радикалів, в енергію кванта світла.
На рис 2.2 приведена схема приладу для вивчення реакцій рідиннофазного окиснення за хемілюмінесценцією. Прилад складається з реакційного сосуду 1, який знаходиться у світлонепроникній камері 2 і до якого під’єднана система продувки газу 3, охолодження 4 та термостатування 5, фотопомножувача ФЕУ-29, що захищений кожухом 7, підсилювача постійного струму (У1-7) 8, високовольтного випрямлювача стабілізатора (ІМТ-05) 9 та автоматичного електронного потенціометра (ЛКС4-003) 10. Світіння, яке виникає у процесі окиснення, через світлофільтр 11 спрямовується на зовнішній торець світлопроводу 12, а далі потрапляє на фотопомножувач, де світловий сигнал перетворюється у постійний струм, який через виносний каскад електрометричного помножувача потрапляє в електрометричний підсилювач 8 та реєструється за допомогою автоматичного потенціометра 10. Більш детально прилад описується в роботі [18].
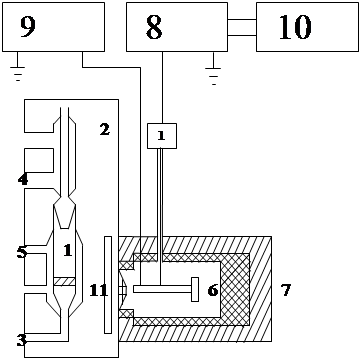
Рис. 2.2 Схема хемілюмінесцентної установки: 1-реакційний сосуд; 2-світлонепроникна камера; 3-продувка газа у реакційний сосуд; 4-зворотній холодильник; 5-вводи термостату; 6-фотопомножувач; 7-кожух фотопомножувача; 8-підсилювач постійного струму; 9-високовольтний стабілізатор; 10-електронний потенціометр; 11-світлофільтр; 12-світлопровід; 13-виносний каскад електрометричного підсилювача.
2.3 Техніка безпеки
Правила безпечної роботи в хімічних лабораторіях
Загальна організація роботи по техніці безпеки покладена на керівників відділів. Працювати в хімічних лабораторіях дозволяється особам віком не менше 18 років, які пройшли інструктаж з ТБ. У всіх приміщеннях лабораторії повинна бути встановлена витяжна вентиляція. Всі роботи, повязані з виділенням шкідливих парів або газів, повинні проводитись у витяжних шафах. Зберігання різних хімічних речовин у лабораторіях повинно відбуватись із врахуванням їх властивостей. Залишати робоче місце і нагрівальні прибори без нагляду заборонено. В кожній лабораторній кімнаті на певному місці повинні знаходитись вогнегасник, пісок, ковдра. Всі реактиви в лабораторіях повинні зберігатися у тарі з підписом. В лабораторії повинно знаходитись не менше двох чоловік. Всі роботи в лабораторії повинні проводитись при задовільному стані електрообладнання.
Основні правила безпеки при роботі з їдкими речовинами
Роботу з концентрованими кислотами та лугами без захисного обладнання заборонено. Концентрована кислота повинна зберігатись у товстостінному скляному посуді ємністю не більше 1 л у витяжній шафі. Розлиті кислоти або луги необхідно миттєво засипати піском. Після уборки піску це місце нейтралізують: кислоту - лугом або содою, луг - слабким розчином оцтової кислоти. Не можна набирати концентровані кислоти та луги в піпетки ротом. При використанні хромової суміші необхідно запобігати попаданню суміші на шкіру, одяг та взуття. Заборонено зливати концентровані кислоти та луги в каналізацію, їх слід окремо збирати в посуд і після нейтралізації зливати в зливи для неорганічних речовин.
Основні правила безпечної роботи з електрообладнанням та електроприладами
Заборонено переносити включені прилади та ремонтувати обладнання, що знаходиться під струмом. Заборонено працювати поруч з оголеними частинами обладнання. Заборонено загромаджувати підступи до електричних приладів. У випадку припинення подачі струму всі прилади повинні бути миттєво відключені. Заборонено залишати без нагляду включені прилади. У випадку загорання проводки слід негайно вимкнути електрику та погасити вогонь за допомогою вуглекислотного вогнегасника та ковдри з азбесту.
3. Окиснювальне старіння пива та його стабілізація
Як вже відомо, причиною органоліптичного старіння пива є перебіг окиснювальних процесів компонентів напою. В інших роботах було встановлено, що такі процеси перебігають за радикально-ланцюговим механізмом. Це дає можливість використати хемілюмінесцентний метод для дослідження таких процесів. Цим методом досліди проводились при температурі 700 С, постійній подачі повітря та наявності 7% Na2 S2 O8 у якості ініціатора радикальних процесів в пиві. Оскільки інтенсивність світіння прямопропорційна кількості досліджуваного субстрату, в експериментах використовували постійно один і той самий обєм пива (5 мл.). Піна, що може виникнути при виділенні діоксиду вуглецю з пива під час досліду, негативно впливає на якість результатів експерименту. Тому пиво кожен раз перед дослідом ретельно звільнялося від діоксиду вуглецю (дегазація).
Необхідність використання Na2 S2 O8 обумовлена дуже слабкою природньою хемілюмінесценцією пива, що означає повільний перебіг окиснювальних процесів у напої у звичайних умовах. У створених умовах, що наведені вище, та присутності Na2 S2 O8 пиво підлягає форсованому “старінню”. Це дозволяє провести експеримент за досить короткий проміжок часу, що є дуже зручним для дослідника.
Ініціююча дія Na2 S2 O8 пов’язана з перебігом таких реакцій:
Nа2 S2 O8 + 2H2 O H2 O2 + 2NаHSO4
H2 O2 2HO•
Nа2 S2 O8 2NаSO4 •
Можливий перебіг і такої реакції [19]:
S2 O8 2- + H2 O SO4 + HSO4 2- + OH •
Кінетична крива ХЛ при окиснення пива, зображена на рис.3.1,де І – інтенсивність ХЛ-світіння.
 |
||
|
||
Як видно, спостерігається досить складна динаміка ХЛ-світіння. На кривій присутні два максимуми різної висоти (h1 ;h2 ). Другий максимум зявляється через певний проміжок часу – період індукції (). Інтенсивність світіння у періоді індукції характеризується величиною h3 .
Було встановлено, що головні параметри ХЛ кривої окиснення пива (h1 ;h2 ; ) залежать від умов досліду. Так, період індукції при збільшенні концентрації Na2 S2 O8 зменшується, а величини h1 ;h2 при цьому зростають як це видно з рис.3.2 та рис.3.3.
 |

Також встановлено, що відключення подачі повітря у систему чи заміна його на такий нейтральний газ, як аргон, призводить до зникнення світіння. Це свідчить про радикальну природу процесів окиснення, а також про те, що висоти першого та другого максимумів характеризують інтенсивність радикальних реакцій окиснення у пиві. Очевидно, що величина є мірою стійкості напою до окиснювальних процесів. Наявність періода індукції на ХЛ кривій обумовлена присутністю у пиві речовин, що здатні пригнічувати окиснювальні процеси (власні антиоксиданти).
Хемілюмінесценція пива сильно залежить від температури. При зниженні температури відбувається зменшення величин h1 та h2 , а період індукції при цьому суттєво збільшується (рис.3.4).
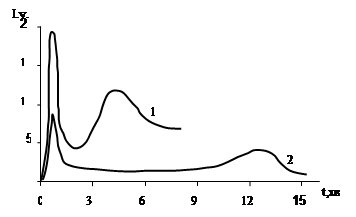 |
||
|
||
Для пояснення такої складної картини ХЛ пива та її зміни у залежності від створених умов було проведено серію дослідів по зясуванню впливу головних компонентів напою на параметри ХЛ. В табл.3.1 приведені результати цих дослідів.
Таблиця 3.1 – Зміна параметрів ХЛ пива при його окисненні з введенням додаткової кількості компонентів. Т=700 С,W(Na2 S2 O8 ) =7%
| Компонент пива | h1 / h01 | h2 / h02 | / 0 |
| Пиво без добавок | 1,0 | 1,0 | 1,0 |
| Твін – 80 | 1,5 | 1,0 | 1,0 |
| Меланоідини | 1,1 | 0,96 | 1,0 |
| Іонол | 1,4 | 0,96 | 1,1 |
| Кофейна к-та | 1,5 | 0,86 | 1,3 |
| СО2 -екстракт хмелю | 1,0 | 0,93 | 1,0 |
| Глюкоза ;сахароза | 1,0 | 1,0 | 1,0 |
| Етиловий спирт | 1,1 | 1,0 | 1,0 |
Аналіз отриманих даних дозволяє відмітити наступне:
– додаткове внесення ефірів ненасичених карбонових кислот (твін – 80) у пиво призводить до збільшення першого піку (h1 ) та не впливає на інші параметри ХЛ кривої (h2 ; );
– меланоідини, які є складною сумішшю сполук, що утворюються при нагріванні амінокислот з сахарами, практично не впливають на параметри хемілюмінесценції;
– додаткове внесення речовин фенольної природи (іонол, кофейна к-та) у пиво призводить до зростання світіння в першому максимумі, зменшення другого максимума та збільшення періоду індукції;
– внесення СО2 -екстракту хмелю, що використовується у виробництві для охмелення сусла, не впливає на параметри ХЛ кривої;
– збільшення вмісту сахарів (глюкоза ;сахароза) у пиві, що окислюється, не вплинуло на ХЛ криву;
– додаткове внесення етилового спирту дуже слабо вплинуло на величину першого піку та не змінило інші параметри ХЛ кривої.
З урахуванням вищезазначеного можна зробити деякі попередні висновки щодо природи ХЛ світіння, яке виникає при окисненні пива:
1. Хемілюмінесценція обумовлена саме радикальними реакціями окиснення компонентів пива за участю кисню. Головною реакцією, що обумовлює виникнення світіння при окисненні пива, є взаємодія двох пероксирадикалів:
RO2 • + RO2 • [ROOOOR] R=O* + O2 R=O + h (1)
2. Інтенсивність ХЛ світіння у першому максимумі обумовлена речовинами, що легко окиснюються (ненасичені карбонові кислоти та їх ефіри) з утворенням пероксирадикалів (RO2 • ), що рекомбінують між собою з хемілюмінесценцією. Також перший пік характеризує світіння, яке виникає у результаті розпаду самого ініціатора, що було встановлено при моделюванні розчину досліджуваного субстрату.
3. Фенольні сполуки (PhOH) пива (кверцетин, протокатехова к-та та ін.) здатні пригнічувати світіння у результаті протікання реакції:
PhOH + RO2 • ROOH + PhO• (2)
Тому інтенсивність світіння (I) повинна зменшуватися до витрачання природних антиоксидантів пива.
Оскільки додавання речовин фенольної природи, як видно із табл.3.1, призводить до збільшення величини першого піку, можна зробити висновок, що джерелом світіння у першому максимумі, окрім вищеперелічених процесів, є реакція між пероксильним та феноксильним радикалами:
PhO• + RO2 • (хінон)* хінон + h (3)
Можливість виникнення ХЛ світіння у результаті протікання реакції 3, встановлено раніше у вуглеводневих середовищах.
Зниження концентрації RO2 • у результаті протікання реакції 2 пригнічує реакції 1 та 3, і тому світіння суттєво зменшується. Результатом такого зменшення і є період індукції на ХЛ кривій окиснення пива. Наявність світіння в періоді індукції пояснюється незначним перебігом реакції 3.
4. Оскільки СО2 -екстракт хмелю не впливає на параметри хемілюмінесценції пива, це вказує на те, що гіркі та ароматичні речовини хмелю (гумулони, лупуліни, хмелеві масла) не приймають участі в окиснювальних процесах, що супроводжуються хемілюмінесценцією. Індиферентність СО2 -екстракту хмелю по відношенню до хемілюмінесценції пива також свідчить про низьку антиоксидантну активність фенолів цього екстракту.
5. Після витрачання PhOH у реакції 2, світіння знов посилюється, головним чином за рахунок реакцій 1;3, що і обумовлює висоту другого максимуму.
Для підтвердження результатів, отриманих хемілюмінесцентним методом, було проведено серію дослідів по вивченню кінетики окиснення пива, використовуючи газоволюмометричний метод. Для можливості співставлення результатів, отриманих хемілюмінесцентним методом, з результатами газоволюмометричних (ГВ) досліджень, досліди в обох випадках проводили за однакових умов (Т=700 С,W(Na2 S2 O8 ) =7%).
Кінетична крива поглинання кисню пивом, отримана газоволюмометричним методом в наведених умовах зображена на рис.3.5
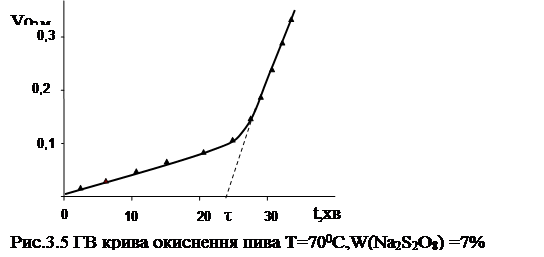
Базуючись на тому, що такий самий зразок пива в аналогічних умовах за відсутністю Na2 S2 O8 не поглинає кисню, можна зробити висновок, що поглинання кисню після додавання Na2 S2 O8 обумовлене перебігом окиснювальних процесів. Як видно, на кривій спостерігається період індукції повільного окиснення. Той факт, що в періоді індукції на газоволюмометричній кривій окиснення пива спостерігається поглинання кисню, корелює з тим фактом, що і на хемілюмінесцентній кривій в періоді індукції також спостерігається деяке світіння. Більш того, період індукції, отриманий хемілюмінесцентним методом, співпадає з періодом індукції, отриманим газоволюмометричним методом. Така відповідність результатів остаточно доводить те, що хемілюмінесцентне світіння обумовлене саме окиснювальними процесами, що йдуть за участю кисню. Також отримані результати свідчать про те, що і газоволюмометричний, і хемілюмінесцентний методи дослідження дають обєктивну оцінку окиснювальним процесам, що перебігають у пиві. Це відкриває широку перспективу застосування цих методів у подальших дослідах при вивченні окиснювального старіння пива.
Наступним етапом роботи було зясування впливу речовин антиокиснювальної природи чи рослинних екстрактів, що містять такі речовини, на кінетику окиснення пива. Як вже було встановлено вище хемілюмінесцентним методом, додавання таких речовин, як іонол чи кофейна кислота у концентрації 5 10-6 моль/л, призводить до збільшення періоду індукції та зменшення величини другого піку, тобто до збільшення стійкості напою до окиснювальних процесів. Аналогічний ефект спостерігається і при використанні газоволюмометричного метода. Як видно на рис.3.6, додавання водно-спиртового екстракту деревини дуба у кількості 0,25 мл до пива призводить до збільшення періоду індукції та зменшення швидкості окиснення в періоді індукції.
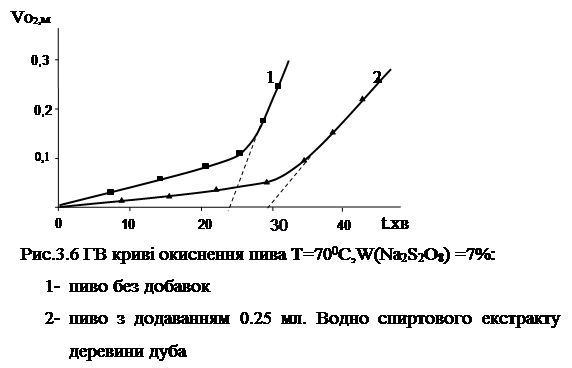 |
Виявлена антиоксидантна активність даного екстракту узгоджується з літературними даними щодо наявності у ньому речовин з антиоксидантними властивостями [8,9].
Оскільки окиснювальні процеси не починаються у пиві лише при його зберіганні, а перебігають від початку виготовлення напою, в якості досліджуваного субстрату було опробовано сусло. Сусло, як відомо, є “попередником” пива і відрізняється від пива підвищеним рівнем сахарів, речовин білкової та ліпідної природи та відсутністю спиртів. Було встановлено, що у створених умовах (Т=700 С, W(Na2 S2 O8 )=7%) і хемілюмінесцентні, і газоволюмометричні криві окиснення сусла ідентичні з кривими для пива, яке було виготовлено з цього сусла (рис.3.7;3.8).
 |
||||
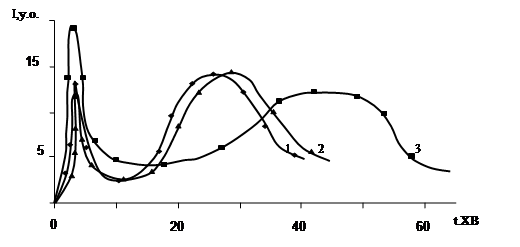 |
||||
|
||||
Така ідентичність кривих для пива та сусла вказує на подібність окиснювальних процесів у суслі та пиві. Також такі результати свідчать про головний внесок в окиснювальні процеси пива компонентів, що потрапили з сусла (ненасичені карбонові кислоти, білки, вільні амінокислоти та ін.). Це додатково свідчить про доцільність вивчення процесів окиснення (старіння) пива на прикладі сусла.
Як видно з рис.3.7 охмелене сусло окиснюється повільніше, ніж неохмелене. Це цілком логічно пояснюється головною відмінністю цих субстратів. Охмелене сусло містить певну кількість речовин з антиоксидантними властивостями (феноли хмелю). Ці речовини здатні уповільнювати окиснювальні процеси. Неохмелене сусло таких речовин містить значно менше і, тому, легше окиснюється. Період індукції окиснення пива порівняно з суслом, є значно вищим. Це можна пояснити тим, що сусло містить достатню кількість речовин проокиснювальної природи (гідро перекиси та ін.). Ці речовини з’являються у суслі у процесі його виготовлення внаслідок термічних навантажень (варка сусла та кип’ятіння з хмелем). Накопиченню цих речовин сприяє також вільний доступ кисню до сусла. Пиво, на відміну від сусла, пройшло процеси бродіння. Дріжджі, які при цьому використовуються, мають ярко виражені відновлюючі властивості. За рахунок такого впливу дріжджів відбувається відновлення речовин проокиснювальної природи до продуктів, що є безпечними для окислювального псування напою. Окрім цього, пиво у результаті надтонкого фільтрування містить значно меншу кількість речовин білкової природи та ліпідів, які здатні легко окиснюватися і тим самим спровоковувати окиснення інших компонентів.
Варто відмітити, що як у випадку газоволюмометричних досліджень, так і у випадку хемілюмінесценції, було встановлено, що криві окиснення охмеленого та неохмеленого сусла відрізняються на незначну величину. Це пояснюється тим, що при виготовленні сусла даним виробником (ЗАО “Сармат”), був використаний не безпосередньо хміль, а СО2 – екстракт хмелю. Такий екстракт містить достатню кількість гірких та ароматичних речовин хмелю, проте вміст речовин фенольної природи у ньому зовсім невеликий. Цей факт широко описується в літературі [36]. Додатковим доказом цього може бути індиферентність СО2 – екстракту хмелю по відношенню до хемілюмінесценції пива, що було встановлено вище (табл.3.1).
Порівняння газоволюмометричних та хемілюмінесцентних кривих окиснення пива та сусла дає змогу зробити висновок, що контроль за вмістом речовин анти- та проокиснювальної природи у пиві на кожному етапі його виготовлення (особливо на стадії виготовлення сусла) є важливим для отримання напою з високими антиокиснювальними можливостями.
Як відомо, метали змінної валентності здатні прискорювати окиснювальні процеси, що йдуть за радикально-ланцюговим механізмом. Одним із таких металів може бути двовалентне залізо (Fe2+ ). Як було встановлено хемілюмінесцентним методом, додавання Fe2+ до пива, що окиснюється у присутності Na2 S2 O8 , призводить до зростання світіння у першому та другому максимумах та зменшення періоду індукції.
На рис.3.9 представлена залежність періоду індукції від кількості двовалентного заліза в пиві.
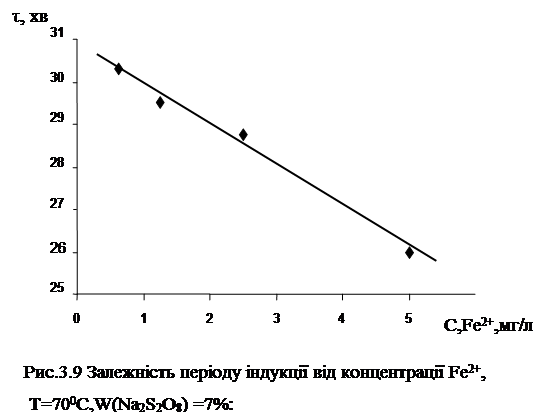 |
З отриманої залежності можна зробити висновок, що додавання Fe2+ призводить до зниження стійкості напою до окиснювальних процесів. Тому контроль за вмістом заліза та інших металів змінної валентності у воді, суслі та пиві є важливим елементом у вирішенні питання підвищення антиокиснювальної стійкості пива.
Вплив Fe2+ на кінетику окиснення пива вивчався також і газоволюмометричним методом. Але у цьому випадку дослід проводився при температурі 400 С, концентрації заліза 5 10-3 моль/л та відсутності інших ініціаторів радикальних процесів. Результати цих спостережень зображені на рис.3.10.
 |
Враховуючи те, що проба пива в аналогічних умовах без додавання Fe2+ практично не поглинає кисню, можна зробити висновок, що додавання Fe2+ призвело не тільки до прискорення, а навіть до зародження окиснювальних процесів. Тобто було виявлено можливість перебігу залізоініційованого окиснення пива.
Можливість перебігу у пиві залізоініційованного окиснення пояснюється тим, що Fe2+ здатне зароджувати ланцюги окиснення за схемою:
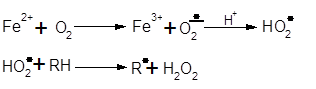
Прискорити чи збільшити глибину таких процесів можуть речовини, які будуть здатні відновити Fe3+ до Fe2+ , оскільки знов відновлене Fe2+ зможе зароджувати нові ланцюги окиснення. Такими речовинами можуть бути чи ферменти, де коферментом є НАДФН2 , чи речовини неферментної природи з підходящим редокс-потенціалом (наприклад аскорбінова к-та).
Можливість перебігу процесів ферментативного залізоініційованого окиснення перевірялася на суслі. Досліди проводились газоволюмометричним методом при температурі 400 С та концентрації заліза 5 10-3 моль/л. Було виявлено, що і охмелене, і неохмелене сусло поглинають кисень у створених умовах з досить великою швидкістю (рис.3.11)
 |
Отримані результати свідчать щодо наявності процесів ферментативного окиснення компонентів сусла. Більшість ферментів, як відомо, є активними в інтервалі температур 20 – 400 С. Для остаточного доказу протікання саме процесів ферментативного окиснення компонентів сусла було проведено експеримент при 500 С та незмінних інших параметрах досліду. Кінетична крива поглинання кисню в таких умовах представлена на рис. 3.12.
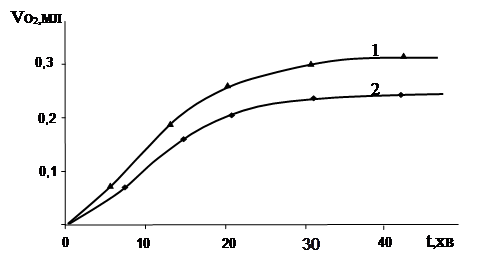 |
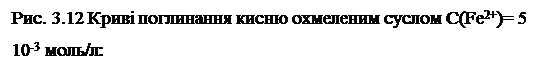
Порівняно з аналогічним дослідом при температурі 400 С швидкість поглинання кисню при 500 С зменшилася. Це означає, що підвищення температури пригнічує ферментативне окиснення в результаті дезактивації ферментів, що здатні відновлювати Fe3+ до Fe2+ . Поглинання кисню (рис. 3.12 кр. 2) навіть після дезактивації ферментів можна пояснити одночасним протіканням як процесів ферментативного, так і неферментативного залізоініційованого окиснення.
Можливість перебігу процесів неферментативного залізоініційованого окиснення перевірялася в умовах аскорбатзалежного залізоініційованого окиснення. Результати цих спостережень зображені на рис.3.13.
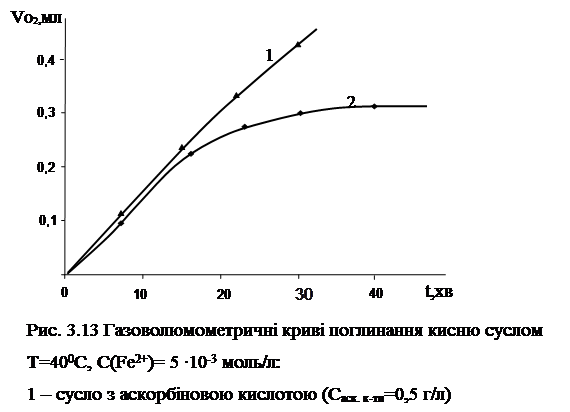
Як видно, додавання аскорбінової кислоти призводить до збільшення глибини окиснення сусла. Можливість перебігу процесу аскорбатзалежного залізоініційованого окиснення перевірялася і безпосередньо на пиві (рис.3.14).
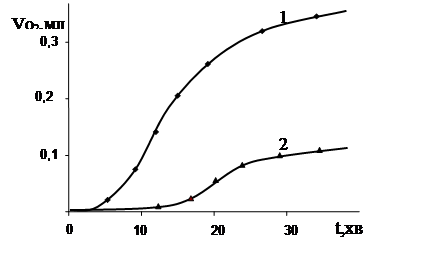 |
|||
|
|||
Як видно, додавання аскорбінової кислоти до пива призвело не тільки до збільшення глибини його окиснення, а навіть до збільшення швидкості окиснення напою. Отримані результати (рис.3.13;3.14) доводять можливість протікання реакцій відновлення Fe3+ до Fe2+ аскорбіновою кислотою, що збільшує швидкість та глибину окиснення пива та сусла. Аналіз результатів показав, що такі відновники, як аскорбінова кислота здійснюють подвійну роль. З одного боку, вони здатні регенерувати Fe3+ до Fe2+ і, таким чином, підтримувати реакції окиснення. З іншого, – якщо концентрація у пиві заліза є незначною, аскорбінова кислота здатна діяти як синергіст натуральних антиоксидантів. Це додатково говорить щодо важливості контролю за вмістом у пиві та суслі речовин, що є ініціаторами окиснювальних процесів (кисень, метали змінної валентності, перекиси та ін.).
Для доказу того, що окиснення компонентів сусла (пива) в умовах залізоініційованого окиснення відбувається саме за радикально-ланцюговим механізмом, було проведено досліди по встановленню впливу антиоксидантів радикально-ланцюгових процесів (іонол) на кінетику окиснення досліджуваного субстрату. Результати представлені на рис.3.15.
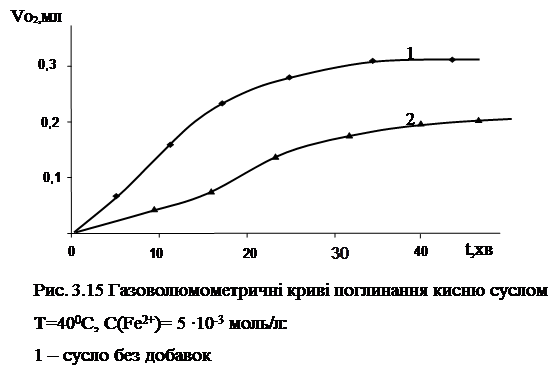 |
Як видно з рис.3.15 іонол уповільнює окиснення сусла. Це означає, що залізоініційоване окиснення компонентів сусла за участю ферментів йде за радикально-ланцюговим механізмом Аналогічні результати отримані і в умовах аскорбатзалежного залізоініційованого окиснення сусла (рис.3.16).
Таким чином, отримані залежності (рис.3.15;3.16) свідчать про те, що залізоініційоване ферментативне і аскорбатзалежне окиснення компонентів сусла (пива) відбувається за однаковим механізмом.
![]()
![]()
Вище для встановлення речовин, які призводять до перебігу окиснювальних процесів пива, хемілюмінесцентним методом було перевірено вплив добавок деяких компонентів пива на кінетику окиснення напою. Для підтвердження результатів, отриманих в такий прийом, було проведено серію дослідів на модельних розчинах пива (розчини окремих компонентів пива (сусла) у фосфатному буфері з рН=5,4; Т=400 С; С(Fe2+ )= 5 10-3 моль/л ) газоволюмометричним методом. Проведені досліди показали:
· сахара (глюкоза, фруктоза, сахароза) не поглинають кисню в заданих умовах
· вільні амінокислоти (фенілаланін, цистеїн, гліцин) у концентраціях, наявних у суслі та пиві, дуже слабо поглинають кисень
· ненасичені карбонові кислоти (лінолева к-та) в концентраціях, наявних в суслі, поглинають кисень з великою швидкістю.
Криві поглинання кисню суслом та модельним розчином лінолевої кислоти у фосфатному буфері зображені на рис.3.17.
![]()
На газоволюмометричній кривій модельного розчину лінолевої кислоти є період індукції. Крива поглинання кисню суслом такого періоду не має. Відмінність можна пояснити тим, що на початкових стадіях окиснення розчину лінолевої кислоти відбувається накопичення пероксидів (первинних продуктів окиснення), які в результаті розпаду прискорюють окиснювальні процеси. У суслі такі речовини є, тому воно окиснюється без періоду індукції. Варто відмітити, що після періоду індукції газоволюмометрична крива розчину кислоти виходить приблизно на один рівень з газоволюмометричною кривою сусла. Це означає, що головний внесок у процеси окиснення сусла (пива) вносять саме ненасичені карбонові кислоти.
Після зясування всіх можливих механізмів окиснювального старіння пива (сусла), встановлення речовин, які є відповідальними за перебіг чи прискорення таких процесів у напої та речовин, що здатні уповільнювати окиснювальні процеси, заключним етапом роботи було опробування різних антиоксидантів та рослинних екстрактів, що містять такі речовини для антиокиснювальної стабілізації пива (сусла). Результати цих експериментів викладено в табл.3.2; 3.3.
Таблиця 3.2 – Зміна параметрів ХЛ пива при введенні різних антиоксидантів. Т=700 С,W(Na2 S2 O8 ) =7%
| Антиоксидант (С= 5 10-6 моль/л) | h1 / h01 | h2 / h02 | / 0 |
| Пиво без добавок | 1,0 | 1,0 | 1,0 |
| Кофейна к-та | 1,5 | 0,86 | 1,3 |
| Кверцетин | 1,2 | 1,1 | 1,1 |
| Протокатехова к-та | 1,3 | 0,97 | 1,1 |
| Ферулова к-та | 1,5 | 0,94 | 1,3 |
| Галова к-та | 1,1 | 0,77 | 1,1 |
| Етиловий ефір галової к-ти | 1,1 | 0,74 | 1,1 |
| Іонол | 1,4 | 0,96 | 1,1 |
| Фенол 2246 | 1,3 | 0,97 | 1,2 |
Таблиця 3.3 – Зміна параметрів ХЛ пива при введенні рослинних екстрактів. Т=700 С,W(Na2 S2 O8 ) =7%
| Рослинний екстракт (W=0,0001%) | h1 / h01 | h2 / h02 | / 0 |
| Пиво без добавок | 1,0 | 1,0 | 1,0 |
| Деревина дуба | 1,5 | 0,88 | 1,4 |
| Коріння кровохлебки | 1,5 | 1,1 | 1,1 |
| Трава звіробою | 0,96 | 0,76 | 1,3 |
| Плоди горобини | 1,5 | 1,1 | 1,2 |
| Шишки хмелю | 1,5 | 1,2 | 1,2 |
| Листя толокнянки | 1,5 | 0,96 | 1,2 |
Отримані результати свідчать щодо можливості антиокиснювальної стабілізації пива класичними антиоксидантами радикально-ланцюгових процесів чи рослинними екстрактами, про що свідчить збільшення періодів індукції при окисненні пива після внесення зазначених речовин.
Також було перевірено можливість антиокиснювальної стабілізації пивного сусла водно-етанольним екстрактом деревини дуба у суміші з аскорбіновою кислотою (рис.3.18).
![]()
Як видно, антиокиснювальна стабільність сусла при додаванні вищевказаних речовин підвищилася. Це адекватно збільшенню періоду індукції та зменшенню величини другого піку на отриманій кривій.
З результатів, наведених в табл.3.2, видно, що додавання таких речовин, як кофейна чи ферулова кислота призводить до найвищої антиокиснювальної стабілізації, якщо виходити з відношення /0 . Так само і серед рослинних екстрактів найбільшу антиокислювальну активність проявив екстракт з деревини дуба.
Таким чином, проведені досліди дозволили визначити всі процеси окиснювального старіння, яким підвержено пиво. Було опробовано для вивчення таких процесів газоволюмометричний та хемілюмінесцентний методи дослідження, які до цього моменту не використовувалися для цих цілей. Розроблений варіант методики використання цих методів, як виявилось, є дуже зручним для отримання якомога повнішої та обєктивної інформації про перебіг окиснювальних процесів у досліджуваному субстраті (пиво, сусло). Також можливе використання цих методів дослідження по розробленій методиці для оцінки антиокиснювальної активності різних речовин чи рослинних екстрактів, використовуючи у якості субстрату пивне сусло. Доведено, що всі окиснювальні процеси, що перебігають у пиві, відбуваються за радикально-ланцюговим механізмом. Було ідентифіковано всі речовини, які здатні прискорювати чи уповільнювати такі процеси. Як виявилось, прискорити окиснювальні процеси (знизити антиокиснювальну стійкість пива) здатні кисень, речовини перекисної природи, метали змінної валентності, надмірний рівень речовин білкової та ліпідної природи, що також негативно впливає на антиокиснювальну стійкість напою. Речовинами, що здатні гальмувати такі процеси, є сполуки фенольної природи та рослинні екстракти, що містять такі речовини. Причому природні феноли (кофейна к-та, ферулова к-та ) проявили сильніший вплив на антиокиснювальну стійкість пива, ніж синтетичні (іонол, фенол 2246). Була виявлена можливість антиокиснювальної стабілізації пивного сусла, що дає можливість вплинути на перебіг процесів окиснювального старіння в пиві ще на ранніх стадіях його виготовлення.
Така інформація дозволяє побудувати повну картину всього спектру окиснювальних процесів, що здатні призводити до “старіння” напою та методів боротьби з ними. Це стане на заваді розробки заходів антиокиснювальної стабілізації пива, які можуть бути впроваджені у виробництво, що обовязково позитивно вплине на якість даного харчового продукту.
Висновки
1. Опробовано газоволюмометричний та хемілюмінесцентний методи дослідження для вивчення процесів окиснювального старіння пива. Розроблений варіант методики використання цих методів є дуже зручним для отримання обєктивної інформації про перебіг окиснювальних процесів в досліджуваному субстраті.
2. Запропоновано використання цих методів дослідження по розробленій методиці для оцінки антиокиснювальної активності різних речовин чи рослинних екстрактів, використовуючи у якості субстрату пивне сусло.
3. Доведено, що окиснювальні процеси, ініційовані персульфатом натрію, перебігають в пиві і суслі за радикально-ланцюговим механізмом.
4. Ідентифіковано речовини, які здатні прискорювати чи уповільнювати процеси окиснення в пиві.
5. Виявлена можливість антиокиснювальної стабілізації пивного сусла фенолами, що дає можливість вплинути на перебіг процесів окиснювального старіння в пиві ще на ранніх стадіях його виготовлення.
6. Доведено можливість протікання реакцій ферментативного та неферментативного окиснення компонентів пива, які можуть бути зароджені двовалентним залізом і відбуваються за радикально-ланцюговим механізмом.
7. Показано, що головним методом антиокиснювальної стабілізації пива є додаткове внесення речовин фенольної природи (антиоксидантів радикально-ланцюгових процесів).
Література
1. Кунце В. Правильное пиво – как его сварить? /В. Кунце // Пиво и напитки. – 2001. – №2. – С. 24 – 25.
2. Иванова Е.Г. Изменение липидов в процессе пивоварения и их влияние на вкусовую стабильность пива /Е.Г. Иванова // Пиво и напитки. – 2003. – №3. – С. 12 – 14.
3. Иванова Е.Г. Антиоксиданты для улучшения вкуса и стабильности пива/ Е.Г. Иванова, Л.В. Киселева, Н.Г. Ленец // Пиво и напитки. – 2004. – №2. – С. 25.
4. Вакербауэр К. Реакция с радикалами и стабильность вкуса пива /К. Вакербауєр, Р. Хардт // Мир пива. – 1997. – №.4. – С. 38 – 42.
5. Рыбакова Е.В. Ионная хроматография универсальная методика для анализа пива/Е.В. Рыбакова//Пиво и напитки. – 2004.– №2. – С. 42 – 43.
6. Савчук С.А. Применение новых хроматографических методов в исследовании пива /С.А.Савчук, К.В.Кобелев // Пиво и напитки. – 2003. – №1. – С. 15 – 20.
7. Тим О’Рурк Роль кислорода в пивоварении / О’Рурк Тим // Пиво и напитки. – 2003. – №2. – С. 24 – 26.
8. Бушина И.А. Изучение антиоксидантной активности экстракта дубового / И.А. Бушина // Хранение и переработка сельхозсырья. – 2003. – №11. – С. 60 – 62.
9. Білокір Г. Напій вищої проби /Г. Білокір, Л. Рибак, Л. Данилова та ін.// Харчова і переробна промисловість. – 2002. – №4. – С. 22 – 23.
10. Хошимото Н. Пути образования летучих альдегидов во время хранения бутылочного пива /Н. Хошимото// Научно-исследовательский отчет лаборатории фирмы Kirin Brew. – 1975. – №18. – С.1–11.
11. Мейльгард М. Затхлый вкус пива, вызванный карбонилами/ М. Мейльгард // Дайджест Brew. Dig. – 1972. – №47. – С.52,54,56,57,62.
12. Блокманс Источники определенных соединений карбонилов, образующихся в результате старения пива /Блокманс Машелен, Деврю А. // Материалы 17-го конгр. Евр. пивов. Конв.: – Берлин, 1979. – C.279 – 291.
13. Машелен Роль фотохимических реакций для устойчивости вкуса пива / Машелен // Cerevisia. –1980. – №5. – C.107 – 110.
14. Тресль Р. Образование альдегидов в результате окисления липидов и их значение как компонентов, нарушающих вкус пива /Р. Тресль, Д. Барри // Материалы 19-го конгр. Евр. повов. Конв.: – Лондон, 1983. – C.525-532.
15. Владимиров Ю.А. Перекисное окисление липидов в биологических мембранах / Ю.А. Владимиров, А.И. Арчаков .–М.: Наука, 1972.–252с.
16. Барабой В.А. Окислительно – антиоксидантный гомеостаз в норме и патологии / В.А. Барабой, Д.А. Сутковой.–К.: Чернобыльинформ, 1997.–Т.1. – С.204.
17. Березов Т.Т. Биологическая химия / Т.Т. Березов, Б.Ф. Коровкин.–М.: Медицина, 1983. – 752с.
18. Хемилюминесцентные методы исследования медленных химических процессов / В.Я. Шляпинтох, О.Н. Карпухина, Л.М. Постников и др. – М.: Наука, 1966.- 300с.
19. Торопцева А.М.,Лабораторный практикум по химии и технологии высокомолекулярных соединений / А.М. Торопцева, К.В. Белгородская, В.М. Бондаренко. – Л., Химия, 1972. – 416с.
Резюме
Данная работа посвящена исследованиям процессов окислительного старения пива с использованием для этой цели хемилюминесцентного и газоволюмометрического методов исследования.
Установлено, что хемилюминесцентный и газоволюмометрический методы исследования, в отработанных вариантах, являются достаточно информативными для изучения процессов окисления в пиве. Результаты полученные этими методами идентичны, что свидетельствует об их объективности. Дана интерпретация хемилюминесцентных и газоволюмометрических кинетических кривых при окислении пива, которые по виду аналогичны с соответствующими кривыми для сусла. Установлено, что введение ингибиторов радикально-цепных процессов приводит к подавлению процессов окисления в пиве. Добавки веществ перекисной природы, металлов переменной валентности, приводит к ускорению процессов.
Полученные результаты позволили сделать вывод о том, что ферментативные и неферментативные окислительные процессы в пиве и сусле протекают по радикально-цепному механизму. Выяснено, что наиболее эффективным методом антиокислительной стабилизации пива является внесение в него веществ с антиоксидантными свойствами или растительных экстрактов, содержащих такие вещества.
Summary
This work deals with the studying of the beer oxidative aging by means of chemiluminescence and gasometric methods of investigation.
It has been established that used methods give enough information. The results obtained by using this methods conform with each other. This evidences about their objectivity.
It has been established that the radical-chain process inhibitors addition results in suppression of oxidation in beer. Adding of peroxide nature substances and metals of changed valency accelerates the processes.
Received results allowed to conclude that fermentative and non- fermentative oxidative processes in beer go according radical-chain mechanism.
It has been find out, that addition of substances with antioxidative properties and plant extract into beer was the most effective way of its antioxidative stabilization.