Фазовые диаграммы как средство описания взаимодействия различных материалов. Основные фазовые диаграммы с участием кремния
СОДЕРЖАНИЕ: Понятие фазового перехода и твердой растворимости. Типы фазовых диаграмм. Системы, их значение в микроэлектронике. Фазовые диаграммы, в которых в качестве одной из компонент фигурирует именно кремний. Двухфазная диаграмма и процесс отвердевания.Фазовые диаграммы как средство описания взаимодействия различных материалов. Основные фазовые диаграммы с участием кремния
Содержание
Введение
1. Типы фазовых диаграмм
2. Системы, имеющие важное значение в микроэлектронике
3. Твердая растворимость
4. Фазовые переходы
Выводы
Литература
Введение
Фазовые диаграммы состояний являются неотъемлемой частью любого обсуждения свойств материалов в тех случаях, когда речь идет о взаимодействии различных материалов. Особенно фазовые диаграммы состояния важны в микроэлектронике, т.к. для изготовления выводов и пассивирующих слоев там приходится использовать большой набор различных материалов. В производстве интегральных микросхем в тесном контакте с различными металлами находится кремний, особое внимание уделим тем фазовым диаграммам, в которых в качестве одной из компонент фигурирует именно кремний.
В данном реферате рассмотрено какие бывают типы фазовых диаграмм, понятие фазового перехода, твердой растворимости, самые важные системы веществ для микроэлектроники.
1. Типы фазовых диаграмм
Однофазовые диаграммы состояний – это графики, на которых в зависимости от давления, объем и температуры изображают фазовое состояние только одного материала. Обычно не принято рисовать трехмерный график на двумерной плоскости – изображают его проекцию на плоскость температура – давление. Пример однофазной диаграммы состояний дан на рис. 1.
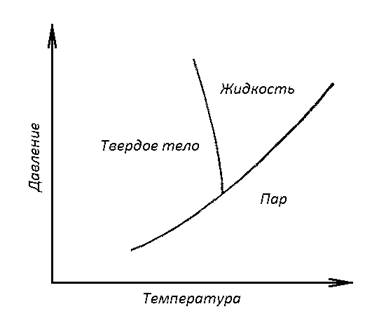
Рис. 1. Однофазная диаграмма состояний
На диаграмме четко разграничены области, в которых материал может существовать только в одном фазовом состоянии – как твердое тело, жидкость или газ. Вдоль разграниченных линий вещество может иметь два фазовых состояния (две фазы), находящихся в контексте друг с другом. Имеет место любая из комбинаций: твердое тело – жидкость, твердое тело – пар, жидкость – пар. В точке пересечения линий диаграммы, так называемой тройной точке, могут одновременно существовать все три фазы. Причем это возможно при одной-единственной температуре, поэтому тройная точка служит хорошей точкой отсчета температур. Обычно в качестве точки отсчета выступает тройная точка воды (например, в прецизионных измерениях с использованием термопар, где опорный спай контактирует с системой лед – вода – пар).
Двойная фазовая диаграмма (диаграмма состояния двойной системы) представляет состояние системы с двумя компонентами. На таких диаграммах по оси ординат откладывается температура, по оси абсцисс – процентное соотношение компонент смеси (обычно это или процент от общей массы (вес. %), или процент от общего числа атомов (ат. %)). Давление обычно полагается равным 1 атм. Если рассматривается жидкая и твердая фазы, измерением объема пренебрегают. На рис. 2. представлена типичная двухфазная диаграмма состояний для компонент A и B с использованием весового или атомного процента.
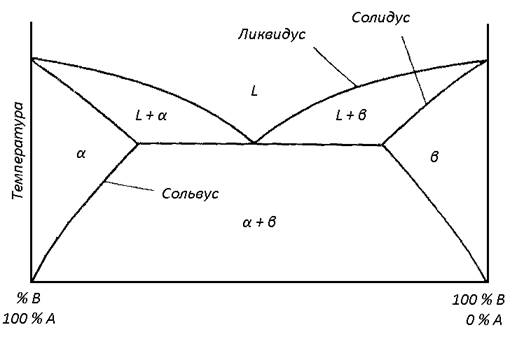
Рис. 2. Двухфазная диаграмма состояний
Буквой обозначена фаза вещества A с растворенным веществом B, означает фазу вещества B с растворенным в нем веществом A, а + означает смесь этих фаз. Буква (от liquid - жидкий) означает жидкую фазу, а L+ и L+ означают жидкую фазу плюс фаза или соответственно. Линии, разделяющие фазы, т. е. линии, на которых могут существовать различные фазы вещества, имеют следующие названия: солидус – линия, на которой одновременно существуют фазы или с фазами L+ и L+ соответственно; сольвус – линия, на которой одновременно сосуществуют фазы и + или и + , и ликвидус – линия, на которой одновременно существует фаза L с фазой L+ или L+.
Точка пересечения двух линий ликвидуса часто является точкой наименьшей температуры плавления для всех возможных комбинаций веществ A и B и называется эвтектической точкой. Смесь с соотношением компонент в эвтектической точке называется эвтектической смесью (или просто эвтектикой).
Рассмотрим как происходит переход смеси из жидкого состояния (расплава) в твердое и как фазовая диаграмма помогает предсказать равновесную композицию всех фаз, существующих при данной температуре. Обратимся к рис. 3.
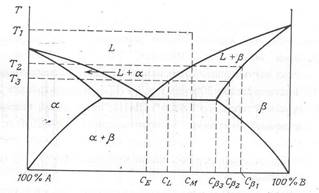
Рис. 3. Двухфазная диаграмма состояний, на которой показаны процессы отвердевания
Предположим, что вначале смесь имела состав CM при температуре T1 , при температуре от T1 до T2 существует жидкая фаза, а при температуре T2 одновременно существуют фазы L и . Состав присутствующей фазы L есть CМ , состав фазы есть C 1 . При дальнейшем снижении температуры до T3 состав жидкой меняется вдоль кривой ликвидуса, а состав фазы – вдоль кривой солидуса до пересечения с изотермой (горизонтальной линией) T3 . Теперь состав фазы L есть CL , а состав фазы есть C 2 . Следует отметить, что состав C 2 должен иметь не только вещество, перешедшее в фазу при при температуре T3 , но и все вещество, перешедшее в фазу при более высокой температуре, должно иметь состав C 2 . Это выравнивание составов должно произойти путем твердотельной диффузии компонента A в существующую фазу , так что к моменту достижения температуры T3 все вещество, находящееся в фазе , будет иметь состав C 2 . Дальнейшее снижение температуры приводит нас в эвтектическую точку. В ней фазы и существуют одновременно с жидкой фазой. При более низких температурах существуют только фазы и . Образуется смесь фаз и состава CE с агрегатами с начальным составом C 3 . Затем, выдерживая эту смесь длительное время при температуре ниже эвтектической, можно получить твердое тело. Образовавшееся твердое тело будет состоять из двух фаз. Состав каждой из фаз можно определить в точке пересечения изотермы с соответствующей линией сольвуса.
Только что было показано, как определить состав каждой из присутствующих фаз. Теперь рассмотрим задачу определения количества вещества в каждой фазе. Во избежания путаницы на рис. 4. еще раз приводится простая двухфазная диаграмма. Предположим, что при температуре T1 состав расплава есть CM (имеется в виду компонента B), тогда при T2 фаза L имеет состав CL , а фаза будет иметь состав Cs . Пусть ML – масса вещества, находящегося в твердом состоянии, а MS – масса вещества, находящегося в твердом состоянии. Условие сохранения суммарной массы приводит к следующему уравнению
(ML + MS )CM = ML CL + MS CS .
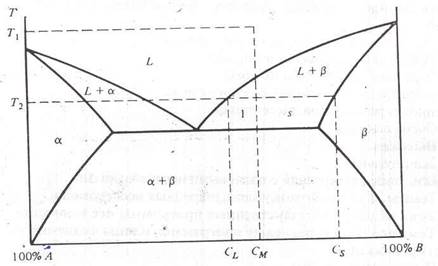
Рис. 4. Правило уровня
В нем нашел отражение тот факт, что общая масса вещества при температуре T1 , умноженная на процент B, – есть общая масса вещества B. Она равна сумме масс вещества B, существующего в жидкой и в твердой фазах при температуре T2 . Решая это уравнение, получаем
![]() . (1)
. (1)
Это выражение известно как «правило уровня». С помощью этого правила, зная начальный состав расплава и общую его массу, можно определить массы обеих фаз и количество вещества B в любой фазе для любого участка двухфазной диаграммы. Точно так же можно вычислить и
На рис. 5. приведен еще одни пример отвердения расплава. Снижение температуры от T1 до T2 приводит к смешиванию фаз L и с составом соответственно CM иC . По мере дальнейшего охлаждения состав L меняется вдоль ликвидуса, а состав - вдоль солидуса, как было описано ранее. При достижении температуры T3 состав станет равным CМ , и, как следует из правила уровня, при температуре, меньшей T3 , жидкая фаза существовать не может. При температуре, меньшей T4 , фазы и существуют как агрегаты фаз и . Например, при температуре T5 агрегаты фазы будут иметь состав, определяемый пересечением изотермы T5 и сольвуса . Состав определяется аналогично – пересечением изотермы и сольвуса .
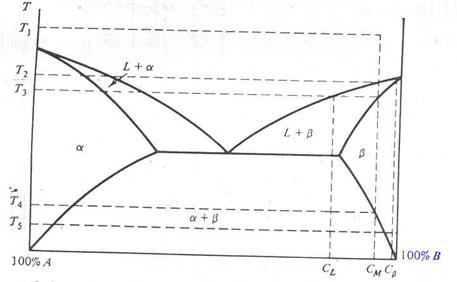
Рис. 5. Двухфазная диаграмма и процесс отвердевания количество вещества A, присутствующего в любой из фаз
Участки двухфазной диаграммы, называемые до сих пор и , – это участки твердой растворимости: в области растворено A и B. Максимальное количество A, которое может быть растворено в B при данной температуре, находятся в зависимости от температуры. При эвтектической или более высокой температуре может иметь место быстрое сплавливание A и B. Если полученный при этом сплав резко охладить, то атомы A могут быть «пойманы» в решетке B. Но если твердая растворимость при комнатной температуре намного ниже (это говорит о том, что при этой температуре рассматриваемый подход не слишком пригоден), то в сплаве могут возникать сильнейшие напряжения, существенно влияющие на его свойства (при наличии значительных напряжений возникают пересыщенные твердые растворы, и система находится не в равновесном состоянии, а диаграмма дает информацию только о равновесных состояниях). Иногда, такой эффект является желательным, например при упрочнении стали закалкой с получением мартенсита. Но в микроэлектронике его результат будет разрушительным. Поэтому легирование, т. е. внесение добавок в кремний до диффузии, проводится при повышенных температурах с таким расчетом, чтобы предупредить повреждение поверхности из-за избыточного сплавления. Если же количество легирующей примеси в подложке окажется выше предела твердой растворимости при любой температуре, то появляется вторая фаза и связанная с ней деформация.
2. Системы веществ, имеющие важное значение в микроэлектронике
Существует ряд материалов, которые полностью растворимы друг в друге. Примером может служить система из двух таких важных для микроэлектроники веществ, как кремний и германий. Система кремний – германий показана на рис. 6.
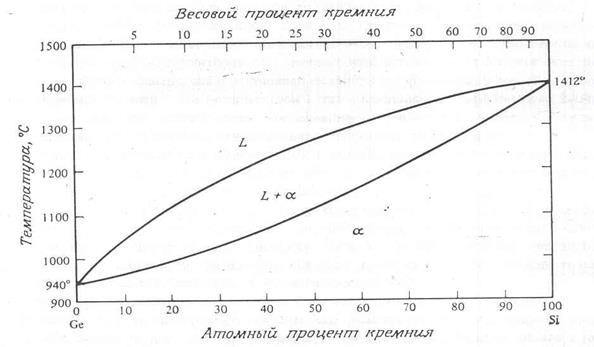
Рис. 6. Система кремний – германий
Диаграмма не имеет эвтектической точки. Подобная диаграмма называется изоморфной. Для того чтобы два элемента были изоморфными, они должны подчиняться правилам Хьюма – Ротери, т.е. иметь различие в значениях атомных радиусов не более чем на 15%, одинаковую вероятность, одинаковую кристаллическую решетку и, кроме того, приблизительно одинаковую электроотрицательность (электроотрицательность атома – это присущее ему семейство привлекать или захватывать лишние электроны, при ковалентных связях). Системы Cu – Ni, Au – Pt и Ag – Pd, также являются изоморфными.
Система Pb – Sn служит хорошим примером простой бинарной системы со значительной, хотя и ограниченной твердой растворимостью. Фазовая диаграмма состояний этой системы приведена на рис. 7. Точка пересечения солидуса и сольвуса называется граничной растворимостью, значение граничной растворимости как олова в свинце, так и свинца в олове будет большим. Данная система важна для микроэлектроники благодаря широкому применению оловянных-свинцовых припоев. Их двухфазной диаграммы этой системы видно, как изменение состава сплава меняет его температуру плавления. Когда при изготовлении микросхемы требуется провести несколько последовательных паек, то для каждой следующей пайки применяется припой с более низкой температурой плавления. Это делается для того, чтобы не потекли пайки, сделанные раньше.
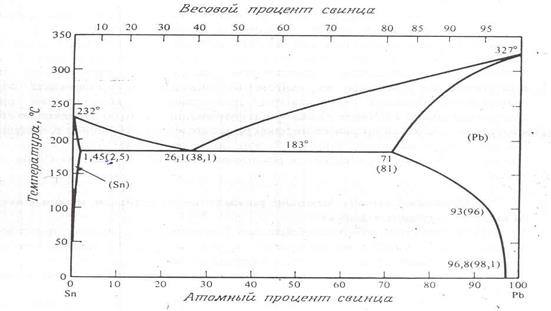
Рис. 7. Фазовая диаграмма состояний системы свинец – олово
Для производства микросхем также важны свойства системы Au – Si, поскольку эвтектическая температура этой системы крайне мала по сравнению с температурами плавления чистого золота или чистого кремния (рис 9). Растворимости золота в кремнии и кремния в золоте слишком малы, чтобы их отобразить на обычной фазовой диаграмме состояний. Из-за низкой эвтектической температуры оказывается выгодно устанавливать кристаллы микросхем на золотые подложки, держатели или платы с золотыми контактными площадками, пользуясь эвтектической реакцией Au – Si в качестве основного механизма сварки (или пайки). Для пайки кремниевых кристаллов также используется золото, содержащее несколько процентов германия.
Комбинации элементов, образующих химические соединения, имеют более сложные диаграммы состояний. Их можно разбить на две (или несколько) более простых диаграммы, каждая из которых относится к определенной паре соединений или соединению и элементов. Например, AuAl2 образуется при соединении 33% (процент атомный) золота с алюминием при температуре менее 1060о (рис. 2.10). Слева от этой линии сосуществует AuAl2 и фаза чистого алюминия. Соединения, подобные AuAl2 , называются интерметаллическими и образуются при соответствующем стехиометрическом соотношении двух элементов. Интерметаллические соединения характеризуются высокой температурой плавления, сложной кристаллической структурой и, кроме того, отличаются твердостью и хрупкостью.
Фазовая диаграмма состояний Au – Al может быть разбита на две или больше диаграмм, например на диаграмму Al – AuAl2 и диаграмму AuAl2 – Au.
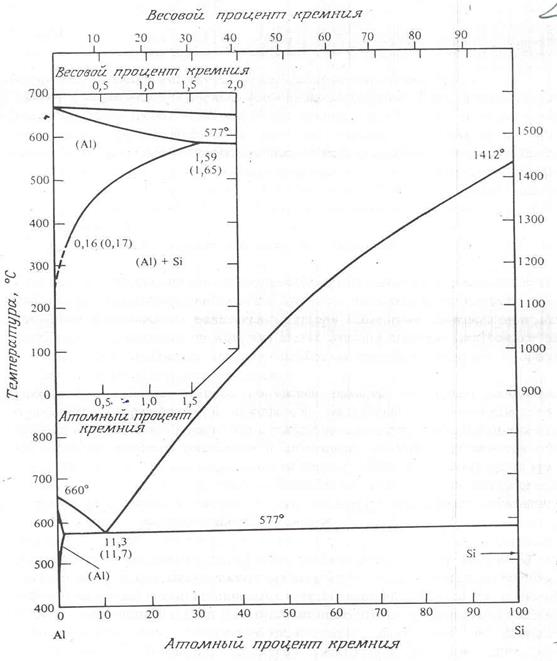
Рис. 8. Система алюминий – кремний
Диаграмма системы Au – Al, показанная на рис. 2.10, имеет в микроэлектронике крайне важное значение, поскольку обычно золотые провода соединяются с алюминиевым слоем металлизации, расположенным поверх кремния. Здесь указано несколько важных интерметаллических соединений: AuAl2 , Au2 Al, Au5 Al2 и Au4 Al. В проводниках связей Au – Al они могут присутствовать все.
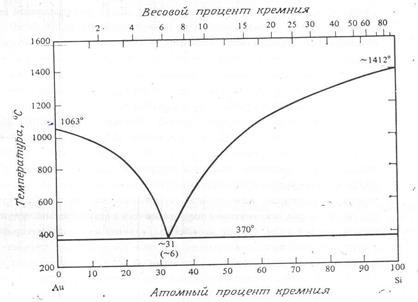
Рис. 9. Система золото – кремний
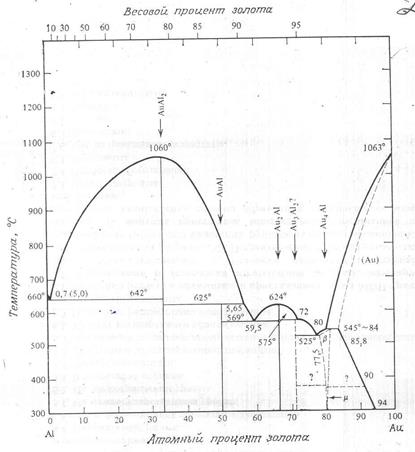
Рис. 10. Система золото – алюминий
3. Твердая растворимость
Граничная растворимость большинства легирующих примесей в кремнии крайне мала и в действительности не является максимальной растворимостью. На рис. 11 представлена типичная кривая солидуса для примеси без кремния. Заметьте, что растворимость растет с температурой до определенного значения, а затем убывает до нуля при температуре плавления кремния. Такая кривая называется ретроградной кривой растворимости. Уточненная версия этой диаграммы в окрестности точки плавления кремния показана на рис. 12.
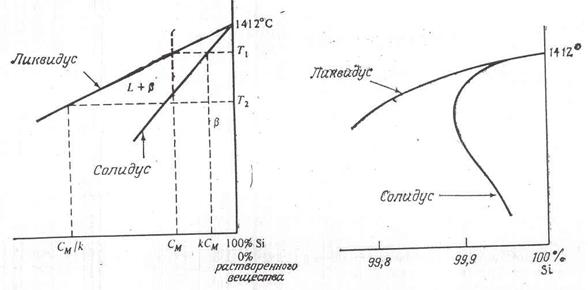
Рис. 11 Ретроградная растворимость кремния
Рис. 12 Типичная фазовая диаграмма кремния
Если состав расплава кремния равен CM в процентах массы растворенного вещества, то кремний будет застывать с содержанием растворенного вещества kCM , где k – коэффициент сегрегации (k=CS /CL ). Когда концентрация в твердом теле достигнет значения CM при замораживании, концентрация в жидком растворе будет равна CM /k, поскольку соотношение концентраций в жидком и твердом растрах должна быть равна k. Наклон линии солидуса, следовательно, равен
![]() ,
,
а наклон ликвидуса равен
![]() .
.
Отношение наклонов ликвидуса и солидуса оказывается равным коэффициенту сегрегации
![]() . (2)
. (2)
4. Фазовые переходы
Переходы из одного фазового состояния в другое при изменении параметров системы.
Фазовые переходы первого рода (испарение, конденсация, плавление, кристаллизация, переходы из одной кристаллической модификации в другую).
Кристаллическое состояние веществ классифицируется по семи сингониям (триклинная, моноклинная, ромбическая, тетрагональная, тригональная или ромб…., гексагональная, кубическая) при этом расположение атомов в этих сингониях характеризуется 14 типами решеток (решетки Браве). Степень упаковки атомов в этих решетках различна:
Простая кубическая f = 0,52
Объемно центрировая кубическая f = 0,68
Гранецентрированная кубическая f = 0,74
Гексагональная плотная упаковка f = 0,74
Из этих данных следует очень важный вывод, при полиморфных превращениях (изменение типа кристаллической решетки) происходит изменение объема и следовательно физико-химических свойств материалов.
При переходах первого рода в точке перехода сосуществует две фазы.
A B
а) переход осуществляется при определенной температуре Tпер
б) при переходе изменяются скачком первые производные энергии: энтальпии, энтропии, объема (следовательно значит и плотности)
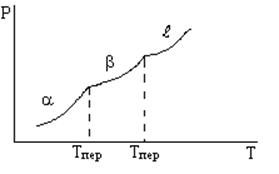
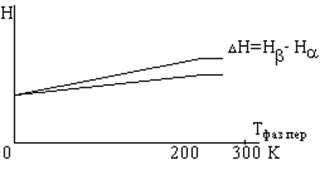
Фазовые переходы второго рода
При переходах второго рода первые производные свободной энергии, энтальпии, энтропии, объема, плотности изменяются монотонно.
Титанат бария – кубическая структура – тетрагональный типичный пьезоэлектрик.
MnO – антиферромагнетик при 117 К переходит в парамагнитную фазу.
1. Согласно классификации фазовых превращений, предложенной в 1933 г. Эрипреситом, превращения подразделяются на превращения (переходы) I и II родов.
Переходы первого рода характеризуются тем, что первые производные термодинамического потенциала по температуре и давлению изменяются скачкообразно
![]()
![]() ,
,
здесь S – энтропия, V – объем
Так как термодинамический потенциал при фазовых переходе меняется непрерывно определяется выражением
![]()
то энергия U также должна изменяться скачком. Так как
![]()
то теплота перехода
![]()
равна произведению температуры на разность энтропии фаз, т. е. скачкообразное изменение или поглощение теплоты.
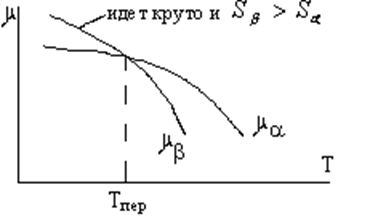
Важным является непрерывное изменение термодинамического потенциала. Функция ![]() (Т) и
(Т) и ![]() (Т) не изменяют особенностей вблизи точки фазового перехода, при этом с обеих сторон точки фазового перехода имеются минимумы термодинамического потенциала.
(Т) не изменяют особенностей вблизи точки фазового перехода, при этом с обеих сторон точки фазового перехода имеются минимумы термодинамического потенциала.
Этой особенностью объясняется возможность перегрева или переохлаждения фаз в случае фазовых переходов в системе.
Определим взаимосвязи между скачками термодинамических функций ![]() и
и ![]() . После дифференцировании по температуре соотношение Функция
. После дифференцировании по температуре соотношение Функция ![]() (Р,Т) =
(Р,Т) =![]() (Р,Т) с учетом выражения для S, V и q получим
(Р,Т) с учетом выражения для S, V и q получим
![]()
Эта известная формула Клайперона-Клаузиса. Она позволяет определить изменение давлений, находящихся в равновесии фаз при изменении температуры либо изменении температуры перехода между двумя фазами при изменении давления. Скачкообразное изменение объема приводит к отсутствию определенной связи между структурой и системой фаз, преобразующихся при фазовом переходе первого рода, которые в связи с этим изменяются скачком.
Типичными для фазовых переходов первого рода являются переходы между агрегатными состояниями вещества, аллотропическими превращения многие фазовые превращения в многокомпонентных материалах.
Принципиальное отличие фазовых переходов второго рода от фазовых переходов первого рода заключается в следующем: переходы второго рода характеризуются как непрерывностью изменения термодинамического потенциала, так и непрерывностью изменения производных термодинамического потенциала ![]() .
.
Химическое равновесие
Термодинамическая функция – функция состояния, определяющая изменение термодинамических потенциалов при изменении числа частиц в системе. Другими словами ![]() – есть функция, которая определяет направление и предел самопроизвольного перехода компонента из одной фазы в другую при соответствующих превращениях и условиях (T, P, V, S, ni
).
– есть функция, которая определяет направление и предел самопроизвольного перехода компонента из одной фазы в другую при соответствующих превращениях и условиях (T, P, V, S, ni
).
Термодинамические потенциалы связаны с друг другом следующими соотношениями
F = U – TS
H = U + pV
G = F + pV
![]() - количество вещества в граммах;
- количество вещества в граммах; ![]() - количества вещества в молях;
- количества вещества в молях;
![]()
М – молекулярный вес соответствующего вещества.
Для теории твердых растворов, на которых работают все приборы микроэлектроники огромное значение имеет развитый Гиббсом метод химических потенциалов. Химическое равновесие можно определить с помощью химических потенциалов.
Химический потенциал характеризуется энергией, приходящейся на 1 атом
![]()
![]() - химический потенциал; G – энергия Гиббса;
- химический потенциал; G – энергия Гиббса;
No
– число Авогадро, NА
– L = ![]() моль-1
моль-1
т. е. ![]() (Р,Т) =
(Р,Т) =![]() (Р,Т)
(Р,Т)
Обе кривые характеризуют монотонное убывание ![]() с температурой, определяя значение энтропии фаз
с температурой, определяя значение энтропии фаз
![]() и
и ![]() .
.
Выводы
Фазовые диаграммы состояний являются неотъемлемой частью обсуждения свойств материалов, когда речь идет о взаимодействии различных материалов.
Однофазовые диаграммы состояний изображают фазовое состояние только одного материала.
Двойная фазовая диаграмма (диаграмма состояния двойной системы) представляет состояние системы с двумя компонентами.
Комбинации элементов, образующих химические соединения, имеют более сложные диаграммы состояний.
Литература
1. Ормонт Б. Ф. Введение в физическую химию и кристаллохимию полупроводников. – М.: Высшая школа, 1973.
2. Физическое металловедение / Под редакцией Кана Р., вып. 2. Фазовые превращения. Металлография. – М.: Мир, 1968.
3. Ю.М. Таиров, В.Ф. Цветков «Технология полупроводниковых и диэлектрических материалов», - М.: Высшая школа, 1990р.
4. «Практикум по полупроводникам и полупроводниковим приборам», /Под ред. Шалимовой К.В. – М.: Высшая школа, 1968р.