Фазовые превращения твердых тел
СОДЕРЖАНИЕ: Министерство образования и науки Российской Федерации ГОУ ВПО Кафедра физики РЕФЕРАТ Фазовые превращения твердых тел Выполнила: Санкт-Петербург 2009Министерство образования и науки Российской Федерации
ГОУ ВПО
Кафедра физики
РЕФЕРАТ
Фазовые превращения твердых тел
Выполнила:
Санкт-Петербург
2009
Содержание
1. Фаза…………………………………………………………….3
1.1. Фазовые переходы I рода……………………………….3
1.2. Фазовые переходы II рода………………………………6
2. Условие равновесия фаз химически однородного вещества..6
3. Возгонка (сублимация)………………………………………...8
4. Плавление и кристаллизация………………………………….9
5. Диаграмма состояния. Тройная точка………………………..12
1. Фаза
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Часто понятие «фаза» употребляется в смысле агрегатного состояния, однако надо учитывать, что оно шире, чем понятие «агрегатное состояние». В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам, составу и строению (лед, например, встречается в пяти различных модификациях — фазах). Переход вещества из одной фазы в другую — фазовый переход — всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
1.1. Фазовые переходы I рода
Различают фазовые переходы двух родов. Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода.
Фазовые переходы первого рода характеризуются постоянством температуры, изменениями энтропии и объёма. Объяснение этому можно дать следующим образом. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решётки. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. При подобных переходах – из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние – степень беспорядка увеличивается и, с точки зрения второго начала термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет.
В качестве примера на рисунке 1 показана температурная зависимость свободной энергии F, приходящейся на одну молекулу кристалла, при его превращении в пар. Верхняя ветвь отвечает кристаллическому состоянию, а нижняя ветвь представляет свободную энергию парообразной фазы. При низких температурах свободная энергия кристалла меньше, чем пара, и, следовательно, кристаллическое состояние выгоднее. При высоких температурах, наоборот, выгоднее существование парообразного состояния. Штриховыми линиями показаны области метастабильных, термодинамически неустойчивых состояний системы.
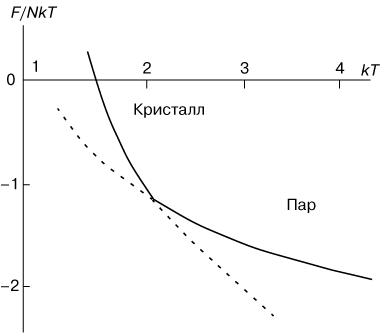
Рис. 1 - Температурная зависимость свободной энергии F при фазовом переходе первого рода пар-кристалл.
Поведение внутренней энергии системы, приходящейся на одну молекулу, изображено на рисунке 2. Нижняя ветвь относится к кристаллическому состоянию, а верхняя к парообразному. Скачок энергии в точке перехода представляет собой поглощаемую скрытую теплоту. Соответственно теплоемкость в точке фазового перехода первого рода имеет всплеск.
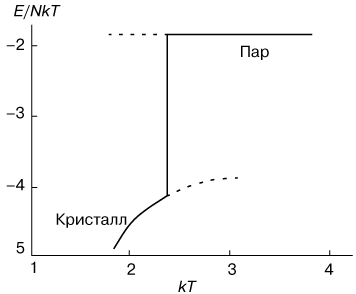
Рис. 2. - Изменение энергии E в зависимости от температуры T при фазовом переходе первого рода пар-кристалл.
При теоретическом описании фазовых переходов первого рода каждую из фаз обычно описывают отдельно. Так, кристаллическую ветвь рассматривают, пользуясь моделью идеального кристалла, т. е. предполагая регулярное расположение всех атомов. Парообразную же ветвь получают, используя модель идеального газа, предполагающую полный беспорядок в системе. Зависимости, полученные для различных моделей, накладывают друг на друга и исследуют, какая из возможностей реализуется в данных условиях. Получить описание фазового перехода первого рода, одновременно учитывая все состояния системы, до настоящего времени не удается из-за огромных математических трудностей.
1.2. Фазовые переходы II рода
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами II рода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Общая трактовка фазовых переходов II рода предложена советским ученым Л. Д. Ландау (1908—1968). Согласно этой трактовке, фазовые переходы II рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, никеля) при определенных давлении и температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, характеризуемоескачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия (гелия I) при Т — 2,9 К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтекучести.
2.Условие равновесия фаз химически однородного вещества
Условие равновесия фаз можно получить из теорем термодинамики. При равновесии системы температуры и давления всех фаз ее одинаковы. Если их поддерживать постоянными, то термодинамический потенциал системы может только убывать. При равновесии он принимает минимальное значение.
Рассмотрим систему, состоящую из двух фаз 1 и 2, которые могут превращаться друг в друга. Пусть m1 - масса первой, а m2 – масса второй фазы. Обозначим посредством j1 и j2 удельные термодинамические потенциалы вещества в этих фазах. Термодинамический потенциал всей системы представляется в виде:
Ф = m1 j1 + m2 j2 .
Пусть давление и температура системы поддерживаются постоянными. Тогда при фазовых превращениях величины j1 и j2 не будет изменяться, так как они являются однозначными функциями только температуры и давления. Не будет, разумеется, изменяться и полная масса вещества m = m1 + m2 . Могут изменяться только массы m1 и m2 . И эти изменения должны происходить в таком направлении, чтобы термодинамический потенциал принял наименьшее значение, возможное в рассматриваемых условиях. Если j1 j2 , то всякое превращение фазы 1 в фазу 2 сопровождается уменьшением Ф. Это превращение и будет происходить, пока вся фаза 1 не перейдет в более устойчивую фазу 2. Тогда система сделается однофазной, а ее термодинамический потенциал достигнет минимального значения mj2 . Наоборот, если j1 j2 , то фаза 2 в конце концов превратиться в фазу 1. Только при условии
j 1 (Р, Т) = j 2 (Р, Т) (1)
фазы будет находиться в равновесии друг с другом. Таким образом, условием равновесия фаз является равенство их удельных термодинамических потенциалов.
Внутренняя энергия U и энтропия S тела определены с точностью до произвольных аддитивных постоянных. Поэтому термодинамический потенциал
Ф = U – TS + PV
и его удельное значение j (Р, Т) определены с точностью до произвольной линейной функции температуры. Возникающая благодаря этому неоднозначность должна быть исключена из условия (1). Для этого достаточно условиться определять удельные термодинамические потенциалы j1 (Р, Т) и j2 (Р, Т) путем интегрирования выражения dj= - sdT + vdP, исходя из одного и того же начального состояния. Смысл условия (1) состоит в том, что при любых фазовых превращениях величина удельного термодинамического потенциала остается неизменной. Таким образом, при всех изменениях состояния вещества его удельный термодинамический потенциал всегда изменяется непрерывно. В этом отношении он отличается от других физических величин - удельного объема, удельной энтропии и теплоемкости, диэлектрической и магнитной проницаемости, электрической проводимости и пр., которые при фазовых превращениях, как правило, меняются скачкообразно.
3. Возгонка (сублимация)
В твердых телах при любой температуре имеется некоторое количество молекул, энергия которых оказывается достаточной для того, чтобы преодолеть притяжение к другим молекулам, покинуть поверхность твердого тела и перейти в газообразную фазу. Переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое, носит название сублимации (возгонка). Поскольку при возгонке изменяется удельный объём вещества и поглощается энергия (теплота сублимации), возгонка является фазовым переходом первого рода. Обратным процессом является десублимация. Известным примером десублимации является появление инея на ветках во время усиления мороза.
Все твердые тела без исключения в той или иной степени сублимируют. У одних веществ, таких, например, как углекислота, процесс сублимации протекает с заметной скоростью; у других веществ этот процесс при обычных температурах столь незначителен, что практически не обнаруживается.
При испарении и сублимации тело покидает наиболее быстрые молекулы, вследствие чего средняя энергия оставшихся молекул уменьшается и тело охлаждается. Чтобы поддерживать температуру испаряющегося тела неизменной, к нему нужно непрерывно подводить тепло. Тепло q, которое необходимо сообщить единице массы вещества для того, чтобы превратить ее в пар, находящийся при той же температуре, какую имело вещество до испарения, называется удельной теплотой испарения.
4. Плавление и кристаллизация
Переход кристаллического тела в жидкое состояние происходит при определенной для каждого вещества температуре и требует затраты некоторого количества тепла, называемого теплотой плавления.
Если веществу, первоначально находившемуся в кристаллическом состоянии, сообщать каждую секунду одно и то же количество тепла, то изменение температуры тела со временем будет таким как показано на рис. 3.
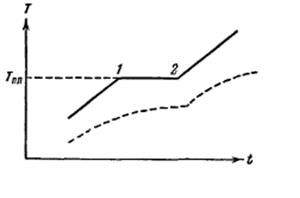
Рис.3
Вначале температура тела все время растет. По достижении температуры плавления Тпл (точка 1 на рис.3), несмотря на то, что к телу по – прежнему продолжает подводиться тепло, температура его перестает изменяться. Одновременно начинается процесс плавления твердого тела, в ходе которого все новые порции вещества превращаются в жидкость. После того как процесс плавления будет закончен и все вещество полностью перейдет в жидкое состояние (точка 2 на рис.2) температура снова начнет повышаться.
Кривая нагревания аморфного тела выглядит иначе (см. пунктирную кривую на рис.3). При равномерном подводе тепла температура аморфного тела непрерывно растет. Для аморфных тел нет определенной температуры перехода в жидкое состояние. Этот переход совершается непрерывно, а не скачками. Можно указать интервал температур, в пределах которого происходит размягчения тела. Это объясняется тем, что жидкости и аморфные тела отличаются лишь степенью подвижности молекул, - аморфные тела представляют собой сильно переохлажденные жидкости.
Температура плавления зависит от давления. Таким образом, переход из кристаллического в жидкое состояние происходит при вполне определенных условиях, характеризуемых значениями давлениями и температуры. Совокупности этих значений соответствует кривая на диаграмме (р, Т), которую принято называть кривой плавления. Кривая плавления идет очень круто. Для того, например, чтобы изменить на 1 К температуру таяния льда, необходимо изменить давление на 132 ат.
Точки кривой плавления определяют условия, при которых кристаллическая и жидкая фазы могут находиться в равновесии друг с другом. Такое равновесие возможно при любом соотношении между массами жидкости и кристаллов, т.е. при значениях объема системы, заключенных в пределах от mV’т до mV’ж , где m - масса системы, а V’т и V’ж - удельные объемы твердой и жидкой фаз.
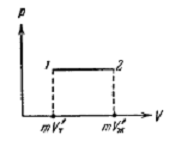
Рис. 5
Поэтому каждой точке плавления соответствует на диаграмме (P,V) отрезок горизонтальной прямой (рис.5.) поскольку вещество в состояниях, изображаемых точками этого отрезка имеет одну и ту же температуру, прямая 1-2 на рис. 5 представляет собой участок изотермы, соответствующий двухфазным состояниям вещества.
Обратный плавлению процесс кристаллизации протекает следующим образом. При охлаждении жидкости до температуры, при которой твердая и жидкая фазы могут находиться в равновесии при данной давлении (т.е. до той же температуры, при которой происходило плавление), начинается одновременный рост кристалликов вокруг так называемых зародышей или центров кристаллизации. Разрастаясь все более, отдельные кристаллики вконце концов смыкаются друг с другом, образуя поликристаллическое твердое тело.
Центрами кристаллизации могут служить взвешенные в жидкости твердые частицы. Тщательно очищенную от таких частиц жидкость можно охладить ниже температуры кристаллизации без того, чтобы началось образование кристалликов. Состояние такой переохлажденной жидкости является метастабильным. Обычно достаточно попасть в такую жидкость пылинке, для того чтобы она распалась на жидкость и кристаллы, находящиеся при равновесной температуре. Однако в некоторых случаях при больших переохлаждениях подвижность молекул жидкости оказывается столь незначительной, что метастабильное состояние может сохраняться очень долго. Жидкость в таких случаях обладает весьма малой текучестью и представляет собой аморфное твердое тело.
Процесс кристаллизации сопровождается выделением такого же количества тепла., которое поглощается при плавлении.
5. Диаграмма состояния. Тройная точка
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния. Одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического теплового движения молекул, и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями - температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления. Для наглядного изображения фазовых превращений используется диаграмма состояния (рис. 6), на которой в координатах р, Т задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (синяя линия), плавления (зеленая линия) и сублимации (красная линия), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой, жидкой и газообразной фаз.
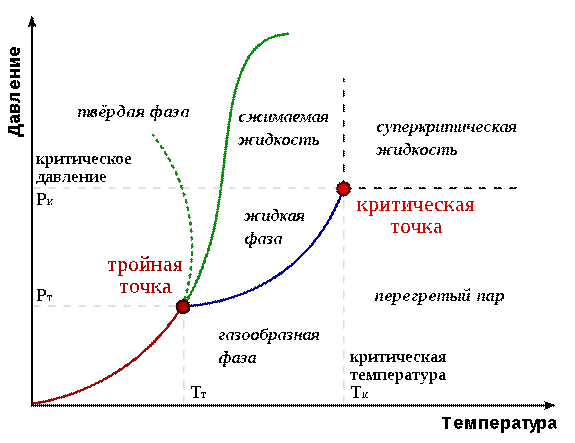
Рис. 6 – Типичные виды фазовых диаграмм
На фазовой диаграмме вещества различные термодинамические фазы занимают определённые области. Линии, разделяющие различные термодинамические фазы, называются линиями фазового перехода. Если вещество находится в условиях, отвечающих точке внутри какой-либо области, то оно полностью находится в этой термодинамической фазе. Если же состояние вещества отвечает точке на одной из линий фазовых переходов, то вещество в термодинамическом равновесии может находиться частично в одной, а частично в другой фазе. Пропорция двух фаз определяется, как правило, полной энергией, запасённой системой.
При медленном (адиабатическом) изменении давления или температуры вещество описывается движущейся точкой на фазовой диаграмме. Если эта точка в своём движении пересекает одну из линий, разделяющих термодинамические фазы, происходит фазовый переход, при котором физические свойства вещества меняются скачкообразно.
Не все фазы полностью отделены друг от друга линией фазового перехода. В некоторых случаях эта линия может обрываться, оканчиваясь критической точкой. В этом случае возможен постепенный, а не скачкообразный переход из одной фазы в другую, в обход линии фазовых переходов.
Точка на фазовой диаграмме, где сходятся три линии фазовых переходов, называется тройной точкой. Обычно под тройной точкой вещества подразумевается частный случай, когда сходятся линии плавления, кипения и сублимации, однако на достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. Тройная точка воды характеризуется температурой 273,16 К и является основной реперной точкой для построения термодинамической температурной шкалы.
Для вещества с несколькими кристаллическими модификациями диаграмма состояния имеет более сложный характер. На рисунке 7 изображена диаграмма для случая, когда число различных кристаллических модификаций равно двум. В этом случае имеются две тройные точки. В точке Tp в равновесии находятся жидкость, газ и первая кристаллическая модификация вещества, в точке Tp’ находятся в равновесии жидкость и обе кристаллические модификации.
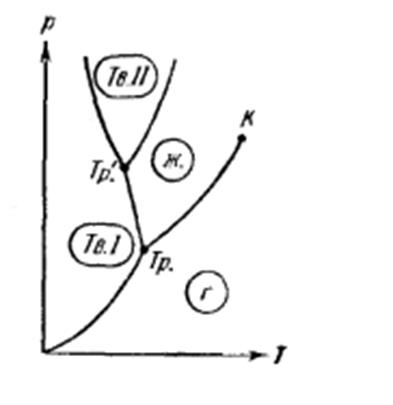
Рис. 7
Диаграмма состояния для каждого конкретного вещества строится на основе экспериментальных данных. Зная диаграмму состояния, можно предсказать, в каком состоянии будет находиться вещество при различных условиях (при различных значениях p и T), а так же какие превращения будет претерпевать вещество при различных процессах.
Если удельный объем кристаллов превосходит удельный объем жидкой фазы, то поведение вещества при некоторых процессах может оказаться весьма своеобразным.

Рис. 8
Возьмем, например, подобное вещество в состоянии, изображенном точкой 1 (см. рис. 8), и подвергаем его изотермическому сжатию. При таком сжатии давление растет и процесс изобразится на диаграмме вертикальной прямой (пунктирная прямая 1-2). Как следует из рисунка 8, вещество проходит при повышении давления такую последовательность состояний: газ – кристаллы – жидкое состояние. Подобная последовательность, очевидно, наблюдается только при температурах меньших, чем температура тройной точки.
Можно отметить еще одну особенность диаграммы состояния. Кривая испарения заканчивается в критической точке К. Поэтому возможен переход из области жидких состояний в область газообразных состояний, совершаемый в обход критической точки, без пересечения кривой испарения (переход 3-4 на рис.8). В этом случае переход из жидкого состояния в газообразное (и обратно) совершается непрерывно, через последовательность однофазных состояний.