Исследование распределения и накопления трихлоруксусной кислоты в модельных системах и природных водах
СОДЕРЖАНИЕ: Механизмы трансформации пестицидов в окружающую среду. Детоксицирующая роль высших водных растений. Физическое, химическое и биохимическое самоочищение водных объектов. Методы анализа и идентификации токсинов. Исследование адсорбции ТХУ на бентоните.Министерство образования и науки Украины
Таврический национальный университете им. В.И. Вернадского
Химический факультет
Кафедра физической и аналитической химии
Курсовая работа
Исследование распределения и накопления трихлоруксусной кислоты в модельных системах и природных водах
Дисциплина Физическая химия
Специальность 7.070301 - химия
Курс 4
Научный руководитель:
доцент кафедры общей химии,
кандидат химических наук
Першина Е.Д.
Симферополь 2004
Содержание
Введение
1. Литературный обзор
1.1 Классификация пестицидов
1.2 Механизмы трансформации пестицидов в окружающую среду
1.2.1 Поступление пестицидов в водную среду и циркуляция в водных экосистемах
1.2.2 Детоксицирующая роль высших водных растений
1.2.3 Пестициды в почве
1.3 Самоочищение водных объектов
1.3.1 Физические механизмы самоочищения
1.3.2 Химические механизмы самоочищения
1.3.3 Биохимическое самоочищение
1.4 Методы анализа пестицидов
1.4.1 Отбор и подготовка проб
1.4.2 Разделение и идентификация пестицидов
1.4.3.Особенности определения пестицидов в почве
2. Материал и методика работы
2.1 Объект исследования
2.2 Методы исследования
2.2.1 Исследование адсорбции ТХУ на бентоните
2.2.2 Исследование поверхностного натяжения растворов ТХУ
2.2.3 Распределение ТХУ в объёме модельных систем
3. Обсуждение результатов
Выводы
Список литературы
пестицид самоочищение адсорбция бетонит
Введение
Экология, загрязнение окружающей среды, экологический мониторинг, экологическая химия — часто встречающиеся в наше время слова и сочетания, выражающие всеобщую озабоченность состоянием природной среды. Первопричина возникновения проблемы — обнаружение в экологических системах, прежде всего в биосфере, интенсивных и тревожных изменений, вызванных деятельностью человека, антропогенных изменений. Из большого числа вредных факторов отметим выброс в биосферу химически чуждых природе веществ, физически активных частиц, пыли, аэрозолей, повышение температуры биосферы, энергетическое загрязнение, физическое и биологическое воздействие на нее. Для оценки степени негативных изменений осуществляют экологический мониторинг — систему наблюдений и контроля за изменениями в составе, и функциях различных экологических систем.
В экологическом мониторинге активно используют различные химические, физико-химические, физические и биологические методы анализа. Речь идет о неком глобальном химико-аналитическом исследовании с помощью различных методов аналитической химии — науки о методах анализа.
Результаты аналитических определений и измерений рассматривают уже в рамках экологического мониторинга. Это дает информацию о загрязнении биосферы различными несвойственными природе загрязняющими веществами, которые собирательно называют ксенобиотиками. Данные экологического мониторинга используют для всестороннего анализа состояния окружающей среды и определения стратегии управления им, для регулирования ее качества, для определения так называемых допустимых экологических нагрузок на природные системы. Степень ответственности здесь очень велика, поскольку указанные факторы, и в первую очередь химические, способны вызвать геофизические и геохимические изменения: возможное изменение климата, закисление природных вод кислотными дождями, загрязнение Мирового океана и нарушение баланса углекислоты в нем, нарушение озонового слоя [1].
Обязательно следует контролировать и самые токсичные вещества, отличающиеся наиболее низкими значениями ПДК. Это позволяет сформировать список приоритетных загрязняющих веществ, которые следует определять в первую очередь.
Косвенные данные позволяют заключить, что в воде вполне могут оказаться гербициды и пестициды, смытые с полей. Поэтому крайне актуально создание системы мониторинга качества питьевой воды, как подсистемы экологического мониторинга.
Можно сказать, что прослеживается явная необходимость в моделировании поведения выше названных загрязнителей в природной воде, изучении кинетики и механизмов трансформации, что является одним из критериев в оценке и мониторинге окружающей среды [2].
1. Литературный обзор
1.1 Классификация пестицидов
К наиболее ощутимым последствиям для экологического равновесия в природе является загрязнение рек, озер и других водоемов.
Одним из источников возможного загрязнения окружающей среды являются химические препараты, используемые для борьбы с различными вредными организмами в сельском хозяйстве, здравоохранении и промышленности, объединяемые общим названием - пестициды.
По химическому принципу пестициды подразделяются:
I. Хлорсодержащие органические пестициды.
1. Хлорпроизводные циклоалканов и циклоалкадиенов.
2. ДДТ и его производные.
3. Хлорпроизводные диоксина.
4. Хлорпроизводные дибензофурана.
5. Хлорбифенилы.
II. Спирты, фенолы и простые эфиры.
III. Карбоновые ксилоты и их производные.
1. Ароматические карбоновые кислоты и их производные.
2. Жирные кислоты и их производные.
3. Арилоксиалканкарбоновые кислоты.
IV. Амины и соли четвертичных аммониевых оснований.
V. Производные карбаминовых, тио- и дитиокарбаминовых кислот.
VI. Производные мочевины.
VII. Фосфорорганические соединения.
1. Производные фосфорной кислоты.
2. Производные тиофосфорной кислоты.
VIII. Азотсодержащие гетероциклические соединения.
1. Гетероциклические соединения с одним гетероатомом.
2. Гетероциклические соединения с двумя гетероатомами.
3. Гетероциклические соединения с тремя гетероатомами.
• производные сим-триазина;
• производные асим-триазина;
• производные тиодиазина.
IX. Пестициды перитроидной природы.
X. Соединения ртути, меди, цинка и других металлов.
1.2 Механизмы трансформации пестицидов в окружающую среду
1.2.1 Поступление пестицидов в водную среду и циркуляция в водных экосистемах
В настоящее время химические средства защиты растений (ХСЗР, пестициды) занимают и будут занимать в обозримом будущем ведущее место в интегрированной системе борьбы с вредителями, болезнями и сорняками. Хорошо растворимые и водной среде пестициды и, как правило, не обладающие выраженным сорбционными свойствами мигрируют преимущественно с водной фазой.
Хлорорганические пестициды (ХОС), отличающиеся очень низкой растворимостью в воде и хорошо выраженными сорбционными свойствами, мигрируют преимущественно с твердой фазой [4].
Источники поступления пестицидов в водную среду, весьма многообразны. К ним относятся вымывание из грунтов накопивших их в результате систематического применения в целях защиты растений, вынос с рисовых полей при сбросе воды в нижерасположенные водные объекты; авиаобработки прибрежных территорий и лесных массивов; санитарно-профилактическая обработка водоемов (для борьбы с гнусом малярийным комаром и т. д.); сброс сточных вод предприятиям, производящими пестициды, а также предприятиями пищевой промышленности (сахарные заводы и др.), которые получают обработанное ядохимикатами сельскохозяйственное сырье; оседание выветриваемого частиц грунта, содержащих остатки пестицидов поступление через притоки из более или менее отдаленных территорий; вы падение атмосферных осадков, содержащих пестициды. Последние способны также испаряться из водных объектов (редистилляция) возвращаться в атмосферу.
Все эти миграционные процессы, естественно, требуют определенного времени, однако в конечном итоге они приводят к перемещению остатков пестицидов с поверхности суши в Мировой океан.
Очень мало известно о том, какую роль в задержке стока пестицидов играют водоемы зарегулированного стока (водохранилища), хотя очевидно, что оседание здесь должно быть не меньшим, чем в дельтах рек [5].
Накапливаясь в клетках планктонных водорослей, пестициды могут существенно нарушать процессы фотосинтеза и роста, а также проявлять альгицидное действие. Вурстер показал на лабораторных культурах, представлявших четыре класса морских планктонных водорослей, что их фотосинтез угнетается уже при микрограммовых концентрациях пестицидов.
Эффект воздействия пестицидов на фитопланктон во многом зависит от того, в какой форме он находится в водной среде. При растворении в нефти и нефтепродуктах пестициды проникают через клеточную оболочку значительно активнее, чем, находясь во взвешенном или растворенном в воде состоянии. Поэтому наиболее опасным для фитопланктона является сочетание нефтяного загрязнения с остатками пестицидов. Аналогичную роль, по-видимому, играет их сочетание с поверхностно-активными веществами.
Претерпевая соответствующую метаболизацию, пестициды по всем основным каналам циркуляции поступают в конечное звено трофических цепей и накапливается в хищных рыбах. Переход в следующее трофическое звено возможен только через рыбоядных птиц, и при использовании рыбы в пищу цикл замыкается на человеке.
Рыбы поглощают пестициды как непосредственно из воды — осмотическим путем, так и, главным образом, через пищу первоначально предполагалось, что основным механизмом является поступление через поверхность жабр, однако этот путь реализуется только в отдельных случаях, когда пестициды непосредственно поглощается из толщи воды.
Установлено, что содержание пестицидов в рыбах может увеличиваться с возрастом, из чего следует, что рыбы выступают как агент самоочищения водоемов от остатков пестицидов, подобно тому, как это имеет место в отношении радиоактивности.
Обобщив данные о путях миграции пестициды в водных экосистемах, предложена следующая схема круговорота пестицидов в гидросфере.
Как видно из схемы, цикл круговорота ДДТ в гидросфере может быть охарактеризован следующим образом:
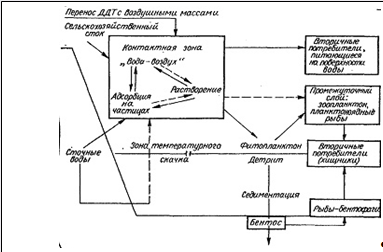
— поступление по основным транспортным путям (сточные воды, атмосфера, почвенный сток) в водные объекты. Судьба пестицидов при этом зависит от того, поступает ли он с потоками тяжелой сточной воды и оказывается в природных слоях (в стратифицированных водоемах — ниже зоны термоклина) или же в толще воды — выше этой зоны;
- адгезия или сорбция пестицидов на минеральных частицах, детрите и т. д. (диаметр частиц 250—1000 мкм);
- осаждение частиц на дно и кумуляция в донных отложениях;
- частичное растворение пестицидов в воде;
- осмотическое поглощение фитопланктоном и микроорганизмами.
Из схемы следует, что если остатки пестицидов попали в экологическую систему водоема, то они, в конечном счете, будут изъяты из первого отсека
- поверхностного планктона и планктоноядных рыб — тремя путями:
- в результате поедания птицами, млекопитающими пли хищными рыбами — обитателями поверхностных слоев поды;
- в результате оседания детрита;
- в результате потребления носителей пестицидов вертикально мигрирующими планктонофагами и хищниками из средних слоев (пелагиали).
Часть фитопланктона, кроме того, оседает на дно в результате отмирания, унося с собой в придонные слои остатки пестицидов [5].
1.2.2 Детоксицирующая роль высших водных растений
Токсикологические исследования, в которых основными объектами являются водные животные — рыбы и беспозвоночные, — неизбежно приводят к выводу о чрезвычайной экологической опасности персистентных пестицидов. Этот вывод относится, прежде всего, к водным животным. Однако водные экосистемы наряду с животными организмами включают и растительные, которые (как высшие, так и низшие) вместе с ассоциированными с ними гидробионтами играют существенную роль в процессах накопления и деградации органических загрязнителей.
Между тем роль растительных организмов и ассоциаций в циркуляции пестицидов в водных экосистемах проанализирована недостаточно. Высшие водные растения и нитчатые водоросли в многочисленных исследованиях по проблеме химической борьбы с водными сорняками рассматривались и рассматриваются только как объекты, подлежащие полному или частичному уничтожению, а не как составная часть водных экосистем, которая активно участвует в самоочищении водоемов от загрязнения пестицидами, поступающими с промышленным и сельскохозяйственным стоком. Вместе с тем, эти исследования показали, что для подавления вегетации высших водных растений нужны очень высокие концентрации гербицидных препаратов (до 80—200 кг/га) — во много раз выше, чем для борьбы с сельскохозяйственными сорняками, и тем более — те концентрации, которые могут временно появляться в водоемах в результате постепенных или залповых загрязнений за счет сельскохозяйственного или промышленного стока.
Хлорорганические инсектициды не обладают гербицидными свойствами, поэтому их взаимодействие с водными растениями не привлекало специального внимания. Это взаимодействие может быть рассмотрено в двух аспектах:
а) влияние на основные жизненные процессы высших водных растений;
б) поглощение пестицидов высшими водными растениями и детоксицирующая роль растений.
Наиболее чувствительным к присутствию токсических агентов в среде физиологическим процессом растении является фотосинтез.
Поэтому в качестве одного из основных показателей, характеризующих влияние ХОП, обычно рассматривается и функциональная активность фотосинтетического аппарата некоторые водных растений в аквариумных опытах [5].
1.2.3 Пестициды в почве
До 80% пестицидов адсорбируется почвенным гумусом. В адсорбированном же состоянии большинство гербицидов практически не подвергается разложению. Биологической трансформации подвержена только та часть из них, которая находится в почвенной влаге в растворенном виде. Тем самым разнообразнейшие процессы трансформации пестицидов в почве можно свести к аналогичным процессам, происходящим в водной среде. При наличии сорбции время жизни пестицидов в почвенном покрове значительно возрастает.
Адсорбционные свойства почвы зависят от природы глинистых минералов, окислов и содержания гумуса (почвенной органики). Соли гуминовых кислот образуют с минеральными частицами прочные органоминеральные комплексы, которые и сорбируют пестициды. Повышение сорбционной емкости почвенных пород по отношению к пестицидам за счет гумифицирования глинистого слоя почвы позволяет задержать миграцию пестицидов и продуктов их трансформации в водоемы. В качестве веществ гумусовой природы могут использоваться перегной, торф, бурый уголь. Можно вводить и лигнинсодержащие вещества, поскольку лигнин — устойчивое к ферментативному разложению соединение, которое постепенно превращается в гумусовое вещество.
Проверка эффективности применения подобного суглинистого экрана с добавлением веществ гумусовой природы для уменьшения выноса остатков гербицидов дренажными водами, проведенная в полевых условиях Краснодарского края, юга Украины и Молдавии, показала, что гербициды почти полностью поглощаются. Интересно отметить, что испарение пестицида протекает более эффективно с поверхности влажных почв, чем с поверхности сухих. Связано это с тем, что вода и пестицид конкурируют за одну и ту же сорбционную поверхность.
Восходящее перемещение химикатов к поверхности осуществляется за счет конвенции, обусловленной испарением воды [6].
В период полевых бурь значительное количество пестицидов переносится воздушными течениями и затем осаждается на поверхности земли, мигрируя далее в водоемы с поверхностным стоком [4].
1.3 Самоочищение водных объектов
1.3.1 Физические механизмы самоочищения
Между компонентами водной экосистемы в процессе ее функционирования непрерывно происходит обмен веществом и энергией. Этот обмен носит циклический характер различной степени замкнутости, сопровождаясь трансформацией вещества под воздействием физических, химических и биологических факторов. В ходе трансформации может происходить постепенное разложение сложных веществ до простых, а простые вещества могут синтезироваться в сложные. В зависимости от интенсивности внешнего воздействия на водную экосистему и характера протекания процессов происходит либо восстановление водной экосистемы до фоновых состояний (самоочищение), либо водная экосистема переходит к другому устойчивому состоянию, которое будет характеризоваться уже иными количественными и качественными показателями биотических и абиотических компонент. В случае, если внешнее воздействие превысит саморегулирующие возможности водной экосистемы, может произойти ее разрушение. Самоочищение водных экосистем является следствием способности к саморегулированию. Поступление веществ из внешних источников есть воздействие, которому водная экосистема способна противостоять в определенных пределах посредством внутрисистемных механизмов. В экологическом смысле самоочищение является следствием процессов включения поступивших в водный объект веществ в биохимические круговороты с участием биоты и факторов неживой природы.
Круговорот любого элемента слагается из двух основных фондов — резервного, образованного большой массой медленно изменяющихся компонент, и обменного (циркуляционного), который характеризуется быстрым обменом между организмами и средой их обитания. Все биохимические круговороты можно разделить на два основных типа — с резервным фондом в атмосфере (например, азот) и с резервным фондом в земной коре (например, фосфор).
Самоочищение природных вод осуществляется благодаря вовлечению поступающих из внешних источников веществ в непрерывно происходящие процессы трансформации, в результате которых поступившие вещества возвращаются в свой резервный фонд.
Трансформация веществ есть результат различных одновременно действующих процессов, среди которых можно выделить физические, химические и биологические механизмы. Величина вклада каждого из механизмов зависит от свойств примеси и особенностей конкретной экосистемы.
Газообмен на границе раздела атмосфера-вода. Благодаря этому процессу осуществляется поступление в водный объект веществ, имеющих резервный фонд в атмосфере, и возврат этих веществ из водного объекта в резервный фонд. Одним из важных частных случаев газообмена является процесс атмосферной реаэрации, благодаря которому происходит поступление в водный объект значительной части кислорода. Интенсивность и направление газообмена определяются отклонением концентрации газа в воде от концентрации насыщения С. Величина концентрации насыщения зависит от природы вещества и физических условий в водном объекте — температуры и давления. При концентрациях, больших С, газ улетучивается в атмосферу, а при концентрациях, меньших Cs , газ поглощается водной массой.
Сорбция — поглощение примесей взвешенными веществами, донными отложениями и поверхностями тел гидробионтов. Наиболее энергично сорбируются коллоидные частицы и органические вещества, находящиеся в недиссоциированном молекулярном состоянии. В основе процесса лежит явление адсорбции. Скорость накопления вещества в единице массы сорбента пропорциональна его ненасыщенности по данному веществу и концентрации вещества в воде и обратно пропорциональна содержанию вещества в сорбенте. Примерами нормируемых веществ, подверженных сорбции, являются тяжелые металлы и СПАВ.
Осаждение и взмучивание. Водные объекты всегда содержат некоторое количество взвешенных веществ неорганического и органического происхождения. Осаждение характеризуется способностью взвешенных частиц выпадать на дно под действием силы тяжести. Процесс перехода частиц из донных отложений во взвешенное состояние называется взмучиванием. Он происходит под действием вертикальной составляющей скорости турбулентного потока.
1.3.2 Химические механизмы самоочищения
Фотолиз — превращение молекул вещества под действием поглощаемого ими света. Частными случаями фотолиза являются фотохимическая диссоциация — распад частиц на несколько более простых и фотоионизация — превращение молекул в ионы. Из общего количества солнечной радиации порядка 1% используется в фотосинтезе, от 5% до 30% отражается водной поверхностью. Основная же часть солнечной энергии преобразуется в тепло и участвует в фотохимических реакциях. Наиболее действенной частью солнечного света является ультрафиолетовое излучение. Ультрафиолетовое излучение поглощается в слое воде толщиной порядка 10 см, однако благодаря турбулентному перемешиванию может проникать и в более глубокие слои водных объектов. Количество вещества, подвергшегося действию фотолиза, зависит от вида вещества и его концентрации в воде. Из веществ, поступающих в водные объекты, относительно быстрому фотохимическому разложению поддаются гумусные вещества.
Гидролиз — реакция ионного обмена между различными веществами и водой. Гидролиз является одним из ведущих факторов химического превращения веществ в водных объектах. Количественной характеристикой этого процесса является степень гидролиза, под которой понимают отношение гид-ролизированной части молекул к общей концентрации соли. Для большинства солей она составляет несколько процентов и повышается с увеличением разбавления и температуры воды. Гидролизу подвержены и органические вещества. При этом гидролитическое расщепление чаще всего происходит по связи атома углерода с другими атомами.
Одним из эффективных путей самоочищения является трансформация загрязнителяза счет окислительно-восстановительных реакций при взаимодействии с редокс-компанентами водной среды.
Возможность протекания Red-Ox превращений в системе характеризуется величиной ее окислительно-восстановительного потенциала (Eh ). На величину Eh природных вод влияют свободный O2 , H2 O2, Fe2+ , Fe3+ , Mn2+ , Mn4+ , H+ , органические соединения и другие потенциалзадающие компоненты. В природных водах Eh обычно колеблется от +0,7 до -0,5В. Поверхностные и грунтовые воды, насыщенные кислородом, чаще всего характеризуются интервалом Eh от +0,150 до +0,700В. Исследования показывают, что в процессах самоочищения большую роль играют редокс - превращения с участием H2 O2 естественного происхождения и присутствующих в водоемах ионов металлов переменной валентности. В природной воде стационарная концентрация H2 O2 находится в пределах 10-6 - 10-4 моль/л [4]. Перекись водорода образуется за счет фотохимических и окислительных процессов с участием молекулярного кислорода в гомогенной среде. Поскольку распад H2 O2 , главным образом, определяют каталитические количества ионов металлов и солнечный свет, его скорость почти не зависит от исходной концентрации.
1.3.3 Биохимическое самоочищение
Биохимическое самоочищение является следствием трансформации веществ, осуществляемой гидробионтами. Как правило, биохимические механизмы вносят основной вклад в процесс самоочищения и только при угнетении водных организмов (например, под действием токсикантов) более существенную роль начинают играть физико-химические процессы. Биохимическая трансформация веществ происходит в результате их включения в трофические сети и осуществляется в ходе процессов продукции и деструкции.
Особенно важную роль играет первичная продукция, так как она определяет большинство внутриводоемных процессов. Основным механизмом новообразования органического вещества является фотосинтез. В большинстве водных экосистем ключевым первичным продуцентом является фитопланктон. В процессе фотосинтеза энергия Солнца непосредственно трансформируется в биомассу. Побочным продуктом этой реакции является свободный кислород, образованный за счет фотолиза воды. Наряду с фотосинтезом в растениях идут процессы дыхания с затратой кислорода.
Автотрофная продукция и гетеротрофная деструкция — две важнейшие стороны преобразования вещества и энергии в водных экосистемах. Характер и интенсивность продукционно-деструкционных процессов и, следовательно, механизм биохимического самоочищения определяются структурой конкретной экосистемы. Поэтому они могут существенно различаться в различных водных объектах. Более того, в пределах одного водного объекта существуют различные зоны жизни (экологические зоны), отличающиеся сообществами населяющих их организмов. Эти отличия обусловлены сменой условий существования при переходе от поверхности к глубине и от прибрежных зон к открытым частям.
В водотоках в силу интенсивного перемешивания и небольших глубин вертикальная зональность не выражена. По живому сечению потока различают рипаль — прибрежную зону и медиаль — открытую зону, соответствующую стрежню реки. Для рипали характерны невысокие скорости течения, заросли макрофитов, высокие значения количественного развития гидробионтов. В медиали скорости движения воды выше, количественное развитие гидробионтов ниже. По продольному профилю различают зоны плесов и зоны перекатов. В зоне плесов, характеризующихся замедленным течением, население количественно богаче, но качественно беднее. Для перекатов характерна обратная картина.
Комплексы экологических условий сказываются на процессах самоочищения в водотоках. Для замедленных течений характерны благоприятные условия для фотосинтеза, интенсивные процессы трансформации веществ, процессы осаждения. Для зон с повышенными скоростями характерны интенсивные процессы перемешивания, газообмена и деструкции веществ.
В водоемах экологическая зональность проявляется отчетливее, чем в водотоках. В водоемах по горизонтальному профилю выделяют литораль — зону прибрежных мелководий и пелагиаль (лимническая зона) — зону открытой воды. В глубоких водоемах в водной массе пелагиали по вертикали выделяют три зоны — эпилимнион, металимнион и гиполимнион. Мета-лимнион, или термоклин, является зоной, разделяющей эпилимнион и гиполимнион. Он характеризуется резким снижением температуры воды (1 градус на 1 м глубины). Выше металимниона расположен эпилимнион. Для эпилимниона характерно преобладание продукционных процессов. С увеличением глубины, по мере снижения фотосинтетически активной радиации (ФАР) происходит уменьшение интенсивности фотосинтеза. Глубина, при которой продукция становится равной деструкции, называется компенсационным горизонтом. Выше него располагается трофогенная зона, где преобладают продукционные процессы, а ниже — трофолитическая, где преобладают процессы дыхания и разложения. Трофогенная зона находится в эпилимнионе, а трофолитическая, как правило, охватывает металимнион и гиполимнион.
В придонной зоне водоемов, кроме литорали, выделяют профундаль — глубоководную часть, примерно совпадающую с частью ложа водоема, заполненной водами гиполимниона.
Таким образом, в водоемах можно выделить зоны с преобладанием фотосинтетической продукции и зоны, где идут только процессы деструкции веществ. В гиполимнионе, особенно в зимний и летний периоды, часто наблюдаются анаэробные условия, что снижает интенсивность процессов самоочищения. Напротив, в литорали температурный и кислородный режимы благоприятны для интенсивного протекания процессов самоочищения [7].
1.4 Методы анализа пестицидов
1.4.1 Отбор и подготовка проб
Химический анализ воды на следы пестицидов в последнее время сильно обогатился новыми методами определения их в растительных продуктах и продуктах животноводства.
Определение пестицидов затруднено тем, что едва ли в какой-либо другой области использования химических реагентов наблюдается такая быстрая смена (применяемых активных веществ).
Отбор проб. Объем пробы воды, необходимый для исследования, различен в разных случаях и может составлять от нескольких миллилитров (например, для хроматографических определений) до почти 50л, если необходимо предварительное концентрирование.
Выделение. Выделение пестицидов из пробы воды часто проводят аналогично выделению углеводородов.
Если для выделения больших количеств пестицидов необходима обработка соответственно больших объемов воды, рекомендуется адсорбция на активном угле.
Большинство пестицидов практически нерастворимо в воде, но они экстрагируются полностью при однократном взбалтывании, например, с четыреххлористым углеродом, хлороформом или петролейным эфиром [8].
1.4.2 Разделение и идентификация пестицидов
Для разделения пестицидов, применяемых для одной и той же цели, большей частью пользуются избирательными методами тонкослойной и газовой хроматографии.
Весьма специфическое определение отдельных инсектицидов возможно на оснoвe получения их ИК-спектров, однако для этого требуются большие количества вещества, чем для проведения химических методов [8].
Основные методы анализа пестицидов различных классов приведены в таблице1.
Таблица 1. Классификация и методы анализа пестицидов.
| Класс пестицидов | Методы анализа |
Хлорорганические пестициды (гексохлоран, ДДТ и его производные, гексохлорбутадиен, гептахлор, хлорофос) |
Тонкослойная и газовая хроматография, полярография, нефелометрия, колориметрия, спектрофотометрия, титриметрия. |
| Карбоновые кислоты и их производные (ТХУ, нафтеновая кислота и их натриевые соли) | Колориметрия, спектрофотометрия, фотоколориметрия, нефелометрия. |
| Производные мочевины (N-арил-N,N-диалкилмочевины) | Колориметрия, хроматография. |
Фосфорорганические пестициды (О-О-диметил-2,2-дихлорвинилфосфат, метилнитрофос, О-О-диметил-S(N-метилкарбамоилметил) дитиофосфата, фосфорамида) |
Хроматография: на бумаге, тонкослойная и ферментная, колориметрия, потенциометрическое титрование. |
Одним из наиболее эффективных методов определения остаточных количеств пестицидов в воде, почве (иле), биологических и других средах является метод газовой хроматографии, позволяющий производить групповой анализ хлорорганических соединений и их идентификацию.
Универсальность, специфичность и высокая чувствительность метода газовой хроматографии делают его наиболее пригодным для определения остаточных количеств пестицидов в различных средах, включая биологические.
Принцип метода газовой хроматографии основан на извлечении остатков хлорорганических пестицидов из пробы экстракцией растворителей, очистке экстракта и конечном определении исследуемых пестицидов па газовом хроматографе с детектором постоянной скорости рекомбинации (детектором по захвату электронов).
Важно, чтобы в распоряжении специалистов, работающих на водоёмах, были простые и доступные методы, позволяющие оперативно выявлять присутствие остатков инсектицидов в органах и тканях рыб и других водных животных [5].
1.4.3 Особенности определения пестицидов в почве
Paбoт по определению остаточных количеств пестицидов в почве крайне мало. Методы хроматографии на бумаге и хроматографии в тонком слое с флуоросциином весьма длительны, более прост способ определения хлорорганичоских пестицидов в растительном и биологическом материале М.А.Клисенко и З.Ф.Юрковой. Он и был применён для обнаружения пестицидов в различных почвах.Сущность методики заключается в выделении ядохимиката органическим растворителем, очистки экстракта от примесей концентрированной серной кислотой, хроматографировании на окиси аллюминия в n-гексане или смеси n-гексан-ацетон и проявление раствором азотнокислого серебра с аммиаком в УФ-лучах.
Существенное значение для определения пестицидов в почве имеет очистка экстракта от примесей. Описанные в литературе способы очистки - ацетонитрильная, водно-ацетоновая, водно-металовая, вымораживание в ацетоне, хромовой кислотой, активированным углем, вакуумной сублимацией, хроматографией на колонках - не дают удовлетворительных результатов. Несколько лучше можно очистить экстракт от примесей концентрированной серной кислотой.
Следующим этапом является хроматографирование и проявление [9].
1.4.4 Методы количественного определения ТХУ в растительном материале и почве
Препарат на основе трихлоруксусной кислоты (её натриевая соль) используется как противозлаковый гербицид для борьбы с однодольными сорными растениями.
В литературе приводится несколько методов определения трихлоруксусной кислоты. Франт и Вестиндорф предложили колориметрический способ определения ее в мочевине. Метод анализа трихлоруксусной кислоты в тканях животных организмов описан Фридманом и Купером. Оба способа основаны на реакции Фудживара.
Предложена также цветная реакция хлороформа с резорцином для колориметрического определения дихлоруксусной и трихлоруксусной кислоты в монохлоруксусной кислоте.
Колориметрическое определение трихлоруксусной кислоты в растительном материале описано Тибитсом и Холмом, а также Бронсои и Гуммером.
Вся упомянутые способы определения трихлоруксусной кислоты в растительных объектах колориметрические. Более точные результаты определений особенно при наличии сложных смесей, какими являются гомогенаты растительных объектов, можно получить при помощи спектрофотометрии, где светопоглощение измеряется в узкой части спектра. Это увеличивает чувствительность определения и точность, так как калибровочный график остается прямолинейным на более широком участке концентраций по сравнению с определением на фотоэлектроколориметре. На спектрофотометре в большей мере устраняется влияние посторонних соединений, чем на колориметре [9].
2. Материал и методика работы
2.1 Объект исследования
Объектами исследования являлись модельные системы, представляющие собой растворы трихлоруксусной кислоты в дистиллированной, морской воде и воде симферопольского водохранилища. В качестве гетерогенной составляющей данных систем использовали природный минерал – щелочноземельный бентонит, который залегает в приповерхностной части и на поверхности Кудринского туфогенно-осадочного месторождения у подножия горы Тепебине в Бахчисарайском районе.
Данный бентонит относится к группе монтмориллонита, приблизительная формула которого:
(Na, Ca)0,33 (Al, Mg)2 SiO4 (OH)2 nH2 O
В качестве обменных катионов – Fe3+ [15]. .
2.2 Методы исследования
2.2.1 Исследование адсорбции ТХУ на бентоните
В растворы ТХУ различной концентрации (от 0.003; до 0.03 моль/л) были помещены навески бентонита массой 1г и оставлены на час. Данные растворы перемешивались на электрической мешалке в течении 45 мин. После отстаивания и фильтрования из каждой колбы были отобраны аликвоты для определения остаточной концентрации ТХУ.
Равновесные концентрации ТХУ в исследуемых системах определяли методом потенциометрического титрования на иономере универсальном ЭВ-74 со стеклянным электродом (точность 0,1 ед. рН, ошибка определения 1,32%) [16]. Аналогичные измерения были проведены через 2,5 и 3,5 часа.
Исходя из экспериментальных данных, рассчитываем адсорбцию по формуле [17]:
Г=((С0 -С)•V)/m,
Где С0 – начальная концентрация ТХУ в растворе,
С – полученная в результате эксперимента концентрация,
V – объем исследуемой системы
m – масса бентонита.
2.2.2 Исследование поверхностного натяжения растворов ТХУ
Поверхностное натяжение растворов ТХУ определяли методом стологмометрии (истечения жидкости через капилляр; d=0,54мм.) .
Рассматривались системы в дистиллированной и природной воде Симферопольского водохранилища с различными концентрациями ТХУ. Расчёт поверхностного натяжения проводили по формуле[17]:
s(ТХУраствор )=s(Н2О)* n(Н2 О)/ n(ТХУ),
где s(ТХУраствор ) – поверхностное натяжение раствора ТХУ,
s(Н2 О) – поверхностное натяжение воды,
n(ТХУ) – число капель раствора ТХУ,
n(Н2 О) – число капель воды.
Для расчёта поверхностного натяжения ТХУ природной воде необходимо знать s (Н2 Оприр. ), её находим по формуле:
s(Н2 Оприр. )=s(Н2 О)* n(Н2 О)/ n(Н2 Оприр. )
и затем рассчитываем:
s(ТХУ)=s(Н2 Оприр. )* n(H2 О) /n(ТХУприр .).
2.2.3 Распределение ТХУ в объёме модельных систем
На первом этапе было изучено накопление ТХУ в водных средах, с учетом её поверхностно активных свойств, и распределение ее в объеме исследуемых систем, содержащих дистиллированную воду и воду Симферопольского водохранилища, а затем оценено влияние сорбционных процессов на распределение ТХУ в данных системах. Концентрацию трихлоруксусной кислоты (ТХУ) в модельных системах определяли потенциометрическим титрованием едким натром. Распределение ТХУ в объёме наблюдалось в двух модельных системах:
1. Раствор ТХУ в дистиллированной воде.
2. Раствор ТХУ в воде симферопольского водохранилища.
3. Раствор ТХУ в дистиллированной воде в присутствии бентонита.
Был использован сосуд ёмкостью 10л. В модельной системе (3) он был заполнен раствором ТХУ в дистиллированной воде, и на дне которого был помещён бентонит. Аликвоты для титрования брались пипеткой со дна, из объёма и поверхности системы в обоих случаях. Рассчитали концентрации в придонной части, в объёме и на поверхности системы.
3. Обсуждение результатов.
Данные, полученные при изучении адсорбции ТХУ на бентоните представленны на рисунке 1.
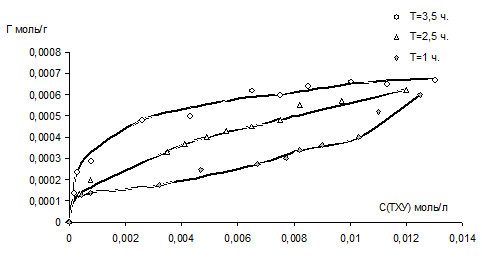
Рис.1.Кинетика адсорбции ТХУ (моль/г.) на монтмориллоните.
Как видно из рисунка, количество адсорбированного вещества пропорционально времени экспозиции, а после 3,5 часов зависимость приобретает экспоненциальный характер, что говорит о процессах насыщения поверхности.
Анализируя построенные графики можно рассчитать величину предельной адсорбции (Гпредельная ) в ленгмюровских координатах ([С], [С]/Г):
Для данного случая уравнение Лэнгмюра имеет вид:
Г=7,1210-4![]()
Очевидно, достаточно высокая адсорбционная емкость бентонита (около 50% от исходного содержания) по отношению к ТХУ в системе, будет обуславливать ее концентрирование в придонной части исследуемых гетерогенных водных систем.
Результаты изучения поверхностной активности трихлоруксусной кислоты в различных водных системах представленны на рисунке 2.
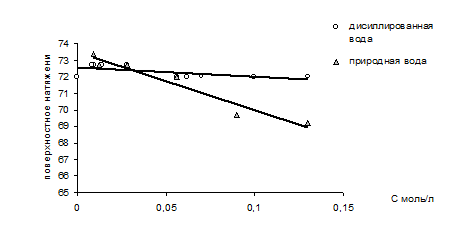
Рис.2 Зависимость поверхностного натяжения растворов трихлоруксусной кислоты от концентрации.
Из рисунка 2 следует, что в растворах с дистиллированной водой ТХУ не проявляет поверхностную активность, тогда как поверхностное натяжение природной воды в присутствии данного компонента незначительно изменяется обратно пропорционально увеличению концентрации растворов.
Возможно, одной из причин проявления поверхностной активности ТХУ в природной воде является повышенная по сравнению с дистиллатом минерализация природной воды. В условиях повышенной минерализации рост ионной силы раствора ведет к повышению степени диссоциации ТХУ. Образующиеся при этом достаточно подвижные трихлорацетат анионы степень гидратации, которых невелика, могут участвовать в формировании двойного электрического слоя на границе раздела жидкость / газ по Олти [18]. При этом концентрирование данных анионов на поверхности ведет к понижению поверхностного натяжения раствора.
Таким образом, поверхностная активность ТХУ в природной воде является одним из факторов, влияющих на распределение кислоты в изучаемой системе.
В результате изучения распределения ТХУ в объеме были полученны данные, представленные в таблицах 2,3.
Таблица 2. Распределение ТХУ в объеме модельных систем (t-1,5 ч.)
С ср ±DС моль/л Н2 О природная |
С ср ±DС моль/л Н2 О дист. |
С ср ±DС моль/л Н2 О дист, бентонит. |
|
| Поверхность | 18,8*10-3 ±6,3*10-5 | 10,5*10 -3 ±2,7*10-5 | 12,5*10-3 ±5,0*10-5 |
| Объём | 16,2*10-3 ±2,4*10-5 | 26,5*10 -3 ±5,4*10-4 | 12,9*10-3 ±7,9*10-5 |
| придонная часть | 3,94*10-3 ±3,2*10-5 | 2,00*10 -3 ±1,8*10-5 | 13,6*10-3 ±1,7*10-5 |
Результаты эксперимента, приведённые в таблице 2, говорят о том, что ТХУ концентрируется в основном в объёме дистиллированной воды. Однако при переходе к системе, содержащей природную воду, концентрация ТХУ у поверхности начинает возрастать, что, по-видимому, связано с изменением возрастанием поверхностной активности ТХУ в условиях повышенной минерализации.
В то же время, в гетерогенных модельных системах с бентонитом наблюдается выравнивание концентраций ТХУ у поверхности и в объеме, а также концентрирование кислоты у границы раствор/бентонит, что связано с адсорбционной активностью бентонита по отношению к ТХУ.
Изучение кинетики адсорбции ТХУ на бентоните показало, что тенденции к насыщению поверхности адсорбента наблюдается после трех часов экспозиции. В связи с этим представлял интерес изучение кинетики распределения ТХУ в объеме гетерогенной модельной системы с дистиллированной водой, полученные результаты представлены в таблице 3.
Таблица 3. Кинетика распределения ТХУ в модельной системе с бентонитом
| С (ТХУ) ср 10-3 ±DС моль/л Н2 О дист, бентонит. | ||||
| 1,5 ч | 2,5 ч | 72 ч | 120 ч | |
| Поверхность | 12,5.±5,0*10-5 | 12,3±4,7*10-5 | 12,3±5,1*10-5 | 12,3±4,5*10-5 |
| Объём | 12,9±7,9*10-5 | 13,0±8,1*10-5 | 13,2±7,4*10-5 | 12,6±8,0*10-5 |
| придонная часть | 13,6±1,7*10-5 | 12,1±1,3*10-5 | 10,4±1,5*10-5 | 8,2±1,5*10-5 |
Из данных, приведенных в таблице, следует, что в течение первых двух часов идет концентрирование кислоты в придонной части системы, вследстви одновременного протекания диффузионных и адсорбционных процессов. Однако при больших временах экспозиции наблюдается постепенное уменьшение концентрации кислоты из-за преобладания сорбции в придонном слое (t=72 ч., t=120 ч.), а затем выравнивание концентраций в объеме и на поверхности, обусловленное диффузионными процессами (t=120 ч.).
Выводы
1. Обнаружено влияние повышения уровня минерализации природной воды на степень диссоциации трихлоруксусной кислоты и ее поверхностноактивные свойства.
2. Повышение поверхностной активности трихлоруксусной кислоты в природных водах связаны с формированием двойного електрического слоя на границе жидкость/газ по Олти.
3. Адсорбционные процессы в системах с монтмориллонитом снижают концентрацию трихлоруксусной кислоты и влияют на её перераспределение в объёме за счёт нивелирования градиента концентрации.
Список использованной литературы
1. Химические основы экологического мониторинга / В.В. Кузнецов.// Соросовский образовательный журнал.-1999.-№1.-С.35-40.
2. Мониторинг качества питьевой воды/А.А Мильнер, Г.Д. Резников. //Химия и технология воды-1996, т.18, №1, с. 83-87.
3. Формирование и контроль качества поверхностных вод. Вып. 3 Охрана вод от воздействия удобрений и ядохимикатов, 1976г. с.139
4. Врочинский К.К. Пути поступления и содержание пестицидов в воде водоисточников/Гидробиологический журнал, 1976, т.12, №5, с.93-101.
5. Брагинский Л.П. Персистентные пестициды в экологии пресных вод./А.П. Брагинский, Ф.Я. Комаровский, Л.И. Мережковский, Киев:1979г-141с.
6. Скурлатов Ю.И. Дука Г.Г. Химия и жизнь воды.- Кишенёв:1989-124с.
7. Экология города./Под ред. Стольберга Ф.В.,Киев: 2000г.-320с.
8. Лейте Вольфганг. Определение органических загрязнителей питьевых природных и сточных вод. М., Химия, 1981г.с.157-169.
9. Методы анализа пестицидов./Ю.С. Ляшков, Москва: 1972г.-159с.
10. Сиренко Л.А., Гавриленко М.Я. Цветение воды и евтрофирование. Киев: Наукова думка. 1978г.-231c.
11. Исследование биологического действия антропогенных факторов, загрязняющих водоемы/О.М. Кожова, Иркутск:ИГУ,1979-184с.
12. Роль микроелементов в жизни водоёмов ( сборник статей )/АН СССР, Всесоюзное гидробиологическое общество, (отв. Ред. Воробьёв) М:Наука, 1980г.-143с.
13. Лурье Ю. Ю., Рыбников А. И. Химический анализ производственных сточных вод. М., Химия,1974 г.-273с.
14. Тарасевич Ю. И. Природные сорбенты в процессах очистки воды.–Киев: Наука, 1981 г.-268с.
15. Тарасевич Ю. И., Овчаренко Ф. Д. Адсорбция на глинистых минералах. –К.: Наукова думка, 1975 г.-235с.
16. Основы аналитической химии./Ю.А.Золотова,т.2. М.:Высшая школа, 2002г.-494с.
17. Фролов К. И. Коллоидная химия. М.: Наука, 1976 г.-289с.
18. Alty T.Proc.Rog.Soc.Lond.Ser.A,V.106, 1934.-316p.
19. Бейерман, Клаус. Определение следовых количеств органических веществ: с англ. А. А. Кирюшкина. М.:Мир, 1987г.-462 с.
20. Мельников Н.Н. Пестициды. Химия, технология и применение. М: 1987г.-525c.