Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
СОДЕРЖАНИЕ: Экспериментальное синтезирование полифенилсилоксана. Анализ мононатровой и тринатровой соли фенилтригидроксисилана на натрий. Исследование взаимодействия поликобальтфенилсилоксана с фенилсилантриолятом натрия. Определение кремния гравиметрическим методом.Министерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение
Дальневосточный Федеральный Университет
Институт химии и прикладной экологии
Кафедра неорганической и элементоорганической химии
Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
Владивосток
2011
Оглавление
Введение
1. Литературный обзор
1.1 Методы синтеза полиметаллоорганосилоксанов
1.1.1 Взаимодействие органилсиланолятов щелочных металлов с хлоридами металлов
2. Обсуждение результатов
3. Экспериментальная часть
3.1 Синтез полифенилсилоксана (ПФС)
3.2 Синтез кристаллосольвата фенилсилантриолята натрия с ДМСО (ФСТН)
3.3 Синтез поликобальтфенилсилоксана
3.4 Взаимодействие поликобальтфенилсилоксана с гидроксидом натрия
3.5 Исследование взаимодействия поликобальтфенилсилоксана с фенилсилантриолятом натрия
3.6 Анализ мононатровой и тринатровой соли фенилтригидроксисилана на натрий
3.7 Определение кремния гравиметрическим методом
Выводы
Список литературы
Введение
Кремнийорганические полимеры, содержащие в своей структуре гетеросилоксановую группировку Si-O-Э (под символом Э подразумевается гетероатом, за исключением атомов водорода и углерода), носят название полигетеросилоксаны. Если элемент является металлом, они классифицируются как полиметаллоорганосилоксаны (ПМОС). Первые полученные в 50г ХХ века, исследования были доведены до промышленного внедрения [1].
Интерес к химии полигетеросилоксанов обусловлен специфическими свойствами и реакционной способностью силоксановой связи и группировки Si–O–M, спектр свойств которых достаточно широк. Ранее было показано, что полигетеросилоксаны, содержащие в своем составе d-элементы обладают высокой термостойкостью, а также выступают в качестве эффективных термостабилизаторов полидиметилсилоксанового каучука (СКТН) и катализаторов некоторых органических реакций [2-4]. Так же полиметаллоорганосилоксаны используются в качестве стойких антикоррозийных покрытий, защитных лаков, катализаторов в нефтеперерабатывающей промышленности [5].
Взаимодействие полиметаллофенилсилоксанов с электрофильными реагентами в частности с кислотами достаточно хорошо изучено.[8] Их взаимодействие с нуклеофильными реагентами практически не изучено. В то же время при взаимодействии полиметаллофенилсилоксанов (содержащих олово и германий органические фрагменты) с такими электрофильными реагентами как спирты, происходит образование мономерных функциональных гетеросилоксанов.
Целью данной работы является исследование возможности синтеза фенилсиликонатов натрия содержащих в своем составе атомы кобальта.
1. Литературный обзор
1.1 Методы синтеза полиметаллоорганосилоксанов
В данное время существует пять основных путей формирования гетеросилоксановой группировки: реакции гидролитической и гетерофункциональной поликонденсации, взаимодействие органилсиланолятов щелочных металлов с галогенидами металлов, расщепление силоксановой связи оксидами элементов и методом механохимической активации. Методы были описаны авторами в следующих работах. [1, 6-12]
1.1.1.Взаимодействие органилсиланолятов щелочных металлов с хлоридами металлов
Наиболее удобным в препаративном отношении и универсальным методом синтеза ПМОС является метод, основанный на взаимодействии хлоридов металлов с органилсиланолятами щелочных металлов [13-16]. Данный способ практически незаменим для получения ПМОС циклолинейного строения.
Данный метод образования полимеров отражен следующими схемами:
RSi(OH)2 ONa+MYx M[O(OH)2 SiR]x +xNaY (1)
M[O(OH)2 SiR]x {[RSi(O)1.5 MOx/2 }+xH2 O (2)
Методика получения ПМОС состоит из двух стадий: сначала при действии дозированного количества щелочи на органосилоксан получают органосиланолят, далее с помощью обменной реакции органосиланолята и галогенида поливалентного металла формируют металлосилоксановый фрагмент Si-O-M-O-Si, при этом металл встраивается в силоксановую цепь. Несмотря на кажущуюся простоту данных схем, соотношение кремния к металлу в получаемых полигетеросилоксанах часто отличается от исходного, они неоднородны по составу, что указывает на сложность процессов полимерообразования. Предложены методы синтеза в водно-органических средах: в этом случае соотношение кремния к металлу в полимерах зачастую сильно завышены относительно исходного и они неоднородны по составу [14,17].
По мнению ряда других авторов при проведении процесса в водно-органических средах преобладающее влияние оказывает гидролиз исходных соединений: реакция по своему характеру мало чем отличается от согидролиза [18].
Методом, основанным на взаимодействии хлоридов металлов с мононатровыми солями органилсилантриолов в безводной среде удается достигнуть значительно лучших результатов. При проведении процесса в среде инертного растворителя, выход полимера значительно улучшается в присутствии бутилового спирта, вероятно вследствие гомогенизации системы [18]. Но данный способ является технологически более трудоемким из-за трудностей получения безводных хлоридов металлов. Однако и в этом случае в реакционной системе будет содержаться некоторое количество воды [19].
Для исключения влияния побочных процессов был предложен новый метод получения ПМОС в среде диметилсульфоксида (ДМСО), который эффективнее чем вода сольватирует ионы металлов [20]. Насыщая координационную сферу металла, ДМСО препятствует протеканию нежелательных побочных процессов, что приводит к получению ПМОС более регулярного строения. Предложенный метод не требует использования в синтезе ПМОС безводных галогенидов металлов и абсолютных растворителей. В полученных полимерах сохраняются соотношения кремния к металлу и они практически однородны по составу.
Метод получения каркасных и полимерных металлоорганосилоксанов, в котором использовали для синтеза полиметаллоорганосилоксанов не силаноляты натрия, полученные щелочным расщеплением предварительно синтезированных полиорганосилоксанов, а мономерные органотриалкоксисиланы предложен авторами [21]. Суть метода заключается в том, что органотриалкоксисилан обрабатывают водно-метанольным раствором едкого натра, причем количество воды должно обеспечивать полный гидролиз алкоксигрупп.
2. Обсуждение результатов
Нами было проведено исследование взаимодействия поликобальтфенилсилоксана по следующей схеме:
(PhSiO1,2 )2 CoO + 2NaOH [PhSi(O)O0,5 NaCoO]n + H2 O (3)
Схема взаимодействия предполагает образование продуктов циклического или олигомерного характера.
Синтез осуществлен в условиях аналогичных для синтеза мононатровой соли фенилсилантриола в водно-ацетоновой среде. Исходный поликобальтфенилсилоксан был синтезирован по раннее описанной методике в присутствии диметилсульфоксида.[20] В результате синтеза наряду с полимерными продуктами были выделены белое кристаллическое вещество, состав которого отвечает финилсилантриоляту натрия: PhSi(ONa)3 6,5H2 O, ИК-спектр представлен на рисунке 1.
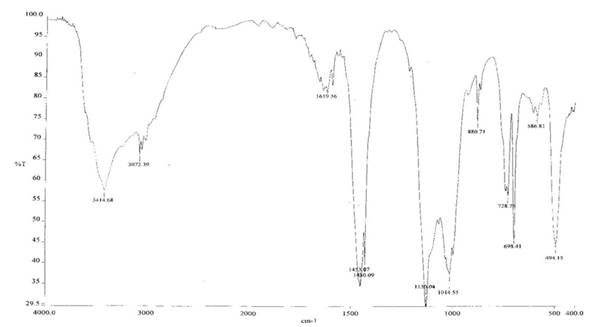
Рис.1 синтезирование полифенилсилоксан натрий гравиметрический
В ИК-спектре соединения в области 1100 см-1 поглощение имеет относительно простую колебательную структуру, что указывает на мономерный характер полученного соединения. В этой области отсутствуют максимумы поглощения которые соответствовали бы колебаниям связи Si-O в циклических и олигомерных продуктах. Присутствует лишь полоса поглощения при 1130 см-1 , 1430 см-1 (характеристическая полоса для связи Si-Ph) и 1600 см-1 , триплет в области 3100 см-1 отвечает колебаниям связи C-H в алифатическом радикале. Выход фенилсилантриолята натрия составил 80 % от теоретически возможного. Таким образом взаимодействие протекает не согласно предполагаемой схеме реакции, а по следующей схеме:
(PhSiO1,5 )2 Co + 2NaOH 0,7(PhSi(ONa)3 ) + (PhSiO1,5 )1,33 CoO + H2 O (4)
Так как взаимодействие между реагентами не приводит к желаемому результату, нами была исследована возможность синтеза подобных соединений по следующей схеме:
CoCl2 + 2(NaO)3 SiPh Co[OSiPh(ONa)2 ]2 + 2NaCl (5)
Фенилсилантриолят натрия получен по раннее описанной методике. Синтез вели в условиях оптимальных для синтеза поликобальтфенилсилоксана, в среде смеси растворителей диметилсульфоксида и бензола. В результате взаимодействия было получено твердое вещество синего цвета. Разделить продукты взаимодействия не удалось. Их обработка избытком триметилхлорсилана с целью перевода кобальт содержащих компонентов в растворимое состояние также не увенчалось успехом.
Предполагаемая схема взаимодействия:
Co[OSiPh(ONa)2 ]2 + 4(CH3 )3 SiCl Co[OSiPh(OSi(CH3 )3 )2 ]2 + 4NaCl(6)
Однако в результате синтеза, растворимые продукты взаимодействия представляли из себя жидкое бесцветное вещество, которое не перегоняется в вакууме при 100 °С/20 мм.рт.ст.
ИК-спектр полученного соединения представлен на рисунке 2.
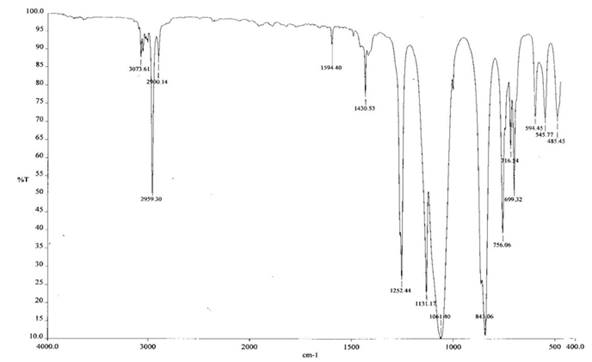
Рис.2
Спектр имеет простую колебательную структуру. В области 1000 – 1100 см-1 имеется только один максимум поглощения при 1061 см-1 отвечающий колебаниям связи Si-O, максимум при 1131 см-1 и 1430 см-1 отвечает колебаниям связи Si-Ph, 1251 см-1 отвечает присутствию атома кремния связанного с тремя метильными радикалами. Таким образом можно сделать предварительный вывод, что выделенное вещество является трис-(триметилсилокси)фенилсилоксаном, его количество практически полностью соответствует введенному количеству фенилсилантриолята натрия. Не растворимое в органических растворителях вещество синего цвета по данным элементного анализа не содержит в своем составе кремний. Оно хорошо растворимо в воде с образованием раствора розового цвета и по видимому представляет собой кристаллосольват хлорида кобальта с диметилсульфоксидом
Таким образом, под действием избытка триметилхлорсилана, по-видимому происходит разрушение образующихся кобальт содержащих гетеросилоксанов и сделать окончательный вывод о их природе и составе на основании проведенных исследований не представляется возможным.
3. Экспериментальная часть
3.1 Синтез полифенилсилоксана (ПФС)
В трехгорлую колбу, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещали 400 мл воды и 200 мл диэтилового эфира. При охлаждении и энергичном перемешивании вводили в реакционную колбу 100 мл (0.3 моль) фенилтрихлорсилана в 100 мл диэтилового эфира так, чтобы не происходило сильного разогревания реакционной среды, охлаждали колбу льдом. После чего смесь перемешивали еще в течение 2 часов. В делительной воронке отделяли водный слой от эфирного, последний промывали водой до нейтральной реакции по универсальному индикатору и сушили над свежепрокаленным хлористым кальцием.
Растворитель отгоняли при 80 °C/10 мм.рт.ст., ПФС сушили до постоянного веса. Получили 38,1 г ПФС, что составляет 98,4 % от теоретического выхода.
3.2 Синтез кристаллосольвата фенилсилантриолята натрия с ДМСО (ФСТН)
К раствору 15,96 г (0,12моль) полифенилсилоксана в 360 мл смеси толуол – этанол 1:1 прибавили 14,88 г (0,37 моль) гидроксида натрия и нагревали с обратным холодильником до полного растворения гидроксида натрия. Прибавили 120 мл ДМСО, растворитель частично отогнали при (t= 75-80 °C) до начала выпадения белых кристаллов. После охлаждения выпавшие кристаллы отделили на воронке Бюхнера и сушили до постоянного веса в вакууме при температуре 40°Cи давлении 12 мм.рт.ст. По данным элементного анализа на Na, состав выпавшего осадка отвечает следующей формуле: PhSi(ONa)3 0,64ДМСО (Найдено: % Na = 25,4; вычислено % Na = 25,3) Выделено 32,1 г что составляет 98,6%.
3.3 Синтез поликобальтфенилсилоксана
К раствору 27,5 г (0,2 моль) ПФС в 276 мл бензола прибавляли 8 г (0,2 моль) гидроксида натрия и 78 мл (1 моль) диметилсульфоксида (ДМСО). Синтез проводили при температуре кипения растворителей до прекращения выделения воды в ловушку Дина-Старка и полного растворения щелочи. Полученный раствор фенилсиликоната натрия использовали для синтеза поликобальтфенилсилоксана без выделения первого.
В трехгорлую колбу, снабженную механической мешалкой, ловушкой Дина-Старка и обратным холодильником, помещали 23,8 г (0,1 моль) СоСl2 6Н2 О, 93,6 мл диметилсульфоксида (ДМСО) и 200 мл бензола. Смесь кипятили до прекращения выделения воды в ловушку Дина-Старка. К полученной суспензии прибавляли раннее полученный раствор фенилсиликоната натрия. Синтез вели в течении четырех часов без нагревания до приобретения раствором интенсивно синей окраски, затем при температуре кипения растворителей – до прекращения выделения воды в ловушку Дина-Старка. Выпавший осадок хлорида натрия отделяли центрифугированием. Из центрифугата бензол удаляют перегонкой, в конце под разрежением (насос Камовского). Раствор полимера в ДМСО, при энергичном перемешивании приливали к четырехкратному объему воды, выпавший осадок поликобальтфенилсилоксана отделяли фильтрованием и промывали водой. Полимер сушили в вакууме до постоянного веса. Получено 31,5 г полимера что составляет 94,8 % от теоретически возможного.
3.4 Взаимодействие поликобальтфенилсилоксана с гидроксидом натрия
К раствору 3,3 г (0,01 моль) поликобальтфенилсилоксана в 30 мл ацетона прибавляли 0,8 г (0,02моль) гидроксид натрия. Постепенно прибавляя воду синтез вели при нагревании до полного растворения гидроксида натрия и образования гомогенного раствора. Выпавшие при охлаждении бесцветные кристаллы отделяли фильтрованием на фильтре Шота. Масса выделившихся кристаллов составляет 1,75 г. По данным элементного состава их состав отвечает формуле: PhSi(ONa)3 6,5H2 O (Найдено: % Si = 7,9; %Na = 20,3. Вычислено: % Si = 8,2; % Na = 20,3.) Количество выделенного фенилсилантриолята натрия составляет 80 % от теоретически возможного в пересчете на NaOH.
3.5 Исследование взаимодействие поликобальтфенилсилоксана с фенилсилантриолятом натрия
В колбу снабженную ловушкой Дина-Старка и обратным холодильником помещали 1,66 г (0,007 моль) СоСl2 6Н2 О, 7 мл диметилсульфоксида (ДМСО) и 50 мл бензола. Смесь кипятили до прекращения выделения воды в ловушку Дина-Старка. К полученной суспензии прибавляли 3,08 г (0,014 моль) PhSi(ONa)3 0,64ДМСО. Реакционную смесь перемешивали до полного обесцвечивания раствора в конце при нагревании. К реакционной смеси при охлаждении и перемешивании прибавляли 7 мл (0,049 моль) триметилхлорсилана. Нерастворимые продукты отделяли фильтрованием. Фильтрат промывали водой для удаления ДМСО и сушили над хлористым кальцием. После отгонки растворителя выделено 3,75 г (72,1 %) кремнеорганических продуктов которые по данным ИК спектроскопии отвечает следующей формуле: PhSi[OSi(CH3 )3 ]3 .
3.6 Анализ мононатровой и тринатровой соли фенилтригидроксисилана на натрий
Навескутринатровой соли массой 0,2г помещали в коническую колбу прибавляли 25 мл 0,1 н раствора соляной кислоты. Раствор нагревали до кипения и титровали раствором щелочи с точно известным титром. В качестве индикатора использовали метилоранж, переход окраски от розовой в желтую. Процентное содержание натрия рассчитывли по формуле:
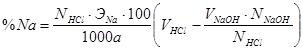 ,
,
а – навеска вещества, г;
ЭNa – эквивалент натрия, г.
Состав анализируемой соли отвечал следующей бруттоформуле PhSi(ONa)3 0,64ДМСО.
3.7 Определение кремния гравиметрическим методом
К навеске 0,2г анализируемого вещества прибавили 2,5 г иодата калия и 20 мл серной кислоты. Анализируемую смесь упарили досуха. После охлаждения прибавляли 50 мл соляной кислоты (3:2) и 350 мл воды, доводили до кипения. Отфильтровывали осадок и прокаливали до постоянного веса при T = 1000C. Процент кремния прасчитывали по следующей формуле:
![]()
0,4672 – фактор пересчета
а - масса навески
ИК – спектры регистрировались на приборе SPEKTRUM 1000 BX-KBr и тонком слое.
Выводы
1. Взаимодействие поликобальтфенилсилоксана с гидроксидом натрия ведет к разрушению гетеросилоксанового фрагмента с образованием фенилсилантриолята натрия.
2. Продукты взаимодействия хлорида кобальта и фенилсилантриола натрия в мольном соотношении 1:2, разрушаются под воздействием триметилхлорсилана, что ведет к образованию трис-(триметилсилокси) фенилсилоксана.
Список литературы
1 Андрианов, К.А. Технология элементоорганических мономеров и полимеров./ К.А. Андрианов, Л.М. Хананашвили – М. : Химия, 1973. – 400с.
2 Соболевский, М.В. Свойства и области применения кремнийорганических продуктов./ М.В.Соболевский, О.А. Музовская, Г.С. Попелева. – М. : Химия, 1975. – 295с
3 Каталитическая активность магнийорганосилоксанов. И.М. Колесников, Г.М. Панченков, К.А. Андрианов, А.А. Жданов, Н.Н. Белов, М.М. Левицкий : Изв.АН ССР. Сер.хим., 1976. - №6, 473 – 474с.
4 Свидерский, В.А. деструкция и стабилизация полимеров : тезисы докладов 9-ой конференции./ В.А. Свидерский, Н.А. Ткач. – М. : 2001. – 172–173с.
5 Талашкевич, Е.А. Твердофазный синтез полиметаллооргансилоксанов : международная научно – практическая конфренция./ Е.А. Талашкевич, Е.Ю. Гаденко, Л.В. Шевченко. – Находка. : 1999. – 32–33.
6 Андрианов, К.А. Методы элементоорганической химии. Кремний. / К.А. Андрианов. – М : Наука, 1976. – 560с.
7 Жданов, А.А. Новые проблемы в синтезе и изучении свойст полиметаллоорганосилоксанов.: Тез.док. Всерос. Конф. Кремний органические соединения. Синтез, свойства, применение. / А.А. Жданов. – М : 2000. – 113с.
8 Воронков, М.Г. Гетеросилоксаны. / М.Г. Воронков, Е.А. Малетина, В.К. Роман. – Новосибирск. : Наука, 1984. – 495с.
9 Воронков, М.Г. Силоксановая связь. / М.Г. Воронков, В.П. Милешкевич, Ю.А. Южелевский. – Новосибирск. : Наука, 1976. – 414с.
10 Борисов, С.Н. Кремнеэлементоорганические соединения./ С.Н. Борисов, М.Г. Воронков, Э.Я. Лукевиц. - Л.:.Химия, 1966. – 542с.
11 Талашкевич Е.А. Получение полиметаллорганосилоксанов методом механохимической активации и исследование их свойств : Автореф. Дис. кан. хим. наук. / Е.А. Талашкевич. – Владивосток : 2000. – 28с.
12 Синтез и исследование дикалиевых производных олигодиорганилсилоксан-, -диолов. / Н.П. Шапкин, А.А. Капустина, Н.И. Симанчук, Е.В. Моисеева. – Известия вузов. Химия и хим.техн., 1995. – Т.38, Вып.3. 24-29с.
13 Жданов, А.А. Синтез и исследование свойств полиметаллоорганосилоксанов. / А.А. Жданов, К.А. Андрианов, М.М. Левицкий.// ВМС. – 1976. – т.18. №10. 2264-2269с.
14 Шапкин, Н.П. Дис. канд.хим.наук./ Н.П. Шапкин. – Владивосток, 1971. – 155с.
15 Щеголихина, Н.А. Дис. канд.хим.наук./ Н.А. Щеголихина. – Иркутск, 1981. – 122с.
16 Шапкина, В.Я. Дис. канд.хим.наук./ В.Я. Шапкина. – Владивосток, 1983. – 146с.
17 Андрианов, К.А. Синтез полиферроорганосилоксанов и полиферроалюмоорганосилоксанов./ К.А. Андрианов, Т.Н. Ганина, Н.Н. Соколов.// ВМС. – 1962. – т.4.№5.678-682с.
18 Жданов, А.А.Исследование в области полиэлементоорганосилоксанов: Дис. докт.хим.наук./ А.А. Жданов.. – Москва. ИНЭОС. 1983. – 146с.
19 Жданов, А.А. Особенности синтеза металлосилоксанов каркасной структуры./ А.А. Жданов, О.И. Щеголихина, Ю.А. Молодцова. // Изв.АН РФ. Сер. хим. – 1993. - №5. 957-961с.
20 Воронков, М.Г. Новый способ получения полиметаллофенилсилоксанов. / М.Г. Воронков, А.В. Аликовский, Г.Я. Золотарь.// Докл. АН СССР. – 1985. – т.281.№4. 858-860с.