Характеристика ацетиленовых углеводородов
СОДЕРЖАНИЕ: АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(АЛКИНЫ)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу Cn
H2
n
-2
. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5
H8
), изомерия положения тройной связи (начиная с C4
H6
) и межклассовая изомерия с алкадиенами.
Получение
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4
––1500
°
C
® HCCH + 3H2
2) Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
| СH3
–CH–CH2
+ 2 KOH ––этанол
® CH3
–CCH + 2KBr + 2H2
O I I Br Br |
| Br I CH3 –C–CH2 –CH3 + 2KOH ––этанол ® CH3 –CC–CH3 (бутин-2) + 2KBr + 2H2 O I Br |
3) Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
CaC2
+ 2H2
O ® Ca(OH)2
+ HCCH
Физические свойства
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2
–С3
– газы, С4
–С16
– жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице.
Таблица. Физические свойства некоторых алкинов
| Название | Формула | t°пл., °C |
t°кип., °C |
d4 20 |
| Ацетилен | HCCH | -80,8 | -83,6 | 0,565 1 |
| Метилацетилен | CH3 –CCH | -102,7 | -23,3 | 0,670 1 |
| Бутин-1 | C2 H5 –CCH | -122,5 | 8,5 | 0,678 2 |
| Бутин-2 | CH3 –CC–CH3 | -32,3 | 27,0 | 0,691 |
| Пентин-1 | CH3 –CH2 –CH2 –CCH | -98,0 | 39,7 | 0,691 |
| Пентин-2 | CH3 –CH2 –CC–CH3 | -101,0 | 56,1 | 0,710 |
| 3-Метилбутин-1 | CH3
–CH–CCH I CH3 |
– | 28,0 | 0,665 |
1 При температуре кипения. 2 При 0°C. |
||||
Химические свойства
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными.
![]()
sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H

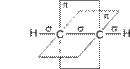
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой,
две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
I. Реакции присоединения
1) Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
CH3 –CCH(пропин) ––t ° , Pd ; H 2• ® CH3 –CH=CH2 (пропен) ––t ° , Pd ; H 2 ® CH3 –CH2 –CH3 (пропан)
2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
HCCH ––Br
2
® CHBr=CHBr(1,2- дибромэтен) ––Br
2
® CHBr2
–CHBr2
(1,1,2,2- тетрабромэтан)
3) Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова.
CH3 –CCH ––HBr ® CH3 –CBr=CH2 (2- бромпропен -1) ––HBr ® CH3 –CBr2 –CH3 (2,2- дибромпропан)
4) Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров.
Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение - кетон.
| C2 H5 –CCH + H2 O ––HgSO4 ® [C2 H5 – | C=CH2
](енол) ® C2
H5
– I OH |
C–CH3
(метилэтилкетон) II O |
В случае гидратации собственно ацетилена конечным продуктом является альдегид.
| O II |
||
| HCCH + H2
O ––HgSO4
® [CH2
= |
CH](енол) ® CH3
– I |
C(уксусный альдегид) I |
| H | O | H |
5) Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
a) Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена.
HCCH ––kat . HC CH ® CH2 =CH–CCH ––kat . HC CH ® CH2 =CH–CC–CH=CH2
b) При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.
| + | ––600 ° C,C ® | 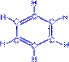 |
II. Кислотные свойства
HCCH ––NaNH 2 ® HCCNa + NH3
HCCH + 2[Ag(NH3 )2 ]OH® AgCCAg + 4NH3 + 2H2 O
AgCCAg + 2HCl ® HCCH + 2AgCl
Применение