Химический язык
СОДЕРЖАНИЕ: Символика, терминология, номенклатура химического языка. Приемы работы над химическими терминами и названиями иностранного происхождения. Определение методов и средств обучения химической науке. Ознакомление с формами контроля усвоения знаний школьниками.Содержание
Введение
Глава 1. Химический язык как цель и средство обучения в общеобразовательной школе
1.1 Символика и терминология химического языка
1.2 Номенклатура химического языка
1.3 Роль химического языка в обучении химии
Глава 2. Формирование химического языка при обучении химии
2.1 Методика изучения химической терминологии
2.2 Приемы работы над химическими терминами и названиями иностранного происхождения
2.3 Разработка упражнений по обучению химической терминологии
Глава 3. Организация уроков по обучению химической терминологии
3.1 Методы обучения химии
3.2 Средства обучения химии
3.3 Формы контроля за усвоением знаний учащихся
Заключение
Список литературы
Приложение 1 Классификация химического языка
Приложение 2 Названия приставок латинских и греческих числительных в сложных словообразованиях
Приложение 3 Иностранные элементы терминов и названий, встречающиеся в курсе химии средней школы
Приложение 4 Словарь химических терминов
Приложение 5 Игра Что? Где? Когда?
Введение
Развитие интереса школьников к предмету химии, их познавательной активности, самостоятельности и любознательности - важнейшая задача современной школы. Этому вопросу уделяется большое внимание в методической литературе и практике общеобразовательной школы.
Актуальность темы обусловлена тем, что знание химической терминологии, умение толковать термины и названия не только с точки зрения энциклопедической, но и с точки зрения их этимологии, способствует более осознанному овладению химическими понятиями и законами, развитию интереса к химии. При введении в обиход каждого нового термина необходимо, чтобы учащиеся не только поняли значение слова, но и запомнили его как буквенное целое, а также уяснили происхождение слова.
К тому же ознакомление с происхождением химических терминов и названий, с их историей обогащает словарь учащихся. К сожалению, учителя химии еще недостаточно внимания уделяют толкованию новых, впервые вводимых в обиход химических терминов и названий, забывая, что отсутствие этимологического анализа ведет не только к плохому запоминанию новых слов, но и к поверхностному овладению теми понятиями, которые обозначаются этими словами.
Знания даны человеку в форме языка. Для выражения научных знаний используются естественные и искусственные языки науки. К ним относится и химический язык, содержащий в своем составе химическую терминологию, номенклатуру и символику. В отличие от языка химической науки, школьный химический язык более простой, приспособлен к целям обучения. Без химического языка невозможно изучение основ химии. Он широко и активно используется на всех этапах обучения предмету и является важным показателем знаний учащихся. С помощью химического языка передаются и усваиваются химические понятия, осваиваются разные способы познавательной деятельности, необходимые для осуществления учения.
В связи с вышесказанным возникает потребность в освещении роли этимологического анализа в формировании интереса учащихся к науке химии, в развитии их познавательной активности.
Методы используемые в работе – метод анализа химических терминов, метод литературного обзора.
Объектом исследования является химическая терминология.
Предмет изучения – химический язык как средство обучения.
Цель работы – изучив научную литературу, представить основы формирования химической терминологии.
Задачи работы:
1) рассмотреть химический язык как цель и средство обучения в общеобразовательной школе;
2) изучить способы формирования химического языка при обучении химии;
3) охарактеризовать организацию уроков по обучению химической языку и номенклатуре.
Глава 1. Химический язык как цель и средство обучения в общеобразовательной школе
1.1 Символика и терминология химического языка
Как в химической науке, так и в химическом образовании невозможно общение, обучение и передача химической информации без использования химического языка.
Химический язык включает три важных раздела: символику, терминологию и номенклатуру, с помощью которых обучаемый познает, обучается и передает свои мысли.
Терминология была введена в химию известным французским ученым А.Л. Лавуазье. Терминология – это совокупность терминов, употребляемых в какой- либо области науки. В химии она имеет очень большое значение и знакомство с ней осуществляется в школьном курсе химии уже в первой главе учебника 8-го класса. Например, термины: отстаивание, декантация, фильтрование, фильтрат, центрифугирование, выпаривание, дистилляция и т.д.
Политехническая сторона основ химии, выраженная с помощью языка науки, дает учащимся представление о необходимости химических знаний на практике. Все это создает основу для воспитания учащихся.
В процессе обучения химический язык является и предметом, и средством изучения. Прежде чем превратить язык науки в орудие обучения, им нужно овладеть. Для этого необходимо познакомить учащихся с существующими классификациями языка наук [34, 132].
Химический язык представлен, прежде всего, знаками - заменителями предмета или явления, используемыми для приема или передачи информации об этом предмете или явлении. Знак, по сути, является вторичным. Это овеществленный носитель образа предмета.
Овладение системой знаков включает два этапа:
1) усвоение алфавита и значения отдельных знаков;
2) овладение способностью извлекать информацию, выходящую за пределы простой совокупности отдельных знаков.
Второй этап много сложнее первого. Здесь, наряду с информационной функцией, проявляется обобщающая функция знаков. Абстрактные знаки, лишенные сходства с натурой, получают большую возможность вскрывать сущность явлений, скрытых под покровом внешне выраженной формы. Наглядные же знаки тормозят развитие способности извлекать информацию из знаков и порождают фрагментарность знаний.
Человек первоначально пользовался пиктографическими изображениями, которые затем претерпели метаморфозу в изображения иероглифические и, в конце концов, абстрагировались до знаково-буквенных изображений. Самая древняя классификация знаков заключается в разделении их на естественные и искусственные. Кроме этого знаки бывают языковые и неязыковые. Применительно к школьным условиям изучения химического языка его классификация представлена на схеме (см. Приложение 1).
В языковом знаке отражается то общее, постоянное свойство, которое скрыто в многообразии явлений. Слова - это сгустки человеческих знаний об определенных сторонах окружающей нас действительности. За каждым словом лежит целое понятие. Понятия могут быть содержательными, охватывающими всю сумму знаний человека о данном предмете, и формальными, тесно связанными со значениями слов. Содержательные понятия хранятся в уме человека свернутыми. Мы не обращаемся к ним без нужды. Например, при упоминании о воде мы не мобилизуем весь наш запас сведений о ней, а оперируем одним словом вода как носителем формального понятия.
Условные знаки относятся к неязыковым знакам. Они возникают в процессе обучения произвольно, могут сознательно изменяться. Связь между знаком и предметом однозначна: для соответствующего значения подбирается только один знак, в то время как в слове возможна многозначность. Например, химический знак B означает элемент бор; слово бор означает:
а) химический элемент B;
б) стальное сверло, применяемое в зубоврачебной практике;
в) сосновый или еловый лес.
Неязыковые знаки обладают компактностью и лаконичностью форм. Они имеют интернациональный характер, что позволяет людям разных национальностей понимать друг друга.
Язык входит в науку, прежде всего как терминология. Есть слова-термины и слова нетермины. Термин - слово или сочетание слов, точно обозначающее определенное понятие, применяемое в науке, технике, искусстве [23, 34].
1.2 Номенклатура химического языка
Терминологию и символику дополняет химическая номенклатура. При ее изучении следует раскрыть ее значение в познании, показать виды номенклатурных систем в обучении, раскрыть роль номинальных названий в познании химии, соотношения между номенклатурной терминологией и символикой. Следует научить школьников читать, произносить, истолковывать названия ионов, веществ неорганического и органического происхождения. Извлекать из названий информацию о классе соединений, о конкретных веществах, их качественном составе и характере, составлять названия веществ по международной номенклатуре, осуществлять переход от названия вещества и наоборот. Соотносить международные, русские и тривиальные названия, составлять рациональные и систематические названия изомеров по формулам органических соединений и наоборот. Использовать номенклатуру при описании и объяснении веществ [5, 118].
Химическая номенклатура, как и химический язык в целом, являются средством и методом передачи учителем и усвоения учащимися химических знаний. С их помощью регистрируются и закрепляются химические знания о качественном и количественном составе веществ, строении молекул и т.д. Химические знаки, формулы и уравнения используются при наблюдении химических реакций, их анализе и объяснении.
Химический язык и номенклатура являются средством и методом применения добытых знаний на практике; решения количественных, экспериментальных и других задач. В процессе обучения химический язык и номенклатура выступают как средство, с помощью которого ученики осмысливают химические процессы, предвидят новые химические факты, планируют практические действия и выполняют их. Пользуясь химическими знаниями и химическим языком, школьники могут находить путь получения вещества, демонстрируя при этом способность, разобраться в конкретной ситуации, предвидеть химические факты и планировать практические действия.
Наряду с этим, химический язык и номенклатура являются средством учета знаний учащихся и изучения развития их мышления [6, 131].
Термин имеет узкую, специфическую сферу применения в определенной области науки или профессии. Общеупотребительные слова, не содержащие элементов профессиональных знаний, не являются научными терминами. Например, слово вода нельзя назвать химическим термином, так как человек любой профессии вкладывает в это слово одинаковый смысл. Термин содержит в себе самые существенные признаки данного вещества, предмета или явления. Несущественные признаки (например, для вещества - цвет, применение) находятся за пределами термина. В отличие от других слов, термин более всего связан с понятием.
Происхождением слова и описанием его отношений с другими словами того же языка или других языков занимается наука этимология. Иными словами, этимология - это раздел языкознания, исследующий происхождение слов разных языков.
Большинство химических терминов образовано из греческих и латинских слов. Материалистические представления о мироздании получили наиболее полное выражение в учениях античных философов Греции. Их учения явились плодом наблюдения, обдумывания разных явлений и желания дать общее объяснение многообразию вещей. Естественнонаучный материализм древних греков послужил основой для возникновения научных теорий и учений. Это отразилось и на химическом языке [8, 152].
Древние, и даже некоторые более поздние, современные химические термины образовались из греческих слов, обозначающих какие-либо свойства и качества вещества: глюкоза - сладкий, атом - неделимый, гомогенный - равный, гетерогенный - разнородный и т.д [20, 166].
Учение Аристотеля о четырех стихиях, свойства которых попарно противоположны друг другу, оставило след на современных терминах, таких как: антибиотики, антифризы, антисептики, в которых фрагмент анти в переводе с греческого означает противоположный.
Фрагмент крио по-гречески означает лёд, холод. Отсюда: криолит - холодный камень (внешне похож на лёд); кристаллы - лёд, горный хрусталь.
Слово гидро, означающее влажность, и слово гидро, означающее воду, входят фрагментами в современные слова: гигроскопичность (влажность + наблюдение); гидрофобность (вода + боязнь) и др.
Расшифровка некоторых терминов, образованных греческими словами, является в то же время формулировкой соответствующих понятий. Например, термин аморфный можно разделить на две части - а (отрицание) и морф (форма или вид). Значит, термин аморфный, т.е. бесформенный, включает в себя понятие о всех веществах, не имеющих кристаллической структуры. Таким образом, когда учитель дает перевод греческих слов на русский язык, он, по сути, разъясняет значение терминов.
Другой пример. Термин азеотропный состоит из трех частей: а (отрицание), зео (кипение), троп (изменение). Этот термин характеризует смеси веществ, которые кипят при постоянной температуре без изменения состава.
Иногда греческое слово входит в состав многих терминов. Например, фрагмент лиз, означающий разложение, дает начало следующим терминам: гидролиз - разложение вещества с помощью воды; электролиз - разложение вещества электрическим током; пиролиз - разложением огнём. Фрагмент некоторых современных терминов изо означает по-гречески равный, одинаковый. Расшифровка терминов приводит к определению понятий: изомеры - равная доля, вещества, имеющие одинаковый качественный и количественный состав, но отличающиеся по свойствам; изотопы - равное место, т.е. элементы, занимающие одно и то же место в периодической системе элементов Д.И.Менделеева, имеющие одинаковое число протонов, но разное число нейтронов в ядре [4, 114].
Латинский язык до XVIII в. был международным языком науки, поэтому оставил большой след в терминах. Термины, образованные от латинских слов, чаще всего означают какую-нибудь технологическую операцию, действие. Например: адсорбция - поглощение; ассоциация - соединение; диссоциация - разъединение; диффузия - распространение; нейтрализация - ни тот, ни другой (реакция взаимодействия кислоты с основанием, при которой ни кислоты, ни основания не остается).
Прикладной характер значений латинских слов сохранился и в наиболее часто употребляемых фрагментах современных терминов. Например, фрагмент ко, означающий соединение, входит в термины комплекс (сочетание, охват), конденсация (сгущение), координация (упорядочение), а фрагмент де, означающий отделение, удаление, встречается в терминах денатурация (потеря природных свойств), деструкция (потеря структуры), дегидратация (отнятие воды), дегидрирование (отнятие водорода).
Многие химические термины произошли от языков других народов: титр - характеристика (франц.), буфер - смягчение удара (англ.), агар-агар - водоросли (малайск.).
Особую группу образуют термины, произошедшие от имен ученых и изобретателей. Например, бакелит - название фенолформальдегидной смолы, созданной американским ученым Л.Бакеландом (1863-1944); бертоллиды - соединения переменного состава, названные в память французского химика К.Л.Бертолле (1748-1822); сплав Вуда - металлоорганический сплав, изготовленный американским физиком Р.У.Вудом (1868).
Существуют именные названия приборов - сосуд Дьюара, прибор Гофмана, воронка Бюхнера, колба Вюрца, склянка Тищенко и т.д. Мартеновский и томассовский способы плавления стали названы в честь изобретателей - французских металлургов отца и сына Мартенов и английского металлурга С.Д.Томаса. Именные названия законов и правил: закон Авогадро, теория Бутлерова, принцип Паули, правило Хунда (Гунда).
Огромно число именных реакций, особенно в органической химии: реакция Кучерова, реакция Зелинского, реакция Вюрца и т.д. В химический язык проникли термины других наук, например, математики.
В химической терминологии они приобрели самостоятельность, обогатились химическим смыслом. Так, мы широко используем такие термины, как индекс, коэффициент, уравнение, эквивалент, тетраэдр и др. Все это свидетельствует о том, что химические термины - постоянно изменяющиеся слова разнообразного происхождения. Изучение же происхождения терминов (этимология) способствует более осознанному овладению химическими понятиями и законами. Изучить же химическую терминологию невозможно, не проникнув в саму суть основ науки [8, 190].
В тесной связи с терминологией находится номенклатура. Сам термин номенклатура означает совокупность или перечень названий, терминов, употребляющихся в какой-либо отрасли науки, искусства, техники и т.д.
Назначение номенклатуры - давать удобные средства для обозначения предметов, т.е. давать им названия. В отличие от терминов, названия не имеют прямого отношения к понятиям. Химическая терминология и номенклатура древнее самой науки химии. Время их зарождения трудно определить. Названия большинства химических веществ давались на основе происхождения этого вещества, приготовления или использования соединения, которые чаще всего были случайными. Такие названия относятся к тривиальным. До конца XVIII в. химики пользовались названиями веществ, возникшими в отдаленные времена, большей частью случайно, по предложению ремесленников, алхимиков, врачей. Среди названий веществ, фигурировавших в алхимических и старых химических сочинениях, имелось множество странных и трудно запоминающихся названий. Например, калькотар остаток после перегонки железного купороса, помфоликс - оксид цинка, минеральный турпет - основной сульфат ртути.
Существовали названия, связанные с различными характеристиками веществ. При этом характеристики брались случайно. Так, летучие жидкости называли спиртами (от лат. спиритус - дух): соляной спирт - соляная кислота; нашатырный спирт - водный аммиак; купоросный спирт - серная кислота. Маслообразные жидкости назывались маслами: купоросное масло - концентрированная серная кислота; мышьяковое масло - хлорид мышьяка; кремнистое масло - жидкое стекло (силикат натрия).
В настоящее время мы можем обнаружить архаичные названия, употребляемые до сих пор или только упоминаемые в химической литературе. К таковым относятся названия веществ, созданные: а) по именам ученых - глауберова соль (сульфат натрия), бертоллетова соль (хлорат калия); б) по названию местности - аммоний (соль из Аммония, области в Ливии, где находился храм бога Солнца - Аммона); бронза (по названию итальянского порта Бринзиди, через который доставляли бронзу в Европу, дословно медь из Бринзиди); в) на основании свойств веществ - горькая соль (сульфат магния), свинцовый сахар (ацетат свинца).
Интересно происхождение древних названий химических элементов. Разные народы называли один и тот же элемент по-разному, что привело к созданию разноликой номенклатуры. В русской номенклатуре старославянские названия переплетаются с древнегреческими и латинскими названиями. Так, древнегреческое название железа сидерос означает звездный, латинское феррум означает крепость, а русское слово жель - блеск; другое объяснение происхождения слова дается от корня лез - резать. Древнеславянское название золота связано с названием солнца, латинское аурум происходит от слова аврора - утренняя звезда, дочь Солнца. Латинское название аргентум означает сверкающий, серебристо-белый, а славянское серебро произошло от слова серп - знаком серпа обозначали луну. Древнее русское название меди произошло от слова металлон, означающее рудник, место добычи металла. Латинское название купрум идет от названия острова Кипр, где находились медные рудники [19, 108].
Современная номенклатура пестрит всеми эпохами. Здесь есть названия, существовавшие 6 тысяч лет назад, и названия, рожденные сегодняшним днем. Если проанализировать названия одних только простых веществ, то можно представить, насколько многогранна и произвольна номенклатура химических веществ. Из более чем сотни названий химических элементов 44 указывают на химические и физические свойства. Например, висмут - белое вещество (1529), фосфор - светоносный (1669), хлор - желто-зеленый (1774), астат - нестойкий (1940). Некоторым химическим элементам даны названия на основе географических наименований (иттрий, рутений, калифорний, скандий, галлий и др.), мифологических образов (титан, ниобий, тантал, прометий), названий планет (уран, селен, нептун, плутоний), имен ученых (гадолиний, кюрий, курчатовий, ганий, мейтнерий).
Итак, химический язык имеет огромное значение в обучении химии, выполняя разнообразные функции. С его помощью передаются и приобретаются знания, формируются и развиваются важнейшие химические понятия. Химический язык участвует в познании конкретных веществ и химических реакций, в описании результатов познания. С помощью химической символики в школьных учебниках и учебных пособиях выражены разные понятия и теоретические построения, отражающие закономерности состава, строения и свойств веществ и их взаимодействий. Велико значение химического языка в повторении, совершенствовании и проверке знаний, умений и навыков, в активном применении их на практике. Все это позволяет считать химический язык важнейшим средством и методом обучения химии. Если при изучении химического языка вкрадывается ошибка, то неизбежно в дальнейшем отражение действительности в искаженном виде.
Согласно современным требованиям, названия химических соединений строятся по позитивным признакам, которые отражают состав и частично характер соединений. В общеупотребительных химических названиях доминирует старая номенклатура. В обиходе мы можем услышать слова вода, нашатырный спирт, сернистый газ, но никак не оксид водорода, гидроксид аммония, оксид серы четыре. Старая номенклатура естественно переплелась с языком народа, ее ломка может привести к уродливому словообразованию. Не случайно за некоторыми названиями сохранились права первозданности: аммиак, фосфин, метан. Названия кислот также сохранились со времен Лавуазье - серная кислота, угольная кислота, азотная кислота и др.
Однако нельзя считать идеальной номенклатуру кислородсодержащих кислот и их солей, в которых центральный атом имеет разную степень окисления: HIO - иодноватистая, HIO3 - иодноватая, HIO4 - метаиодная, H3 IO5 - мезаиодная.
Учащихся можно познакомить с краткой историей возникновения и развития химического языка. Рассказ может включать в себя примерно следующие сведения, например [6, 112]:
Разделение номенклатуры и символики началось еще в период алхимии. Для обозначения веществ алхимики применяли иносказания: зеленый лев, красный лев, дракон. Мир алхимиков был раздвоен на реальный мир (конкретные вещества) и символический (львы, драконы и пр.). В алхимической символике можно найти изображение превращений с помощью своеобразных обозначений - пиктограмм, упрощенных рисунков соответствующих явлений или веществ. Конечно, они не дают истинных представлений о химических реакциях. Но в них видно стремление древних вложить в символ какое-то определенное свойство и качество предмета. Алхимическая символика просуществовала до конца XVIII в., хотя запросам химии не соответствовала уже во времена М.В.Ломоносова.
Затем представления о двойственности мира были преодолены с помощью мыслей об однородности всего сущего. Символические и реальные образы слились в сплошной материальности.
Когда в начале XIX в. Я.Берцелиус ввел свои знаки химических элементов, он, по сути, добился максимально возможного сближения символа с названием.
С возникновением атомистической теории строения вещества Д.Дальтона (начало XIX века) появилась новая символика, в которой нашло отражение представление о существовании неделимых мельчайших частичек - атомов. Атомистическая теория дала возможность определять не только качественный, но и количественный состав вещества.
Для наглядного выражения атомного состава химических соединений Я.Берцелиусом были предложены специальные знаки, представлявшие собой первые буквы латинских названий химических элементов. Согласно Я.Берцелиусу, формула должна точно показывать, из каких элементов состо-ит соединение, показывать число атомов каждого элемента (оно указывалось цифрами).
Символика Я.Берцелиуса используется и в записи химических реакций. Она значительно упростила записи. Так, в современных уравнениях не пишут слова действуют, получается, и. Эти слова заменяются знаками +, =. Очевидно, что знак + заменяет слово и, а знак = заменяет слово получаются [13, 87].
Учителю необходимо помнить, что при формировании у учащихся навыков чтения химических уравнений необходимо обращать внимание на химический смысл математических знаков, указывая, например, что знак + для левой части уравнения означает взаимодействие веществ, а для правой части уравнения это понятие распространяется только в случае обратимых реакций.
Поскольку химическая символика вводится в процесс обучения с первых уроков, при формировании первоначальных языковых умений и навыков большое значение имеет запоминание. Центральное место при этом отводится приемам заучивания. Заучиваются знаки химических элементов, валентность некоторых элементов, рациональные названия и пр. Значительно облегчают запоминание химических знаков и названий такие несложные методические приемы, как передвижная азбука, химические лото и домино, стихотворные правила, химические диктанты - буквенные, терминологические, понятийные, на правописание, толкование терминов, использование карточек-планшетов с правильно написанными словами и формулами.
Изучению химической терминологии, как указывалось выше, способствует этимологический анализ слов. Одновременное ознакомление школьников с происхождением химических терминов и объяснение того, что они обозначают, способствует более прочному запоминанию. Одно только понятийное толкование, без этимологического анализа приводит к скорому забыванию значения многих терминов и названий. Смысл слова, которому дано всестороннее толкование, запоминается надолго еще и потому, что во время работы над ним у учащихся пробуждаются интерес и любознательность. Разве неинтересно школьнику узнать, что название элемента фтора произошло от греческого фторос, что означает разрушающий; название брома - от бромос, что означает зловонный. В переводе на русский язык раскрываются во многих случаях наиболее характерные свойства химических элементов. В результате такой работы над словом легче идет процесс запоминания. Интересно организованная работа над словом возбуждает у школьников внимание, усиливает их познавательную активность [14, 122].
Работа над этимологией терминов и названий позволяет устанавливать и развивать межпредметные связи химии не только с историей, культурой, но и с русским, английским, немецким и другими языками, что способствует гуманитаризации курса химии.
Учитель в своей практике должен уделять особое внимание формированию химического языка. Если химический язык освоен школьниками, то химия не будет представлять для них сложности. Если не освоен, то предмет будет трудным. Поэтому формированию химического языка следует уделять особое внимание.
Рассмотрим, какие требования должны предъявляться к овладению учащимися химическим языком:
1. Усвоение качественного и количественного значения химических знаков элементов и умение правильно применять их.
2. Усвоение качественного и количественного значения химических формул, приобретение умения составлять формулы веществ по валентности, образующих их элементов. Формирование умения читать формулы, проговаривать их на слух, и применять их при истолковании состава веществ и химических процессов с точки зрения теории строения вещества. Умение производить по формулам простейшие расчеты.
3. Составление ионных и простейших электронных формул, чтение и понимание их.
4. Составление структурных формул органических и некоторых неорганических веществ, чтение и понимание их. Применение структурных формул при изложении вопросов о составе, получении и химических свойствах вещества.
5. Усвоение качественного и количественного значения уравнений химических реакций, умение составлять и читать их, производить стехиометрические расчеты [15, 190].
Основу химического языка составляет терминология, введенная в науку французским ученым А. Лавуазье. Термины вводятся, формируются и развиваются на протяжении всего школьного курса. Для успешного усвоения терминологии целесообразно учить школьников умению работать с терминами, использовать составленный ими в процессе обучения терминологический словарь. Школьники должны знать значение и смысл химических и научных терминов; уметь связывать их с основными химическими понятиями, раскрывать этимологическое и смысловое значение термина, уметь его проанализировать.
Наряду с этим, школьника следует учить произношению и записи термина, раскрывать содержание термина; заменять, при необходимости, его другим, близким по смыслу и значению (например: сублимация – возгонка); осуществлять анализ и взаимопереходы между терминами и символами.
С помощью химического языка и номенклатуры, учащиеся излагают свои знания о составе, химических свойствах и применении веществ, объясняют реакции с точки зрения теории строения вещества. В процессе обучения химии, должен быть достигнут свободный переход учащихся от химического языка к химическим терминам, общенаучным словам и предложениям, от них к самостоятельной постановке эксперимента, т.е. к практическим действиям [17, 198].
1.3 Роль химического языка в обучении химии
Важнейшая образовательная задача школьного курса химии — формирование химических понятий. Поскольку они отражают химическую картину мира, эти понятия являются основой, на которой формируется научно-материалистическое миро воззрение учащихся.
Научные понятия в процессе развития науки изменяются, совершенствуются, проходят определенные этапы познания. Понятия школьного курса химии также не остаются неизменными. Историко-логический подход к изучению курса химии в целом предусматривает постепенное движение по ступеням познания, характеризующееся прежде всего развитием понятий.
Известны разные принципы классификации химических понятий. Наиболее простая классификация — группировка понятий по общим широким категориям, изучаемым на всех этапах школьного курса химии. Это сложные системы понятий о веществе, химическом элементе, химической реакции и химическом производстве. Анализ содержания школьного курса химии показывает, что все понятия школьного курса химии могут быть сгруппированы в эти категории [10, 81].
Условия формирования понятий заключаются в следующем:
1. Вновь формируемое понятие вводят тогда, когда достаточно опорных знаний для его восприятия.
2. При формировании понятия вычленяют его существенные признаки (структуру), определяют последовательность их раскрытия и устанавливают связи между ними.
3. При формировании каждого конкретного понятия прослеживаются не только внутренние связи, но и связи его с другими понятиями.
4. Существенные признаки понятия должны обеспечивать возможность развития понятия, облегчать его применение. Если этих признаков недостаточно, необходимо ввести дополнительные.
5. Независимо от логического подхода, используемого при формировании того или иного понятия — дедуктивного или индуктивного, понятие подкрепляют фактами, чтобы придать ему большую убедительность и избежать догматизма.
6. При формировании понятия следует использовать принцип историзма, привлекая к обучению материал о принципиальной борьбе идей. При этом желательно использовать проблемный подход, способствующий более осознанному усвоению материала.
7. Абстрактный характер некоторых химических понятий требует применения разного рода наглядности — химического эксперимента для изучения внешних свойств веществ, моделирования, экранных пособий — для понимания внутреннего строения веществ и т. д.
8. В разных вариантах сочетают индуктивный и дедуктивный подходы.
9. В процессе формирования понятий используются межпредметные связи.
Все четыре системы понятий в школьном курсе химии тесно связаны в единый блок. Их формирование и развитие осуществляются последовательно по ступеням обучения. Рассмотрим методику формирования каждой из них [11, 277].
Химический язык вносит существенный вклад в реализацию развивающей функции обучения. Особенно велика его роль в развитии мышления учащихся и формировании их творческой деятельности, так как все операции с химическим языком являются умственными. Наиболее часто при оперировании химическим языком используются анализ, синтез, сравнение, абстрагирование и другие мыслительные операции.
Химический язык вносит важный вклад в реализацию воспитательной функции обучения. Он может использоваться как активное средство формирования научного мировоззрения учащихся, поскольку позволяет раскрыть многие мировоззренческие вопросы. Например, символически выраженная периодическая система химических элементов Д.И. Менделеева используется для подтверждения законов диалектики.
Таким образом, роль химического языка в овладении школьниками химическими знаниями, умением и навыками чрезвычайно велика. В процессе последовательного овладения предметом, химический язык совершенствуется в тесной связи с развитием теоретических знаний, с накоплением химических фактов и усложнением химических понятий [16, 280].
Глава 2. Формирование химического языка при обучении химии
2.1 Методика изучения химической терминологии
Система понятий о веществе состоит из следующих компонентов: 1) состав веществ; 2) строение; 3) свойства; 4) классификация; 5) получение; 6) химические методы исследования; 7) применение. Ограничиваться выделением лишь известного треугольника: состав—строение—свойства — для целей обучения недостаточно, несмотря на его ведущую роль.
Структура системы понятий о классификации веществ
Классификацию веществ (схема 1) нельзя дать только на основе какого-то одного критерия

Схема 1 Система понятий о классификации веществ
Это сильно обеднит представления учащихся о веществе. Так, например, неорганические вещества учащиеся классифицируют вначале по составу. После изучения электронного строения вещества появляется новый принцип классификации веществ по строению вещества — по видам химической связи и по типам кристаллической решетки. Этот принцип классификации веществ получает свое развитие в темах Теория электролитической диссоциации, где разбирается донорно-акцепторный механизм ковалентной связи, а также в теме Металлы, где изучаются металлическая связь и металлическая кристаллическая решетка.
При рассмотрении теории электролитической диссоциации вещества классифицируют по свойствам в растворах и соединениях. Далее при изучении поведения в окислительно-восстановительных реакциях вещества разделяют на окислители и восстановители.
В органической химии вначале классификация осуществляется по составу на три большие группы: углеводороды, кислородсодержание и азотсодержание, а внутри их — по строению (схема 2).
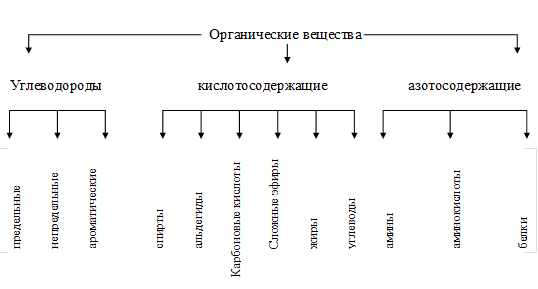
Схема 2 Классификация органических веществ
Таким образом, главными критериями классификации веществ является их состав и строение. Деление веществ по свойствам на окислители и восстановители, а также на электролиты и неэлектролиты является, во-первых, относительным, а во-вторых, функцией состава и строения веществ.
Понятия о классификации веществ позволяют устанавливать связи между веществами разных групп, подчеркивают идею материального единства мира [5, 159].
Свойства веществ систематизируют исходя из их состава или строения. Связи эти причинно-следственные.
Формирование системы понятий о веществе начинается с самых первых уроков на основе межпредметных связей с физикой. Определение вещества не дают, разъясняют только смысл понятия о веществе в сопоставлении с уже известным учащимся из физики понятием о теле и говорят о том, что каждое вещество имеет свои свойства. Но поскольку тела могут состоять из разных веществ, дается понятие о смеси веществ и о чистом веществе и сразу же включается понятие о методах исследования, например способах очистки веществ. Понятие о молекуле используется то, что было получено на уроках физики. Затем вводится первое понятие о классификации веществ на простые и сложные и их определение. Почти сразу дается понятие о количественной характеристике вещества — о их относительной молекулярной массе, о постоянстве их состава [13, 177].
В теме Кислород. Оксиды. Горение приводятся состав простого вещества кислорода, его свойства, методы, исследования свойств посредством химического эксперимента (получение из перманганата калия). В этой теме вводится новое понятие о кислороде как окислителе. Понятия о строении вещества в этой теме дальнейшего развития не получают.
В теме Кислород. Оксиды. Горение развивается понятие о сложных веществах — оксидах. Рассматриваются их состав и некоторые свойства, в частности свойство оксида углерода (IV) вызывать помутнение известковой воды, свойство оксида фосфора (V) растворяться в воде, получение оксидов при взаимодействии кислорода с простыми и сложными веществами. Но все это пока лишь внешнее описание без объяснения сущности — накопление фактов.
В теме Кислород. Оксиды. Горение развивается понятие о смеси веществ на примере воздуха, дальнейшая его конкретизация — в теме Водород. Кислоты. Соли. Понятие обогащается новым конкретным содержанием: вещество — восстановитель. Осторожно и очень медленно, чтобы избежать формального усвоения, вводят понятие о кислотах:
1) сначала учащимся рассказывают о кислотах, известных им из практики, — лимонной, яблочной, щавелевой, молочной, муравьиной, уксусной, отмечают их кислый вкус, иногда едкость, жгучесть (муравьиная кислота);
2) затем демонстрируют осушающее действие серной кислоты, ее разогревание при растворении, обугливание органических веществ. Обсуждают правила техники безопасности при работе с серной кислотой;
3) далее переходят к общим свойствам соляной кислоты (дымящая): действие на индикаторы (объясняется слово индикатор), на металлы;
4) состав кислот — абстрактный материал. Учащихся знакомят с формулами четырех кислот: НСl, НNО3 , Н2 SО4 , Н3 РO4 . Это примеры для классификации по составу и по основности. Так накапливается материал для классификации.
В органической химии система понятий о строении вещества обогащается таким большим числом качественно новых знаний, что актуализация предшествующих опорных знаний становится обязательным условием усвоения учащимися содержания органической химии.
Понятия химического строения: химическое строение как порядок соединения и взаимного влияния атомов в молекулах, изомерия, гомология.
Понятия пространственного строения — более высокий этап познания строения по отношению к химическому строению. Имеются в виду понятия о валентных углах и геометрии молекул органических веществ.
Особое внимание в органической химии уделяется энергетическим характеристикам веществ, в частности энергии связи.
Вопросы химического, электронного, стереохимического строения органических веществ, энергетические представления получают такое мощное развитие, что обособляются в отдельную теорию.
Структура содержания понятия химический элемент. Как и всякое сложное понятие, система понятий химический элемент имеет свою структуру содержания. В состав ее входят понятия: 1) об атомах химических элементов; 2) о распространенности и круговороте элементов в природе; 3) о классификации и систематизации химических элементов. Все три блока тесно связаны между собой, а кроме того, и с понятием вещество.
Каждый из указанных блоков содержания имеет свою структуру. Например, понятия об атомах можно сгруппировать так: строение атомов, свойства атомов. Они связаны между собой причинно-следственной связью (схема 3).

Схема 3 Причинно-следственная связь
Выявление этой связи в каждом конкретном случае позволяет организовать проблемные ситуации. Например, объяснение связи между строением электронной оболочки атома и его степенью окисления позволяет построить цепочку умозаключений по прогнозированию возможных степеней окисления. (Строение атома серы позволяет предположить, что отрицательная степень окисления ее должна быть равна -2, а высшая положительная +6. Дальнейшее рассуждение позволит прогнозировать свойства веществ, содержащих серу в соответствующей степени окисления.) Легко просматривается связь между числом электронных слоев и радиусом атома, строением электронной оболочки и электроотрицательностью. Интересно выявление и обратных связей, когда требуется установить строение внешнего электронного слоя на основании известных степеней окисления.
Вполне понятно, что формирование системы понятий о химическом элементе происходит не сразу, а постепенно, последовательно, обогащаясь за счет изучаемых в процессе обучения теорий. Начинается оно с формирования понятий об атоме.
Формирование понятий о естественных группах сходных элементов.Знакомя всех учащихся с понятием об естественных группах сходных химических элементов, вначале употребляют термин естественное семейство, чтобы не путать его с группами периодической системы. Формируют это понятие индуктивным путем на трех семействах — благородных газах, щелочных металлах и галогенах. Подход к ним единый: составление сводной таблицы по каждому семейству с соотнесением свойств с относительной атомной массой. Используют разные приемы, например таблицы, отражающие сравнительную характеристику галогенов, щелочных металлов и др.
Таблица 1 Сравнительная характеристика галогенов
| Элемент | Химический знак | Относительная атомная масса | Формула простого вещества | Физическое состояние | Окраска | Плотность | Температура кипения | Растворимость в воде |
Таблица 2 Сравнительная характеристика щелочей
| Элемент | Химический знак | Валентность в кислородных соединениях | Условия реакции с кислородом | Валентность в летучих водородных соединениях | Условия реакции с водородом |
Таблица 3 Сравнительная характеристика гидроксидов
| Элемент | Химический знак | Формула высшего оксида | Характер свойств оксида | Формула высшего гидроксида | Характер свойств гидроксида | Формула летучего водородного соединения |
В процессе сравнения используют химический эксперимент и другие средства наглядности. В результате делают выводы по следующим параметрам:
1) сходство свойств между элементами изучаемого семейства;
2) различие свойств изучаемого семейства;
3) взаимосвязь свойств и значений атомной массы;
4) сходство и различие свойств семейств и их зависимость от значения атомной массы.
Последний пункт особенно важен для понимания периодического закона. Все это необходимый фактический материал, не получающий пока теоретического объяснения, так как учащиеся пока еще не знакомы со строением атомов. Естественно, возникает проблемная ситуация, которая будет решаться на последующих уроках. Она состоит в противоречии между необходимостью объяснения фактов и нехваткой имеющихся знаний. Учитель должен эту проблему вскрыть и четко ее сформулировать: почему наблюдается такая закономерность в изменениях свойств в зависимости от атомных масс элементов?
Затем при изучении периодического закона и периодической системы элементов Д. И. Менделеева происходит качественный скачок в развитии понятий об атомах. Атом предстает как сложная система, состоящая из ядра и электронной оболочки. Здесь дается понятие об изотопах [5, 35].
Значительно пополняются представления учащихся о свойствах атомов. Вводятся представления об атомном радиусе, о степени окисления, электроотрицательности. Понятие степень окисления при всей его условности методически очень важно, так как помогает раскрыть сущность периодичности, облегчает пользование периодической системой. На этой стадии следует разграничить понятия степень окисления и валентность чтобы в дальнейшем учащиеся их четко различали.
Особое внимание при формировании системы понятий о химическом элементе следует обратить на тему Обобщение знаний по курсу неорганической химии. Здесь устанавливаются внутрипредметные связи между важнейшими химическими понятиями — о химическом элементе, веществе, химической реакции и химическом производстве. Эта тема очень важна для формирования у учащихся правильных теоретических представлений о соотношении этих понятий. Она является отправной точкой, подготавливающей переход от неорганической к органической химии. После нее значительно легче сопоставлять и сравнивать свойства органических веществ с неорганическими, выявлять особенности органических реакций по сравнению с неорганическими. Формирование системы понятий о химическом элементе завершается в основном именно в этой теме [9, 50].
Таким образом, развитие понятия химический элемент осуществляется в несколько этапов:
1) подготовительный — до формулирования определения химического элемента;
2) экспериментальный — до изучения атомно-молекулярного учения;
3) изучение элементов на базе атомно-молекулярного учения;
4) формирование понятия о естественной группе элементов;
5) изучение периодической системы Д. И. Менделеева и теории строения атома;
6) изучение элементов по группам периодической системы;
7) обобщение знаний учащихся в конце IX класса, установление связей понятия о химическом элементе с другими понятиями курса химии.
В X классе завершается развитие понятия о химическом элементе. В курсе органической химии прежде всего отмечают, что молекулы органических веществ состоят из атомов тех же элементов, что и неорганических.
Далее рассматривается понятие о гибридизации орбиталей атома углерода, а также о том, что атомы элемента в составе соединения не просто суммируются в разных комбинациях, а испытывают влияние других атомов, т. е. атомы одного и того же элемента в разных соединениях несколько отличаются друг от друга по свойствам. Эту мысль можно провести и в неорганической химии, но в органической она звучит более убедительно.
В курсе органической химии дается понятие о возможности соединения в одном и том же веществе большого числа одноименных атомов, что редко наблюдается в неорганических веществах.
В конце курса X класса в обобщающей теме понятие об элементе должно прозвучать как важнейшее связующее звено между неорганической и органической химией. Поэтому заключительное обобщение начинается именно с него. Особое внимание обращают на философский смысл и воспитательное значение учения о химических элементах.
Структура системы понятий о химической реакции.Понятие о химической реакции сложное и многогранное. Это, как и понятие вещество, целая система понятий, имеющая свою структуру. В курсе химии средней школы четко различаются шесть компонентов понятия химическая реакция, которые рассматриваются в единстве и формируются постепенно:
1) признаки, сущность и механизм реакций; 2) закономерности возникновения и протекания; 3) количественные характеристики; 4) классификация; 5) практическое использование; 6) методы исследования. Сочетание этих шести блоков понятий не только определяет систему знаний, но и позволяет вскрыть философскую сущность понятия химическая реакция. Химическая реакция должна характеризоваться с позиций всех шести блоков содержания понятия. Каждый из них имеет свою структуру. Например, структура содержания понятий о классификации химических реакций имеет такой вид (табл. 4).
Таблица 4 Классификация химических реакций
| Принципы классификации | Характеристика реакций | Примеры реакций |
| Исходное состояние реагирующей системы | Гомогенные Гетерогенные | Взаимодействие азота с кислородом Взаимодействие оксида кальция с оксидом углерода (IV) |
| Наличие окислительно-восстановительного процесса | Окислительно-восстановительные Реакции, в которых окислительно-восстановительный процесс отсутствует |
Взаимодействие цинка с соляной кислотой Разложение карбоната кальция с образованием оксида кальция и оксида углерода (IV) |
| Участие катализатора | Каталитические Некаталитические | Взаимодействие азота с водородом Взаимодействие оксида серы (IV) с водой |
| Обратимость реакции | Обратимые Необратимые | Взаимодействие оксида серы (IV) с водой Разложение дихромата аммония |
| Энергетический эффект реакции | Экзотермические Эндотермические | Горение магния Разложение оксида ртути |
| Соотношение числа исходных и полученных веществ | Соединение Разложение Замещение и обмен |
Взаимодействие оксида кальция с водой Разложение оксида ртути Взаимодействие железа и хлорида меди (II) Взаимодействие нитрата серебра и хлорида натрия |
| Реакции, протекающие без изменения качественного состава простых и сложных веществ | Аллотропные превращения Изомеризация |
Превращение кислорода в озон Образование одного изомера из другого |
Такими должны быть знания учащихся о классификации химических реакций после усвоения школьного курса химии.
Система понятий о сущности, механизмах и признаках химической реакции может быть представлена двумя сторонами: понятиями о внешних признаках и внутренней сущности реакций. Между ними существует причинно-следственная связь [2, 29].
Понятие о внутренней сущности реакций развивается постепенно, усложняясь при переходе от теории к теории. В атомно-молекулярном учении сущность химической реакции объясняется как перегруппировка атомов. При изучении электронного строения веществ химические реакции рассматриваются как процесс разрыва одних связей и образование других, на уровне теории электролитической диссоциации — как взаимодействие ионов, а при изучении теории строения органических веществ анализируется механизм протекания химической реакции.
Последовательность формирования понятия химическая реакция.Понятие химическая реакция формируется на нескольких уровнях.
Уровень 1. Понятие о химической реакции начинается формироваться с самых первых уроков. Сначала дают понятие о химическом явлении, так как термин явление более знаком учащимся, а затем сообщают, что химическое явление — это и есть химическая реакция. На этом этапе опора делается на знания, полученные учащимися из физики. На уровне атомно-молекулярного учения разъясняют, как можно по внешним признакам обнаружить химическую реакцию (образование осадка, изменение окраски, выделение газа, выделение или поглощение теплоты и т. д.) [7, 169].
Классификация химических реакций дается на уровне сравнения числа исходных и полученных веществ. При этом учащиеся используют такие мыслительные приемы: сравнение, анализ, синтез, обобщение. Все эти сведения о химической реакции включены в тему Первоначальные химические понятия. Далее все стороны системы понятий о химической реакции должны расширяться и дополняться новыми данными, т. е. после этапа обобщения снова начинается этап накопления.
В теме Кислород. Оксиды. Горение понятие о химической реакции обогащается новыми фактами, вводится частное понятие об окислении, но уровень объяснений и обоснований тот же, что и в предыдущей теме. Такой индуктивный логический подход применяется тогда, когда для широких обобщений нет еще подготовки. Здесь говорится об окислении как химической реакции, но рассматривается оно как соединение с кислородом, т. е. применяется изученный учащимися принцип классификации.
Закономерности протекания реакций разбираются при изучении условий возникновения и прекращения горения. Новым здесь является понятие о катализаторе на примере бертолетовой соли и первые, самые простые, представления о скорости химической реакции. Впервые вопрос о скорости химической реакции затрагивается в теме Вода. Растворы. Основания, и возвращаются к нему только в конце IХ класса при изучении темы Основные закономерности химических реакций. Производство серной кислоты.
В темах Водород. Кислоты. Соли, Вода. Растворы. Основания понятие о химической реакции обогащается фактическим материалом. Дается понятие о реакции обмена на примерах взаимодействия кислот с оксидами, о реакции нейтрализации кислоты основанием, о восстановлении как разновидности реакции замещения и как о процессе отнятия кислорода от вещества.
Уровень 2. В теме VIIIкласса Количественные отношения в химии понятие о химической реакции получает дальнейшее развитие. В частности, начинают формироваться энергетические представления о химических процессах. Рассматривается понятие об экзотермических и эндотермических реакциях, вводится качественно новое понятие о тепловом эффекте химических реакций, термохимических уравнениях. Именно здесь раскрывается на химическом материале важнейший закон природы — закон сохранения и превращения энергии. Так появляется возможность снова показать, что все химические процессы имеют две стороны — качественную и количественную. При изучении энергетики химической реакции учитель обязательно должен установить межпредметную связь с физикой на основе закона сохранения и превращения энергии. Это создаст условия для формирования научно-материалистического мировоззрения, утверждения идеи о материальном единстве мира и даст возможность упомянуть о новой форме энергии — энергии, выделяемой при химических реакциях. В этой теме количественные отношения веществ трактуются как молярные отношения реагирующих веществ и продуктов реакции. С помощью соответствующего перерасчета эти отношения можно выразить как массовые или объемные отношения (если речь идет о газах).
Уровень 3. Понятие о химической реакции претерпевает качественное изменение в теме Химическая связь. Строение вещества. Химическая реакция начинает трактоваться как разрушение одних связей и образование новых. Рассматривается это на примере окислительно-восстановительных реакций. Механизм реакции окисления и восстановления объясняют с точки зрения перехода электронов, поднимаясь на более высокий теоретический уровень. На основе нового понятия степень окисления анализируют известные учащимся реакции разных типов, доказывая, что среди реакций любого типа можно найти окислительно-восстановительные. Следовательно, степень окисления элемента — это, как правило, еще один критерий классификации химических реакций. Здесь появляется возможность показать учащимся диалектический характер окислительно-восстановительных процессов (единство и борьба противоположностей).
В теме Галогены дается первое понятие о качественной реакции на примере соляной кислоты и хлоридов. В теме Подгруппа кислорода вводится новый тип реакций — аллотропные превращения на примере озона, серы.
Уровень 4. Наибольшее развитие понятия о закономерностях протекания химических реакций получат в теме Основные закономерности химических реакций. Производство серной кислоты. Здесь дают понятие о скорости химической реакции и о факторах, влияющих на скорость (природа реагирующих веществ, их концентрация, поверхность соприкосновения, температура, наличие катализатора), приводится формула прямой зависимости скорости от концентрации реагирующих веществ, говорится о температурном коэффициенте скорости.
В этой теме развивается и обобщается понятие о химической реакции.
Уровень 5. Тема Теория электролитической диссоциации, с которой начинается курс химии в IX классе, помимо мировоззренческого значения, вносит много нового в объяснение механизма реакции. На базе понятия об обратимости реакций можно объяснить сущность процесса диссоциации, а также гидролиза солей. Гидролиз рассматривается только в ионной форме, чтобы не вводить понятие о гидроксо-солях. Гидролиз — очень важное теоретическое понятие, которое развивается в последующих темах IX класса и в органической химии. Его следует изучать с использованием понятия о химическом равновесии.
Далее изучение химических реакций в IX классе происходит дедуктивно. Знания, сформированные на базе перечисленных теорий, применяются для объяснения фактов и явлений и прогнозирования протекания процессов.
Уровень 6. Дальнейшее развитие понятия химическая реакция осуществляется в курсе органической химии. Понятие о классификации химических реакций дополняется и расширяется. В курсе органической химии вводится новый тип реакции — изомеризация. Самая первая классификация реакций на типы приобретает качественно новое, более глубокое содержание. Например, реакция замещения — галогенирование алканов приводит не к образованию нового простого и нового сложного вещества, а к образованию двух сложных веществ. Реакция соединения включает в себя целую систему понятий органического синтеза: гидрирование, гидратацию, полимеризацию, фотосинтез и др. Реакция разложения объединяет такую систему понятий, как крекинг, риформинг, гидролиз (омыление) и т. д.
В органической химии вносится качественно новый материал в понятия и о механизмах реакций [38, 144]. Впервые дается представление о свободнорадикальном механизме реакций замещения и полимеризации и ионном механизме реакций присоединения. Свободнорадикальный механизм рассматривают на примере реакций замещения (галогенирование алканов), присоединения (полимеризация), отщепления (крекинг углеводородов). В неорганической химии этот механизм не разбирают (цепные реакции исключены из программы). Расширяется понятие о ионном механизме химической реакции: приводятся примеры присоединения неорганических веществ к алкенам (симметричным и несимметричным), реакций замещения при гидролизе гало-геноалкилов.
Уровень 7. В теме Обобщение знаний по неорганической и органической химии завершается обобщение понятия химическая реакция. В конце обучения учащийся должен суметь охарактеризовать предложенную ему в качестве примера химическую реакцию в свете компонентов содержания [16, 134].
2.2 Приемы работы над химическими терминами и названиями иностранного происхождения
Опираясь на свой опыт и опыт других учителей и методистов, автор одной из первых статей по проблеме этимологического анализа терминов С.В. Дьякович рекомендует следующие приемы работы над химическими терминами и названиями иностранного происхождения, встречающимися при изучении химии [9, 122].
1. Обязательная запись каждого нового термина на доске, сопровождаемая этимологическим анализом и объяснением значения. При раскрытии этимологии слова, содержащего иноязычные корни, полезно записывать также и слова, из которых произведен термин, на языке оригинала. Например, гербицид - от латинского слова herba (трава) и caedo (убиваю). Большой интерес вызывает у учащихся приведение ряда однокоренных слов. Так, давая объяснение слову гербицид, можно привести и такие примеры: гербарий - коллекция специально собранных и засушенных растений; зооцид яд, убивающий животных-вредителей. Каждый новый термин разделяется на морфемы - части слова, которые четко произносятся с усилением главного звука, с выделением его под ударением. Это способствует правильному написанию терминов, повышает грамотность учащихся.
2. Запись слова в словарь химических терминов с кратким объяснением. Ведение таких словариков (справочников) методисты считают обязательным, начиная с 8 класса. Слова можно записывать как в специальную тетрадь, так и на листах бумаги, вклеенных (вложенных) в учебник химии. После каждого записанного слова рекомендуется указывать страницу учебника (другого издания), на которой это слово встречается. В результате получается нечто вроде предметного указателя.
3. Систематическое проведение (после изучения крупных разделов программы) терминологических диктантов, на которые достаточно выделить 3-5 мин урока. Диктанты позволяют проконтролировать, насколько правильно учащиеся воспринимают термины и названия на слух и записывают их. В терминологическом диктанте можно практиковать и толкование отдельных терминов. Например, на обобщающем уроке по теме Электролитическая диссоциация, можно предложить записать под диктовку слова - электролит, диссоциация, катион, анион и сделать перевод на русский язык этих терминов. Работу можно проводить фронтально или по вариантам, когда учащиеся каждого варианта объясняют свои термины.
4. Обучение учащихся приемам работы со словарями и энциклопедиями. Желательно ознакомить учащихся с правилами пользования наиболее распространенными словарями - толковым словарем русского языка В.И.Даля (или под редакцией Д.Н.Ушакова), кратким словарем иностранных слов, отдельными томами Большой и Малой энциклопедий, химической энциклопедией, словарем (справочником) юного химика. Во многих случаях в словаре или энциклопедии можно найти не только объяснение химического термина или названия, но и указание на их происхождение. В настоящее время огромные возможности для поиска необходимой информации предоставляет Интернет.
5. Для того чтобы облегчить учащимся понимание терминов и названий, имеющих одинаковые корни, приставки или суффиксы, полезно иметь в кабинете химии справочные терминологические таблицы (см. Приложение 2, 3).
6. Более глубокое изучение этимологии химических терминов и названий (в частности, происхождение названий химических элементов) можно перенести на внеклассные занятия (см. Приложение). Их организовывают в занимательной форме (викторины, решение кроссвордов, чайнвордов, игры типа Что? Где? Когда? и т.д.). Эти мероприятия способствуют более глубокому усвоению химического языка [22, 41] (Приложение 5).
2.3 Разработка упражнений по обучению химической терминологии
Ход урока
I. Организационный момент. Приветствие учеников
Учитель объявляет о предстоящем уроке-соревновании. Класс делится на четыре группы. Каждая группа садится за отдельные столы.
На столах находятся карточки: информационные, техника безопасности, экспериментальная, задания для самостоятельной работы.
II. Актуализация знаний
Учитель напоминает, что в процессе изучения химии учащиеся познакомились со свойствами сложных веществ: оксиды, кислоты, соли. На этом уроке полученные ранее знания необходимо привести в стройную систему, установить связи между изученными веществами, выяснить причины взаимного превращения одних веществ в другие. Изучить новый класс веществ — основания.
III. Изучение нового материала
1)Учитель: Сегодня на уроке мы должны изучить новый класс веществ - основание. Для этого рассмотрите вещества, находящиеся у вас на столах и попытайтесь вывести определение.
Мы провели опрос простой
Он высветили состав такой
Кислород с водородом вместе - о и аш
Образуют дружную группу ОН (о-аш).
А металлы разные с группой этой
И есть основания,
Их главная примета:
Ме(ОН)n
А за скобкой что за эн
Я забыла спросить зачем
В общей формуле сей знак?
Цифры ставить? Ну а как?
Чтобы формулы писать,
Надо всем валентность знать!
Хоть в гидроксогруппе два элемента
Но вся эта группа - одновалентна!
Затем работа по карточке № 1. Каждый стол, отвечает на вопрос, соответствующий номеру стола.
Карточка № 1.
Какие вещества называются основаниями. Дать определение.
Определите состав основания. Какие различия и что общего в составе оснований? Приведите примеры.
Определите валентность гидроксогруппы. Выведите общую формулу оснований.
Классифицируйте основания на растворимые и не растворимые (пользуясь таблицей растворимости). Приведите примеры.
Учащиеся работают с учебником.
Учитель проверяет правильность ответов, вызывая по одному учащемуся от группы. После ответа ребят учитель ёще раз сам проговаривает определение и закрепляет классификацию оснований.
Учитель: Основаниями называют сложные вещества, в состав которых входят атомы металлов и гидроксогруппы (ОН). Гидроксогруппа образуется из молекулы воды:
Учитель записывает на доске примеры:
2) Учитель: Далее мы должны познакомиться с физическими свойствами оснований. Основания — это твердые вещества. Растворимые в воде основания называются щелочами. Однако большинство оснований в воде нерастворяются. Найдите в таблице растворимости примеры щелочей и не растворимых оснований.
Ученики, пользуясь таблицей растворимости, приводят примеры.
Учитель: Щелочи - едкие вещества. Они разъедают кожу и ткани. Поэтому технические названия некоторых из них указывают на это свойство. Например: NаОН - едкий натр, КОН- едкий кали. Обращаться со щелочами нужно очень осторожно. На ваших столах находится инструктаж по технике безопасности при работе со щелочами. Для дальнейшей работы вам нужно с ним ознакомиться.
Техника безопасности при работе со щелочами
Щелочи оказывают на организм в основном локальное действие, вызывал омертвление только тех участков кожного покрова, на которые они попали. Однако в дальнейшем организм испытывает общее отравление в результате всасывания в кровь продуктов взаимодействия мышечных тканей и щелочей. Действие щелочей, особенно концентрированных, характеризуются значительной глубиной проникновения, поскольку они растворяют белок. В связи с этим очень опасно попадание щелочей в глаза: при запоздалой первой помощи возможна полная потеря зрения.
Твердые щелочи очень гигроскопичны. Хранить твердые щелочи следует в емкостях из полиэтилена или в толстостенных широкогорлых стеклянных банках.
Во время приготовления растворов щелочей из твердых щелочей, последние берут из емкостей только специальной ложечкой и ни в коем случае не насыпают, потому что пыль может попасть в глаза и на кожу. После использования ложечку тщательно моют, так как щелочь прочно пристает ко многим поверхностям.
При попадании щелочи на кожу необходимо промыть пораненное место обильной струей воды. Щелочь смывается плохо, промывание должно быть продолжительным (10-15 мин) и тщательным.
При попадании щелочи в глаза их необходимо тщательно промыть 0,2 % раствором борной кислоты.
Ученики изучают технику безопасности.
Учитель: Определите агрегатное состояние, цвет и запах предложенных вам веществ. Занесите результаты в таблицу.
Ученики заполняют таблицу.
Агрегатное состояние веществ
Таблица 3
| Вещество | Агрегатное состояние | Цвет | Запах |
| NaOH | |||
| KOH | |||
| Cu(OH)2 | |||
| Fe(OH)3 |
Учитель закрепляет знания, полученные по физическим свойствам.
3) Экспериментальная часть:
Учитель: Перед вами лежат карточки с описанием лабораторных работ. Соблюдая инструктаж по технике безопасности, проведите эти работы, проанализируйте результат, используя таблицу окраски индикаторов в зависимости от среды, и сделайте выводы.
Индикатор NaOH |
Цвет индикатора | ||
| В чистой воде (нейтральная среда) | В растворах кислот (кислая среда) |
В растворах щелочей (щелочная среда) |
|
| Лакмус | Фиолетовый | Красный | Синий |
| Метилоранж | Оранжевый | Красный | |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Карточка 2. Описание лабораторных работ
Лабораторная работа № 1. Даны З пробирки с бесцветными жидкостями. При помощи индикатора (лакмус) определите в какой пробирке вода, в какой раствор щелочи, а в какой кислота?
Ученики добавляют лакмус в пробирки.
Ученики делают анализ работы: пробирка № 1- красный цвет, пробирка № 2- фиолетовый цвет, пробирка № 3 - синий цвет.
Вывод: В пробирке № 1 находится кислота, в пробирке № 2- вода, № 3 - щелочь.
Учитель: Приступаем к работе № 2.
Лаборатовная работа № 2. Прилейте в пробирку, где лежит гранула едкого натра, несколько капель воды. Что наблюдаете? Происходит ли разогревание пробирки при растворении гидроксида натрия? В полученный раствор щелочи добавьте еще немного воды и разлейте (аккуратно!) раствор в три пробирки. В первую добавьте фенолфталеин, во вторую —2 капли лакмуса, а в третью- метилоранж. Отметьте цвет индикаторов в растворе, сравните полученные результаты с данными таблицы.
Ученики проводят лабораторную работу № 2, анализируют ее, делают соответствующие выводы.
Учитель анализирует работу учеников, закрепляет экспериментальную часть, предлагает решить качественную задачу.
Задача: Опытные мастера определяют окончание схватывания штукатурки по внешним признакам (Са(ОН)2 — используются как компонент штукатурного раствора). Можно ли определить это химическим путем с помощью индикатора?
Ответ: (при полном схватывании весь Са(ОН)2 превращается в соль карбонат, и проба с фенолфталеином не дает окрашивания. Если же штукатурка не схватилась полностью, то присутствующий Са(ОН)2 даст с фенолфталеином малиновое окрашивание.)
4) Практическое значение оснований.
Учитель: Мы познакомились еще с одним классом сложных веществ - основаниями. Как вы думаете, имеют ли основания практическое значение?
Ученики: Да.
Учитель: Основания распространены в природе реже, чем кислоты и соли. Их получают в промышленности или в лаборатории. Наиболее базисными являются гидроксиды калия, натрия, кальция. Са(ОН)2 гашеная известь, применяется в строительстве.
IV. Закрепление материала
Учитель предлагает выполнить самостоятельную работу по пройденному материалу. Работу выполняет каждый ученик индивидуально.
Учитель: А теперь обменяйтесь работами, обсудите выполненные задания, исправьте ошибки (ответы представлены на доске). Оцените работу друг друга. По окончании урока самостоятельные работы сдайте учителю.
V. Вывод увока
Учитель закрепляет изученный материал. Оценивает работу учеников, как в группе, так и индивидуальную.
VI. Домашнее задание
Изучить § 17 стр.87. Провести домашний эксперимент.
Домашний эксперимент:
Возьмите кусочек негашеной извести (СаО). В стакан налейте воды и бросьте в него с помощью стальной ложки кусочек извести. (Не трогайте известь голыми руками! не наклоняйтесь над стаканом!) Что Вы наблюдаете?
Чтобы подтвердить, что в результате реакции образовалось щелочь, надо раствор испытать индикатором.(Фенолфталеин продается в аптеках в качестве слабительного). Меняет ли фенолфталеин окраску при добавлении к вашему раствору? Опишите свои наблюдения [15, 170].
Глава 3. Организация уроков по обучению химической терминологии
3.1 Методы обучения химии
К основным разделам методики обучения химии относятся методы, формы, средства обучения и научная организация труда учителя химии.
Как известно, любое учебное содержание не может быть введено в учебный процесс вне метода. Поэтому метод обучения с философской точки зрения называют формой движения содержания в учебном процессе. Если предметное содержание — дидактический эквивалент науки, то методы обучения — дидактический эквивалент методов познания и методов изучаемой науки. Они должны отражать их структуру, специфику и диалектику. Поэтому в дидактике не случайно ставится вопрос о соотношении методов науки и методов обучения.
Главной задачей учителя является оптимальный выбор методов обучения, чтобы они обеспечивали образование, воспитание и развитие учащихся. Метод обучения — это вид (способ) целенаправленной совместной деятельности учителя и руководимых им учащихся. Специфика методов обучения химии кроется, во-первых, в специфике содержания и методов химии как экспериментально-теоретической науки и, во-вторых, в особенностях познавательной деятельности учащихся, необходимости мыслить двойным рядом образов, объяснять реально ощутимые свойства и изменения веществ состоянием и изменениями в невидимом микромире, понять которые можно, пользуясь теоретическими, модельными представлениями [26, 144].
Следует помнить, что каждый метод нужно применять там, где он наиболее эффективно выполняет образовательную, воспитывающую и развивающую функции. Любой метод может и должен выполнять все три функции и выполняет их, если применен правильно, выбран адекватно содержанию и возрастным особенностям учащихся и используется не изолированно, а в сочетании с другими методами обучения. Методы обучения выбирает и применяет учитель, а воздействие личности учителя — чрезвычайно важный фактор обучения, и особенно воспитания, учащихся. Поэтому, выбирая метод, учитель должен быть уверен, что в данных конкретных условиях именно этот метод будет оказывать наибольшее образовательное, воспитывающее, развивающее действие.
При изучении методов обучения химии затрагивается проблема оптимального их выбора. При этом учитывается следующее: 1) закономерности и принципы обучения; 2) цели и задачи обучения; 3) содержание и методы данной науки вообще и данного предмета, темы в частности; 4) учебные возможности школьников (возрастные, уровень подготовленности, особенности классного коллектива); 5) специфика внешних условий (географических, производственного окружения и пр.); 6) возможности самих учителей [7, 176].
В основе классификации методов обучения лежат три важных признака: основные дидактические цели (изучение нового материала, закрепление и совершенствование знаний, проверка знаний), источники знаний, а также характер познавательной деятельности учащихся.
Методы можно классифицировать по функциям: образовательной, воспитывающей и развивающей, которые должны в той или иной мере реализовывать все методы. Кроме того, выделяют специальные функции отдельных групп методов обучения: методы организации и осуществления учебно-познавательной деятельности учащихся, доминирующей функцией которых является организация познавательной деятельности учащихся по чувственному восприятию, логическому осмысливанию учебной информации, самостоятельности в поиске новых знаний; методы стимулирования и мотивации познавательной деятельности, доминирующей функцией которых является стимулирующе-мотивационная, регулировочная, коммуникативная; методы контроля и самоконтроля учебно-познавательной деятельности, доминирующей функцией которых является контрольно-оценочная деятельность [7, 44].
Методы организации и осуществления учебно-познавательной деятельности учащихся — это большая и сложная группа методов. Наиболее близкая к химии и удобная для систематического изучения классификация этой группы методов — деление по характеру познавательной деятельности (объяснительно-иллюстративный, эвристический, исследовательский). Каждый такой метод выступает в качестве методического подхода. А в их рамках используются более частные методы, различающиеся по источнику знаний (словесные, словесно-наглядные, словесно-наглядно-практические). Обращает на себя внимание то, что в этой классификации нет членения на чистые наглядные и практические методы. Здесь учтена взаимная интеграция групп методов. Эти группы методов разделяются на отдельные конкретные методы (лекция, рассказ, беседа и т. д.). Таким образом возникает четкая система методов обучения по следующим признакам:
1. Характер познавательной деятельности учащихся (общие методы): объяснительно-иллюстративный, эвристический, исследовательский.
2. Вид источников знаний (частные методы): словесные, словесно-наглядные, словесно-наглядно-практические.
3. Формы совместной деятельности учителя и учащихся (конкретные методы): лекция, рассказ, объяснение, беседа, самостоятельная работа, программированное обучение, описание и т. д.
В данной классификации также имеются спорные вопросы, которые свидетельствуют о сложности задачи классификации методов обучения, однако она достаточно удобна для практического пользования [19, 150].
Рассмотрим особенности деятельности учащихся и учителя в условиях разных общих методов обучения.
При объяснительно-иллюстративном методе учитель сообщает учащимся готовые знания, используя разные частные и конкретные методы — объяснение учителя, работа с книгой, магнитофоном и т. д. При этом, если нужно, применяются средства наглядности (эксперимент, модели, экранные пособия, таблицы и т.п.). Может быть использован и лабораторный эксперимент, но лишь как иллюстрация слов учителя. При объяснительно-иллюстративном методе предполагается сознательная, но репродуктивная деятельность учащихся и применение знаний в сходных ситуациях [14, 147].
Эвристические методы могут осуществляться при активном участии учителя. В качестве примера можно привести эвристическую беседу о выявлении сравнительной активности галогенов, в которой поиск учащихся постоянно корректируется учителем. Демонстрируя опыт, приливают в раствор иодида калия крахмальный клейстер — окраски не наблюдается. Отдельно в хлорную воду также приливают крахмальный клейстер — окраски тоже нет. Когда же смешивают все три компонента вместе — иодид калия, крахмальный клейстер и хлорную воду, крахмал синеет. Далее учитель ведет беседу по анализу данного опыта.
При исследовательском методе также возможна разная степень самостоятельности и сложности задачи исследования. Ученическое исследование, как и научное, сочетает в себе использование теоретических знаний и эксперимента, требует умения моделировать, осуществлять мысленный эксперимент, строить план исследования, например при решении экспериментальных задач. В более сложных случаях при исследовательском методе ученик сам формулирует проблему, выдвигает и обосновывает гипотезу и разрабатывает эксперимент для ее проверки. Для этого он пользуется справочной и научной литературой и т. д. Таким образом, при исследовательском методе от учащихся требуется максимум самостоятельности. Вместе с тем при использовании такого метода требуется значительно больше времени.
Рассмотрим словесные методы обучения, среди которых различают монологические и диалогические.
К монологическим методам обучения относят описание, объяснение, рассказ, лекцию, построенные в основном на изложении материала самим учителем.
Описание знакомит учащихся с фактами, добытыми путем эксперимента и наблюдения в науке: способы защиты окружающей среды от вредных воздействий отходов промышленных предприятий, круговорот того или иного элемента в природе, ход химического процесса, характеристика прибора и т. д. При этом методе полезно использовать наглядность.
Объяснение применяется для изучения сущности явлений, для ознакомления учащихся с теоретическими обобщениями: например, в VII классе — с законом сохранения массы веществ с точки зрения атомно-молекулярного учения, в VIII классе — с причинами периодической повторяемости свойств элементов или процессом обратимости и необратимости реакций и т. д. При этом методе вскрываются связи между понятиями и отдельными фактами. В объяснении главное — четкость. Она достигается соблюдением строгой логической последовательности изложения, установлением связей с уже известными учащимся знаниями, доступностью терминов, правильным использованием записей на доске и в тетрадях учащихся, приведением доступных конкретных примеров, расчленением объяснения на логически законченные части с поэтапным обобщением после каждой части, обеспечением закрепления материала.
Лекция — более длительный вид монологического изложения. Она включает в себя и описание, и объяснение, и рассказ, и другие виды кратковременного монологического изложения с использованием средств наглядности.
К диалогическим методам относят разные виды бесед, семинары, в основе которых лежат диалог учителя с учащимися, диспут между учащимися и т. д.
Беседа — это диалог учителя с учащимися. Выражается она в том, что учитель задает учащимся вопросы, а они на них отвечают. Иногда бывает, что в процессе беседы у учащихся возникает вопрос, на который учитель либо отвечает сам, либо организует для этого учащихся.
К новым в школьной практике методам относится семинар, который также можно причислить к словесным диалогическим методам обучения. Семинар практикуется в основном со старшеклассниками. Учащиеся к нему готовятся по заранее разработанному плану. Проводится семинар, как правило, по достаточно большому разделу, теме в форме обсуждения учащимися той или иной проблемы. Полезнее всего проводить семинары с целью обобщения знаний учащихся. На семинаре учащимся предоставляется для высказываний большее время, чем при беседе, обращается внимание на их речь, логику, аргументацию, умение участвовать в дискуссии и т. д. В качестве тем семинарских занятий можно предложить, например, такие: Зависимость свойств углеводородов от их строения, Значение достижений органической химии в развитии народного хозяйства и др. Семинар — это метод, сближающий школьные формы работы с вузовскими, и для старшеклассников он полезен.
Словесно-наглядные методы обучения определяют использование в учебном процессе различных средств наглядности в сочетании со словом учителя. Они непосредственно связаны со средствами обучения и зависят от них. Кроме того, методы обучения предъявляют к дидактическим средствам определенные требования. Процесс устранения этого противоречия лежит в основе совершенствования этих систем.
Систему словесно-наглядных методов обучения и ее место в учебном процессе можно представить себе в виде схемы (схема 6).
Схема Система словесно-наглядных методов обучения
Такое разделение на блоки определено содержанием курса химии. Демонстрационный эксперимент и натуральные объекты помогают изучать свойства веществ, внешние проявления химической реакции. Модели, чертежи, графики (сюда же следует отнести и составление формул и химических уравнений как знаковых моделей веществ и процессов) способствуют объяснению сущности процессов, состава и строения веществ, теоретическому обоснованию наблюдаемых явлений. Такое разделение функций наглядности говорит о необходимости использования содержания обоих блоков в дидактическом единстве. В этом случае методы обучения будут способствовать движению от фактов — к теории, от конкретного — к абстрактному. Дидактическое единство нашло свое отражение в так называемых комплексах оборудования по теме. Сущность их заключается в том, что для решения разных задач обучения используют различные средства наглядности в пределах одного урока, выполняющие многообразные функции и дополняющие друг друга. Если, например, демонстрируемый прибор слишком мал и плохо виден издали, а знать его устройство учащимся необходимо, учитель может воспроизвести его в виде чертежа, сделать рисунок на доске или изобразить его с помощью магнитных аппликаций, фланелеграфа. Химический процесс в приборе протекает при определенных условиях. Для их обоснования можно привести справочные данные о веществах в виде графиков или цифровых данных, объяснить протекание процесса при помощи шаростержневых моделей и пр. Важно не увлекаться избытком наглядности, так как это утомляет учащихся. Особое внимание следует уделить сочетанию наглядности со словом учителя. Опыт, показанный без комментария учителя, не только не приносит пользы, но иногда может даже повредить. Например, при демонстрации взаимодействия цинка с соляной кислотой учащиеся могут вынести впечатление, что водород выделяется не из кислоты, а из цинка. Весьма распространенной ошибкой является мнение о том, что окраску меняет не индикатор, а среда, в которую он попадает. И большинство других опытов без пояснений не будут выполнять необходимых образовательной, воспитывающей и развивающей функций, Поэтому слово учителя играет важную руководящую и направляющую роль. Но и слово находится в определенной зависимости от средств наглядности, так как учитель строит свое объяснение, ориентируясь на те средства обучения, которые имеются в его распоряжении.
Использование демонстрационного эксперимента в обучении химии
Важнейшим из словесно-наглядных методов обучения является использование демонстрационного химического эксперимента. Специфика химии как науки экспериментально-теоретической поставила учебный эксперимент на одно из ведущих мест. Химический эксперимент в обучении позволяет ближе ознакомить учащихся не только с самими явлениями, но и с методами химической науки.
Демонстрационным называют эксперимент, который проводится в классе учителем, лаборантом или иногда одним из учащихся. Демонстрационные опыты по химии указаны в программе, но учитель может заменить их другими, эквивалентными в методическом отношении, если у него отсутствуют требуемые реактивы.
Проблема использования школьного химического эксперимента — одна из наиболее разработанных в методике, так как именно она более других отражает специфику учебного предмета. Широко известны в методике исследования В. Н. Верховского, К. Я. Парменова, В. С. Полосина, Л. А. Цветкова, И. Н. Черткова и др. Материалы о химическом эксперименте регулярно публикуются на страницах журнала Химия в школе. Общеизвестны требования к демонстрационному эксперименту.
Наглядность. Реактивы должны использоваться в таких количествах и в посуде такого объема, чтобы все детали были хорошо видны всем учащимся. Пробирочные опыты видны хорошо не далее третьего ряда столов, поэтому для демонстрирования применяют цилиндры, стаканы или демонстрационные пробирки достаточно большого объема. Со стола снимают все, что может отвлечь внимание. Жест учителя тщательно продуман, руки учителя не заслоняют происходящее.
Наглядность опыта можно усилить, демонстрируя его через кодоскоп в кювете или чашке Петри. Например, взаимодействие натрия с водой нельзя показывать с большим количеством металла, а с малым количеством он плохо виден, выдать же его учащимся для лабораторной работы нельзя — опыт опасен. Опыт, иллюстрирующий свойства натрия, очень хорошо виден при проецировании через кодоскоп. Для большей наглядности широко используются предметные столики.
Простота. В приборах не должно быть нагромождения лишних деталей. Следует помнить, что, как правило, в химии объектом изучения является не сам прибор, а процесс, в нем происходящий. Поэтому чем проще сам прибор, тем он лучше отвечает цели обучения, тем легче объяснить опыт. Однако не нужно путать простоту с упрощенчеством. Нельзя употреблять в опытах бытовую посуду — это снижает культуру эксперимента.
Учащиеся с большим удовольствием смотрят эффектные опыты со вспышками, взрывами и т. д., но увлекаться ими, особенно в начале обучения, не следует, так как менее эффектные опыты тогда пользуются меньшим вниманием.
Безопасность эксперимента. Учитель несет полную ответственность за безопасность учащихся во время урока или на внеклассных занятиях. Поэтому он обязан знать правила техники безопасности при работе в химическом кабинете. Помимо обеспечения занятий средствами пожарной безопасности, вытяжными средствами, средствами для оказания мер первой помощи пострадавшим, учителю необходимо помнить о приемах, способствующих соблюдению безопасности на уроке. Посуда, в которой проводится опыт, должна быть всегда чистой, реактивы проверены заранее, при опытах со взрывами используется защитный прозрачный экран. Газы на чистоту проверяют заранее и перед проведением самого опыта. Если опыт проводится со взрывом, учащихся предупреждают об этом заранее, чтобы взрыв не был для них неожиданностью. Нужно предусмотреть средства личной безопасности (защитные очки, халат из хлопчатобумажной ткани, резиновые перчатки, противогаз и т. д.), следить за тем, чтобы волосы были подобраны [13, 180].
Надежность. Опыт должен всегда удаваться, так как неудавшийся опыт вызывает у учащихся разочарование и подрывает авторитет учителя. Опыт проверяют до урока, чтобы отработать технику его проведения, определить время, которое он займет, выяснить оптимальные условия (последовательность и количество добавляемых реактивов, концентрация их растворов), продумать место эксперимента в уроке и план объяснения. Если опыт все же не удался, лучше сразу же показать его вторично. Причину неудачи следует объяснить учащимся. Если опыт снова провести невозможно, то его обязательно показывают на следующем уроке.
Необходимостъ объяснения эксперимента. Каждый эксперимент лишь тогда имеет познавательную ценность, когда его объясняют. Лучше меньше опытов на уроке, но все они должны быть понятны учащимся. По замечанию И. А. Каблукова учащиеся должны смотреть на опыт как на метод исследования природы, как на вопрос, задаваемый природе, а не как на фокус-покус.
Важнейшим требованием к демонстрационному эксперименту является филигранная техника его выполнения. Малейший ошибочный прием учителя будет многократно повторен его учениками.
В соответствии с перечисленными требованиями рекомендуется следующая методика демонстрации опытов [8, 188].
1. Постановка цели опыта (или проблемы, которую нужно решить). Учащиеся должны понимать, для чего проводится опыт, в чем они должны убедиться, что понять в результате проведения опыта.
2. Описание прибора, в котором проводится опыт, условий, в которых он проводится, реактивов с указанием их требуемых свойств.
3. Организация наблюдения учащихся. Учитель должен сориентировать учащихся, за какой частью прибора наблюдать, чего ожидать (признак реакции) и т. д.
4. Вывод и теоретическое обоснование.
Для хорошего владения химическим экспериментом нужно многократное и длительное упражнение в его проведении.
Развивающая функция эксперимента может быть усилена посредством разных способов сочетания эксперимента со словом учителя. Выявлены четыре основных способа сочетания слова учителя с экспериментом:
1) знания извлекаются из самого опыта. Объяснение учителя сопровождает опыт, идет как бы параллельно процессу, который наблюдают учащиеся. Такое сочетание неприемлемо для эффектных опытов, которые привлекают внимание учащихся ярким зрелищем, создают сильный доминирующий очаг возбуждения в коре головного мозга;
2) слово учителя дополняет наблюдения, сделанные в опыте, поясняет то, что видят учащиеся (например, опыт с восстановлением меди из оксида водородом);
3) слово учителя предшествует эксперименту, который выполняет иллюстративную функцию;
4) сначала дается словесное объяснение, расшифровка явления, а затем демонстрационный эксперимент. Однако из этого не следует, что при демонстрировании учитель предугадывает ход эксперимента и рассказывает, что должно получиться.
Первый и второй подход используют при проблемном обучении; они более способствуют развитию мыслительной деятельности.
Использование учебно-наглядных пособий при обучении химии
Помимо демонстрационного эксперимента, в арсенале учителя химии имеется множество других средств наглядности, которые при правильном использовании повышают эффективность и качество урока (классная доска, таблицы различного содержания, модели, макеты, магнитные аппликации, экранные пособия). Их применяют как в сочетании с химическим экспериментом и друг с другом, так и раздельно, но обязательно со словом учителя.
Запись на доске нужно заранее планировать. Она должна выполняться четко и последовательно, так, чтобы весь ход урока был отражен на доске. В этом случае учитель может вернуться к уже объясненному и обсудить с учащимися недостаточно хорошо усвоенные вопросы. Рисунки на доске выполняют при помощи трафаретов.
Учитель руководит также работой учащихся у доски, чтобы их запись была четкой и аккуратной.
Запись на доске целесообразнее других видов наглядности в тех случаях, когда нужно отразить последовательность вывода формулы или другого алгоритмического предписания. Пользоваться следует только чистой доской, на которой нет посторонних записей. Стоять у доски учитель должен так, чтобы не загораживать запись, которую он делает.
Необходимо помнить, что решение задач — это не самоцель, а средство обучения, способствующее прочному усвоению знаний.
Классифицируют задачи по типам решений, в основном на качественные и расчетные.
Качественные задачи по химии
Среди широко известных типов качественных задач можно указать следующие:
1. Объяснение перечисленных или наблюдаемых явлений: почему реакция карбоната кальция с серной кислотой начинается сначала бурно, а затем прекращается? Почему при нагревании сухого карбоната аммония образуется другое вещество?
2. Характеристика конкретных веществ: с какими веществами и почему может реагировать соляная кислота? С какими из перечисленных веществ будет вступать в реакцию соляная кислота?
3. Распознавание веществ: в какой из пробирок находятся кислота, щелочь, соль? В какой из пробирок находятся соляная кислота, серная, азотная?
4. Доказательство качественного состава веществ: как доказать, что в состав хлорида аммония входят ион аммония и ион хлора?
5. Разделение смесей и выделение чистых веществ: как очистить кислород от примеси оксида углерода (IV)?
6. Получение веществ: получить хлорид цинка всеми возможными способами.
К этому же типу задач относят и цепочки превращений, а также получение вещества, если дан ряд других веществ как исходных. Могут быть задачи на применение прибора, например: указать, какой из приборов можно использовать для собирания аммиака, кислорода, водорода, хлора и т. д. [10, 119].
3.2 Средства обучения химии
Средства обучения и воспитания — система материальных объектов, используемых с целью образования, воспитания и развития личности учащихся. Это единство функций обеспечивает целостность системы.
Средства обучения образуют три большие группы, которые различают между собой по своему назначению и способу воздействия на учащихся:

Пособие для учителя – методическая литература – воздействует на учащихся опосредованно через учителя.
Оборудование школьного кабинета предназначено для непосредственного обеспечения учебно-воспитательного процесса; оно оказывает прямое воздействие на учащихся во время уроков и внеурочных занятий. Учебник химии — средство обучения, которым ученик пользуется индивидуально в школе и дома.
При создании кабинета химии специально подбирают такое помещение, которое позволяет наилучшим образом использовать учебное оборудование для осуществления учебно-воспитательного процесса.
Рассмотрим систему учебного оборудования по химии.

Схема учебного оборудования\
Ни один элемент учебного оборудования не может выполнить самостоятельно образовательную, воспитывающую и развивающую функции в учебном процессе. Они занимают подчиненное положение по отношению к методам обучения. Однако наличие и дидактические возможности средств обучения и воспитания определяют выбор методов. В этом их диалектическое единство. Так, например, внедрение в учебный процесс телевидения как средства обучения и воспитания создало телеуроки. Использование графопроектора позволило внести коррективы в традиционные наглядные методы: проецирование химических опытов и заданий для самостоятельной работы, самопроверки. Размещение на ученических столах реактивов, посуды и принадлежностей позволило шире внедрить в учебный процесс лабораторные опыты.
Именно сочетание методов и средств обучения позволяет успешно решать проблему реализации триединой функции обучения. Например, специфический интерьер химического кабинета, справочные таблицы на стенах, оборудованные стол учителя и столы учащихся, удобно расположенный вытяжной шкаф, рационально размещенное и доступное для пользования оборудование создают определенный деловой настрой, способствуют трудовому воспитанию.
Рабочие места учителя и учащихся
Рабочее место учителя — большой стол, поверхность которого решена в двух уровнях. Верхняя часть — демонстрационная, где осуществляется непосредственный показ учащимся объектов наблюдения, на нижней — размещают вспомогательные предметы, которые скрыты от учащихся бортиком. Внимание учащихся сосредоточивается только на изучаемом объекте. При таком оборудовании рабочего места рационально организованный труд учителя оказывает большое воспитательное воздействие, способствует формированию серьезного отношения к предмету. Проекционная аппаратура находится у противоположной стены класса и управляется дистанционно. Использование демонстрационного вытяжного шкафа при проведении опытов с ядовитыми газами убеждает учащихся в необходимости соблюдать правила техники безопасности, которой учитель должен уделять особое внимание при изучении химии.
Классная доска должна иметь три щита, магнитную часть поверхности и экран над доской. Под доской размещают плоские ящики для хранения таблиц.
Рабочее место учащегося также оборудовано специально разработанными лабораторными принадлежностями и способствует формированию и развитию практических умений и навыков, развитию интереса, самостоятельности, обеспечивает самостоятельность работы, делает более убедительными полученные знания.
Комплексы средств обучения
В обучении химии на каждом уроке используется не одно, а несколько разных средств обучения, которые взаимно дополняют друг друга, способствуя формированию у учащихся возможно более объективных и четких представлений об изучаемом предмете или явлении. Так, например, при демонстрировании работы прибора небольшого размера, когда издали плохо просматриваются детали, может быть показана и плоскостная модель прибора, смонтированная на магнитной доске, фланеле-графе или нарисованная мелом на доске.
Лаборантская комната
Организовать труд учителя во время урока невозможно без тщательной предварительной подготовки, которая предусматривает подбор необходимых средств обучения, хранящихся в лаборантской комнате. Эта комната небольшая, поэтому размещение в ней оборудования должно быть тщательно продумано. Лаборантская комната — рабочее место учителя и лаборанта. Пребывание учащихся в лаборантской комнате категорически запрещается.
Лаборантская комната должна иметь два выхода — в класс-лабораторию и в коридор, чтобы не нужно было проходить через класс во время урока. В ней должен быть препараторский стол для подготовки и проверки планируемого эксперимента. Для хранения раздаточных склянок и банок с реактивами, которые редко используются и поэтому не входят в ученические наборы на столах, предназначен емкий лоточный шкаф. Реактивы в нем хранятся в выдвижных лотках (в виде полок с бортиками). Нужный лоток с банками вынимают, выносят в класс и реактивы расставляют по столам. В шкафу также размещены в поролоновых укладках некоторые виды посуды, стеклянные приборы.
Значение учебника в обучении химии
Проблема школьного учебника широко обсуждается в педагогической литературе в самых разных аспектах: содержание, гигиенические характеристики, структурные особенности, воспитательные функции и т. д.
Требования к системе содержания учебника
Содержание любого учебника инвариантно можно отразить схемой 10.

Система содержания учебника отражает обучение в целом, моделируя деятельность учителя, обеспечивающего учебную деятельность учащихся. Следовательно, учебник можно считать обучающей системой.
Формирование у учащихся умения работать с учебником — одна из важнейших задач учителя химии.
3.3 Формы контроля за усвоением знаний учащихся
Контроль результатов обучения — важная часть процесса обучения. Его задача заключается в том, чтобы определить, в какой мере достигнуты, цели обучения. Так как контроль носит в средней школе обучающий характер, его методы рассматриваются в тесной связи с другими методами обучения [14, 156].
Контроль результатов выполняет все три функции, присущие процессу обучения в целом, и имеет четко выраженное образовательное, воспитывающее и развивающее значение. Особенно важен он для учащихся. Обучающее значение его выражено в том, что позволяет ученику корректировать свои знания и умения. Воспитательное значение контроля велико. Постоянная проверка приучает учащихся систематически работать, отчитываться перед классом в качестве приобретенных знаний и умений. У учащихся вырабатывается чувство ответственности, стремление повысить успеваемость. Контроль воспитывает целеустремленность, настойчивость и трудолюбие, умение преодолевать трудности, т. е. способствует формированию нравственных качеств личности. Систематический контроль способствует развитию самостоятельности, формированию навыков самоконтроля.
Контроль результатов обучения важен и для учителя, так как позволяет ему изучать своих учащихся и корректировать учебный процесс, и для родителей, которые стремятся быть осведомленными об успеваемости своих детей.
На схеме 7 показано, как цели контроля соотносятся с целями обучения химии.
Соотнесение целей контроля с целями обучения
Схема 7 показывает, что в процессе обучения должна контролироваться реализация всех трех функций процесса обучения, что и является содержанием проверки.
Зачет
Одним из методов устной проверки знаний в старших классах является зачет. Его проводят обычно в конце какой-либо большой и сложной темы. Например, может быть проведен зачет по теме Теория электролитической диссоциации, Азот и его соединения или по всему разделу о металлах. Зачет назначается во внеурочное время; класс при этом разделяется на две или три группы.
О зачете сообщают заранее, чтобы учащиеся могли к нему подготовиться. Для подготовки к нему учитель составляет вопросы, а также примерные задачи, рекомендует литературу, предварительно проверив, имеется ли она в школьной библиотеке. Вопросы учащимся нужно продиктовать, а затем вывесить на доске объявлений химического кабинета, чтобы учащиеся, пропустившие занятия, могли их переписать.
На зачете вопросы для подготовки должны быть выданы сразу всем учащимся, которых отпускать по мере сдачи зачета. Учащихся, часто и хорошо отвечающих в классе на уроке, можно от зачета освободить, объявив это в классе как поощрение.
Сроки проведения зачета должны быть известны завучу школы, чтобы можно было регулировать нагрузку учащихся. На зачет можно пригласить представителя администрации школы или классного руководителя.
Экзамен
Метод заключительной проверки — выпускной экзамен, который проводится в X классе по окончании обучения в школе. С одной стороны, это проверка знаний, с другой — торжественный акт.
К экзамену должен быть специально подготовлен химический кабинет. Нужно разместить оборудование для подготовки эксперимента так, чтобы учащимся это было удобно. В кабинете вывешивают таблицы, которые использовались в процессе обучения, связанные по содержанию с вопросами билетов, дополнительные доски и т. п.
Контрольная работа
К методам письменной проверки результатов обучения относятся письменная контрольная работа на 45 мин, проверочные работы на 10—15 мин, письменные домашние задания, письменный учет знаний отдельных учащихся по карточкам, химические диктанты, программированный контроль и т. п.
Длительные контрольные работы проводятся по химии редко, обычно после прохождения отдельной темы. О проведении контрольной работы учащихся предупреждают заранее, чтобы они могли подготовиться. Иногда учитель предлагает вопросы для подготовки к ней. Контрольная работа по химии не чаще, чем раз в четверть, включается в график контрольных мероприятий школы завучем школы, которого учитель ставит в известность. В этот день ни один другой учитель не имеет права провести контрольную работу.
Самостоятельная проверочная работа
Проверочные работы на 10 —15 мин проводятся на уроке довольно часто. При их проведении учащихся заранее не предупреждают. Проводить их можно даже после объяснения нового материала для проверки его усвоения или закрепления. Для этой цели можно использовать и тестовый (программированный) контроль. Содержание таких работ весьма разнообразно. Например, в VIIклассе часто используется химический диктант по проверке усвоения символов элементов, работа по расстановке коэффициентов, по определению валентности элемента в соединении, по написанию химических формул по валентности и т. д. В IX классе — по написанию ионных уравнений и т. п.
Проверка письменных домашних заданий
Проверка домашних заданий может производиться по-разному, в зависимости от их содержания. Прежде всего необходимо добиться выполнения домашнего задания всеми учащимися в классе. Для этого нужно регулярно контролировать наличие выполненного задания в тетрадях учащихся. Это может сделать учитель, бегло просматривая тетради при движении между рядами. Он предлагает открыть тетради с заданиями и отмечает в своей тетради задания невыполненные. Правильность выполнения при этом проверить нельзя. Эта процедура неудобна тем, что на нее затрачивается некоторое время урока, а задача, которую она решает, — чисто дисциплинарного характера. Обучающая функция при этом не осуществляется. Правда, в это время классу дают какое-то задание, но сам учитель не может в этом участвовать с необходимой активностью.
Заключение
Овладеть языком науки в совершенстве при обучении химии помогают также различные упражнения. Надо иметь в виду, что химический язык в широком смысле - это не только язык химии, но и язык предметов, связанных со многими профессиями, которыми предстоит овладеть учащимся в будущем. Поэтому специальная работа над языком значительно ускоряет процесс овладения профессиональной речью.
При этом большая роль должна отводиться упражнениям. Поскольку химический язык - это язык научный, то на него накладываются речевые особенности, характерные для научного стиля речи: логичность, точность, лаконичность. Здесь-то упражнения и выходят на первый план. К основным трудностям, с которыми сталкиваются учащиеся при освоении химического языка, можно отнести неточное знание содержания отдельных терминов, неумение строить высказывание в форме логичного рассуждения, делать высказывания краткими и содержательными. Преодолению этих трудностей способствует работа со словарем, а также с текстами учебника.
В целях формирования у школьников речевой логичности полезными будут такие вопросы и задания: о чем говорится в тексте? Перескажите, что именно говорится в тексте о доказываемом. Прочитав объяснение, сформулируйте объясняемое и т.д. Выполнение подобных упражнений способствует формированию навыков последовательного изложения материала, речь учащихся становится точнее и логичнее. Полезно также требование учителя дать толкование тому или иному термину, записи, которые ученик использует в своем ответе. Выполняя эти требования, учащиеся постепенно приучаются использовать химический язык в своих рассуждениях.
Приведем примеры специальных заданий, направленных на формирование умения пользоваться химическим языком.
Перечислите все сведения, которые можно дать на основании записи: Fe. При выполнении этого задания учащиеся записывают: Fe - химический знак элемента железа, латинское название феррум, читается в формулах феррум. Означает один атом железа, масса атома ma(Fe) = 56 а.е.м., относительная атомная масса Ar(Fe) = 56. В дальнейшем учащиеся дополняют, что молярная масса M(Fe) = 56 г/моль, так как знак Fe означает один моль простого вещества. За химическим знаком Fe кроятся также сведения о положении элемента в периодической системе химических элементов Д.И.Менделеева. Для железа учащиеся указывают порядковый номер 26, четвертый период, восьмую группу, главную подгруппу и строение атомов. Обычно указывают: заряд ядра +26, протонов 26, нейтронов 30, электронов 26; если необходимо, то учащиеся показывают распределение электронов по энергетическим уровням.
Перечислите все сведения, которые можно дать на основании записи - H2O. Учащиеся указывают, что H2 O - это формула воды, означает одну молекулу воды, состоящую из двух элементов - водорода (два атома) и кислорода (один атом); масса молекулы воды m(H2 O) = 18 а.е.м., относительная молекулярная масса воды Mr(H2 O) = 18. Водород имеет валентность равную I, а кислород - II. В дальнейшем учащиеся могут указать молярную массу воды, равную 18 г/моль, а также составить графическую и электронную формулы, назвать тип химической связи между атомами кислорода и водорода, определить степени окисления обоих элементов, охарактеризовать воду как слабый электролит, написать уравнения реакций, в которые вступает вода.
Объясните, что обозначают следующие записи: 2H2 O, 3Al2 O3 , 2Al(NO3 )3 , SO3 . Выполняя это задание, учащиеся учатся различать коэффициенты и индексы, определять число атомов каждого элемента по формуле. Такие упражнения готовят учащимся к составлению и объяснению химических уравнений.Рассматривая формулы оснований, кислот и солей, учащиеся дают более содержательные ответы. Кроме характеристики качественного и количественного состава молекул учащиеся указывают также число гидроксильных групп или кислотных остатков и их валентность, заряды ионов, растворимость данного вещества в воде, приводят уравнения электролитической диссоциации и т.д.
Подробная характеристика уравнений реакций требует от учащихся еще больших усилий, сосредоточения ранее полученных знаний при выполнении упражнений, подобных приведенным выше. Учащиеся указывают тип химической реакции, названия взаимодействующих и образующихся в результате реакции веществ, их качественный состав, условия протекания реакции.
Например, рассматривая уравнение реакции между металлическим натрием и водой, учащиеся дают следующий комментарий: Уравнение реакции
2Na + 2H2 O = 2NaOH + H2
означает взаимодействие металлического натрия с водой. В результате реакции образуется щелочь, которую можно обнаружить при помощи индикатора. Кроме щелочи образуется водород, который можно обнаружить поджиганием.
Систематическое использование подобных заданий, этимологический анализ терминов и названий способствует созданию особого эмоционального фона, на котором возникает познавательная активность учащихся и интерес к химии как науке, более осознанному усвоению химического языка, повышению качества знаний учащихся. Работа со словарями, справочниками и другими источниками информации способствует развитию самостоятельности учащихся в добывании знаний.
В последнее время получает развитие новое направление развития творческой познавательной деятельности учащихся - разработка различных проектов, в том числе в рамках Интернет. На наш взгляд, темой одного из таких проектов по химии может быть создание учащимися сборника химических терминов и названий, связанных с каким-либо курсом химии, или областями применения химических знаний, различными профессиями.
Мы предлагаем учащимся восьмых классов готовить сообщения и рефераты о веществах, которые человек использует в быту, а учащиеся девятых классов составляют так называемые паспорта химических элементов. В обоих случаях в задания включается исторический материал и проводится этимологический разбор всех используемых терминов и названий, в частности, названий химических элементов и веществ, а также химических и физических явлений.
В заключение хочется отметить, что, реализуя в своей практике приведенные выше рекомендации по обучению учащихся, мы убедились в их положительном влиянии на качество знаний учащихся по химии, а также интерес учащихся к этому предмету и в целом на формирование их культуры.
Таким образом, можно сделать вывод, что химический язык вносит существенный вклад в реализацию развивающей функции обучения. Особенно велика его роль в развитии мышления учащихся и формировании их творческой деятельности, так как все операции с химическим языком являются умственными. Наиболее часто при оперировании химическим языком используются анализ, синтез, сравнение, абстрагирование и другие мыслительные операции.
Химический язык вносит важный вклад в реализацию воспитательной функции обучения. Он может использоваться как активное средство формирования научного мировоззрения учащихся, поскольку позволяет раскрыть многие мировоззренческие вопросы. Например, символически выраженная периодическая система химических элементов Д.И. Менделеева используется для подтверждения законов диалектики.
Список литературы
1. Аюпова С.В. Кто лучше знает и помнит определения? // Химия в школе. 2001. № 1.
2. Белова Т.А., Авдосенок Н.М. Интегрированный урок химии и русского языка // Химия в школе. 1997. № 6.
3. Бусев Л.И., Ефимов И.П. Определения, понятия, термины в химии. М.: Просвещение, 1972.
4. Выбо методов обучения в средней школе / Под ред. Ю.К. Бабанского. М.: педагогика, 1981.
5. Габдулхаков В.Ф. О работе над химическим языком в средних профтехучилищах // Химия в школе. 1987. № 6.
6. Грабецкий А.А., Назарова Т.С. Кабинет химии. М.: Издательство МарТ, 2001.
7. Гроссе Э., Вайсмантель Х. Химия для любознательных. Л., Химия, 1985.
8. Дрига И.И. Кабинетная система в общеобразовательной школе. М.: просвещение, 1981.
9. Дьякович С.В. Этимологический анализ при изучении химических терминов и названий // Химия в школе. 1971. № 3.
10. Дьякович С.В., Чагочкина Л. Изучение химических терминов и названий на уроках химии / Некоторые вопросы химии и методики ее преподавания: Научные труды НГПИ. Вып.37. Новосибирск, 1969.
11. Зазнобина Л.С. Экранные пособия на уроках химии. М.: ЮНИТИ-ДАНА, 2003.
12. Зырянова О.И. Химический диктант как средство закрепления основных химических понятий // Химия в школе. 1978. № 1.
13. Иванова Р.Г., Черкасова А.М. Уроки химии в 7-8 классах. М.: просвещение, 1982.
14. Казеннова Н.Б. Краткие правила номенклатуры органических соединений // Химия в школе. 1996. № 4.
15. Канделаки Т.Л. Проблемы языка науки и техники. М.: Наука, 1970.
16. Кацнельсон Д. Содержание слова, значения и обозначения. М.: Наука, 1965.
17. Котляр М.М. Как использовать знание иностранного языка при обучении химии // Химия в школе. 2001. № 3.
18. Котлярова О.С. Учет знаний по химии. М.: Наука, 2001.
19. Кузнецова Н.Е. О методическом аспекте номенклатуры неорганических веществ // Химия в школе. 1978. № 2.
20. Кузнецова Н.Е. О проблеме химического языка в школьном курсе химии в средней школе. М.: Педагогика, 1973.
21. Кузнецова Н.Е., Владыкина Л.В. Химический язык в школе. Вологда, 1980.
22. Кузнецова Н.Е., Шорова Ж.И. Изучние химического языка на первом этапе обучения // Химия в школе. 1981. № 5.
23. Лидин Р.А. Современный химический язык. 1. Неорганическая номенклатура - формулы и названия веществ // Химия. Методика преподавания в школе. 2002. № 2.
24. Назарова Т.С., Грабецкий А.А., Алексинский В.Н. Организация работы лаборанта в школьном кабинете химии. М.: просвещение, 1984.
25. Некрасов Б.В. Рациональная номенклатура неорганических соединений. М., 1965.
26. Общая методика обучения химии / Под ред. Л.А. Цветкова. Ч. 1 и 2. М.: Просвещение, 1983.
27. Ожегов С.И. Словарь русского языка. М.: Советская энциклопедия, 1973.
28. Парменов К.Я. История открытия химических элементов и происхождение названий их // Биология, химия в средней школе: Методический сборник № 1. М.: Учпедгиз, 1935.
29. Плетнер Ю.В., Полосин В.С. Практикум по методике преподавания химии. М.: Юнити, 2006.
30. Прокопенко В.Г., Дайнеко В.И. О некоторых терминах и понятиях // Химия в школе, 1987. № 4.
31. Пронина И.В. Изучение трудных слов с применением этимологического анализа. М.: Просвещение, 1964.
32. Рысс В.Л. Контроль знаний учащихся. М.: педагогика, 2003.
33. Словарь иностранных слов. - 14-е изд., испр. - М.: Рус.яз., 1987.
34. Соловьев Ю.И. История химии. М.: Просвещение, 1976.
35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005.
36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2.
37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970.
38. Цветков Л.А. Преподавание органической химии в средней школе. М.: ЮНИТИ-ДАНА, 2005.
39. Шаповаленко С.Г. Методика обучения химии. М.: Приор, 2003.
40. Шилов В.И. К вопросу о правильном произношении и написании некоторых химических терминов // Химия в школе. 1988. № 5.
Приложение 1
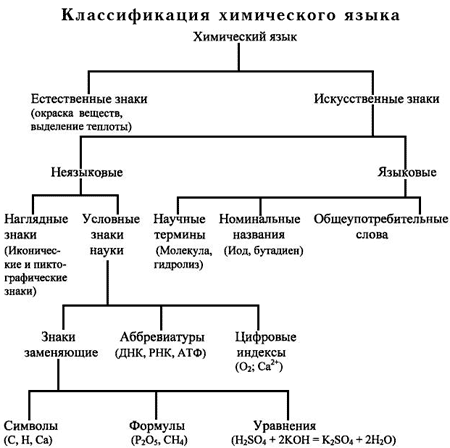
Приложение 2
Названия приставок латинских и греческих числительных в сложных словообразованиях
| Цифры | Числительные количественные | Числительные порядковые | |||
| Латинские | Греческие | Русские | Латинские | Греческие | |
| 1 | Уни- | Моно- | Первый | Прим- | Прото- |
| 2 | Ду-, би- | Ди- | Второй | Секунд- | Дейтеро- |
| 3 | Три- | Три- | Третий | Терци- | Трито- |
| 4 | Квадр- | Тетра- | Четвертый | Кварт- | |
| 5 | Квикв- | Пента- | Пятый | Квинт- | |
| 6 | Секс- | Гекса- | Шестой | Секст- | |
| 7 | Септ- | Гепта- | Седьмой | Септим- | |
| 8 | Окто- | Окта- | Восьмой дважды | Бис- | Дис- |
| 9 | Нона- | Эна- (нона-) | Девятый, трижды | Тер- | Трис- |
| 10 | Деци- | Дека- | Десятый, много | Полиамфо- | |
Приложение 3
Иностранные элементы терминов и названий, встречающиеся в курсе химии средней школы
| Приставка | Значение | Пример |
| Абразио- | Лат,соскабливание | Абразив |
| Аггломераре- | Лат. присоединение | Агломерация, агломерат |
| Агро- | Гр. поле | Агрохимия, агрономия |
| Актино- | Гр. луч | Актиний |
| Аллос- | Гр. другой | Аллотропия |
| Анти- | Гр. против | Антифриз |
| Ацет- | Лат. уксус | Ацетат |
| Бари- | Гр. тяжелый | Барий |
| Бромос- | Гр. зловонный | Бром |
| Валентиа- | Лат. сила | Валентность |
| Гало- | Гр. соль | Галоид, галоген |
| Ген(о)- | Гр. родить | Галоген |
| Гигро- | Гр. влажный | гигроскопичность |
| Гидр- | Гр. вода | Гидролиз, гидратация |
| Диссоциацио- | Лат. распад | Диссоциация |
| Декстер- | Лат, правый | Декстрины |
| Из- (изос-) | Гр. равный | Пзотоп, изомер |
| Карбон- | Гр. | Карбонат,карбид |
| Катализис- | Гр. растворение | Катализатор |
| Крекинг | Англ, расщепление | Крекинг |
| Лиз- | Гр. растворение | Диализ, электролиз |
| Макро- | Гр. крупный | Макромолекула |
| Микро- | Гр. малый | Микромир |
| Молес | Лат. масса | Молекула |
| Нитро- | Гр. азот | Нитрат |
| Поли- | Гр. много | Полимер |
| Экзо- | Гр. вне, снаружи | Экзотермический |
| Эндо- | Гр. внутри | Эндотермический |
Приложение 4
Словарь химических иностранных терминов
Химия
Слово звучит сходно почти во всех европейских языках. Несомненно его арабское происхождение (al-kimiya), в арабский же оно попало из греческого, где означало (естественно, без арабского артикля — а с артиклем оно досталось алхимии) чёрную магию из Египта. Сами египтяне словом kem называли чёрную плодородную землю, обнажающуюся после разлива Нила, а свою страну звали kemeia. Таким образом, получается, что химия — это египетская наука.
Реакция
Этимология этого слова достаточно прозрачна на латыни re — против, actio — действие. Получаем противодействие. В политическом значении (в смысле противодействия прогрессу — реакционер, реакционный) это слово появилось в русском языке в 40-х годах XIX века. В биологии оно означает отклик на раздражитель. Д.И. Менделеев в 1868 году писал, что реагировать означает изменяться химически, в каком-то смысле это также отклик системы на внешнее воздействие (хотя бы на смешение реагентов).
Анализ,синтез
По-гречески analysis — разложение, расчленение. Чтобы проанализировать вещество, химики разлагали его на составные части. Соответственно слово синтез — от греческого synthesis — соединение, сочетание, составление. Смысл для химика очевиден.
Валентность
В современном итальянском языке от этого древнего корня образовано слово valoroso — мужественный, храбрый. Попало оно и в другие европейские языки. По-английски valid — действительный, имеющий силу, по-французски valide — крепкий, здоровый, по-немецки Valoren — ценные бумаги и т. д. Отсюда недалеко и до валюты (сильной денежной единицы) — слова того же корня. Так от валентности мы добрались до валюты.
Газ
Это слово звучит очень похоже на всех языках (даже на хинди, турецком и арабском). Придумал его в XVII веке голландский естествоиспытатель Ян Баптист ван Гельмонт, взяв из латинского (chaos), в который оно пришло из греческого. Греки словом chaos (хаос) называли пустое туманное пространство, существовавшее до мироздания.
Дистилляция
Латинская приставка dis означает разделение, отделение; stilla — капля. То есть дистилляция — это капельное разделение. Действительно, при правильной перегонке конденсирующиеся пары стекают каплями.
Изотоп и изомер
По-гречески isos — равный, одинаковый, подобный; topos — место, meros — доля, часть. Таким образом изотопы — занимающие одно и то же место (в Периодической таблице элементов); изомеры — состоящие из равных частей, то есть имеющие одинаковую брутто-формулу.
Ингибитор, катализатор, фермент, энзим
Первый термин происходит от латинского inhibere — сдерживать, останавливать. Ингибиторы, в отличие от катализаторов, замедляют или прекращают химические реакции. Слово же катализатор — греческого происхождения.
Калория, термометр, термодинамика, кинетика
Этимология этих слов прозрачна. Calor на латыни — тепло, therme — тоже тепло, только по-гречески. Dynamis — греческое слово, означающее силу, мощь; корень этот легко найти во многих словах: динамит, динамо-машина, динамизм, динамометр. Близкое значение в ряде случаев имеет и слово кинетика (греч. kinetikos — приводящий в движение). Например, химическую кинетику можно рассматривать как часть химической динамики. Примечание — часто калориметрию путают с колориметрией. Значительно чаще, чем тепло путают со светом.
Квант
В латинско-русском словаре для слова quant приводятся разные значения: во-первых, сколько, как много, насколько, а во-вторых, как мало. Надо полагать, что, когда Макс Планк выдвинул в 1900 году новую идею, предположив, что энергия, как и материя, состоит из отдельных мельчайших порций, он имел в виду именно второе значение этого слова.
Коллоид, коллодий, клей, гель, агар-агар, желатин, золь, аэрозоль, суспензия, эмульсия, диализ, мембрана
Все эти термины встречаются в коллоидной химии. Если выпаривать водные растворы некоторых веществ, то вместо кристаллов образуется аморфная масса, похожая на студень. Чаще всего такие свойства проявляли вещества оранического происхождения, нередко их растворы обладали клеющими свойствами. Английский химик Томас Грэм (1805–1869), изучавший такие растворы, дал им название коллоидных — от греческих kolla — клей (kollodes — клейкий) и eidos — вид. Когда хозяйка варит свиные ножки для получения студня, она готовит коллоидный раствор желатина. Столярный клей — ещё один пример коллоидного раствора. К коллоидным растворам относятся также молоко, маргарин и другие молочные продукты, тушь, различные краски и многое другое. Того же происхождения и слово коллодий — спиртово-эфирный раствор нитроцеллюлозы, дающий после высыхания тонкую пленку.
По-голландски klei — вовсе не клей, а глина, ведь она тоже клейкая. Отсюда и английское clay — глина. Учитывая, что по-украински глей — это клей, следует признать, что клей и глина — почти однокоренные слова; во всяком случае, они имеют одинаковое происхождение.
Конверсия
В химии это слово часто используют в сочетании степень конверсии, то есть степень превращения исходного вещества. Происходит оно от латинского conversio — превращение, изменение. Здесь просматривается приставка con — с и глагол verso — вращать, приводить в движение, изменять.
Концентрация
На латыни centrum — центр, средоточие. Вместе с приставкой con получаем скопление,сосредоточение (сил, средств). Концентрические — с общим центром. В химии же слово концентрация приобрело специфическое значение — относительное содержание составной части в растворе.
Криоскопия, эбуллиоскопия, осмос
Все эти методы раньше широко использовались для определения молекулярной массы веществ. По-гречески kryos — холод, мороз, лёд. Отсюда криогенный — низкотемпературный, минерал криолит, похожий на лёд, прибор криостат (греч. states — стоящий), криотерапия — лечение холодом. Skopeo по-гречески — смотрю, наблюдаю. Ebullire — латинский термин, означает выкипать, эбуллиоскопия — метод, основанный на повышении температуры кипения растворов. Osmos по-гречески — толчок, давление.
Нейтрализация
Этот международный термин происходит от латинского uter — кто-то из двух; либо тот, либо другой. Соответственно neuter — ни один из обоих, ни тот, ни другой, средний (genus neutrum — средний род в грамматике).
Неорганические соединения
Амальгама
Слово восходит к греческим malassein — смягчать, malagma — смягчающий. Действительно, ртуть делает мягкими металлы, с которыми она образует сплавы — амальгамы. Отсюда и английское malleable, одно из значений которого — податливый, уступчивый.
Аммиак, аммоний, амины, аммины
Эти термины имеют общее и несколько неожиданное происхождение. Храм древнеегипетского бога Амона отапливали верблюжьим кизяком, который содержит азотистые соединения. В результате на стенах храма отлагались блестящие игловидные кристаллики — sal ammoniac, аммонова соль (NH4 Cl). Газ, который английский химик Джозеф Пристли выделил из этой соли в 1772 году, получил название аммониака (в русском языке его сократили до аммиака). Замещение атомов водорода в аммиаке на органические радикалы приводит к образованию аминов. А неорганические комплексы аммиака называются амминами.
Берлинская лазурь, турнбулева синь
Полагают, что берлинская лазурь была впервые получена в начале XVIII веке в Берлине красильным мастером Дизбахом. Она образуется при взаимодействии солей железа(III) с гексацианоферратом(II) калия. Турнбулева синь получается в реакции солей железа(II) с гексацианоферратом(III) калия.
Каломель, сулема
Название хлорида ртути(I) происходит от греческих слов kalo — красивый (отсюда же и каллиграфия) и melas — чёрный (загар создается чёрно-коричневым пигментом меланином, а меланхолия в переводе — чёрная желчь). Но ведь каломель белого цвета! Однако раньше её получали совместной возгонкой тёмной смеси мелкораздробленной ртути и сулемы — хлорида ртути(II). Кстати, и слово сулема связано с возгонкой и происходит от латинского sublimatum — добытое возгонкой, старое английское название сулемы — corrosive sublimate (едкий сублимат). В старину сулему получали растворением ртути в крепкой серной кислоте и последующим нагреванием образовавшегося сульфата с поваренной солью HgSO4 + 2NaCl = HgCl2 + Na2SO4. Сулема кипит при очень низкой для неорганических солей температуре — 302°С
Каустик
Это в значительной степени устаревшее название едкого натра (каустической соды) происходит от греческого слова kaustikos — жгучий, едкий.
Агат
Греки словом Achates называли реку в Сицилии, на берегах которой, согласно Естественной истории Плиния, был впервые найден твёрдый слоистый камень агат.
Аквамарин
Здесь все просто aqua marina на латыни — морская вода. Этот камень имеет синевато-зелёную или голубую окраску.
Алебастр, гипс
Греки называли белый минерал, полуводный сульфат кальция, alabastros, термин, вероятно, египетского происхождения. Слово гипс происходит из семитских языков, так, в древнееврейском он назывался gephes, по-арабски — jibs. Во многих европейских языках гипс как минерал и гипс, используемый скульпторами и медиками, называются по-разному (например, в английском — gypsum и plaster).
Алмаз, бриллиант
По-гречески damasma — покорение, укрощение, damao — сокрушаю, соответственно adamas — несокрушимый (интересно, что и по-арабски аль-мас — твердейший, самый твёрдый). В древности этому камню приписывали чудесные свойства, например такое если между молотом и наковальней положить кристаллик алмаза, то скорее они разлетятся вдребезги, чем повредится царь камней.
Аметист
В древности драгоценные камни наделяли магическими свойствами (некоторые верят в это и сейчас). Так, полагали, что красивые фиолетовые камни предохраняют от опьянения, особенно если из этого камня сделан кубок для питья. Кроме того, считали, что вино надо разводить водой до цвета аметиста. По-гречески methy — вино, и вместе с отрицательной приставкой получилось amethystos — противодействующий опьянению.
Антрацит
По-гречески anthrax означает и уголь, и чёрный. А вот на латыни уголь (а также искра) — carbo, carbunculus — уменьшительное от carbo, то есть карбункул дословно — искорка, уголёк. Карбункулами в старину называли различные красные камни, и прежде всего — гранат.
Асбест, известь
По-гречески sbeno — гасить, тушить, с отрицательной приставкой а asbestos — негаснущий, неугасимый. В средние века так называли мифический камень, который, будучи подожжён, уже не мог быть погашен. Потом это название перешло к несгорающему минералу асбесту. От этого же корня произошло, оказывается, и уникальное (то есть отсутствующее в других славянских языках) слово известь — негашёный оксид кальция.
Берилл
Название восходит к городу Веллуру на юге Индии, недалеко от Мадраса, и пришло в европейские языки через греческий и затем латинский. А греческая буква бета в большинстве европейских языков передается звуком б, а в русском — звуком в (ср. Babilon — Вавилон, bismut — висмут, Basil — Василий, barbar — варвар, Byzantium — Византия и т. д.).
Бирюза
Слово восходит к персидскому пируз — победоносный счастливый. Наиболее крупные месторождения бирюзы находятся в Иране.
Гранит и гранат
Название зернистого минерала произошло от латинского granum — зерно. Отсюда же старинная единица массы гран, основанная когда-то на массе пшеничного зерна, а также гранула, граната и драгоценный камень гранат.
Изумруд
Греческое название этого камня smaragdos пришло с Ближнего Востока, откуда произошло старинное название изумруда — смрагд, а затем, чтобы избежать идущих подряд согласных, — измарагд. Отсюда уже недалеко до изумруда.
Кварц
В русский язык слово попало из немецкого (Quarz), а оно вероятно, произошло от чешского горняцкого термина tvrz — твёрдая горная порода. Если это так, то мы имеем редкий случай, когда славянский корень пришёл в русский язык через посредство немецкого.
Кремень
Слово того же происхождения что и кремль кромка, крой (и закройщик), край. Все они восходят к индоевропейскому корню kre (kro) — резать, отделять Действительно древние люди резали кремневыми ножами, а кремль — отделённое (отрезанное) место.
Ляпис-лазурь (лазурит, алюмосиликатный минерал синего цвета)
Lapis на латыни — камень (в том числе драгоценный), лазурь — арабское слово, означающее синий цвет и синюю краску.
Мел
Слово того же происхождения, что и мелкий, молоть (мелю), и восходит к индоевропейскому корню mel — дробить, молоть. Этот минерал легко размалывается в мелкий, как мука, порошок (кстати, по-немецки Mehl — мука).
Сапфир
Прежде чем попасть к нам, это слово прошло долгий путь. Истоки названия этого камня — в древнеиндийском saniprija (которое до сих пор сохранилось в языке хинди). Далее через древнееврейский (sappir) оно попало в греческий (sappheiros), а уже из него — в европейские языки, например английский (sapphire).
Пирит, халькопирит, халькоген, галоген
Пирит FeS2 — минерал золотистого цвета. Его название (греч. pyr — огонь) связано со старинным способом высекать огонь, ударяя по камню железным бруском. Халькопирит CuFeS2 содержит медь (по-гречески — chalkos). От этого слова произошёл и термин халькоген — общее название серы, селена и теллура, в природе все эти элементы часто образуют соединения с медью, то есть из этих руд может родиться медь (от греч. genes — рождающийся, рождённый). Соответственно галоген — рождающий соль (соль по-гречески hals).
Рубин
Смысл этого слова очевиден, если сравнить его с русским рдеть, чешским rudy, немецким rot, английским red, французским rouge (Мулен-Руж — Красная мельница) и т. д. Все они восходят к латинскому rubens (rubidis) и древнеиндийскому rohita — красный. Отсюда и элемент рубидий, и слова руда и рыжий. А у Даля можно найти слова рудой в значении рыжий, и руда в значении кровь. То есть рубин, рыжий и рудник — дальние родственники.
Халцедон,колчедан
Оба слова восходят к названию греческого города Халкедона в Малой Азии, на берегу Босфора (похожее чередование к/ц/ч мы встречаем также в словах лик — лицо — личина).
Хризолит
Слово греческого происхождения chrysos — золото, lithos — камень. Хризолит (оливин) на самом деле вовсе не золотого, а зелёного цвета. Дело в том, что название хризолит на протяжении веков использовали для обозначения разных минералов. Например, так называли жёлтую разновидность хризоберилла, а также топаз и цитрин (жёлтый кварц).
Квасцы
Раньше этот термин относился только к алюмокалиевым квасцам. Их получали из природных минералов, из которых наиболее пригодным для этой цели был алунит. Природный алунит обычно находили в виде бесцветных кристаллов, которые римляне называли alumen (родительный падеж — aluminis).
Комплексы, лиганды
Complexus на латыни — связь, сочетание (а также любовь), то есть что-то комплексное состоит из нескольких связанных частей. Ligo — вязать, связывать (а также запрягать), отсюда не только лиганд, но и лига (в политике и музыке), лигатура (часть сплава, а также некоторые двойные буквы в западноевропейских языках). По числу центров связывания лиганды делятся на моно-, би-, три-, тетрадентатные, название происходит от латинского dens (dentis) — зуб. Отсюда и дантист — зубной врач.
Металлы и сплавы
Начнём с самого слова металл. Этот термин, присутствующий во всех европейских языках, произошёл от греческого металлон — шахта, рудник. Слово сталь происходит от древнегерманского stakh — быть твёрдым. От этого корня произошло и современное немецкое название Stahl, и голландское staal, и английское steel.
Баббит
Этот антифрикционный сплав получил название по имени американского изобретателя И. Баббитта.
Бронза, томпак
В названии бронзы лингвисты усматривают и персидское бириндж — жёлтая медь, и название итальянского города Бриндизи, порта на Адриатическом побережье, где в древности делали бронзовые зеркала. Не менее интересно и происхождение названия золотистого монетного сплава меди с цинком томпака: в Европе название сначала появилось у португальцев (tambaca), которые заимствовали его из своих колоний (в малайском языке tabmaga — медь), по-английски томпак и сейчас пишется tombac.
Нейзильбер, мельхиор, инвар
Сплав меди с цинком и никелем нейзильбер имеет серебристый цвет, отсюда и его название (Neusilber по-немецки — новое серебро). Название другого распространённого серебристого сплава меди с никелем, мельхиора, — это искажённое французское maillechort, от имени французских изобретателей Maillot(Майо) и Chorier(Шорье). В названии почти не удлиняющегося при нагревании сплава железа с никелем инвара (из него делают волоски часов) заключено основное его свойство на латыни invanabilis — неизменный.
Нашатырь
По-арабски nusadir — аммиак (нашатырь NH4 Cl — производное аммиака), из арабского через тюркские языки слово попало в русский.
Озон
Это слово придумал в 1840 году швейцарский химик Кристиан Шенбейн, хотя озон был открыт ещё в 1785 году. Название произведено от греческого ozon — пахнущий.
Оксид, пероксид, супероксид, гидроксид, гидроксил
По-гречески oxys — острый на вкус, жгучий, пряный. От этого корня произошли не только оксиды, но и оксалаты, оксидазы, оксидирование, оксидиметрия, оксиликвит, уксус и другие химические (и не только химические) термины. Вновь придуманные на основе древних языков слова гидроксид и гидроксил содержат также греческий корень hydor — вода.
Приложение 5
Игра Что? Где? Когда?
Подготовка к игре. Учащимся заранее даем задание сделать себе эмблему с номером 1, 2, 3 и т. д. (в зависимости от того, сколько игроков в команде), изготовить сову, волчок, скрипичный ключ, написать объявление о сроках и месте проведения игры.
Игру проводим в актовом зале, на стенах которого плакат Что? Где? Когда?, периодическая система, таблицы, схемы, диаграммы, рисунок или детская поделка совы и т. д. На сцене стол для знатоков, стол для демонстрации опытов, подготовлены реактивы и оборудование для опытов, стол с призами, магнитофон или проигрыватель, диски, пленка с записями марша, веселой музыки и т. д.
С одной стороны играют сборные команды по 5 человек - представители от каждого VIII класса (знатоки), с другой стороны — группа организаторов игры во главе с учителем. Организаторы игры готовят оформление зала, химический эксперимент, вопросы.
Ведущий. Мы начинаем игру Что? Где? Когда?. Прошу подняться на сцену представителей команд VIII классов, имеющих № 1. Сборные команды играют в составе (Ф. И. О.). Звучит музыка (марш).
Правила игры.
1. Соревнование проводится до 8 побед у одной из сторон.
2. Каждая сборная команда может продолжить игру до 3 побед подряд. В случае поражения игру продолжает команда в другом составе и т. д.
3. На обдумывание дается минута. Если команда за это время не справляется, то дается еще одна минута для совета и помощи со стороны своего класса. Если команда после этого дает правильный ответ, то организаторам записывается поражение, а продолжает игру уже другая сборная команда (№ 3 или № 4...).
4. При ответах можно пользоваться таблицами и схемами, находящимися в аале.
5. За подсказку, нарушение дисциплины из зала удаляются болельщики или запасные игроки.
6. При задержке ответа знатокам записывают поражение.
7. Конверт с вопросами выбирается с помощью волчка или по любой детской считалочке.
8. При пропадании стрелки на ключ соль проводится музыкальная пауза или исполняется номер художественной самодеятельности, а если на колбу, стоящую в едином круге с конвертами и музыкальным ключом, то исполняется эффектный занимательный опыт.
ВОПРОСЫ И ОТВЕТЫ К ИГРЕ ЧТО? ГДЕ? КОГДА?
1. Какое холодное масло, будучи влито в холодную воду, делает ее горячей? (Купоросное масло — серная кислота и олеум.)
2. В каких змеях много ртути? (Фараоновых — роданид ртути (//).)
3. Какой химический элемент был открыт раньше на Солнце, а потом уже на Земле? (Гелий.)
4. Какой элемент носит имя древнегреческого сказочного героя? (Тантал.)
5. Какой элемент называют по имени одной части света? (Европий.)
6. Какие простые вещества находятся при обычных условиях в жидком состоянии? (Бром, ртуть.)
7. Название какого элемента состоит из названий двух млекопитающих животных? (Мышьяк.)
8. Твердое водородное соединение в огне не горит и в воде не тонет, не окисляется ни концентрированной серной, ни азотной кислотами. При соединении его с бесцветным соединением меди (II) образуется окрашенное вещество. О каком водородном соединении идет речь? (Лед—вода.)
9. Как обуглить дерево без огня? (Серной кислотой, конц.)
10. Какую синюю бумагу и как можно моментально окрасить в красный цвет? (Лакмусовую бумагу — кислотой.)
11. Как, при каких условиях можно сжечь спичкой стальную иглу или перо? (В атмосфере кислорода.)
12. Как получить воду из огня? (При горении водорода.)
13. Какая вода мутится от дыхания? (Известковая вода.)
14. В какой воде лучше растворяется поваренная соль — в холодной или горячей? (Одинаково, так как ее растворимость незначительно возрастает при нагревании.)
15. Как разрезать стальную плиту, не дотрагиваясь до нее твердым предметом? (Газовая резка металлов с помощью смеси кислорода с горючим газом: ацетиленом или водородом.)
16. Какую жидкость можно заставить моментально застыть, причем она не только не охладится, но даже нагреется? (Пересыщенный раствор, например, гипосульфита.)
17. Как зажечь свечу или спиртовку без огня? (С помощью сильного окислителя — белого фосфора или смеси перманганата калия и конц. серной кислоты.)
18. Какой русский химик был знаменитым музыкантом? (А. П. Бородин, 1833—1887.)
19. Какой русский химик и когда организовал первую в России химическую лабораторию? (М. В. Ломоносов в 1748 г.)
20. Проявите надпись и объясните, с помощью какого вещества она сделана. (Разб. серной кислотой.)
21. Как очистить яйцо, не разбивая скорлупы? (Опустив в раствор разб. кислоты.)
22. Какие элементы наиболее распространены в космосе? (Водород и гелий.)
23. Какой химик впервые открыл закон сохранения массы вещества? Как он его сформулировал? (М. В. Ломоносов: Все перемены, в натуре случающиеся, такого суть состояния, что сколько у одного тела отнимется, столько присовокупляется к другому. Так, ежели где убудет несколько материй, то умножится в другом месте.)
24. В каком платье можно загорать? (Ацетатном, так как ацетатный шелк пропускает ультрафиолетовые лучи, или из стекловолокна.)
Ответы на вопросы 9, 10, 11, 12, 20, 21 можно подтверждать практически.
Для экспериментальных пауз можно предложить следующие опыты: безртутные фараоновы змеи, светящаяся пробирка, вулкан, бенгальские огни, зажигание костра водой, тушение горящего магния водой, взрыв гремучей смеси, проявление тайнописи, огнедышащий дракон.
Игра завершается подведением итогов (заключительное слово учителя) и награждением команды-победительницы и всех участников. Призами могут быть поделки учащихся из кружка умелые руки, торты, печенье, испеченные самими организаторами (или их родителями), веселые номера художественной самодеятельности.
Викторины могут проводиться под самым различным названием, содержание каждой из них может решать свои определенные задачи. Например, викторина Кто? Как? Когда? предполагает раскрыть, кто, как и когда открыл элемент, закон, химическое соединение, свойство вещества; Что? С чем? Почему? — строится на системе вопросов о веществе (классе веществ), с чем оно реагирует и с объяснением, почему возможно данное взаимодействие; Где? Какие? Кем? — задаются вопросы о том, где в природе, какие полезные ископаемые, минералы и кем найдены; Что? Где? На основе чего? — вопросы о применении химии в технике, науке, производстве, быту и т. д.; Кем? Какие? В честь кого? — названия элементов, веществ, минералов (в честь планет, стран, континентов, ученых и т. д.).