Методические рекомендации для проведения семинарских и лабораторных занятий по органической химии со студентами химико-биологического факультета Авт сост.: Т. А. Шатунова
СОДЕРЖАНИЕ: Методические рекомендации предназначены для студентов химико-биологического факультета, изучающих органическую химию. Они содержат перечень теоретических вопросов, упражнений и задач для проведения семинарских занятий, описание методик проведения лабораторных опытов по изучаемым темам, задания для самостоятельной работы студентов и список необходимой литературыМИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
НИЖНЕТАГИЛЬСКАЯ ГОСУДАРСТВЕННАЯ СОЦИАЛЬНО-ПЕДАГОГЧЕСКАЯ АКАДЕМИЯ
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
Методические рекомендации для проведения семинарских и лабораторных занятий по органической химии со студентами химико-биологического факультета
Авт.-сост.: Т.А. Шатунова
Нижний Тагил
2004
Печатается по решению кафедры химии и МПХ НТГСПА (протокол № от )
Т.А. Шатунова. Функциональные соединения: Методические рекомендации для проведения семинарских и лабораторных работ по органической химии со студентами химико-биологического факультета.
Нижний Тагил, 2004. с.
Рецензенты: И.Г. Белавина, канд. хим. наук, профессор каф. химии и
МПХ НТГСПА;
В.С. Пятыгина, ст. преподаватель каф. биологии НТГСПА.
Настоящие методические рекомендации предназначены для студентов химико-биологического факультета, изучающих органическую химию. Они содержат перечень теоретических вопросов, упражнений и задач для проведения семинарских занятий, описание методик проведения лабораторных опытов по изучаемым темам, задания для самостоятельной работы студентов и список необходимой литературы.
Нижнетагильская государственная
социально-педагогическая академия, 2003
Производные карбоновых кислот
1. Теоретические вопросы
Функциональные производные карбоновых кислот: сложные эфиры, галогенангидриды, ангидриды, амиды. Методы их получения и свойства. Механизм реакции этерификации. Электронное строение амидов, влияние р-p сопряжения на основные свойства. Механизм кислотного и щелочного омыления сложных эфиров.
2. Упражнения
1. Составьте структурные формулы следующих соединений: а) этилового эфира муравьиной кислоты, б) метилового эфира пропионовой кислоты, в) метилацетата, г) метилформиата, д) бутилацетата, е) ацетилхлорида, ж) пропионилбромида, з) хлорангидрида изомасляной кислоты, и) уксуснопропионового ангидрида, к) формамида, л) втор.валерамида.
2. Дайте названия следующим соединениям: а) СН3 – СО – О – СО – СН3 , б) СН3 СН2 СОNН2 , в) СН3 СООNа, г) СН3 ССН2 СОСl, д) СН3 – СН – СООСН3 .
СН3
3. Напишите структурные формулы изомерных сложных эфиров, имеющих состав:С4 Н8 О2 (четыре изомера), С5 Н10 О2 ( девять изомеров).
4. Напишите структурные формулы сложных эфиров, изомерных по составу валериановой кислоте.
5. Напишите уравнения реакции этерификации пропионовой кислоты метиловым спиртом. Разберите её механизм.
6. Напишите уравнения реакции получения из бромистого пропила и неорганических соединений изопропилового эфира изомасляной кислоты.
7. Получите этилацетат, используя в качестве исходного вещества ацетилен.
8. Получите этиловый эфир уксусной кислоты по реакции Тищенко из уксусного альдегида. Объясните механизм данной реакции.
9. Объясните следующие факты: а) этерификация большинства карбоновых кислот практически не идет без добавления сильной минеральной кислоты; б) высокая концентрация минеральной кислоты производит «антикаталитический» эффект – скорость этерификации резко снижается.
10. Для метилпропионата напишите следующие уравнения реакций: а) гидролиза, б) алкоголиза (пропиловым спиртом), в) аммонолиза. Укажите условия их осуществления.
11. Какие вещества можно получить при взаимодействии этилбутирата со следующими веществами: а) водным раствором серной кислоты, б) водным раствором гидроксида натрия, в) пропилмагний иодидом, г) водным раствором аммиака, д) изопропиловым спиртом.
12. Рассмотрите механизм кислотного гидролиза метилпропионата.
13. Напишите структурные формулы следующих соединений: а) ацетилхлорида, б) пропионилбромида, в) хлорангидрида изомасляной кислоты, г) уксуснопропионового ангидрида, д) масляновалерианового ангидрида.
14. Из уксусной кислоты всеми известными способами получите хлористый ацетил.
15. Из этилена получите бромангидрид a-бромпропионовой кислоты.
16. Получите ангидрид пропионовой кислоты: а) из пропионовой кислоты, б) из пропионата натрия.
17. Из ацетилена и неорганических реагентов получите уксуснопропионовый ангидрид.
18. Путем каких реакций можно осуществить превращение 3-метил-1-бутена в хлорангидрид 2,2-диметилбутановой кислоты.
19. Сравните ацилирующую способность хлорангидрида, ангидрида и пропионовой кислоты.
20. Напишите уравнения реакций пропионового ангидрида: а) с водой, б) с этиловым спиртом, в) с аммиаком, г) с этиламином. Назовите полученные соединения.
21. Какое соединение получится в результате следующих превращений:
SOCl2 2CH3 MgI H2 O
CН3 – СН2 – СООН ® А ® В ® С
(аб.эфир) Н+
22. Сравните механизмы нуклеофильного замещения на примере реакции гидролиза хлористого бутила и хлористого бутирила. Отметьте общее в этих механизмах.
23. Напишите структурные формулы: а) формамида, б) ацетамида, в) пропиониламида, г) амида изомасляной кислоты.
24. Из ацетилена и неорганических реагентов получите ацетамид.
25. Получите ацетамид: а) ацилированием аммиака, б) из аммонийной соли карбоновой кислоты, в) из нитрила.
26. Напишите уравнения реакции, лежащие в основе получения амида изомасляной кислоты из пропилена.
27. Предложите способ получения ацетамида из ацетилена и диметиламина.
28. Рассмотрите строение молекулы ацетамида. Объясните причину амфотерных свойств амидов карбоновых кислот.
29. Расположите следующие соединения в порядке возрастания их основных свойств: а) метиламин, б) ацетамид, в) N-метилацетамид.
30. Напишите уравнения реакций взаимодействия амида валериановой кислоты: а) с водным раствором гидроксида калия при нагревании, б) с разбавленной серной кислотой, в) с азотистой кислотой.
31. Напишите формулы конечного и промежуточных продуктов в данной схеме многостадийного синтеза:
2[Н] SOCl2 Mg CO2 H2 O
CH3 – CH2 – CO – CH3 ® A ® B ® C ® D ® E
NH3 t° KOBr (аб.эфир) (аб.эфир) HCl
® F ® G ®H
32. Образец смеси метилацетата и метилформиата общей массой 15.52 г обработан при нагревании 68 мл раствора гидроксида бария с концентрацией 2.5 моль/л Избыток основания может прореагировать с 45.4 мл раствора хлорида меди (II) (массовая доля соли 13.5%, плотность раствора 1.1 г/мл) с образованием осадка. Вычислите массовые доли сложных эфиров в исходной смеси и объем оксида углерода (IV) (н. у.), который мог бы прореагировать с раствором, образующимся после нагревания исходной смеси со щелочью.
33. Для полного гидролиза 14.38 г смеси двух сложных эфиров потребовалось160 г 7% -ного раствора гидроксида калия. При добавлении к такой же массе смеси избытка аммиачного раствора оксида серебра выделилось 6.48 г осадка. Определите строение сложных эфиров и их мольные доли в исходной смеси.
34. При нагревании 25.8 г смеси этилового спирта и уксусной кислоты нагрели с несколькими каплями серной кислоты. Для нейтрализации полученной смеси веществ потребовалось 84 г 10% -ного раствора гидрокарбоната натрия. Какие вещества и в каком количестве содержались в смеси после реакции, если в реакцию вступило 80% исходной уксусной кислоты? (При расчетах не учитывать расход гидрокарбоната натрия, пошедшего на нейтрализацию серной кислоты).
Лабораторная работа «Производные карбоновых кислот»
Получение сложных эфиров
В сухую пробирку поместите 3 лопаточки порошка безводного ацетата натрия и 3 капли этанола. Добавьте 2 капли концентрированной серной кислоты и осторожно нагрейте над пламенем горелки (раствор может выплеснуться). Через несколько секунд появляется приятный освежающий запах.
Проделайте аналогичный опыт, взяв вместо этанола изоамиловый спирт. После нагревания смеси появляется характерный запах грушевой эссенции.
Вопросы и задания
1. Как называется реакция карбоновой кислоты со спиртом?
2. Напишите схемы реакций уксусной кислоты с этиловым и изоамиловым спиртами и назовите полученные продукты
3. Приведите механизм этих реакций и объясните роль концентрированной серной кислоты.
4. Задания для самостоятельной работы студентов
1. Напишите структурную формулу этилового эфира изомасляной кислоты и назовите его по международной номенклатуре.
2. Напишите уравнения реакций гидролиза соединений:
а) СН3 – СООС(СН3 )3 , б) NC – CH2 – COOC2 H5 , в) H2 NOC – CH2 – CH2 – CN,
г) CH3 – CH – CH2 – CONH2
СН3
3. Из бутилового спирта получите хлористый бутирил. Напишите уравнение реакции его с безводным ацетатом натрия.
4. Какие соединения получатся из бутановой кислоты при последовательном действии на нее тионилхлорида и аммиака?
5. Напишите схему получения метилпропионата, взяв в качестве одного из компонентов хлорангидрид соответствующей кислоты.
6. Как можно получить ангидрид валериановой кислоты? Напишите схему реакции.
7. Напишите схему кислотного гидролиза пропилового эфира муравьиной кислоты.
8. Напишите схему восстановления этилацетата.
9. Напишите схемы взаимодействия хлористого ацетила : а) с аммиаком, б) с этилатом натрия. Назовите продукты реакций.
10. Почему хлорангидриды карбоновых кислот – более энергичные ацилирующие реагенты, чем сами кислоты?
Непредельные и дикарбоновые кислоты
1. Теоретические вопросы
Номенклатура и изомерия непредельных кислот. Акриловая, кротоновая, метакриловая, винилуксусная кислоты. Геометрическая изормерия. Малеиновая и фумаровая кислоты. Химические свойства непредельных кислот.
Дикарбоновые кислоты. Гомологический ряд и номенклатура. Общие методы получения. Физические и химические свойства: константа диссоциации, отношение к нагреванию. Подвижность a-водородных атомов малоновой кислоты. Натриймалоновый эфир, его получение, свойства и применение в синтезах.
2. Упражнения
1. Напишите структурные формулы следующих соединений: а) акриловая кислота, б) кротоновая кислота, в) метакриловая кислота, г) аллилуксусная кислота, д) b-хлоркротоновая кислота, е) диметилмалеиновая кислота, ж) этилфумаровая кислота.
2. Составьте структурные формулы непредельных кислот состава С4 Н6 О2 , назовите их по правилам номенклатуры IUPAC. Для соответствующих кислот написать геометрические изомеры.
3. Напишите уравнения реакций получения метакриловой кислоты из ацетона и синильной кислоты.
4. С помощью каких реакций можно превратить этиловый спирт в кротоновую кислоту?
5. Напишите уравнения реакций получения метакриловой кислоты из изомасляной.
6. Синтезируйте непредельные кислоты путем карбоксилирования магнийорганических соединений, полученных из следующих веществ: а) хлористого аллила, б) 4-бром-1-бутена, в) 5- иод-4-метил-1-пентена.
7. Получите акриловую кислоту из: а) пропилового спирта, б) этилена (через этиленгидрохлорид).
8. Получите 3-бутеновую кислоту исходя из следующих веществ:
а) СН2 Вr – СНВr – СН2 – СООН, б) СН2 = СН – СН2 Вr.
9. Расположите в ряд по уменьшению кислотных свойств: а) пропионовую кислоту, б) винилуксусную кислоту, в) муравьинную кислоту, г) акриловую кислоту, д) 4-пентеновую кислоту.
10. Какие соединения образуются при взаимодействии акриловой кислоты с: а) Na2 CO3 , б) Br2 , в) НBr? Разберите механизм последней реакции. Какие соединения можно получить при окислении акриловой кислоты?
11. Напишите уравнения реакции присоединения брома к акриловой кислоте. Объясните почему бром присоединяется к a- и b-непредельным кислотам труднее, чем к этилену.
12. Какие вещества образуются при взаимодействии акриловой кислоты: а) с раствором перманганата калия в щелочной среде, б) с хромовой смесью при нагревании, в) с гидроксидом натрия.
13. Напишите уравнения реакций образования производных винилуксусной кислоты: а) калиевой соли, б) хлорангидрида, в) этилового эфира, д) амида.
14. Составьте схемы реакций: а) промышленного получения метилметакрилата, б) полимеризации метилметакрилата.
15. Установите строение кислоты С5 Н8 О2 , которая при энергичном окислении образует ацетон и щавелевую кислоту.
16. Непредельная кислота, имеющая формулу С4 Н6 О2 , при озонировании и последующем разложении озонида водой образует уксусный альдегид и гликолевую кислоту НООС – СНО. При энергичном окислении исследуемой кислоты образуется уксусная и щавелевая кислоты. Каково строение этой кислоты?
17. Составьте структурные формулы следующих дикарбоновых кислот:
а) метилмалоновая, б) метилянтарная, в) a-метилглутаровая, г) ангидрид янтарной кислоты, д) b-хлорадипиновая, е) моноэтиловый эфир щавелевой кислоты, ж) имид янтарной кислоты (сукцинимид), з) оксалат кальция, и) a, a-дибром-янтарная кислота.
18. Напишите структурные формулы предельных двухосновных кислот, содержащих шесть углеродных атомов.
19. Как, исходя из этилового спирта и необходимых неорганических веществ, получить: а) щавелевую кислоту, б) малоновую кислоту, в) метилмалоновую кислоту.
20. Как на основе пропионовой кислоты получить: а) метилмалоновую кислоту, б) этилмалоновую кислоту.
21. Адипиновую кислоту в технике получают исходя из фенола:
фенол ® циклогексанол ® циклогексанон ® адипиновая кислота.
22. Синтезируйте янтарную кислоту исходя из: а) этилена, б) акрилонитрила.
23. Объясните, какая кислота сильнее уксусная или щавелевая.
24. Как изменяется сила двухосновных кислот в гомологическом ряду? Расположите следующие кислоты в порядке уменьшения кислотных свойств: а) щавелевая, б) малоновая, в) янтарная, г) адипиновая.
25. Высокая подвижность водорода метиленовой группы в малоновой кислоте обеспечивает конденсацию её с альдегидами (в присутствии оснований). Объясните причину подвижности атомов водорода. Напишите уравнение реакции конденсации уксусного альдегида с 1 моль малоновой кислоты.
26. Напишите формулы промежуточных и конечного продукта в следующей схеме:
Br2 KOH HBr KCN 2H2 O нагрев.
а) СН3 – СH – СООН ® А ® В ® С ® D ® E ® F
H+
CH3
HBr KCN 2H2 O Br2 KCN 2H2 O
б) СН3 – СН = СН2 ® А ® В ® С ® D ® E ®F
H+ H+
27. С помощью каких реакций можно осуществить превращение малоновой кислоты в сукцинимид.
28. Какие соединения получатся при нагревании следующих кислот: а) щавелевой, б) малоновой, в) янтарной, г) метилмалоновой, д) глутаровой?
29. Получите натриймалоновый эфир. Рассмотрите его строение и химические свойства.
30. Напишите реакцию конденсации натриймалонового эфира с этиловым эфиром бромуксусной кислоты. полученное соединение подвергните гидролизу с последующем нагреванием.
31. Исходя из малонового эфира получите следующие кислоты: а) масляную кислоту, б) диметилуксусную кислоту, в) мтилэтилуксусную кислоту,
г) янтарную кислоту.
32. Напишите уравнения реакций получения фумаровой кислоты из бромянтарной кислоты.
33. Составьте уравнения реакции получения малеинового ангидрида. Объясните, почему фумаровая кислота не имеет соответствующего ей ангидрида
34. Как взаимодействуют фумаровая и малеиновая кислоты со следующими реагентами: а) водородом в присутствии Pt, б) хлороводородом, в) озоном, г) водой в присутствии серной кислоты.
35. Вещество, имеющее эмпирическую формулуС4 Н6 О4 обладает кислотными свойствами. При взаимодействии его с этиловым спиртом в присутствии хлороводорода получается новое вещество состава С8 Н14 О4 . Исследуемое вещество при нагревании выделяет оксид углерода (IV) и образует вещество состава С3 Н6 О2 , обладающее кислотными свойствами. Установите строение исследуемого вещества.
36. При обработке 20 г смеси олеиновой и пальмитиновой кислот избытком брома получено 13.26 г продукта бромирования. Каков состав исходной смеси?
37. Для каталитического гидрирования 250 г смеси олеиновой и стеариновой кислот потребовалось 16.8 л водорода. Каков состав исходной смеси и сколько стеариновой кислоты получилось после гидрирования смеси?
3. Лабораторная работа «Непредельные и дикарбоновые кислоты»
Обнаружение щавелевой кислоты
В пробирку поместите лопаточку щавелевой кислоты и прибавьте 3-4 капли воды до полного растворения. Пипеткой возьмите 1 каплю полученного раствора и нанесите на предметное стекло. добавьте к ней 1 каплю 5% -ного раствора хлорида кальция. Появляются кристаллы оксалата кальция. Предметное стекло поместите под микроскоп и рассмотрите форму кристаллов: они похожи на почтовые конверты.
С помощью стеклянной палочки разделите кристаллы на предметном стекле на две части. К одной части прибавьте 1 каплю уксусной кислоты, к другой – 1каплю 10 -й хлороводородной кислоты. В каком случае наблюдается растворение кристаллов оксалата кальция.
Вопросы и задания
1. Напишите схему реакции образования оксалата кальция.
2. Какая из кислот – уксусная или хлороводородная – разлагает оксалат кальция? Напишите схему реакции.
Окисление щавелевой кислоты
Поместите в первую пробирку 1 лопаточку щавелевой кислоты, добавьте 2 капли 2% -ного раствора перманганата калия и 1 каплю 10% -ного раствора серной кислоты. Отверстие пробирки закройте пробкой с газоотводной трубкой, конец которой опустите во вторую пробирку с баритовой водой. Нагрейте реакционную смесь в первой пробирке. Раствор перманганата калия, имеющий первоначально розовую окраску, при этом обесцвечивается, а во второй пробирке выпадает белый осадок.
Вопросы и задания
1. Напишите схему окисления щавелевой кислоты.
2. Образование какого газообразного продукта окисления щавелевой кислоты подтверждается с помощью баритовой воды? Напишите схему реакции.
Декарбоксилирование щавелевой кислоты
В сухую первую пробирку поместите лопаточку щавелевой кислоты, закройте пробкой с газоотводной трубкой, конец которой опустите во вторую пробирку с баритовой водой. Нагрейте первую пробирку до появления осадка во второй пробирке. Удалите конец газоотводной трубки из жидкости, подожгите у отверстия трубки выделяющийся газ. Он горит характерным голубым пламенем.
Вопросы и задания
1. Напишите схемы реакций, происходящих в первой пробирке.
2. Какой продукт разложения щавелевой кислоты доказывается с помощью пробы с баритовой водой?
3. Какой газ при поджигании горит голубым пламенем?
4. Задания для самостоятельной работы студентов
1. Напишите схему реакции олеиновой кислоты: а) с бромной водой,
б) с раствором перманганата калия.
2. Объясните, что такое цис-, транс- изомерия на примере кислоты
Н3 С – (СН2 )7 = СН(СН2 )7 – СООН. Назовите геометрические изомеры.
3. Напишите схему полимеризации метилметакрилата.
4. Какое соединение образуется при каталитическом гидрировании
( над никелем) олеиновой кислоты?
5. Объясните, почему двухосновные кислоты (особенно со сближенными карбоксильными группами) более сильные, чем одноосновные.
6. Каков промышленный способ получения щавелевой кислоты? Напишите схему реакции и назовите кислоту по международной номенклатуре.
7. По какой реакции можно отличить малоновую и янтарную кислоты?
8. Напишите схему получения диамида янтарной кислоты из соответствующей кислоты.
9. Напишите схему взаимодействия фумаровой кислоты с разбавленным раствором перманганата калия.
10. Каким образом можно синтезировать с помощью малонового эфира диметилуксусную кислоту?
11. Напишите схему получения имида янтарной кислоты.
12. Как различаются по поведению при нагревании малоновая и глутаровая кислоты?
13. Запишите схему в виде формул и проставьте над стрелками реагенты: бромянтарная кислота ® фумаровая кислота ® аммонийная соль фумаровой кислоты ® полный амд фумаровой кислоты.
Липиды
1. Теоретические вопросы
Общая характеристика класса липидов. Классификация липидов: простые липиды – жиры, воски и стериды; сложные липиды – фосфолипиды и гликолипиды. Фосфатидилглицерины. локализация липидов в клетке и их биологическое значение. Жиры, их состав, структура и свойства. Воски. их состав и строение. Биологическая роль восков. Стериды. Их состав, строение, физические и химические свойства. Фосфолипиды, структура их молекул, характеристика высших жирных кислот, азотистых оснований и многоатомных спиртов, входящих в их состав. Биологическая роль.
2. Упражнения
1. Чем отличаются по химическому строению жидкие жиры от твердых?
2. Напишите структурные формулы триглицеридов, образованных одним остатком пальмитиновой кислоты и двумя остатками олеиновой кислоты. Назовите данный триглицерид.
3. В состав свиного жира входят триглицериды: трипальмитин, триолеин, пальмитодиолеин, пальмитостериоолеин. Напишите формулы перечисленных триглицеридов.
4. В кокосовом и пальмовом маслах найдены: стеародипальмиьин, олеодипальмитин, миристодипальмитин и пальмитодимиристин. Напишите формулы перечисленных триглицеридов.
5. Напишите структурные формулы тригицеридов: а) тристеарин, б) трипальмитин, в) триолеин, г) олеодистеарин, д) стеародипальмитин.
6. Главные триглицериды хлопкового масла – пальмитодилинолеин, трилинолеин, пальмитоолеолинолеин. Составьте структурные формулы этих соединений.
7. Напишите уравнения реакций гидрирования стеародиолеина, олеодистеарина, пальмитоолеолинолеина. В каких условиях проводят эти реакции в промышленности? Какое применение находят гидрированные жиры?
8. Рассмотрите схемы гидролиза следующих триглицеридов: а) олеодипальмитина, б) пальмитодистеарина, в) пальмитоолеостеарина. Какие вещества называются мылами?
9. Иодные числа соответственно равны: для сливочного масла-30, для соевого масла-130, для конопляного масла-150. Что означают эти числа? Вычислите иодные числа: а) пальмитоолеолинолеина, б) стеародилинолеина, в) трилинолеина.
10. Жироподобные вещества (фосфатиды) – производные фосфатидной кислоты. Приведите в общем виде формулу последней.
11. При гидролизе фосфатидной кислоты были получены следующие вещества: а) глицерин, б) стеариновая кислота, в) олеиновая кислота, г) фосфорная кислота. Приведите все структурные формулы фосфатидной кислоты.
12. Составьте структурные формулы фосфатидов: а) лецитина (фосфатидилхолина) б) кефалина ( фосфатидилколамина).
13. Объясните различие в строении a- и b-лецитинов.Приведите схему гидролиза a- лецитина, учитывая, что это стадийный процесс.
14. Под влиянием змеиного яда от молекулы лецитина отщепляется непредельная кислота. Образуется лизолецитин, который обладает сильным гемолитическим действием, разрушает эритроциты крови. Какова схема образования лизолецитина?
15. При гидролизе 356 г жира образованного одной карбоновой кислотой образовалось 36,8г глицерина. Установите структурную формулу этого жира.
16. Сколько граммов жира, представляющего собой чистый триолеин, было взято, если для гидрирования образовавшейся в результате его гидролиза кислоты потребовалось 13,44 л водорода (н. у.).
17. Этерификацией 27,6 г глицерина смесью стеариновой и олеиновой кислот получено некоторое количество сложного эфира, входящего в состав жира. Сколько эфира было получено и какое количество олеиновой и стеариновой кислот вступило в реакцию, если для гидрирования всего полученного эфира потребовалось 13,44 л водорода?
18. При омылении жира и последующим подкислении было выделено три соединения А, Б, В. Соединение А дает ярко-синее окрашивание с гидроксидом меди (II).Соединение Б и В окрашивают лакмус в красный цвет. При обработке соединения Б избытком бромной воды, было получено дибромпроизводное, в молекуле которого содержится 36,2% брома. Соединение В имеет неразветвленную цепь углеродных атомов, не присоединяет бром и содержит в молекуле36,3% кислорода. Какое строение имеют соединения А, Б и В?
19.Из 2,704 кг пчелиного воска выделили один моль мирицилового эфира, пальмитиновой кислоты, что составляет 25% по массе. Напишите структурную формулу этого сложного эфира.
3. Лабораторная работа «Липиды»
Эмульгирование жиров
В две пробирки налить воду и по 20 капель подсолнечного масла. В первую пробирку внести 2 капли 10-ного раствора гидроксида калия. Содержимое обеих пробирок сильно взболтать, чтобы образовалась эмульсия жира в водном растворе. Пробирки поставить в штатив. Эмульсия в пробирке без щелочи быстро расслаивается. Во второй пробирке образуется стойкая эмульсия.
Вопросы и задания
1. Объясните полученный эффект.
Обнаружение двойных связей в молекуле жира
К 2-3 мл подсолнечного масла добавить около 1 мл бромной воды. Взболтать.
Вопросы и задания
1. Объясните, почему бромная вода обесцветилась. Напишите схему реакции.
4. Задания для самостоятельной работы студентов
1.Дайте определение, что такое жиры. Напишите формулу жира.
2. Напишите формулы пяти кислот, которые обычно входят в состав жиров и масел.
3. Напишите структурную формулу триглицерида, образованного одним остатком пальмитиновой и двумя остатками пальмитиновой кислоты.
4. Напишите схему получения пальмитодистеарина. Какой по консистенции будет жир?
5. Напишите схему гидролиза линоленодипальмитина в присутствии щелочи. Назовите полученные продукты.
6. Как можно получить натриевую соль стеариновой кислоты из жира?
7. Какие величины служат для химической характеристики жиров?
8. Напишите схему каталитического гидрирования триглицерида линоленовой кислоты. Назовите продукт реакции.
9. Напишите схему гидролиза трипальмитина с последующим действием соды. . Какую консистенцию имеет полученное мыло?
10. Напишите схему получения трилиноленоата. Почему некоторые растительные жиры используются в производстве лаков и красок?
Оксикарбоновые кислоты и оптическая изомерия
1. Теоретические вопросы
Изомерия и номенклатура оксикарбоновых кислот. a- и b-оксикарбоновые кислоты. Способы получения из карбонильных соединений через оксинитрилы, из галоген производных и аминокислот. Химические свойства оксикислот. Особые свойства оксикислот. Понятие о поляризованном свете и оптической активности. Устройство поляриметра. Асимметрический атом углерода. Оптические антиподы, рацемат. Конфигурация и знак вращения. Соединения с одним и несколькими асимметрическими центрами.
2. Упражнения
1. Напишите структурные формулы оксикислот и их производных: а) a-оксипропионовой кислоты, б) b-оксимасляной кислоты, в) яблочной кислоты, г) сегнетовой соли, д) оксалата кальция, е) пентанол-2-овой кислоты, ж) 2-метил-пропанол-2-овой кислоты, з) гидроксиэтановой кислоты.
2. Для оксикислот состава С5 Н10 О3 напишите структурные формулы и назовите их.
3. Какие из следующих соединений являются оптически активными:
а) СН3 – СНОН – СООН, б) СН3 – СОН – СООН, в) СН3 – СН2 – СН2 – СН2 ОН,
СН3
г) СН3 – СН – СНОН – СООН, д) СН3 – СН2 – СН2 ОН – СН3,
С2 Н5
е) НОСН2 – СНОН – СНО, ж) НООС – СН2 – СНBr – СООН,
з) НОСН2 – СН2 – СН2 – СООН, и) НООС – СНОН – СН2 – СООН.
Какой углеродный атом называется асимметрическим?
4. Сколько оптически активных форм возможно для следующих соединений: а) СН3 – СНОН – СН2 – СНО, б) СН3 – СН2 – СНОН – СООН,
в) СН3 – СНВr – СНВr – СН2 – СН3 , г) СН3 – СН2 – СН(СН3 ) – СН2 ОН.
Какие оптические изомеры называются антиподами?
5. Укажите, какие из перечисленных ниже соединений являются оптически недеятельными вследствие внутримолекулярной компенсации, а какие из них не имеют таких изомеров: а) НООС – СНСl – СНОН – СООН,
б) НООС – СНСl – СНСl – СООН, в) НООС – СНСl – СНСl – СНО,
г) СН2 ОН – СНОН – СНОН – СНО.
6. Приведите проекционные формулы стереоизомерных яблочных кислот:
D – (R) яблочной, L – (S) яблочной, D – (R) глицериновой, L – (S) глицериновой.
7. Винные кислоты относятся к двухосновным четырехатомным оксикислотам. Изобразите их проекционные формулы, определите число изомеров и укажите какие из них являются антиподами, а какие – диастериоизомерами? Что такое рацемат?
8. В молекулах хлоряблочных кислот, также как и в молекулах винных имеются два асимметрических атома углерода. Объясните: а) почему у хлоряблочных кислот четыре оптически деятельных изомера, а у винных кислот – только два; б) почему среди хлоряблочных кислот нет изомера подобно мезовинной кислоте?
9. Для формальдегида, метилпропаналя, метилбутанона и 4-метил-3-гекса-нона напишите уравнения реакций с синильной кислотой. Проведите гидролиз продуктов присоединения и назовите полученные вещества.
10. Получите циангидринным способом 2-гидроксм-3,3-диметилбутановую и 2-гидрокси-2,4-диметилпентановую кислоты. Для полученных соединений напишите реакции с НСl и NаОН.
11. Напишите структурные формулы промежуточных и конечного продуктов по следующей схеме:
Вr2 С2 Н5 ОН Zn СН3 – СН(СН3 ) – С(СН3 )=О
СН3 – СН2 – СООН ® А ® В ® С® D
Н+ эфир абс. эфир.
гидролиз
® Е
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) этилена в 3-гидроксипропановую кислоту, б) ацетилена в 2-гидрокси пропановую и 3-гидроксипропановую кислоты.
13. Как осуществить следующие превращения:
а) СН3 – СН = СН2 ® СН3 – СН(ОН) – СН2 – СООН,
б) СН3 – СН2 – СОСl ® СН3 – СН2 – СН(ОН) – СООН.
14. Расположите следующие кислоты: гликолевую, уксусную и хлоруксусную в ряд по возрастанию кислотных свойств. Дайте объяснения.
15. Получите из пропионовой кислоты молочную и напишите для последней реакции: а) с уксусным ангидридом, б) с хлоридом фосфора (V), в) с этиловым спиртом ( в присутствие конц. серной кислоты).
16. Предложите схему превращения этилового спирта в яблочную кислоту.
17. Предложите схему синтеза из этилена и неорганических соединений винной кислоты.
18. Какие соединения получатся при нагревании следующих кислот: а) 3-гидросипропановой, б) 2-гидроксибутановой, в) 4-гидрокстипентановой, г) 4-гидрокси-5-метилгексановой?
19. Из пропионового альдегида через продукт альдольной конденсации получите 3-гидрокси-2-метилпентановую кислоту.
20. Гидратацией соответствующей непредельной кислоты получите b-гидроксивалериановую кислоту. Для последней напишите уравнение реакции с NaOH, а для полученного соединения с н.-С4 Н9 Вr.
21. Напишите схему взаимодействия g-бутиролактона с водным раствором щелочи при нагревании. Что образуется при действии минеральной кислоты на полученное соединение?
22. Осуществите следующие превращение:
Cl2 HBr KCN (1моль) 2H2 O H2 O t°
CН3 – СН = СН2 ® А ® В ® С ® D ® Е ®
400° Н2 О2 t° Н+ ОН-
® лактон
23. Определите строение вещества, имеющего состав, С3 Н6 О3 . Оно обнаруживает кислотные свойства, при взаимодействии с этиловым спиртом образует вещество эмпирической формулы С5 Н10 О3 ,а с уксусной кислотой – С5 Н8 О4 . Это последнее при действие щелочи вновь образует исходное вещество. Если исследуемое соединение нагреть, то образуется новое соединение состава С6 Н8 О4 .
24. Определите строение вещества, имеющего состав С4 Н8 О3 . При взаимодействие с этиловым спиртом оно дает сложный эфир состава С6 Н12 О3 . Исследуемое вещество при нагревании выделяет воду и образует соединение состава С4 Н6 О2 . Это последнее обнаруживает кислую реакцию, присоединяет бром, а при окислении перманганатом калия дает уксусную и щавелевую кислот.
3. Лабораторная работа «Оксикислоты»
Получение и свойства винной кислоты
Гидротартрат и тартрат калия. В пробирку поместите по 2 капли 10% -ного раствора винной кислоты и 5% -ного раствора гидроксида калия. Пробирку энергично встряхните до появления кристаллического осадка гидротартрата калия. Содержимое пробирки разделите на две части. В первую пробирку добавьте 4 капли 5% -ного раствора гидроксида натрия. В обеих пробирках осадок постепенно растворяется с образованием в первой пробирке тартрата калия, во второй – двойной соли калия и натрия – сегнетовой соли (раствор сохраните).
Вопросы и задания
1. Напишите уравнения реакции образования гидротартрата калия.
2. Напишите уравнения реакции образования тартрата калия-натия.
3. Почему этот эксперимент можно использовать для доказательства наличия в молекуле винной кислоты двух карбоксильных групп?
Комплексная соль меди ( II). В две пробирки поместите по 2 капли 2% -ного раствора сульфата меди (II) и 10% -ного раствора гидроксида натрия. В первую пробирку к выпавшему голубому осадку гидроксида меди (II) добавьте несколько капель ранее полученного раствора сегнетовой соли до полного растворения осадка. Прозрачный раствор приобретает интенсивную синюю окраску. Нагрейте обе пробирки до кипения. Окраска раствора в первой пробирке при этом не изменится. Отметьте изменения, происходящие во второй пробирке.
Вопросы и задания
1. Объясните, почему разложение гидроксида меди (II) произошло только во второй пробирке.
2. Доказательством наличия какого структурного фрагмента в молекуле винной кислоты служит ее способность образовывать комплексную соль меди (II)?
Разложение молочной кислоты серной кислотой
В сухую пробирку поместите 2 капли молочной и 2 капли концентрированной серной кислоты. Нагрейте пробирку над пламенем горелки. Жидкость при этом темнеет и пенится с выделением газа. Подожгите газ у отверстия пробирки, пламя приобретает голубоватый оттенок.
Вопросы и задания
1. Какой химический процесс происходит при нагревании молочной кислоты с концентрированной серной кислотой? Напишите уравнение реакции.
4. Задания для самостоятельной работы студентов
1. Напишите проекционные формулы D- и L-глицериновой кислоты.
2. Напишите схему превращения a-оксимасляной кислоты в хлорангидрид a-хлормасляной кислоты.
3. Напишите проекционные формулы стереоизомеров a,d-диоксивалериановой кислоты. Отметьте в них асимметрические атомы углерода.
4. Какие пространственные изомеры называются антиподами?
5. Какие оптические изомеры называются диастериоизомерами?
6. Какие соединения, несмотря на наличие асимметрических атомов углерода, не обладают оптической активностью?
7. Какую оксикислоту можно получить из ацетона оксинитрильным синтезом. Напишите схему синтеза.
8. Напишите схему молочнокислого брожения.
9. Какие соединения образуются при разложении (в присутствии серной кислоты) a-оксикислот? Приведите схему реакции.
10. Дополните схему следующих превращений, укажите над стрелками реагенты: пропионовая кислота ® a-хлорпропионовая кислота ® 2-метоксипропановая.
Оксо- и аминокислоты
1. Теоретические вопросы
Альдегидо- и кетокислоты, методы получения и свойства. Глиоксиловя и пировиноградная кислоты. Ацетоуксусная кислота. Ацетоуксусный эфир и механизм его образования. Таутомерия – особый вид структурной изомерии. Выделение таутомерных форм. Кетонные и енольные реакции ацетоуксусного эфира. Кетонное и кислотное расщепление ацетоуксусного эфира. Применение ацетоуксусного эфира для синтеза кислот и кетонов.
Аминокислоты. Номенклатура, изомерия и оптическая активность a-аминокислот. Синтез аминокислот. Амфотерность и образование биполярных ионов. Химические свойства. Отношение a-,b- и g-аминокислот к нагреванию. Лактам-лактимная таутомерия.
2. Упражнения
1. Напишите структурные формулы следующих кислот: а) глиоксиловой, б) a-метилацетоуксусной, в) 3-оксогептановой, г) пировиноградной, д) g-кето-капроновой, е) 2-метил-4-оксопентановой, ж) 3,3-диметил-2-оксобутановой, з) 2,5-диметилгексанон-3-овой,и) 2-этилбутанон-3-овой.
3. Назовите следующие соединения:
а) СН3 – СО – СН2 – СООН, б) СН3 – СО – СН2 – СН2 – СООН,
в) СНО – СН2 – СООН, г) СН3 – СО – СН – СООН д) СН3 – СН – СО – СООН
СН3 СН3
3. Напишите структурные формулы изомерных альдегидо- и кетокислот состава С4 Н6 О3 .
4. Глиоксиловая кислота может быть получена: а) гидролизом дихлоруксусной, б) окислением этиленгликоля азотной кислотой, в) окислением гликолевой кислоты. Приведите уравнения этих реакций.
5. Напишите уравнения реакций получения пировиноградной кислоты из следующих соединений: а) СН3 – СН2 – СООН, б) СН3 – СН = СН2 ,
в) СН3 – СН2 – ОН.
6. Получите a-кетомасляную кислоту исходя из следующих соединений: а) пропионового альдегида, б) пропионовой кислоты.
7. Получите a-метил-b-кетомасляную кислоту из 3-хлорбутанона-2.
8. Расположите в порядке уменьшения кислотных свойств следующие кислоты: пропионовую, пировиноградную, ацетоуксусную. Ответ обоснруйте.
9. Приведите уравнения реакций, характеризующих глиоксиловую кислоту.
10. Рассмотрите на примере этилацетата механизм сложноэфирной конденсации по Кляйзену.
11. Составьте схему таутомерного кето-енольного превращения ацетоуксусного эфира. Объясните механизм этого превращения.
12. Напишите уравнения реакций взаимодействия ацетоуксусного эфира со следующими веществами: а) циановодородом, б) гидросульфитом натрия, в) гидроксиламином, г) ацетилхлоридом, д) бромом.
13. Приведите схемы реакций кетонного и кислотного расщепления:
а) ацетоуксусного эфира, б) пропилацетоуксусного эфира
14. Используя ацетоуксусный эфир синтезируйте следующие кетоны:
а) 2-пентанон, б) метилизопропилкетон, в) 3-метил-2-пентанон.
15. Используя ацетоуксусный эфир синтезируйте следующие кислоты:
а) масляную, б) диметилуксусную, в) глутаровую.
16. Установите строение соединения С5Н8О3, которое устойчиво к нагреванию, дает оксим, не реагирует с аммиачным раствором оксида серебра, а при восстановлении превращается в н.валериановую кислоту.
17. Напишите структурные формулы следующих соединений: а) глицин, б) аланин, в) b-метил-a-аминоизокапроновая кислота (изолейцин), г) серин,
д) аспаргиновая кислота, д) e-аминокапроновая кислота, е) 2,5-диаминогексановая кислота, ж) 2-амино-3-фенлпропановая кислота (фенилаланин).
18. Напишите структурные формулы аминокислот состава С4 Н9 О2 N и назовите их.
19. Действием аммиака на галогензамещенные кислоты получите следующие аминокислоты: а) аминоуксусную, б) a-аминовалериановую, в) изолейцин.
20. Какие аминокислоты можно получить взяв за исходное вещество:
а) ацетон, б) метилэтилкетон, в) диэтилкетон, г) пропионовый альдегид.
21. Напишите формулы веществ в следующей схеме:
а) НОСl KCN HBr NH3 2H2 O
CH2 = CH2 ® A ® B ® C ® D ® E
H+
б) NH2 OH H+ H2 O
циклогексанон ® А ® В ® С
перегруппировка
Бекмана
22. Предложите схемы следующих синтезов:
а) СН3 – СН2 – ОН ® глицин
б) СН2 = СН2 ® аланин
в) НС СН ® NН2 – СН2 – СН2 – СООН
23. Изобразите в виде внутренних солей следующие аминокислоты:
а) глицина, б) аланина, в) a-аминоглутаровой (глутаминовой). Разберите механизм образования внутренних солей.
24. Рассмотрите схему взаимодействия аланина со следующими веществами: а) соляной кислотой, б) аммиаком, в) гидроксидом калия, г) хлоридом фосфора (V), д) ацетилхлоридом, е) азотистой кислотой.
25. Какие вещества образуются при нагревании: а) a-аминомасляной,
б) b- аминовалериановой, в) g- аминокапроновой.
26. Напишите структурные формулы промежуточных и конечного веществ в следующих схемах:
а) HBr 2 NН3 НСl t°
СН2 = СН – СН2 – СООН ® А ® В ® С ® D
б) HBr KCN 4[Н]
СН3 – СН = СН – СООН ® А ® В ® С
27. Напишите уравнения реакций b-аминомасляной кислоты со следующими веществами: а) иодметаном, б) азотистой кислотой, в) уксусным ангидридом, г) гидроксидом меди (II).
28. Известно, что вещество с эмпирической формулой С3 Н7 О2 N растворяется в кислотах и щелочах, при реакции с азотистой кислотой выделяет азот, с этиловым спиртов в присутствие хлороводорода образуется соединение С5 Н11 О2 NСl, а при нагревании дает новое вещество состава С6 Н10 О2 N. Установите строение вещества.
29. Исследуемое вещество имеет эмпирическую формулу С3 Н7 О2 N. Установите его строение, зная, что оно обладает амфотерными свойствами, с метиловым спиртом дает вещество состава С4 Н9 NО2 , а при нагревании выделяется аммиак и образуется вещество состава С3 Н4 О2 , обнаруживающее кислотные свойства.
30. Определите строение сложного эфира a-аминокислоты, если известно, что он содержит 15,73% азота по массе.
31. Какой объем 10% -ного раствора гидроксида натрия (плотность 1,1 г/мл) может прореагировать с глицином, полученным из 32 г карбида кальция?
32. К 150 г 5% -ного раствора аминоуксусной кислоты, которую можно получить из 15 г уксусной кислоты двухстадийным синтезом с выходом продукта на каждой стадии, равным 75%.
33. К 16,3 г a-аминокислоты и первичного амина (молярное соотношение 3:1) могут прореагировать с 20 г 36,5% -ной соляной кислоты. Определите качественный и количественный (в граммах) состав смеси, если известно, что оба вещества содержат одинаковое число атомов углерода.
3. Лабораторная работа «Оксо- и аминокислоты»
Кето-енольная таутомерия ацетоуксусного эфира
Поместите в пробирку 1 каплю ацетоуксусного эфира 1 каплю 1% -ного раствора хлорида железа (III). Появляется фиолетово-красное окрашивание. Прибавьте 1 каплю насыщенного раствора брома ( над раствором в склянке должны быть оранжевые пары брома). Фиолетово-красное окрашивание сначала исчезает, но затем появляется вновь. Это явление может повториться несколько раз при добавлении каждый раз по 1 капле бромной воды.
Вопросы и задания
1. Напишите схему таутомерных превращений ацетоуксусного эфира, происходящих при комнатной температуре.
2. Какой структурный фрагмент молекулы ацетоуксусного эфира обуславливает фиолетово-красное окрашивание хлоридом железа (III).
3. Почему фиолетово-красное окрашивание исчезает каждый раз при прибавлении раствора брома?
Кетонное расщепление ацетоуксусного эфира
В пробирку с газоотводной трубкой поместите 5 капель ацетоуксусного эфира и 5 капель 10% -ного раствора серной кислоты. Пробирку нагрейте и конец газоотводной трубки опустите в пробирку, содержащую 5 капель насыщенного раствора гидроксида бария. Появляется муть.
Вопросы и задания
1. Напишите схему расщепления ацетоуксусного эфира под действием серной кислоты.
2. Напишите схемы реакций обнаружения продуктов расщепления ацетоуксусного эфира.
Амфотерные свойства a-аминокислот
В две пробирке поместите по 5 капель 1%-ного раствора аланина. В первую пробирку добавьте по каплям 0.1%-ю хлороводородную кислоту, подкрашенную индикатором конго в синий цвет, до появления в пробирке розово-красного окрашивания. Во вторую пробирку добавьте по каплям 0.1%-й раствор гидроксида натрия, подкрашенный фенофталеином, до исчезновения в пробирке окрашивания.
Вопросы и задания
1. Напишите схемы реакций аланина с хлороводородной кислотой и с гидроксидом натрия.
2. О чем свидетельствует изменение окраски индикатора в каждой из пробирок?
Образование комплексных солей меди ( II)
В пробирку поместите около 1мл 1% -ного раствора глицина. Добавьте на кончике лопаточки карбоната меди (II) и смесь нагрейте. Раствор приобретает синюю окраску.
Вопросы и задания
1. Напишите схему реакции глицина с карбонатом меди (II).
2. Для каких классов соединений характерна подобная реакция с солями меди (II).
Реакция с азотистой кислотой
В пробирку поместите по 5 капель 1%-ного раствора глицина и 5%-ного раствора нитрита натрия. Добавьте 2 капли концентрированной хлороводородной кислоты и осторожно взболтайте. Наблюдается выделение пузырьков газа.
Вопросы и задания
1. Напишите схему реакции глицина с азотистой кислотой.
2. Органические соединения каких классов будут мешать определению аминокислот этим методом?
4. Задания для самостоятельной работы студентов
1.Напишите схему получения ацетоуксусного эфира из этилацетата.
2. Напишите схему окисления глиоксалевой кислоты аммиачным раствором оксида серебра.
3. Какая кислота получается при восстановлении пировиноградной?
4. Напишите схему получения g-кетовалериановой кислоты из соответствующей кислоты. Назовите кетокислоту по международной номенклатуре.
5. Напишите структурные формулы ацетоуксусного эфира и диметилацетоуксусного эфира. Укажите, для какого из этих соединений существует енольная форма.
6. Напишите две таутомерные формы ацетоуксусного эфира.
7. Напишите схему взаимодействия ацетоуксусного эфира с бисульфитом натрия.
8. Напишите схемы трех реакций, характерных для енольной формы ацетоуксусного эфира.
9. Напишите уравнения реакций, лежащих в основе превращения серина в аланин: СН3 ОН, НСl PCl5 H2 O,H+ Na/Hg,
СН2 ОН – СНNН2 – СООН ®A ®B®C®
нейтрализация (CH3 )3 CHO
СН3 – СНNН2 – СООNa ® СН3 – СНNН2 – СООН
10. Приведите примеры аминокислот, у которых преобладают: а) основные свойства, б) кислотные свойства.
11. Напишите уравнения реакций, доказывающих амфотерность аланина.
12. Соединение состава С5 Н9 NО4 в реакции с гидроксидом натрия образует соединение состава С5 Н7 NNа2 О4 , с хлолводородной кислотой –С5 Н10 СlNО4 , с этанолом в присутствии серной кислоты – С9 Н17 О4 . Предложите одну из возможных структур этого соединения и напишите уравнения упомянутых реакций.
Полипептиды. Белки
1. Теоретические вопросы
Роль белков в живой материи и процессах жизнедеятельности. Молекулярная масса белков. Форма белковых молекул. Аминокислотный состав. Способ связи аминокислот в белковой молекуле. Работы А.Я. Данилевского и Э. Фишера. Пептиды. Структура белковой молекулы. Денатурация и ренатурация белков. Понятие о нативном белке. Номенклатура и классификация белков. Качественные реакции на белки
2. Упражнения
1. Какие из перечисленных аминокислот участвуют в образовании белковых молекул?
2. Приведите формулы следующих дипептидов: а) аланил-глицин, б) лейцил-аланин, в) лейцил-валин, г) глутамил-глицин.
3. Назовите следующие дипептиды:
а) Н2 N – СН – СО – NН – СН – СООН
CH3 CH3
б) Н2 N – СН – СО – NН – СН2 – СООН
CH3
в) Н2 N – СН – СО – NН – СН – СООН
CH3 СН3 – CH – СН3
4. Изобразите структурные формулы дипептидов, которые могут быть получены из следующих аминокислот: а) аланина и валина, б) глицина и лейцина, в) аланина и серина.
5. Приведите структурную формулу пептида:
(Н2 N)– гли – гли – про – мет – ала – тир – мет – асп – фен – (ОН).
6. Для установления первичной структуры инсулина белок обработали пепсином при рН=1.9 и химотрипсином при рН=8.0. Получили следующие пептиды, содержащие дисульфидные связи:
а) (Н2 N)–лей – вал – цис – гли –(ОН), б) (Н2 N)–гис – лей – цис – гли –(ОН)
S S
S S
(Н2 N)– тир – цис – асп –(ОН) (Н2 N)– цис – ала –(ОН)
в) (Н2 N)–сер – вал – цис – (ОН)
S
S
(Н2 N)– гли – иле – вал – глу – глу – цис (ОН)
7. Вывести все изомеры трипептидов состава С11 Н21 N3 О4 , если известно, что при гидролизе образуется глицин, лейцин и аланин. Дать название всем изомерам.
8. Содержание азота в серине составляет 13.3%. Вычислите молекулярную массу серина, если известно, что в молекуле серина один атом азота.
9. Гемоглобин содержит 0.34% железа. Вычислите минимальную молекулярную массу гемоглобина.
10. При гидролизе 14.6г природного дипептида раствором гидроксида натрия 9массовая доля щелочи 12 %, плотность раствора 1.2г/мл) из раствора выделено 11.1г соли массовая доля натрия в которой равна 20.72%. Установите возможную структурную формулу дипептида и вычислите объем раствора щелочи, израсходованной на гидролиз.
12. Для полного гидролиза образца дипептида массой 9.60г потребовалось 0.9г воды. установите структуру дипептида, если известно, что при гидролизе образовалась только одна аминокислота.
13. При гидролизе нескольких дипептидов образовалась смесь глицина, фенилаланина, глутаминовой кислоты и лизина. Один из дипептидов разделили на три равные части. Одну часть обработали избытком раствора гидрокарбоната калия и получили 1.68л газа (н. у.). Вторая часть смогла прореагировать с 30мл азотной кислоты (концентрация 2.5 моль/л). Для гидролиза третьей части дипептида потребовалось 1.35мл воды, а масса образовавшихся продуктов оказалась равной 18.0г. Установите возможное строение дипептида и его возможную массу.
14. При частичном гидролизе некоторого пептида А, имеющего молекулярную массу 293г/моль и содержащего 14.3% азота по массе, получено два пептида, В и С. Образец пептида В массой 0.472г может при нагревании вступить в реакцию с 18 мл 0.222 М раствора НCl. Образец пептида С массой 0.666 г полностью реагирует при нагревании с 14.7 мл 1.6%-ного раствора NaOH (плотность 1.022 г/мл).Приведите две структуры пептида А, отвечающие условию задачи.
3. Лабораторная работа «Полипептиды Белки»
Свертывание белков при нагревании
В пробирку наливают 4 капли раствора белка и нагревают в пламени горелки до кипения. Белок при этом выпадает в виде мути или хлопьев. Содержимое пробирки слегка охлаждают и добавляют 1 каплю раствора сульфата аммония и нагревают до начала кипения. Количество свернувшегося белка при этом увеличивается.
Вопросы и задания
1. Как называется процесс, происходящий при нагревании?
2. Почему при добавлении сульфата аммония количество свернувшегося белка увеличивается?
Осаждение белков солями тяжелых металлов
В две пробирки помещают по 3 капли раствора белка. В одну пробирку добавляют 1 каплю раствора сульфата меди (II), в другую – 1 каплю раствора ацетата свинца. Образуется хлопьевидный осадок или муть.
Вопросы и задания
1. На чем основано применение раствора белка при отравлении солями тяжелых металлов?
Качественные реакции пептидов и белков
Биуретовая реакция. В пробирку поместите 10 капель раствора яичного белка, 5 капель 10% -ного раствора гидроксида натрия и по стенке добавьте 1 – 2 капли 2% -ного раствора сульфата меди (II). Появляется красно-фиолетовое окрашивание.
Вопросы и задания
1. Напишите схему реакции биурета с сульфата меди (II).
2. Дают ли положительную биуретовую реакцию a-амнокислоты?
Ксантопротеиновая реакция. В пробирку поместите 10 капель раствора яичного белка и 2 капли концентрированной азотной кислоты. Смесь осторожно нагрейте, непрерывно встряхивая. Раствор и осадок окрашивается в желтый цвет. пробирку охладите и добавьте концентрированный раствора аммиака или 10% -й раствор гидроксида натрия до появления оранжевого окрашивания.
Вопросы и задания
1. Объясните, какие аминокислоты, входящие в состав белка, обнаруживаются с помощью ксантопротеиновой реакции.
2. Чем обусловлено появление желтых пятен на коже при попадании на нее концентрированной азотной кислоты?
4. Задания для самостоятельной работы студентов
1. Приведите типичные реакции осаждения белков.
2. Какие цветные реакции на белки вам известны?
3. Как делят белки – по наличию или отсутствию небелковой (простетической) части?
4. Что такое протеины? Приведите примеры.
5. Что такое протеиды? Приведите примеры.
6. Как связаны остатки аминокислот в белковых молекулах?
7. Приведите схему ступенчатого гидролиза белковой молекулы.
8. Напишите формулу фрагмента структуры белковой молекулы, состоящего из двух остатков глицина и одного остатка аланина с последовательностью гли-ала-гли.
9. Какие структуры белковой молекулы вы знаете? Приведите примеры.
10. что такое a-спираль Полинга.
Углеводы
А. Моносахариды.
1. Теоретические вопросы
Классификация углеводов. Моносахариды. Их типы и классификация. Доказательство химического строения моноз. Формулы Фишера, Колли-Тол-ленса и Хеуорзса. Пиранозы и фуранозы. Гликозидный гидроксил и его особенности. Стереохимия моносахаридов. Явление муторатации. Химические свойства моноз.
2. Упражнения
1. Какие виды структурной и пространственной изомерии характерны для моноз? Рассчитайте, сколько стереоизомеров существует для альдопентоз. Какие из них являются антиподами, какие диастериоизомерами?
2. Напишите проекционные формулы D- и L-глюкозы. Какой из углеродных атомов определяет принадлежность глюкозы к D- или L-ряду?
3. Напишите проекционные формулы по Фишеру следующих моносахаридов: а) D- и L-фруктозы, б) D- и L-галактозы, в) D- и L-рибозы, г) 2-дезокси- D-рибозы, д) D- и L-арабинозы.
4. К какому стереохимическому ряду (D- или L-) относится каждый из следующих моносахаридов:
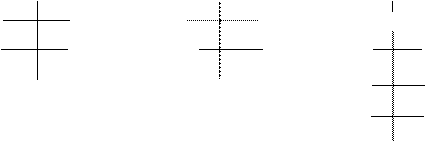 СНО СНО СНО
СНО СНО СНО
Н ОН Н ОН С = О
Н ОН НО Н НО Н
СН2 ОН СН2 ОН Н ОН
Н ОН
СН2 ОН
-эритроза -ксилоза -фруктоза
5. Какие моносахариды называются эпимерными? Составьте проекционные формулы моноз, эпимерных D-глюкозе.
6. Какое явление называется мутаротацией? Объясните мутаротацию на примере D-маннозы. Как можно обнаружить мутаротацию?
7. Напишите проекционные формулы по Хеуорзсу следующих соединений: a- D-рибофуранозы, b- D-галактопиранозы, b- L-арабопиранозы, b- D-фруктофуранозы, a-этил- D-гактопиранозида, b-метил- D-рибофуранозида, 1,2,3,4,6-пентаметил-b- D-глюкопиранозида.
8. Какими химическими реакциями можно доказать строение глюкозы
( нормальная углеродная цепь, наличие альдегидной группы и пяти гидроксильных групп)?
9. Почему глюкоза не проявляет некоторых реакций альдегидной группы (не реагирует с гидросульфитом натрия, не окрашивает раствор фуксинсернистой кислоты)? Почему алкилирование приводит к исчезновению свойств, присущих альдегидам?
10. Как можно отличить альдозу от кетулозы? Напишите уравнения реакций.
11. Как можно удлинить цепь атомов углерода в моносахариде? цепь атомов углерода в моносахариде? Напишите схему превращений альдопентозы в альдогексозу.
12. Как можно укоротить цепь атомов углерода в моносахариде? Напишите схему превращений альдогексозы в альдопентозу.
13. Напишите уравнения следующих реакций: а) восстановление D-глю-козы, б) окисление D-глюкозы бромной водой и конц. азотной кислотой, в) превращение D-глюкозы в D-фруктозу, г) получение пентаацетилглюкозы, д) спиртовое брожение глюкозы.
14. В промышленности глюкоза является сырьем для получения витамина «С» (L-аскорбиновой кислоты). Напишите уравнения последующих реакций: восстановление D-глюкозы в D-D-сорбит, окисление D-сорбита в L-сорбрзу, дальнейшего окисления в кислоту и ее лактонизации с образованием
витамина «С».
15. С помощью каких реакций можно перейти от фруктозы к глюкозе?
16. Кем и когда впервые получено синтетическое сахаристое вещество? Укажите исходное вещество и условие реакции.
17. Составьте уравнения реакций по следующей схеме: D-глюкоза ® тетраметил-a-метил- D-глюкопиранозид ® тетраметил-a-метил- D-глюко-пираноза + KMnO4 ® X
18. Вычислите массу 10% -ого раствора глюкозы, подвергшегося брожению, если известно, что при этом выделилось столько же газа, сколько его образуется при полном сгорании 35 мл этанола ( плотность 0.8 г/мл).
19. Смесь ацетальдегида и глюкозы общей массой 2.68 г растворили в воде и полученный раствор прибавили к аммиачному раствору оксида серебра, приготовленному из 36 мл 34% -ного раствора нитрата серебра (плотность 1.4 г/мл). Выпавший при легком нагревании осадок отфильтровали и к нейтрализованному азотной кислотой фильтрату прибавили избыток раствора хлорида калия. При этом выпало 5.74 г осадка. Рассчитайте массовые доли веществ в исходной смеси.
20. Раствор глюкозы массой 200 г вступил в реакцию с избытком аммиачного раствора оксида серебра; при этом образовалось 8.64 г осадка. Вычислите массовую долю глюкозы в растворе.
3. Лабораторная работа «Моносахариды»
Доказательство наличия гидроксильных групп в глюкозе
В пробирку поместите 1 каплю 0.5% -ного раствора D-глюкозы, 6 капель 10% -ного раствора гидроксида натрия и добавьте 1 каплю 2% -ного раствора сульфата меди (II). Выпавший вначале осадок гидроксида меди (II) быстро растворяется. Прозрачный раствор имеет интенсивную синюю окраску. Сохраните его для следующего опыта.
Вопросы и задания
1. Какой процесс обуславливает растворение голубого осадка гидроксида меди (II)?
2. Почему глюкоза, этиленгликоль, винная кислота, проявляют общность в реакции взаимодействия с гидроксида меди (II)?
3. Объясните, будет ли получаться аналогичный результат в этой реакции с другими моносахаридами?
Восстановление гидроксида меди (II) глюкозой
Эта реакция называется пробой Троммера. К полученному в предыдущем опыте раствору добавьте несколько капель воды и разделите раствор по двум пробиркам. Одну из них нагрейте над пламенем горелки до начала кипения, но не кипятите. Окраска раствора меняется на желто-красную.
Вопросы и задания
1. Напишите схему реакции восстановления гидроксида меди (II) глюкозой при нагревании.
2. Какая функциональная группа глюкозы обуславливает ее восстановительные свойства?
Восстановление гидроксида диамминсеребра глюкозой
В пробирку поместите 1 каплю 5% -ного раствора нитрата серебра и по каплям добавляют раствор аммиака до появления бурого осадка гидроксида серебра. Его растворяют избытком раствора аммиака (1-2 капли). Затем добавляют одну каплю 0.5% -ного раствора глюкозы и осторожно нагревают над пламенем горелки. Через несколько минут на стенке пробирки осаждается серебро в виде зеркального налета.
Вопросы и задания
1. Напишите схему реакции восстановления гидроксида диамминсеребра глюкозой.
2. Какая функциональная группа глюкозы обуславливает ее восстановительные свойства?
Сравнительное изучение реакции глюкозы с фуксинсернистой кислотой
В две пробирки внося по 2 капли раствора фуксинсернистой кислотоы. В одну добавляют 2 капли раствора формальдегида, в другую – 2 капли раствора глюкозы. Содержимое первой пробирки постепенно окрашивается в фиолетовый цвет (выделяется свободный фуксин). Содержимое второй пробирки остается бесцветным.
Вопросы и задания
1. Объясните, почему глюкоза, имеющая в своем составе альдегидную группу, не дает качественной реакции на альдегиды.
4. Задания для самостоятельной работы студентов
1. Напишите схему синтеза первого сахаристого вещества, проведенного А.М. Бутлеровым.
2. Что обозначают символы D- и L-, а также знаки “+” и “-” перед названием моносахаридов?
3. Какой гидроксил называется полуацетальным? Какое название он еще имеет?
4. Какие формы моносахаридов называются a-и какие b-?
5. Напишите структурные формулы двух таутомерных форм D-фруктозы (открытую и пиранозную) и назовите их.
6. Напишите структурную формулу a-D-маннофуранозы.
7. Напишите проекционную формулу Фишера и формулы двух аномеров рибофуранозы.
8. Напишите формулу гидратной формы глюкозы.
9. Какие свойства моносахаридов не могут быть объяснены с помощью одной открытой формы?
10. Напишите формулу озазона глюкозы.
11. Что такое мутаротация и чкм она объясняется?
12. Как гликозиды относятся к гидролизу? напишите схему реакции.
Б. Ди- и полисахариды
1. Теоретические вопросы
Ди- и полисахариды. Их типы и классификация. Доказательство строения восстанавливающих и невосстанавливающих дисахаридов. Инверсия. Химические свойства.
Полисахариды. Их классификация. Нахождение в природе и значение. Крахмал, его выделение, свойства и доказательство строения. Гликоген, его строение и свойства. Целлюлоза, ее строение и свойства. Производные целлюлозы, их получение, свойства и применение в технике.
2. Упражнения
1. Изобразите перспективные формулы по Хеуорсу следующих дисахсридов: а) трегалозы, б) мальтоза, в) целлобиозы, г) лактозы, д) сахарозы. Какие из перечисленных дисахаридов относятся к восстанавливающим. а какие – к не восстанавливающим?
2. Напишите уравнения реакций, доказывающих способность мальтозы к типичным альдегидным реакциям, то есть ее принадлежность к группе восстанавливающих дисахаридов.
3. Обнаруживает ли мальтоза мутаротацию? Может ли она существовать в виде двух аномеров (a- и b-)? Составьте перспективные формулы таутомерных форм мальтозы.
4. Какова перспективная формула восстанавливающего трисахарида, построенного из трех остатков глюкозы?
5. Какова перспективная формула не восстанавливающего трисахарида, построенного из трех остатков глюкозы?
6. Напишите уравнения реакций для мальтозы: а) образования озазона, б) окисления бромной водой, в) взаимодействие с гидроксидом меди (II) при нагревании.
7. Напишите уравнения реакций согласно следующей схеме:
бромная вода диметилсульфат (избыт.) серная кислота (р-р)
Целлобиоза ®А®В® С+D
8. Составьте уравнения реакций следующей схеме:
H2 SO4 (р – р)
Лактоза ® лактобионовая кислота ® А + В
9. Сахарозу подвергли нагреванию с разбавленной серной кислотой. Полученные продукты обработали избытком фенилгидразина. Какие соединения при этом образуются? Напишите уравнения соответствующих реакций.
10. Объясните, почему гидролиз сахарозы называется «инверсией» (обращением)? Напишите уравнения соответствующих реакций.
11. Напишите уравнение реакции сахарозы с избытком уксусного ангидрида. Назовите полученное соединение.
12. На сахарозу подействовали избытком диметилсульфата в присутствие щелочи, затем разбавленной серной кислотой при нагревании и, наконец - фенилгидразином. Напишите уравнения перечисленных реакций.
13. Приведите уравнения реакций с помощью которых, лактозу можно отличить от сахарозы.
14. Приведите перспективные формулы по Хеуорсу фрагментов молекул амилозы и амилопектина. Укажите типы связей между остатками D-глюкозы. Отметьте различие в строении амилозы и амилопектина.
15. Какие промежуточные и какой конечный продукт полуится при гидролизе крахмала? Приведите схему его гидролиза.
16. Как можно из крахмала получить глюконат кальция? Составьте уравнения реакций.
17. Чем объясняется появление синей окраски при действие на крахмал иода? Почему происходит обесцвечивание раствора при нагревании и восстановление его окрашивания при охлаждении.
18. С помощью каких качественных реакций можно отличить сахарозу от крахмала?
19. Чем гликоген отличается от амилопектина? Какую роль он играет в организме?
20. Изобразите фрагмент молекулы целлюлозы.
21. Как из целлюлозы получить этиловый спирт?
22. Напишите уравнения реакции получения моно-, ди- и три-нитратов целлюлозы, используя формулы Хеуорса. Что такое коллоксилин и пироксилин? Какое применение находят нитраты целлюлозы.
23. Как получают и где используют ацетаты целлюлозы? Напишите уравнения реакций. Чем отличаются моно-, ди- и триацетаты целлюлозы?
24. В бурых водорослях встречается полисахарид ламинарин. Основная цепь этого биополимера построена из остатков b-D-глюкопиранозы, соединенных b-1,3-гликозидными связями. Приведите перспективную формулу фрагмента молекулы ламинарина.
25. Синтетический арабинан построен из остатков a-L-арабинофурано-зы, соединенных a-1,5-связями. Какова формула фрагмента молекулы этого полисахарида?
26. Макромолекулы инулина состоят из остатков b-D-фруктофуранозы, соединенных между собой b-2,1- гликозидными связями. Приведите перспективную формулу фрагмента молекулы инулина.
27. Биополимер хитин является основой кутикулы беспозвоночных. Он представляет собой линейный полимер N-ацетил-b-D-глюкозамина, в котором остатки моноз связаны b-1,4-гликозидными связями. Составьте формулу фрагмента молекулы хитина.
28. В печени содержится полисахарид гепарин, в линейной цепи которого регулярно чередуются остатки a-(1,5)- D-глюкуроновой кислоты и a-(1,5)- D-глюкозамина, соединенных связями типа a-1,4. Приведите перспективную формулу фрагмента молекулы гепарина.
29. Какой объем углекислого газа (при температуре 15°С и давлении 96 кПа) образуется при сжигании 85.5г сахарозы?
30. Массовая доля крахмала в картофеле составляет 20%. Какую массу глюкозы можно получить из 1620 кг картофеля, если выход продукта реакции составляет 75% от теоретического.
31. Установите формулу сложного эфира, образованного целлюлозой и азотной кислотой, если известно, что он содержит 14.14% азота по массе.
2. Лабораторная работа «Ди- и полисахариды»
Отсутствие восстановительной способности у сахарозы
В пробирку поместите 1 каплю 1% -ного раствора сахарозы и 6 капель 10% -ного раствора гидроксида натрия. Смесь разбавьте 5 – 6 каплями воды и добавьте 1 каплю2% -ного раствора сульфата меди (II). Образуется прозрачный раствор комплексной соли меди (II) с сахарозой, имеющий интенсивную синюю окраску. Пробирку нагреть до кипения. Изменение окраски раствора не происходит.
Вопросы и задания
1. Почему в аналогичном опыте с глюкозой происходит изменение окраски раствора, а с сахарозой – нет?
2. Объясните, будет ли мутаротировать свежеприготовленный раствор сахарозы.
Восстановительная способность лактозы
Аналогично предыдущему проделайте опыт 1 каплей 1 –ного раствора лактозы. Полученный синий раствор комплексной соли меди (II) с лактозой нагрейте до кипения. Окраска раствора меняется на желто-красную.
Вопросы и задания
1. Объясните причину наличия восстановительных свойств у лактозы в отличие от сахарозы.
2. Будет ли обладать восстановительными свойствами мальтоза и метил-b-лактозид?
Качественная реакция на крахмал
В пробирку поместите 5 капель 0.5% -ного раствора крахмального клейстера и 1 каплю раствора иода в иодиде калия, разбавленного водой до светло-желтой окраски. Раствор приобретает желтую окраску. Нагрейте раствор – окраска исчезает; при охлаждении раствора окраска появляется вновь.
Вопросы и задания
1. Какой из компонентов крахмала обуславливает образование окрашенного комплекса с иодом?
2. Объясните исчезновение при нагревании синей окраски комплекса иода с крахмалом.
Кислотный гидролиз крахмала
В пробирку поместите 1 каплю 0.5% -ного раствора крахмального клейстера. Добавьте 2 капли 10% -ного раствора серной кислоты и поместите пробирку в кипящую водяную баню. Смесь становится прозрачной примерно через 10 мин. Пипеткой нанесите 1 каплю гидролизата на предметное стекло и добавьте 1 каплю раствора иода в иодиде калия, разбавленного водой до светло-желтой окраски. Если проба не дает положительной иодкрахмальной реакции, добавьте в пробирку 8 капель 10% -ного раствора гидроксида натрия до создания щелочной среды. Затем добавьте 1 каплю 2% -ного раствора сульфата меди и осторожно нагрейте пробирку до кипения. Окраска раствора меняется на желто-красную.
Вопросы и задания
1. Напишите схему реакции гидролиза мальтозы – структурной единицы крахмала.
2. О каких изменениях в структуре крахмала свидетельствует отрицательная иодкрахмальная проба?
3. О чем свидетельствует положительная проба Троммера с продуктами гидролиза крахмала? Можно ли на основании положительной пробы Троммера заключить, что продуктом гидролиза является глюкоза?
4. Задания для самостоятельной работы студентов
1. Напишите структурную формулу мальтозы. Какие монозы образуются при гидролизе мальтозы?
2. Способна ли мальтоза к таутомерии? Проявляет ли мутаротацию?
3. Напишите схему образования сахарозы. Характерна ли для нее мутаротация?
4. Напишите структурную формулу глюкопиранозидоглюкозы с a-1,6-гликозидной связью. Будет ли данный дисахарид окислятся реактивом Фелинга или аммиачным раствором оксида серебра?
5. Напишите схему реакции получения a-метиллактозида.
6. Какова причина растворения Cu(OH)2 в растворе сахарозы? Как называются соединения, образующиеся при этом.
7. Укажите, чем отличается строение крахмала от строения целлюлозы?
8. Укажите, чем отличаются амилоза и амилопектин (по свойствам).
9. Что такое растворимы крахмал?
10. При гидролизе какого полисахарида образуется целлобиоза как промежуточный продукт?
11. Что общего в строении крахмала, гликогена, целлюлозы, декстрана?
12. Что такое коллодий?
13.Напишите схему образования мононитрата целлюлозы.
14. Объясните сущность приготовления вискозного волокна.
Литература
1. Агрономов А. Е., Болесов И. Г. и др. Задачи и упражнения по органичекой химии. М., 1971.
2. Альбицкая В. М., Серкова В. И. Задачи и упражнения по органичекой химии. М., 1983.
3. Артеменко А. И. Органическая химия. М. 2000.
4. Артемьева Н. Н. , Белоблродов В. Л., Зурабян С. Э. и др. Руководство к лабораторным занятиям по органической химии. М., 2002.
5. Березин Б. Д., Березин Д. Б. Курс современной органической химии.М., 1999.
6. Василенко Ю. К. Биологическая химия. М. 1978.
7. Веселовская Т. К. , Мачинская, и. В. , Пржиялговская Н. М. Вопросы и задачи по органической химии. М. 1977.
8. Кост А. Н., Сагитуллин Р. С., Терентьев А. П. Упражнения и задачи по органической химии. М. 1974.
9. Строев Е. А. Биологическая химия. М. 1986.
10. Филиппович Ю. Б., Севастьянова Г. А., Щеголева Л. И. Упражнения и задачи по биологической химии.
Содержание
| Производные карбоновых кислот |
3 |
| 1. Теоретические вопросы |
3 |
| 2. Упражнения |
3 |
| 3. Лабораторная работа «Производные карбоновых кислот» |
6 |
| 4. Задания для самостоятельной работы студентов |
7 |
| Непредельные и дикарбоновые кислоты |
8 |
| 1. Теоретические вопросы |
8 |
| 2. Упражнения |
8 |
| 3. Лабораторная работа «Непредельные и дикарбоновые кислоты» |
12 |
| 4. Задания для самостоятельной работы студентов |
14 |
| Липиды |
15 |
| 1. Теоретические вопросы |
15 |
| 2. Упражнения |
15 |
| 3. Лабораторная работа «Липиды» |
17 |
| 4. Задания для самостоятельной работы студентов |
18 |
| Оксикарбоновые кислоты и оптическая изомерия |
19 |
| 1. Теоретические вопросы |
19 |
| 2. Упражнения |
19 |
| 3. Лабораторная работа «Оксикарбоновые кислоты и оптическая изомерия» |
22 |
| 4. Задания для самостоятельной работы студентов |
24 |
| Оксо- и аминокислоты |
24 |
| 1. Теоретические вопросы |
24 |
| 2. Упражнения |
25 |
| 3. Лабораторная работа «Оксо- и аминокислоты» |
28 |
| 4. Задания для самостоятельной работы студентов |
30 |
| Полипептиды. Белки. |
31 |
| 1. Теоретические вопросы |
31 |
| 2. Упражнения |
32 |
| 3. Лабораторная работа «Полипептиды. Белки» |
34 |
| 4. Задания для самостоятельной работы студентов |
35 |
| Углеводы |
36 |
| А. Моносахариды |
36 |
| 1. Теоретические вопросы |
36 |
| 2. Упражнения |
36 |
| 3. Лабораторная работа «Моносахариды» |
38 |
| 4. Задания для самостоятельной работы студентов |
40 |
| Б. Ди- и полисахариды |
41 |
| 1. Теоретические вопросы |
41 |
| 2. Упражнения |
41 |
| 3. Лабораторная работа «Моносахариды» |
44 |
| 4. Задания для самостоятельной работы студентов |
46 |
| Литература |
47 |
| Содержание |
48 |