Методические указания для студентов 2-го курса фармацевтического факультета по аналитической химии Донецк, 2007
СОДЕРЖАНИЕ: Глушкова Е. М. Качественный анализ. Методические указания для студентов 2-го курса фармацевтического факультета по аналитической химии. – Донецк, 2007. 150 сМинистерство здравоохранения Украины
Донецкий национальный медицинский университет им. М. Горького
Е. М. Глушкова
Качественный анализ
Методические указания
для студентов 2-го курса фармацевтического факультета
по аналитической химии
Донецк, 2007
УДК 543 (075.5)
Глушкова Е.М. Качественный анализ. Методические указания для студентов 2-го курса фармацевтического факультета по аналитической химии. – Донецк, 2007. - 150 с.
Данное методическое пособие предназначено для самоподготовки по аналитической химии студентов 2-го курса фармацевтического факультета. Методические указания по каждой теме унифицированы, строго конкретизируют учебную информацию, а также позволяют проверить качество ее усвоения. Знания по аналитической химии являются фундаментом для изучения профессионально-ориентированных дисциплин, таких как фармацевтическая химия, фармакогнозия, фармакология. Работа над каждой темой методического пособия повысит мотивацию изучения предмета и будет способствовать формированию у студентов-фармацевтов стройной системы профессиональных навыков, приобретение которых начинается при изучении базовых дисциплин.
Рецензенты: Бутева Л.В. – к. мед. н., доцент кафедры социальной медицины ОЗО и истории медицины ДонНМУ им. М. Горького,
методист учебно-методического отдела ДонНМУ
Митрофанова Т.А. – к.х.н., доцент кафедры медицинской химии ДонНМУ им. М. Горького
Методические указания утверждены на заседании Ученого совета ДонНМУ им. М. Горького
(протокол № 9 от октября 2007 г.)
СОДЕРЖАНИЕ
1. Предисловие...................................................................................................................................................................................................................4
2. Занятие № 1 «Правила работы и техники безопасности в химической лаборатории. Аналитические свойства веществ и аналитические
реакции. Методы систематического хода анализа катионов»……………………………………………………………………………………. 6 3. Занятие № 2 «Качественные реакции катионов I-ой аналитической группы K+ , Na+ , NH4 + . Анализ смеси катионов
I-ой аналитической группы».....................................................................................................................................................................................14
4. Занятие № 3 «Качественные реакции катионов II-ой аналитической группы Ag + , Hg2 2+ , Pb 2+ . Анализ смеси катионов
II-ой аналитической группы. Решение расчетных задач на равновесия в водных растворах сильных и слабых электролитов»..................24
5. Занятие № 4 «Качественные реакции катионов III -ей аналитической группы Ba2+ , Sr2+ , Ca2+ . Анализ смеси катионов
III-ей аналитической группы. Решение расчетных задач на равновесия в гетерогенных системах».................................................................34
6. Занятие № 5 «Качественные реакции катионов IV-ой аналитической группы Al3+ , Zn2+ , Cr3+ , Sn2+ , Sn4+ , As3+ , As5+ . Анализ
смеси катионов IV аналитической группы. Решение расчетных задач на равновесия в буферных растворах»...............................................44
7. Занятие № 6 «Качественные реакции катионов V-ой аналитической группы Mg2+ , Sb3+ , Sb5+ , Bi3+ , Fe2+ , Fe3+ , Mn2+ . Анализ
смеси катионов V аналитической группы. Решение задач на равновесия в растворах гидролизующихся солей»...........................................56
8. Занятие № 7 «Качественные реакции катионов VI-ой аналитической группы Cu2+ , Hg2+ , Co2+ , Ni2+ . Анализ смеси катионов
VI-ой аналитической группы. Решение расчетных задач на равновесия в растворах комплексных соединений».................................... .....68
9 . Занятие № 8 «Анализ смеси катионов I –VI-ой аналитических групп».................................................................................................................77
10. Занятие № 9 «Контрольная работа на тему: Качественный анализ катионов. Равновесия в растворах электролитов» ……………… ..89
11. Занятие № 10 «Качественный анализ анионов. Качественные реакции анионов I-ой аналитической
группы. Анализ смеси анионов I-ой аналитической группы»................................................................................................................................93
12. Занятие № 11 «Качественные реакции анионов II- ой , III- ей аналитических групп и анионов органических кислот
Анализ смеси анионов II –ой и III- ей аналитических групп».............................................................................................................................103
13. Занятие № 12 «Анализ смеси анионов I –III-ей аналитических групп»................................................................ .............................................116
14. Занятие № 13 «Анализ смеси неизвестного состава (сухих солей)»....................................................................................................................127
15. Занятие № 14 «Контрольная работа на тему: Качественный анализ анионов. Анализ смеси неизвестного состава»....................................145
Предисловие
Кафедра фармацевтической и токсикологической химии Донецкого национального медицинского университета им. М. Горького проводит подготовку студентов фармацевтического факультета, которые обучаются на специальности «Фармация». Учитывая возросшие требования к обучению студентов, на кафедре активно внедряется система программно-целевого управления качеством подготовки специалистов. Одним из главных принципов этой системы является ориентация студентов на всех этапах обучения на достижение конечных целей обучения, а именно, готовность к выполнению профессиональной деятельности. Кафедра фармацевтической и токсикологической химии обеспечивает преподавание нескольких химических дисциплин, как базовых, так и профессионально-ориентированных. Достичь конечных целей обучения невозможно, не освоив в заданном порядке цели обучения на младших курсах, которые в свою очередь являются целями исходного уровня для дисциплин старших курсов. Курс аналитической химии относится к базовым и изучается студентами в течение двух семестров. Аналитическая химия закладывает основы для дальнейшего освоения будущими специалистами фармации профильных дисциплин: фармацевтической химии, фармакогнозии, технологии лекарств, токсикологической химии и т.д. Реакции идентификации катионов и анионов, а также методы количественного определения веществ, которые являются предметом изучения аналитической химии, широко применяются для контроля качества лекарственных препаратов и установления их подлинности
Подготовленные методические указания написаны в соответствии с «Программой по аналитической химии» для студентов фармацевтических факультетов высших учебных заведений. В практическое пособие включены разделы аналитической химии, которые изучаются студентами в первом (осеннем) семестре: «Теоретические основы аналитической химии (равновесия в растворах электролитов)»,
«Качественный анализ катионов», «Качественный анализ анионов».
Методические указания могут быть использованы как для самостоятельной подготовки студентов во внеаудиторное время, так и на лабораторно-практических занятиях по аналитической химии. Весь учебный материал структурирован и разделен по темам в соответствии с тематическим планом лабораторно-практических занятий по аналитической химии. Каждая тема пособия унифицирована и включает в себя следующие разделы:
1. Актуальность темы. В этой части четко выделяются изучаемые соединения, устанавливается взаимосвязь с дисциплинами последующих этапов обучения, подчеркивается применение в медицинской практике – все это создает мотивацию изучения учебного материала студентом.
2. Цели обучения. В качестве общих целей на основании государственных стандартов образования (ОКХ и ОПП) для фармацевтов предлагается умение трактовать химико-аналитические свойства различных групп катионов и анионов и их реакции идентификации для качественного химического контроля лекарственных средств. Конкретные цели отражают действия, необходимые для достижения общей цели, и располагаются в нужной для этого последовательности.
3. Содержание обучения.
Внеаудиторная подготовка студентов. Раздел содержит основные теоретические вопросы, подробно раскрывающие суть изучаемой темы, и позволяющие выполнить целевые виды деятельности. Материал для освоения этих вопросов содержится в приведенной обязательной и дополнительной литературе. Для самопроверки усвоения материала по теме предлагается ответить на целевые обучающие задания, которые включают в себя как тесты, так и расчетные задачи, составленные в соответствии с целями занятия. Правильность решения можно проверить, сопоставив их с эталонами ответов (эталоны ответов для тестов помещены в таблицу, что облегчает работу над тестами для студентов, и проверку для преподавателей). Темы, в которые включены расчетные задачи, содержат таблицы с алгоритмами решения наиболее важных задач, задания для самостоятельного решения, а также эталоны ответов к ним.
Правильному восприятию изучаемого материала помогает специально разработанные для каждой темы графы логической структуры.
Самостоятельная работа студентов на лабораторном занятии. Для самостоятельного выполнения студентами лабораторных работ разработаны алгоритмы, которые описывают последовательность химических реакций и экспериментов, которые необходимо провести. Студент должен выполнить исследования, написать уравнения химических реакций, описать наблюдения в ходе реакций, обдумать их и написать выводы.
Итоговые темы, на которых предусмотрено проведение контрольных работ, имеют некоторые особенности в структуре и содержат более подробный список теоретических вопросов, а также больше тестовых заданий для самоподготовки студентов.
Надеемся, что подготовленное практическое пособие будет способствовать формированию у студентов-фармацевтов стройной системы профессиональных навыков, приобретение которых начинается при изучении базовых дисциплин.
Доцент кафедры фармацевтической
и токсикологической химии, к.х.н. Глушкова Е.М.
ЗАНЯТИЕ № 1
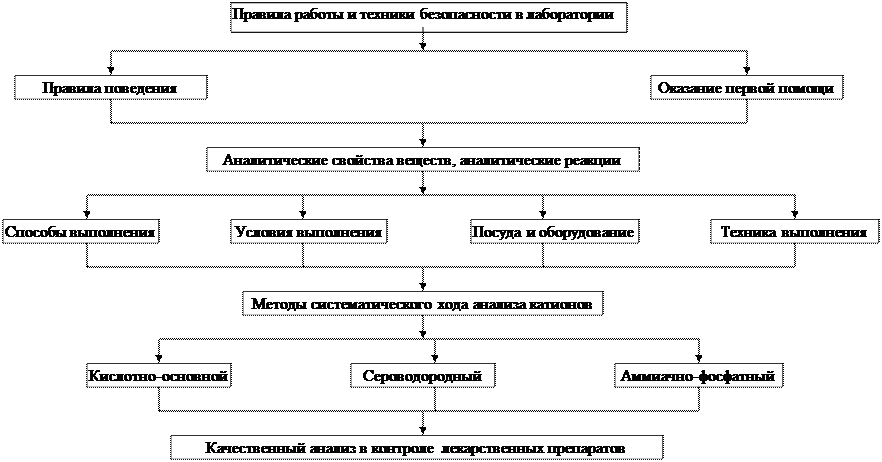
Тема: Правила работы и техники безопасности в химической лаборатории. Аналитические свойства веществ и аналитические реакции. Методы систематического хода анализа катионов.
Актуальность темы. Аналитическая химия – наука, разрабатывающая теоретические основы и практические методы химического анализа. Практической задачей аналитической химии является установление химического состава веществ и их смесей. Сначала устанавливают качественный состав вещества, т.е. решают вопрос, из каких элементов, групп элементов и ионов состоит это вещество. Затем приступают к определению количественного состава - в каких количественных соотношениях находятся составные части в данном веществе. В качественном анализе применяют специфические реакции для обнаружения ионов. Когда таких реакций недостаточно, разрабатывают определенную последовательность реакций обнаружения, представляющую систематический ход анализа. Реакции идентификации катионов и анионов, а также методы количественного определения веществ, которые являются предметом изучения аналитической химии, широко применяются для контроля качества лекарственных препаратов и установления их подлинности.
Общая цель. Уметь трактовать правила поведения и техники безопасности в лаборатории, аналитические свойства веществ и аналитические реакции, методы систематического хода анализа катионов.
Конкретные цели. Уметь:
1. Интерпретировать правила поведения в химической лаборатории и оказывать первую помощь при несчастных случаях.
2. Трактовать аналитические свойства веществ и аналитические реакции.
3. Трактовать методы систематического хода анализа катионов.
Содержание обучения.
Перечень теоретических вопросов:
1. Правила работы и техника безопасности в лаборатории аналитической химии.
1.1. Правила поведения в лаборатории.
1.2. Первая помощь при несчастных случаях.
2. Аналитические свойства веществ и аналитические реакции.
2.1. Способы выполнения аналитических реакций.
2.2. Условия выполнения и чувствительность аналитических реакций.
2.3. Посуда и оснащение химической лаборатории.
2.4. Правила и техника выполнения отдельных аналитических операций.
4. Методы систематического хода анализа катионов.
4.1. Кислотно-основной.
4.2. Сероводородный.
4.3. Аммиачно-фосфатный.
5. Качественный анализ в контроле лекарственных препаратов.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия. Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова.- Харьков, изд-во НФАУ «Золотые страницы», 2001. – C. 5 – 23.
2) Аналiтична хiмiя. Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004. – C. 5 – 21.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1)
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 9 - 38.
Перед началом работы в химической лаборатории внимательно изучите правила техники безопасности!
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ЛАБОРАТОРИИ АНАЛИТИЧЕСКОЙ ХИМИИ
Большинство применяемых в лаборатории аналитической химии веществ являются в той или иной степени токсичными, поэтому работать с ними следует осторожно, с соблюдением общих правил работы в химической лаборатории.
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ ПРОБОВАТЬ АНАЛИЗИРУЕМЫЕ ВЕЩЕСТВА И РЕАГЕНТЫ НА ВКУС!
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ ПРИНИМАТЬ ПИЩУ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ!
Перед началом работы студенты должны ознакомиться с общими и специальными правилами работы в химической лаборатории, расписаться об этом в журнале по ТБ и при выполнении работ строго их соблюдать.
Приступать к выполнению какого-либо опыта следует после тщательного ознакомления с его описанием и подготовки необходимой посуды, оборудования и материалов; на рабочем столе, кроме этого, может находиться только лабораторный журнал для записи результатов работы. Учебные пособия лучше помещать в ящик стола.
Работу с летучими, огне- и взрывоопасными веществами, а также выпаривание растворов и прокаливание летучих соединений следует выполнять только в вытяжном шкафу, окна которого должны быть подняты на высоту, удобную для работы, не более чем на одну треть. Недопустимо работать с воспламеняющимися веществами (эфир, спирт, бензол и др.) и хранить их возле зажженной горелки.
НАГРЕВАТЬ ВОСПЛАМЕНЯЮЩИЕСЯ ВЕЩЕСТВА МОЖНО ТОЛЬКО НА ВОДЯНОЙ БАНЕ!
Если горючая жидкость разлилась по столу или по полу и загорелась, ее тушат сухим песком или одеялом. Никогда не следует задувать пламя.
Пробирки с растворами нельзя нагревать в открытом пламени газовой горелки. Их нагревание проводится на водяной бане, горелкой пользуются только в случае необходимости.
Концентрированными кислотами и концентрированными растворами щелочей пользоваться только под тягой. Остатки их выливать в специальную посуду в вытяжном шкафу (емкости для слива).
Отходы после работы с солями ртути, мышьяка (ЯДЫ!) и серебра собирать в специальную посуду.
ПОСЛЕ ВЫПОЛНЕНИЯ РАБОТЫ ТЩАТЕЛЬНО ВЫМЫТЬ РУКИ С МЫЛОМ.
Нельзя оставлять без присмотра нагревательные и электрические приборы. Следует строго соблюдать правила работы с электроприборами.
Перед уходом из лаборатории обязательно проверить газовые и водопроводные краны, выключить электроприборы, электрический свет.
МЕРЫ НЕОТЛОЖНОЙ ПОМОЩИ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
При легких термических ожогах обожженное место смазывают глицерином или прикладывают вату, смоченную спиртом. На более сильные ожоги сразу же накладывают вату или марлю, обильно смоченную 3% раствором таннина.
При попадании на кожу или одежду кислот и щелочей необходимо промыть пораженное место большим количеством воды, затем 3% раствором натрия гидрокарбоната (при попадании кислоты) или 1-2% раствором уксусной кислоты (при попадании щелочи).
При сильных ожогах кислотами и щелочами после промывания водой на обожженное место накладывают повязку, смоченную одним из указанных растворов, применяемых при химических ожогах.
При попадании брызг кислоты или щелочи в глаза их промывают водой, а затем 3% раствором натрия гидрокарбоната (если попала кислота) или насыщенным раствором борной кислоты (если попала щелочь).
При порезах стеклом удаляют из ранки осколки стекла, обрабатывают ее раствором йода и перевязывают.
Студенты, работающие в лаборатории, должны знать места расположения противопожарных средств и аптечки.
При любом несчастном случае студенты должны немедленно обратиться к преподавателю или лаборанту.
С правилами техники безопасности в лаборатории аналитической химии ознакомлен. ПОДПИСЬ СТУДЕНТА ___________
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ.
| 1) В химико-аналитической лаборатории химику на кожу попал раствор щелочи. Чем нужно промыть пораженное место после того, как щелочь смыли большим количеством воды? A. 1 – 2 % р-ром натрия гидрокарбоната. B. 3% р-ром перекиси водорода. C. 50% р-ром уксусной кислоты. D. 3% р-ром таннина. E. 1 – 2 % р-ром уксусной кислоты. |
2) В химико-аналитической лаборатории химику на кожу попал концентрированный раствор кислоты. Пораженное место промыли водой и раствором натрия гидрокарбоната. Какой концентрации раствор натрия гидрокарбоната использовали? A. 3% B. 33% C. 30% D. 13% E. 0,03% |
| 3) В химико-аналитической лаборатории химику в глаза попали брызги натрия гидроксида. Какой раствор необходимо использовать после того, как глаза промыли водой? A. раствор натрия карбоната. B. 3% раствор натрия гидрокарбоната. C. раствор борной кислоты. D. 3% раствором серной кислоты. E. 3% раствором уксусной кислоты. |
7) В химико-аналитической лаборатории химик получил сильный термический ожог на руке. Как необходимо поступить в данной ситуации? A. Обожженное место смазать глицерином или приложить вату, смоченную спиртом. B. Опустить руку в емкость с холодной водой. C. Поднести руку под проточную холодную воду. D. Наложить вату или марлю, смоченную 3% р-ром кислоты. E. Наложить вату или марлю, смоченную 3% р-ром таннина |
| 4) В аналитической химии существует классификация катионов, основанная на различной растворимости фосфатов катионов. Как называется данный метод анализа? A. Сероводородный. B. Кислотно-основной. C. Аммиачно-фосфатный. D. --- E. --- |
8) Исторически первым в аналитической химии был сероводородный метод анализа. Главным недостатком этого метода, ограничивающим его применение, является: А. Образование малорастворимых сульфидов. В. Использование сероводорода. С. Использование концентрированной серной кислоты. D. Образование малорастворимых сульфатов. Е. Использование концетрированных щелочей. |
| 5) В аналитической химии для обнаружения катионов и анионов используют характерные качественные реакции, для которых присущи внешние проявления: образование осадков, изменение цвета раствора, выделение газообразных продуктов и т. д. Вещество, которое используют для проведения аналитической реакции, называют: А. Катализатором. В. Реагентом. С. Ингибитором. D. Растворителем. Е. Экстрагентом. |
9) В аналитической химии существует классификация катионов, основанная на различной растворимости фосфатов катионов. Как называется данный метод анализа? A. Сероводородный. B. Кислотно-основной. C. Аммиачно-фосфатный. D. --- E. --- |
| 6) Щелочные металлы находятся в первой группе главной подгруппе Периодической системы и на внешнем электронном уровне имеют по одному электрону. В ходе химических реакций щелочные металлы: А. Отдают один электрон. В. Присоединяют один электрон. С. Отдают два электрона. D. Присоединяют два электрона. Е. Не отдают и не присоединяют электроны. |
10) Наиболее распространенной классификацией катионов в аналитической химии является классификация по кислотно-основному методу. Разделение катионов на группы в кислотно-основном методе основано на различной растворимости: A. солей и гидроксидов катионов. B. солей, образованных катионами и сильными кислотами. C. гидроксидов катионов и их солей, образованных сильными кислотами. D. гидроксидов катионов и их солей, образованных слабыми кислотами. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
6 |
||
| 2 |
А |
7 |
Е |
| 3 |
8 |
||
| 4 |
9 |
||
| 5 |
В |
10 |
А |
Заполните следующие таблицы, используя эталон выполнения задания.
1. Классификация катионов по аммиачно-фосфатному методу:
| Группа |
Катионы |
Групповой реагент |
Растворимость соединений |
| I |
|||
| II |
|||
| III |
|||
| IV |
|||
| V |
2. Классификация катионов по кислотно-основному методу:
| Группа |
Катионы |
Групповой реагент |
Растворимость соединений |
| I |
|||
| II |
|||
| III |
|||
| IV |
|||
| V |
|||
| VI |
Эталон выполнения задания:
3. Классификация катионов по сероводородному методу:
| Группа |
Катионы |
Групповой реагент |
Растворимость соединений |
| I |
K+ , Na+ , NH4 + , Mg2+ |
Нет |
Сульфиды, карбонаты, хлориды и гидроксиды растворяются в воде. |
| II |
Ba2+ , Sr2+ , Ca2+ |
(NH4 )2 CO3 , NH4 *H2 O + NH4 Cl, pH = 9.25 |
Карбонаты не растворяются в воде. |
| III |
Fe2+ , Fe3+ , Cr3+ , Al3+ , Mn2+ , Ni2+ , Zn2+ , Co2+ |
(NH4 )2 S, NH4 *H2 O + NH4 Cl, pH = 9.25 |
Сульфиды не растворяются в воде, но растворяются в разведенных кислотах. |
| IV |
Cu2+ , Hg2+ , Bi3+ , Sn2+ , Sn(IV), Sb(III), Sb(V), As(III), As(V) |
H2 S, HCl, pH = 0.5 |
Сульфиды не растворяются в воде и разведенных кислотах. |
| V |
Ag+ , Pb2+ , Hg2 2+ |
HCl |
Хлориды не растворяются в воде и разведенных кислотах. |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
10 |
Учебная лаборатория. |
||
| 2. |
Инструктаж по технике безопасности. |
30 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 3. |
Самостоятельная работа. |
80 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Химическая посуда, реактивы. |
Учебная лаборатория. |
| 4. |
Анализ и коррекция усвоения материала. |
20 |
Учебная лаборатория. |
||
| 5. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 5. |
Подведение итогов занятия. |
10 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Правила работы и техники безопасности в химической лаборатории. Аналитические свойства веществ ианалитические реакции. Методы систематического хода анализа катионов.
 |
ЗАНЯТИЕ № 2
Тема: Качественные реакции катионов I-ой аналитической группы K+ , Na+ , NH 4 + . Анализ смеси
катионов I-ой аналитической группы.
Актуальность темы. К катионам I-ой аналитической группы относятся катионы натрия, калия, аммония и лития. Они входят в состав различных солей, среди которых много лекарственных средств (бикарбонат натрия, хлорид натрия, бромид и йодид натрия, бромид и йодид калия, гидроксид аммония, хлорид аммония), применяемых в медицинской практике. Например, хлорид натрия используется для приготовления изотонического раствора, хлорид калия - как антиаритмическое средство и при гипокалиемии. Реакции идентификации катионов I-ой аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании лекарственных веществ на содержание примесей.
Общая цель. Уметь трактовать химико-аналитические свойства катионов I-ой аналитической группы и их реакции идентификации для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Трактовать химико-аналитические свойства катионов I-ой аналитической группы.
2. Проводить реакции идентификации на катионы K+ , Na+ , NH 4 + в растворах и по окрашиванию пламени.
3. Трактовать ход качественного анализа катионов I-ой аналитической группы при совместном присутствии.
4. Интерпретировать свойства катионов I-ой аналитической группы в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
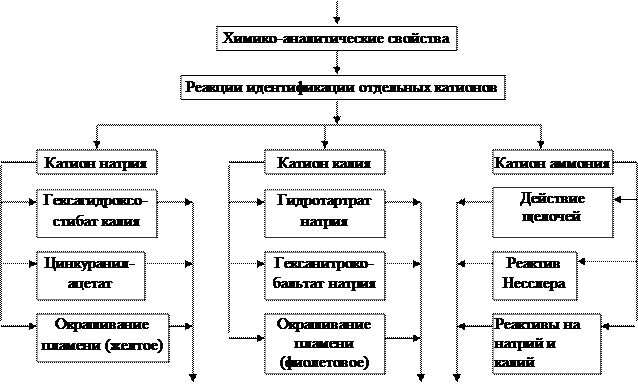
- Химико-аналитические свойства катионов I-ой аналитической группы, их положение в Периодической системе.
- Реакции идентификации катионов I-ой аналитической группы в растворах.
2.1. Реакции идентификации катиона натрия.
2.1.1.Действие гексагидроксостибата калия.
2.1.2. Действие цинкуранилацетата (микрокристаллоскопическая реакция).
2.1.3. Действие метоксифенилуксусной кислоты.
2.2. Реакции идентификации катиона калия.
2.2.1. Действие гидротартрата натрия.
2.2.2. Действие гексанитрокобальтата натрия.
2.2.3. Действие натрия свинца гексанитрокупрата (микрокристаллоскопическая реакция).
2.3. Реакции идентификации катиона аммония.
2.3.1 Действие щелочей.
2.3.2. Действие реактива Несслера.
2.3.3. Отношение катионов аммония к действию реагентов, применяемых для обнаружения катионов калия и натрия.
2.4. Идентификация катионов I-ой аналитической группы по окрашиванию пламени горелки.
3. Систематический ход анализа катионов I-ой аналитической группы при совместном присутствии
4. Свойства и использование катионов I-ой аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-тво НФАУ «Золотые страницы», 2001. – C. 23 – 35
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004. – C. 21 – 38.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 121 – 147.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ.
| 1) К катионам I-ой аналитической группы относятся K+ , Na+ , NH4 + , которые образуют хорошо растворимые в воде соединения. Какой групповой реагент можно использовать для отделения катионов I-ой аналитической группы? A. хлористоводородную кислоту. B. серную кислоту. C. групповой реагент отсутствует. D. гидроксид натрия. E. аммиак. |
3) Фармакопея Украины рекомендует определять катион калия в лекарствах действием винной кислоты. Какой аналитический эффект наблюдается в случае обнаружения катиона калия при помощи этого реактива? A. Желтый кристаллический осадок. B. Белый творожистый осадок. C. Белый кристаллический осадок. D. Желтый творожистый осадок. E. Черный творожистый осадок. |
| 2) В химико-аналитической лаборатории исследовали растворы, содержащие смеси катионов. В каком из растворов содержатся только катионы I-ой аналитической группы? A. Na+ , NH4 + , Ca2+ . B. K+ , NH4 + , Ba2+ . C. Na+ , Co2+ , Ni2+ . D. Na+ , K+ , NH4 + . E. NH4 + , Ca2+ , Со2+ . |
4) В растворе присутствеуют катионы кальция, бария, аммониия, калия и натрия. После того, как к раствору добавили небольшое количество раствора цинкуранилацетата, образовался желтый кристаллический осадок. Какой катион определили этой реакцией? A. Кальция. B. Калия. C. Бария. D. Натрия. E. Аммония. |
| 5) Действие щелочей является фармакопейной реакцией на один из катионов I-ой аналитической группы. Какой катион идентифицируют с помощью этой реакции? A. NH4 + . B. Na+ . C. Ва2+ . D. Ca2+ . E. K+ . |
8) В аналитической лаборатории идентифицировали соединение, внося его в бесцветное пламя горелки, при этом пламя окрашивалось в фиолетовый цвет. Соли какого катиона дают такой эффект? A. Са2+ . B. Sг2+ . C. Ва2+ . D. Na+ . E. K+ . |
| 6) При идентификации катиона калия используют раствор натрия гексанитрокобальтата ( III). Какой катион мешает определению калия при помощи этой реакции? A. Co2+ . B. Na+ . C. NH4 + . D. Ca2+ . E. Ba2+ . |
9) В лаборатории необходимо идентифицировать катион аммония. Какой раствор можно для этого использовать? A. Калия хромата. B. Цинка уранилацетата. C. Реактива Чугаева. D. Натрия сульфата. E. Реактива Несслера. |
| 7) Катион калия можно обнаружить при помощи микрокристалл -лоскопической реакции с гексанитрокупратом (II) натрия-свинца. Каким аналитическим эффектом сопровождается эта реакция? A. Выпадает желтый кристаллический осадок. B. Выпадает белый кристаллический осадок. C. Образуются черные кубические кристаллы. D. Образуются белые кристаллы в форме октаэдров. E. Раствор окрашивается в желтый цвет. |
10) В аналитической лаборатории проводили анализ лекарственного вещества, в состав которого входят катионы первой аналитической группы. Для определения натрия какой катион необходимо предварительно удалить из исследуемого раствора? A. Аммония. B. Калия. C. Лития. D. Аммония и калия. E. Калия и лития. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
С |
6 |
|
| 2 |
7 |
С |
|
| 3 |
С |
8 |
|
| 4 |
9 |
Е |
|
| 5 |
10 |
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания.
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
||
| 2. Реакции идентификации катионов I-ой аналитической группы в растворах. |
||||
| 2.1 Реакции идентификации катиона натрия. |
||||
| 2.1.1. Действие K[ Sb( OH)6 ]. а) К 3-4 каплям раствора натрия хлорида прибавляют 3-4 капли раствора K[Sb(OH)6 ], внутренние стенки пробирки потирают стеклянной палочкой. Испытывают отношение осадка к раствору натрия гидроксида, холодной и горячей дистиллированной воде. |
||||
| 2.1.2. Микрокристаллоскопическая реакция с Zn[( UO2 )3 ( CH3 COO)8 ]. На предметное стекло помещают каплю раствора соли натрия. Осторожно выпаривают почти досуха. Рядом помещают каплю раствора цинкуранилацетата, соединяют стеклянной палочкой. Образовавшиеся кристаллы рассматривают под микроскопом. |
||||
| 2.1.3. Действие метоксифенилуксусной кислоты. К 3-4 каплям раствора натрия хлорида прибавляют 3-4 капли раствора метоксифенилуксусной кислоты. Испытывают отношение осадка к раствору аммиака. |
||||
| 2.2. Реакции идентификации катиона калия. |
||||
| 2.2.1. Действие NaHC4 H4 O6 . К 3-4 каплям раствора калия хлорида прибавляют 3-4 капли раствора NaHC4 H4 O6 и потирают внутренние стенки пробирки стеклянной палочкой. Испытывают отношение осадка к минеральной кислоте, щелочи, холодной и горячей дистиллированной воде. |
||||
| 2.2.2. Действие Na3 [ Co( NO2 )6 ]. К 2-3 каплям раствора калия хлорида прибавляют 2 капли раствора Na3 [Co(NO2 )6 ]. |
||||
| 2.2.3. Микрокристаллоскопическая реакция с Na2 Pb[ Cu( NO2 )6 ]. На предметное стекло помещают каплю раствора соли калия. Осторожно выпаривают почти досуха. К сухому остатку прибавляют каплю раствора Na2 Pb[Cu(NO2 )6 ]. Образовавшиеся кристаллы рассматривают под микроскопом. |
||||
| 2.3. Реакции идентификации катиона аммония. |
||||
| 2.3.1. Действие раствора NaOH. К 3-4 каплям раствора соли аммония прибавляют 3-4 капли 2М раствора NaOH и нагревают. К отверстию пробирки подносят полоску фильтровальной бумаги, смоченной раствором фенолфталеина, или влажную красную лакмусовую бумагу. |
||||
| 2.3.2. Действие реактива Несслера. К 2-3 каплям разбавленного раствора соли аммония прибавляют 2-3 капли реактива Несслера. |
||||
| 2.3.3. Отношение катионов аммония к действию реагентов, применяемых для обнаружения катионов калия и натрия. а) к 2-3 каплям насыщенного раствора солей аммония прибавляют соответственно по 2-3 капли растворов NaHC4 H4 O6 и Na3 [Co(NO2 )6 ]; б) к 2-3 каплям насыщенного раствора солей аммония прибавляют 2-3 капли раствора K[Sb(OH)6 ] |
||||
| 2.4. Реакция окрашивания пламени горелки солями калия и натрия. |
||||
| 2.4 . Очищенной раскаленной нихромовой петлей захватывают летучую соль соответствующего катиона и вносят в несветящуюся часть пламени газовой горелки. Окраску солей калия в присутствии солей натрия рассматривают через синее стекло. |
||||
| 3. Систематический ход анализа смеси катионов I-ой аналитической группы. |
||||
| 3.1. Предварительные наблюдения и испытания. Определяют цвет, запах, рН раствора, отношение раствора к уксусной и минеральным кислотам, также проводят реакцию окрашивания пламени газовой горелки. |
||||
| 3.2. Определение катионов аммония. 3.2.1. Действие щелочей. К 2-3 каплям исследуемого раствора прибавляют 6-8 капель 2М раствора NaOH или KOH и нагревают. К отверстию пробирки подносят влажную лакмусовую бумажку, не касаясь её стенки. Изменение цвета свидетельствует о присутствии катионов NH4 + . 3.2.2. Действие реактива Несслера. К 2-3 каплям исследуемого раствора прибавляют 3-5 капель реактива Несслера. |
||||
| 3.3. Определение катионов калия (после предварительного удаления катионов аммония в случае их присутствия). 3.3.1. Подготовка раствора. К 5 каплям исследуемого раствора прибавляют 5 капель 2М раствора Na2 CO3 или NaOH. Пробирку с раствором нагревают на водяной бане до полного удаления аммиака (влажная красная лакмусовая бумажка не должна синеть). После удаления ионов аммония к раствору прибавляют по каплям 2М раствор уксусной кислоты до нейтральной реакции (проба с индикатором), упаривают на водяной бане и охлаждают. 3.3.2 Обнаружение катионов калия действием раствора натрия гидротартрата. К 2 каплям раствора, полученного по п. 3.3.1., прибавляют 3-5 капель раствора натрия гидротартрата, потирают внутренние стенки пробирки стеклянной палочкой. 3.3.3. Обнаружение катионов калия действием натрия гексанитрокобальтата. К 3-4 каплям раствора, полученного по п. 3.3.1., прибавляют 2 капли раствора Na3 [Co(NO2 )6 ]. |
||||
| 3.4. Определение катионов натрия (после предварительного удаления катионов аммония в случае их присутствия). 3.4.1. Подготовка раствора. К 5 каплям исследуемого раствора прибавляют 5 капель 2М раствора К2 CO3 или КOH. Пробирку с раствором нагревают на водяной бане до полного удаления аммиака (влажная красная лакмусовая бумажка не должна синеть). После удаления ионов аммония к раствору прибавляют по каплям 2М раствор уксусной кислоты до нейтральной реакции (проба с индикатором), упаривают на водяной бане и охлаждают. 3.4.2. Обнаружение катионов натрия действием раствора калия гексагидроксостибата. К 3-4 каплям раствора, полученного по п. 3.4.1., прибавляем 3-4 капли раствора K[Sb(OH)6 ] и потирают стенки пробирки стеклянной палочкой. |
||||
Эталон выполнения задания экспериментальной работы:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
|
| 2. Реакции идентификации катионов I-ой аналитической группы в растворах. |
|||
| 2.2 Реакции идентификации катиона натрия. |
|||
| 2.1.1. Действие K[ Sb( OH)6 ]. а) К 3-4 каплям раствора натрия хлорида прибавляют 3-4 капли раствора K[Sb(OH)6 ], внутренние стенки пробирки потирают стеклянной палочкой. Испытывают отношение осадка к раствору натрия гидроксида, холодной и горячей дистиллированной воде. |
NaCl + K[Sb(OH)6 ] Na[Sb(OH)6 ] + КCl [Sb(OH)6 ] - + H+ Н[Sb(OН)6 ] Н[Sb(OН)6 ] НSbO3 +3Н2 О |
белый кристаллический осадок белый аморфный осадок |
|
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Инструктаж по технике безопасности. |
5 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 4. |
Самостоятельная работа. Выполнение лабораторной работы. |
100 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Микроскоп, химическая посуда, реактивы. |
Учебная лаборатория. |
| 5. |
Анализ и коррекция усвоения материала. |
15 |
Учебная лаборатория. |
||
| 6. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 7. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественные реакции катионов I-ой аналитической группы K+ , Na+ , NH 4 + . Анализ смеси катионов I-ой аналитической группы.
|
 |
||
 |
||
ЗАНЯТИЕ № 3
ЗАНЯТИЕ № 3
Тема: Качественные реакции катионов II-ой аналитической группы Ag + , Hg2 2+ , Pb 2 . Анализ смеси катионов II-ой аналитической группы.
Решение расчетных задач на равновесия в водных растворах сильных и слабых электролитов.
Актуальность темы. К катионам II-ой аналитической группы относятся катионы d -элементов Ag + , Hg2 2+ и p- элемента Pb 2+ . Соединения данных элементов применяются в медицине т.к. входят в состав многих лекарственных средств, например, меркурия дихлорид (сулема), меркурия оксид желтый, меркурия оксицианид, колларгол, протаргол, которые используют как антисептические средства. Присутствие катионов свинца (наряду с другими токсичными металлами) контролируют в лекарственных веществах как недопустимую примесь. Реакции идентификации катионов II -ой аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Химические равновесия, которые устанавливаются в растворах сильных и слабых электролитов, подчиняются закону действия масс и применяются для расчетов рН и концентраций растворов кислот и оснований, которые используются в анализе лекарственных субстанций и сырья.
Общая цель. Уметь трактовать химико-аналитические свойства катионов II -ой аналитической группы, их реакции идентификации, а также равновесия в растворах сильных и слабых электролитов для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Трактовать химические свойства катионов II-ой аналитической группы и действие группового реагента.
2. Проводить качественные реакции идентификации на катионы серебра, ртути и свинца в растворах
3. Трактовать ход качественного анализа катионов II-ой аналитической группы при совместном присутствии.
4. Решать задачи на равновесия в растворах сильных и слабых кислот и оснований.
5. Интерпретировать свойства катионов II-ой аналитической группы в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
- Химико-аналитические свойства катионов II -ой аналитической группы, их положение в Периодической системе.
- Действие группового реагента (2М раствора соляной кислоты).
- Реакции идентификации катионов II -ой аналитической группы в растворах.
3.1. Действие сульфид-ионов.
3.2. Действие щелочей.
3.3. Действие калия йодида.
3.4. Действие аммиака.
3.5. Действие хромат-ионов.
3.6. Действие карбонат-ионов.
3.7. Действие сульфат-ионов.
4. Систематический ход анализа катионов II -ой аналитической группы при совместном присутствии.
5. Равновесия в растворах сильных и слабых электролитов.
5.1. Закон действия масс. Константы диссоциации электролитов.
5.2. Закон разбавления Оствальда. Степень диссоциации слабых электролитов.
5.3. Диссоциация воды. Водородный показатель.
6. Свойства и использование катионов II -ой аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001. – C. 35 – 47, 184 – 187.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004. – C. 38 – 48, 181 – 184.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – C.148 – 205, 71 – 84.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ.
ТЕСТЫ
| 1) К катионам II-ой аналитической группы относятся Ag+ , Hg2 2+ , Pb2+ . Какой раствор является групповым реагентом на эти катионы? A. 6 М HCl. B. 0,1М NaOH. C. 2 М NaOH. D. 2 М HCl. E. 2 М HNO3 . |
2) В химико-аналитической лаборатории исследовали растворы, содержащие смеси катионов. В каком из растворов содержатся только катионы II-ой аналитической группы? A. Hg2 2+ , NH4 + , Ag+ . B. Ag+ , Hg2 2+ , Pb2+ . C. Na+ , Pb2+ , Ni2+ . D. Na+ , Hg2 2+ , NH4 + . E. Pb2+ , Ag+ , Со2+ . |
| 3) В растворе присутствуют катионы калия, ртути ( I), серебра, магния и натрия. После добавления небольшого количества раствора калия йодида, образовался желтый осадок. Какой катион определили при помощи этой реакции? A. серебра. B. калия. C. магния. D. натрия. E. ртути (I). |
6) К исследуемому раствору прибавили 2М раствор HCl. При этом образовался белый осадок, который при добавлении горячей воды полностью растворился. Какой катион присутствует в растворе? A. Pb2+ . B. Ba2+ . C. Mg2+ . D. Ag+. E. Hg2 2+ . |
| 4) В раствор, который содержит катионы меркурия ( I), прибавили раствор хлороводородной кислоты. К образовавшемуся осадку прилили раствор аммиака. Укажите химический состав вновь образовавшегося осадка: A. [HgNH2 ]Cl + Hg. B. [HgNH2 ]Cl. C. HgO + Hg D. Hg(OH)2 + [HgNH2 ]Cl. E. Hg2 Cl2 + Hg. |
7) В химико-аналитической лаборатории идентифицировали катионы свинца. Какой осадок выпадает при действии избытка щелочи на раствор, который содержит катионы Pb2+ ? A. белый аморфный осадок гидроксида свинца. B. осадок в данных условиях не выпадает. C. белый кристаллический осадок гидроксида свинца. D. белый осадок гидроксида свинца, который затем растворяется. E. желтый осадок оксида свинца. |
| 5) В химико-аналитической лаборатории идентифицировали катионы серебр в лекарственной субстанции. Какой аналитический эффект наблюдается при действии щелочи на раствор, который содержит катионы Ag+ ? A. Выпадает черный осадок серебра, который растворяется. B. Выпадает бурый осадок оксида серебра. C. Выпадает белый осадок гидроксида серебра, который буреет. D. Раствор окрашивается в желтый цвет, затем буреет. E. Раствор окрашивается в черный цвет. |
8) В химико-аналитической лаборатории идентифицировали фармпрепарат «Колларгол», содержащий катионы серебра, действием НС l. Какие химические соединения образуются при взаимодействии хлорида серебра с избытком раствора аммиака? A. [Аg(NН3 )2 ]Сl. B. [Аg4 (NН2 )3 ]С1. C. АgОН; D. АgNH2 ; E. Реакция не идет. |
| 9) К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить закон действия масс и записать выражение константы равновесия. Для диссоциации уксусной кислоты выражение для константы равновесия имеет вид: А. К= [Н+ ]* [СНзСОО ] / [СНзСООН] В. К= [Н+ ] *[СНзСОО ] * [СНзСООН] С. К= [СНзСООН]* [Н+ ] / [СНзСОО ] D. К= [СНзСООН] *[Н+ ] * [СНзСОО ] Е. К= [СНзСООН] / [Н+ ] *[СНзСОО ] |
10) Для слабых электролитов степень диссоциации возрастает при разбавлении раствора. При этом уравнение для степени диссоциации записывается в виде К/С и показывает связь между степенью диссоциации электролита и: А. Температурой раствора. В. Концентрацией раствора. С. рН раствора. D. Ионной силой раствора Е. Активностью ионов раствора. |
Эталоны ответов к тестам.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
6 |
А |
|
| 2 |
B |
7 |
|
| 3 |
8 |
||
| 4 |
A |
9 |
|
| 5 |
10 |
В |
РАСЧЕТНЫЕ ЗАДАЧИ ПО ТЕМЕ:
«Равновесие в водных растворах сильных и слабых электролитов»
Пример решения задач:
| Условие задачи |
Решение задачи |
| Вычислить [H+ ], pH в 0,7%-ном растворе циановодородной (синильной) кислоты. |
Синильная кислота – слабый электролит, поэтому в водных растворах она диссоциирует не полностью согласно уравнению: HCN H+ + CN Выражение для константы диссоциации: Ка = [H + ] * [CN ] / [HCN]; Ка = 5,0 * 10 -10 (1) Обозначим [H + ] = Х, тогда из уравнения диссоциации кислоты следует, что [H + ] = [CN ] = Х. Равновесная концентрация молекул равна начальной концентрации кислоты (С) за вычетом концентрации диссоциированной части (Х). [HCN] = С – Х. Подставим указанные значения в формулу для константы диссоциации (1), получаем уравнение (2) Ка = Х2 / (С – Х) (2) Т.к. HCN – слабый электролит, можно предположить, что Х С. При этом величиной Х в знаменателе уравнения (2) можно пренебречь, и оно принимает упрощенный вид (3): Ка = Х2 / С (3) Из уравнения (3) следует: [H + ] = Х = (Ка * С), (4) где С – молярная концентрация электролита. Переводим процентную концентрацию раствора HCN () в молярную (С) с помощью формулы: С = 1000 * * / М * 100 = 10 * 0,7 * 1 / 27,02 = 2,59 * 10-1 моль/дм3 , где М – молярная масса HCN; – плотность раствора HCN. Вследствие малой концентрации раствора HCN (0,7%) принимаем = 1 г/см3 . По формуле (4) рассчитаем [H + ]: [H + ] = Х = (2,59 * 10-1 * 5,0 * 10-10 ) = 1,14 * 10-5 моль/дм3 . рН = - lg [H + ] = - lg (1,14 * 10-5 ) = 4,94 ОТВЕТ: рН =4,94 |
Пожалуйста, решите самостоятельно:
| Условие задачи |
Решение задачи |
| 1) Вычислить [OH- ], рН, рОН в 0,5%-ных растворах натрия гидроксида и аммиака |
|
| 2) Вычислить [H+ ], рН в 0,7%-ных растворах хлорной и хлорноватистой кислот. |
|
| 3) Вычислить рН, степень диссоциации и долю (%) недиссоциированных молекул в 0,3М растворе азотистой кислоты. |
|
| 4) Вычислить молярную концентрацию раствора уксусной кислоты с рН = 3,54. |
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к задачам.
Задача 1. Раствор натрия гидроксида: рН =13,1 [OH- ] = 0,125 моль/дм3 рОН = 0,9
Раствор аммиака: рН =11,2 [OH- ] =0,0016 моль/дм3 рОН = 2,8
Задача 3. рН =1,9 = 4,1% а = 95,9%
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие 2М раствора HCl (группового реагента). К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора хлороводородной кислоты. Испытывают отношение осадков к раствору аммиака и избытку хлороводородной кислоты. |
||
| 3.1. Действие раствора натрия сульфида. К 3-4 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора натрия сульфида. Испытывают отношение осадков к разведенной азотной кислоте при нагревании. |
||
| 3.2. Действие NaOH и KOH. К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора натрия или калия гидроксида. Образующиеся осадки делят на три части и испытывают отношение к раствору аммиака, разведенной азотной кислоте и избытку натрия гидроксида. |
||
| 3.3. Действие калия йодида. К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора калия йодида. Осадок свинца йодида делят на две части. К одной части прибавляют 3-4 капли разведенной уксусной, к другой – 10 капель дистиллированной воды. Содержимое пробирок нагревают, а затем охлаждают. |
||
| 3.4. Действие раствора аммиака. К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют сначала по 2-3 капли, а затем избыток раствора аммиака. Полученный раствор, содержащий [Ag(NH3 )2 ]+ - ионы, делят на две части, к первой прибавляют 2М раствор HNO3 до кислой реакции, а ко второй – 3 капли раствора калия йодида. |
||
| 3.5. Действие хроматов. К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора калия хромата. Осадок свинца хромата делят на две части и исследуют его отношение к 2М растворам HNO3 и NaOH. |
||
| 3.6. Действие карбонатов. К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора натрия карбоната или калия карбоната |
||
| 3.7. Действие сульфатов на катионы свинца. К 2-3 каплям раствора солей серебра, свинца и ртути (I) прибавляют 2-3 капли 1М раствора серной кислоты и испытывают отношение полученного осадка сульфата свинца к 2М раствору NaOH и 30% раствору ацетата аммония. |
Эталон выполнения задания экспериментальной работы.
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие 2М раствора HCl (группового реагента). К 2-3 каплям растворов солей серебра, свинца и ртути (I) прибавляют по 2-3 капли раствора хлороводородной кислоты. Испытывают отношение осадков к раствору аммиака и избытку хлороводородной кислоты. |
Ag+ + Cl- AgCl Hg2 2+ + Cl- Hg2 Cl2 Pb2+ + 2Cl- PbCl2 AgCl + Cl- [AgCl2 ]- Hg2 Cl2 + Cl- [Hg2 Cl3 ]- PbCl2 + Cl- [PbCl3 ]- AgCl + 2NH3 * H2 O [Ag(NH3 )2 ]+ + Cl- + H2 O Hg2 Cl2 + 2NH3 * H2 O [NH2 Hg2 ]Cl + NH4 + + Cl- + 2H2 O [NH2 Hg2 ]Cl NH2 HgCl + Hg |
Выпадение белых кристаллических осадков Частичное растворение осадков Растворение осадка Почернение белого осадка |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Решение задач. |
20 |
Целевые обучающие задания. |
||
| 4. |
Инструктаж по технике безопасности. |
5 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 5. |
Самостоятельная работа. Выполнение лабораторной работы. |
85 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 6. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 7. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 8. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественные реакции катионов II-ой аналитической группы Ag + , Hg2 2+ , Pb 2 . Анализ смеси катионов II-ой аналитической группы. Решение расчетных задач на равновесия в водных растворах сильных и слабых электролитов.
|
|
|
|
|
|
|
|
|
|
|
 |
ЗАНЯТИЕ № 4
Тема: Качественные реакции катионов III -ей аналитической группы Ba2+ , Sr2+ , Ca2+ . Анализ смеси катионов III -ей аналитической группы. Решение расчетных задач на равновесия в гетерогенных системах.
Актуальность темы. К катионам III-ей аналитической группы относятся катионы щелочноземельных металлов бария, стронция, кальция. Эти элементы используются в медицине, т.к. входят в состав многих лекарственных средств, например, кальция хлорид, кальция лактат, кальция глюконат, кальция глицерофосфат, бария сульфат. Данные соли применяются как источники ионов кальция для организма, антиаллергические антигистаминные препараты, антидоты при отравлении солями тяжелых металлов, сульфат бария применяют как рентгеноконтрастное средство. Реакции идентификации катионов III-ей аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Химические равновесия, которые устанавливаются в гетерогенных системах (между твердой фазой и раствором), подчиняются закону действия масс и применяются при расчетах растворимости веществ, в том числе, лекарственных средств.
Общая цель. Уметь трактовать химико-аналитические свойства катионов III-ей аналитической группы, их реакции идентификации, а также равновесия в гетерогенных системах для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Трактовать химические свойства катионов III-ей аналитической группы и действие группового реагента.
2. Проводить качественные реакции идентификации на катионы бария, стронция, кальция в растворах.
3. Трактовать ход качественного анализа катионов III-ей аналитической группы при совместном присутствии.
4. Решать задачи на равновесия в гетерогенных системах.
5. Интерпретировать свойства катионов III-ей аналитической группы в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
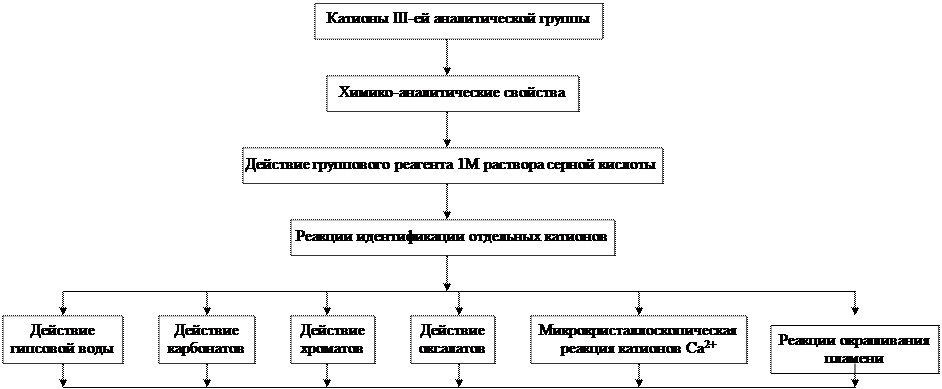
- Химико-аналитические свойства катионов III-ей аналитической группы, их положение в Периодической системе.
- Действие группового реагента (1М раствора серной кислоты)
- Реакции идентификации катионов III-ей аналитической группы в растворах.
3.1. Действие гипсовой воды (насыщенного раствора кальция сульфата).
3.2. Действие карбонатов.
3.3. Действие хроматов.
3.4. Действие оксалатов.
3.5. Микрокристаллоскопическая реакция на катионы кальция.
3.6. Реакции окрашивания пламени солями бария, стронция и кальция.
4. Систематический ход анализа катионов III -ей аналитической группы при совместном присутствии.
5. Равновесия в гетерогенных системах.
5.1. Растворимость электролитов, насыщенные растворы.
5.2. Произведение растворимости электролитов.
6. Свойства и использование катионов III -ей аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 46 – 66, 197 – 200.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004 – C. 48 – 68, 192 – 195.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 148 – 156.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ.
ТЕСТЫ
| 1) В химико-аналитической лаборатории исследовали раствор, содержащий катионы III-ей аналитической группы. Какой реактив является групповым реагентом для этой группы катионов? A. 0,1М раствор H2 SO4 + C2 H5 OH. B. 1М раствор H2 SO4 + C2 H5 OH. C. 1М раствор HCl + C2 H5 OH. D. Групповой реагент отсутствует. E. 2М раствор HCl + C2 H5 OH. |
3) В лаборатории исследовали растворы со смесями катионов. Какой цвет имеют растворы, которые содержат катионы III -ей группы? A. Желтый. B. Бурый. C. Зеленоватый. D. Бесцветный. E. Голубой. |
| 2) В лаборатории исследовали растворы со смесями катионов. Какой раствор содержит катионы только III-ей аналитической группы? A. Sr2+ , Ca2+ , Со2+ . B. Ca2+ , NH4 + , Ba2+ . C. Na+ , Co2+ , Sr2+ . D. Ba2+ , NH4 + , Ca2+ . E. Ba2+ , Ca2+ , Sr2+ . |
4) С помощью карбонат-ионов можно осадить катионы III-ей аналитической группы. Какой аналитический эффект наблюдается в этой реакции? A. Выпадение белых кристаллических осадков. B. Окрашивание раствора в желтый цвет. C. Выделение пузырьков газа. D. Выпадение желтых кристаллических осадков. E. Окрашивание раствора в зеленый цвет. |
| 5) В смеси присутствуют катионы стронция и бария, для их идентификации используют раствор хромат-ионов. Какой аналитический эффект при этом наблюдается? A. Окрашивание раствора в желтый цвет. B. Выпадение осадка белого цвета. C. Выпадение осадка черного цвета. D. Окрашивание раствора в зеленый цвет. E. Выпадение осадка желтого цвета. |
8) В аналитической лаборатории идентифицировали соединение, внося его в бесцветное пламя горелки. В ходе испытания пламя окрасилось в желто-зеленый цвет. Соли какого катиона присутствуют в растворе? A. Ca2+ . B. Sr2+ . C. Ba2+ . D. Na+ . E. K+ . |
| 6) В смеси присутствуют катионы Na+ , Ba2+ , Co2+ , Zn2+ , K+ . Какой из перечисленных катионов выпадет в осадок при добавлении к раствору гипсовой воды? A. Co2+ . B. Ba2+ . C. Na+ . D. K+ . E. Zn2+ . |
9) В систематическом ходе анализа катионов III-ей аналитической группы на раствор подействовали групповым реагентом. После этого образовавшиеся сульфаты следует перевести в: A.Фосфаты. B. Карбонаты. C. Бикарбонаты. D. Нитраты. E. Хроматы. |
| 7) В химико-аналитической лаборатории исследовали раствор, содержащий катионы Ba2+ , Ca2+ и Sr2+ . При действии группового реагента для практически полного осаждения ионов кальция необходимо прибавить: A. Этиловый спирт. B. Хлороформ. C. Гипсовую воду. D. Минеральную кислоту. E. Аммиак. |
10) В насыщенном растворе сульфата кальция установилось равновесие между молекулами твердой фазы и ионами. Как записать выражение для произведения растворимости для СaSO4 ? A. ПР= [Ca 2+ ]*[SO4 2 ] 2 B. ПР= [Ca 2+ ] 2 *[SO4 2 ] C. ПР= [Ca 2+ ]*[SO4 2 ] D. ПР= [Ca 2+ ] / [SO4 2 ] E. ПР= [ Ca 2+ ] / [SO4 2 ] 2 |
Эталоны ответов к тестам.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
B |
6 |
|
| 2 |
7 |
A |
|
| 3 |
D |
8 |
|
| 4 |
9 |
||
| 5 |
10 |
C |
РАСЧЕТНЫЕ ЗАДАЧИ ПО ТЕМЕ:
«Равновесия в гетерогенных системах»
Пример решения задачи:
| Условие задачи |
Решение задачи |
| Рассчитайте ПР бария сульфата, если в 100 см3 его насыщенного раствора содержится 2,45 * 10-4 г соли. |
В насыщенном растворе бария сульфата твердая фаза находится в равновесии с ионами Ba2+ и SO4 2- : BaSO4 Ba2+ + SO4 2- (1) По уравнению (1) растворимость S, моль/дм3 : S = [Ba2+ ] = [SO4 2- ]. Формула, которая связывает S и ПР, имеет вид: ПРBaSO 4 = [Ba2+ ] * [SO4 2- ] = S * S = S2 (2) Выразим концентрацию насыщенного раствора в моль/дм3 . Если в 100 см3 раствора содержится 2,45 * 10-4 г соли, то в 1 дм3 ее будет в 10 раз больше, т.е. 2,45 * 10-3 г. Рассчитаем растворимость S, моль/дм3 : S = С/М, (3) где М – молярная масса, г/моль; МBaSO 4 = 233,9 г/моль. S = 2,45 * 10-3 / 233,9 = 1,05 * 10-5 моль/дм3 . Подставим значение S в (2): ПРBaSO 4 = ( 1,05 * 10-5 ) 2 = 1,1 * 10 – 10 ОТВЕТ: ПРBaSO4 = 1,1 * 10-10 |
Пожалуйста, решите самостоятельно:
| Условие задачи |
Решение задачи |
| 1) Вычислите ПР железа (II) сульфида, если в 100 см3 его насыщенного раствора содержится 1,97 * 10-8 г соли. |
|
| 2) Вычислите ПР марганца сульфида, если концентрация его насыщенного раствора равна 1,38 * 10-3 г/дм3 . |
|
| 3) Вычислите ПР свинца фосфата, если концентрация его насыщенного раствора равна 1,04 * 10-8 г/дм3 . |
|
| 4) Вычислите ПР бария арсената, если концентрация его насыщенного раствора равна 1,04 * 10-8 г/дм3 . |
|
| 5) По величине ПР бария сульфата вычислите массу осадка ВаSО4 , потерянного за счет растворимости при промывании его 100 см3 воды. |
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к задачам.
Задача 1. ПРFeS =5,01 * 10 -18
Задача 5. 2,45*10 -4 г.
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
|
| 2. Действие 1М раствора H2 SO4 . К 2-3 каплям растворов солей бария, стронция и кальция прибавляют по 2-3 капли 1М раствора H2 SO4 и этанола. Отмечают количество образовавшегося осадка и объясняют, почему сульфаты катионов III аналитической группы осаждаются по-разному. Помещают в две пробирки небольшое количество каждого осадка и приливают в одну 2М раствор минеральной кислоты, в другую – 2М раствор уксусной кислоты. |
|||
| 3.1. Действие гипсовой воды (насыщенного раствора CaSO4 ). К 2-3 каплям растворов солей бария, стронция и кальция прибавляют по 3-4 капли гипсовой воды. Испытывают отношение осадков к действию минеральной и уксусной кислот. |
|||
| 3.2. Действие карбонатов. К 2-3 каплям растворов солей бария, стронция и кальция прибавляют по 3-4 капли раствора Na2 CO3 . Испытывают отношение осадков к действию 2М растворов минеральной и уксусной кислот. |
|||
| 3.3. Действие хроматов. К 2-3 каплям растворов солей бария, стронция и кальция прибавляют по 3-4 капли раствора K2 CrO4 . Испытывают отношение осадков к действию 2М растворов минеральной и уксусной кислот. |
|||
| 3.4. Действие оксалатов. К 2-3 каплям растворов солей бария, стронция и кальция прибавляют по 3-4 капли раствора (NH4 )2 C2 O4 , помещают в две пробирки небольшое количество каждого осадка и приливают в одну 2М раствор HCl, а в другую 2М раствор уксусной кислоты. |
|||
| 3.5. Микрокристаллоскопическая реакция на Са2+ . На предметное стекло наносят каплю раствора соли кальция, прибавляют 1 каплю 1М раствора H2 SO4 , слегка выпаривают на водяной бане до появления кромки по краям капли и рассматривают под микроскопом. |
|||
| 3.6. Реакция окрашивания пламени солями бария, стронция и кальция. |
|||
| Очищенной раскаленной нихромовой петлей захватывают летучую соль соответствующего катиона и вносят в несветящуюся часть пламени горелки. |
|||
| 4. Систематический ход анализа смеси катионов III- ей аналитической группы |
|||
| 4.1. Предварительные наблюдения и испытания Определяют цвет, запах, рН раствора, отношение раствора к уксусной и минеральным кислотам, также проводят реакцию окрашивания пламени газовой горелки. |
|||
| 4.2. Действие группового реагента. К 30 – 40 каплям исследуемого раствора прибавляют последовательно по 10 – 15 капель 1М раствора серной кислоты и этилового спирта, перемешивают.Смесь нагревают на водяной бане, охлаж дают и центрифугируют. Проверяют пол - ноту осаждения. После достижения пол - ноты осаждения Центрифугат отбрасывают, осадок промывают дист. водой, к которой прибавляют несколько капель серной кислоты. |
|||
| 4.3. Перевод сульфатов катионов III -ей аналитической группы в карбонаты. Осадок, полученный по п. 4.2., помещают в фарфоровую чашку, прибавляют 15-20 капель насыщенного раствора карбоната натрия и нагревают на кипящей водяной бане в течение 10-15 минут при постоянном перемешивании. Охлажденную смесь переносят в пробирку и центрифугируют. Центрифугат отбрасывают. Эту операцию повторяют не менее трех раз. |
|||
| 4.4. Растворение осадка карбонатов. Осадок, полученный по п. 4.3., растворяют в 15-20 каплях 2М раствора уксусной кислоты при нагревании на водяной бане |
|||
| 4.5. Обнаружение и отделение катионов бария. К 2-3 каплям раствора, полученного по п. 4.4., прибавляют 2 капли калия хромата. Образование желтого осадка указывает на присутствие ионов бария. Если они присутствуют, то ко всему раствору прибавляют раствор калия хромата в таком количестве, чтобы жидкость над осадком была окрашена в желтый цвет. Проверяют полноту осаждения BaCrO4 . Осадок отделяют центрифугированием и убирают. |
|||
| 4.6. Обнаружение и отделение катионов стронция. К 3-4 каплям центрифугата, полученного по п. 4.5., прибавляют 3-4 капли гипсовой воды, нагревают на водяной бане в течение 1-2 минут и оставляют на несколько минут. Появление белой мути свидетельствует о присутствии ионов стронция. Если ионы стронция присутствуют, то к центрифугату прибавляют 1,5 объема насыщенного раствора аммония сульфата и нагревают на водяной бане 10 -15 минут. Смесь центрифугируют и осадок не анализируют. |
|||
| 4.7. Обнаружение катионов кальция. К 2-3 каплям центрифугата, полученного по п. 4.6., прибавляют 2-3 капли 2М раствора уксусной кислоты и 4-5 капель раствора аммония оксалата. Выпадение белого осадка указывает на присутствие Ca2+ . |
|||
Эталон выполнения задания экспериментальной работы.
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие 1М раствора H2 SO4 . К 2-3 каплям растворов солей бария, стронция и кальция прибавляют по 2-3 капли 1М раствора H2 SO4 и этанола. Отмечают количество образовавшегося осадка и объясняют, почему сульфаты катионов III аналитической группы осаждаются по-разному. Помещают в две пробирки небольшое количество каждого осадка и приливают в одну 2М раствор минеральной кислоты, в другую – 2М раствор уксусной кислоты. |
Ba2+ + SO4 2- BaSO4 Sr2+ + SO4 2- SrSO4 Ca2+ + SO4 2- CaSO4 CaSO4 + SO4 2- [Ca(SO4 )2 ]2- |
Выпадение белых кристаллических осадков Растворение осадка |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Решение задач. |
20 |
Целевые обучающие задания |
||
| 4. |
Инструктаж по технике безопасности. |
5 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 5. |
Самостоятельная работа. Выполнение лабораторной работы. |
85 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 6. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 7. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 8. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественные реакции катионов III -ей аналитической группы Ba2+ , Sr2+ , Ca2+ . Анализ смеси катионов III -ей аналитической группы. Решение расчетных задач на равновесия в гетерогенных системах .
 |
||
 |
||
ЗАНЯТИЕ № 5
Тема: Качественные реакции катионов IV-ой аналитической группы Al3+ , Zn2+ , Cr3+ , Sn2+ , Sn4+ , As3+ , As5+ . Анализ смеси катионов IV-ой аналитической группы. Решение расчетных задач на равновесия в буферных растворах.
Актуальность темы. К катионам IV-ой аналитической группы относятся катионы p-элементов: Al3+ , Sn2+ , Sn 4+ , As 3+ , As 5+ и
d-элементов: Zn2+ , Cr3+ . Соединения этих элементов применяются в медицине, т.к. входят в состав многих лекарственных средств, например, цинка оксид (вяжущее и дезинфицирующее средство), цинка сульфат (антисептическое средство), алюминия гидроксид (адсорбирующее и обволакивающее средство, составная часть препарата «Альмагель»), арсенистый ангидрид. Реакции идентификации катионов IV-ой аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Буферные растворы широко применяются в качественном и количественном анализе для создания и поддержания нужного рН среды, что часто применяется в анализе лекарственных форм и сырья.
Общая цель. Уметь трактовать химико-аналитические свойства катионов IV-ой аналитической группы, их реакции идентификации, а также равновесия в буферных растворах для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Интерпретировать химико-аналитические свойства катионов IV-ой аналитической группы и действие группового реагента.
2. Проводить качественные реакции идентификации на катионы алюминия, цинка, хрома, олова (II), олова (IV), мышьяка (III), мышьяка (V) в растворах.
3. Трактовать ход качественного анализа катионов IV-ой аналитической группы при совместном присутствии
4. Решать задачи на равновесия в буферных растворах.
5. Интерпретировать свойства катионов IV-ой аналитической группы в случаях их присутствия в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
1. Химико-аналитические свойства катионов IV-ой аналитической группы, их положение в Периодической системе.
2. Действие группового реагента (6М раствора натрия гидроксида в присутствии 3%-ного раствора пероксида водорода).
3. Реакции идентификации катионов IV-ой аналитической группы в растворах.
3.1. Реакции идентификации соединений мышьяка.
3.1.1. Реакция восстановления мышьяка (III) и мышьяка (V) металлическим цинком.
3.1.2. Реакция восстановления мышьяка (III) и мышьяка (V) раствором олова (II) хлорида.
3.2. Реакции идентификации катионов олова (II)
3.2.1. Действие растворов солей ртути (II)
3.2.2. Другие реакции восстановления оловом (II)
3.3. Реакции идентификации катионов хрома.
3.3.1. Окисление ионов хрома пероксидом водорода.
3.3.2. Образование надхромовой кислоты.
3.3.3. Образование окрашенных перлов буры.
3.4. Реакции идентификации катионов цинка.
3.4.1. Действие раствора калия гексацианоферрата (II).
3.4.2. Действие дитизона.
3.5. Реакции идентификации катионов алюминия.
3.5.1. Действие ализарина.
3.5.2. Действие раствора натрия ацетата.
3.5.3. Действие кобальта нитрата.
4. Систематический ход анализа катионов IV-ой аналитической группы при совместном присутствии.
5. Буферные растворы, буферная емкость, рН буферных растворов.
6. Свойства и использование катионов IV-ой аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 –C. 67 – 82, 188 – 195.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова.- Харків, вид-во НФАУ Оригiнал, 2004 – C. 68 – 83, 184 – 191.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Лурье Ю.Ю.: Справочник по аналитической химии: Справочник. Москва – Химия, 1989 – С. 267 – 276.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ.
ТЕСТЫ
| 1) В химико-аналитической лаборатории определяли катионы IV аналитической группы. Какой реактив является групповым реагентом для этих катионов? A. Групповой реагент отсутствует. B. 1М раствор H2 SO4 + 3% раствор H2 O2 . C. 6М раствор NaOH + C2 H5 OH. D. 0,2М раствор H2 SO4 + C2 H5 OH. E. 6М раствор NaOH + 3% раствор H2 O2 . |
2) В лаборатории исследовали растворы со смесями катионов. Какой раствор содержит катионы только IV аналитической группы? A. Al3+ , Zn2+ , Cr3+ , As5+ B. Ba2+ , Zn2+ , Cr3+ , As5+ . C. Bi3+ , Hg2+ , Cr3+ , As3+ . D. Al3+ , Zn2+ , Fe3+ , Sb5+ . E. Fe3+ , Cu2+ , Cr3+ , As5+ . |
| 3) В химико-аналитической лаборатории идентифицировали катион алюминия с помощью реакции с ализарином. Результатом данной реакции является образование внутрикомплексной соли или «алюминиевого лака». Какого цвета данное соединение? A. Бледно-розового. B. Ярко-красного. C. Ярко-зеленого. D. Бледно-красного. E. Ярко-желтого. |
6) В химико-аналитической лаборатории исследовали раствор, содержащий соль цинка. При взаимодействии исследуемого раствора с K4 [ Fe( CN)6 ] образовался белый осадок двойной соли. В какой среде должна протекать данная реакция? A. Сильнокислая. B. Сильнощелочная. C. Нейтральная. D. Слабокислая. E. Слабощелочная. |
| 4) В кислой среде ионы As( III) и As( V) восстанавливаются металлическим цинком до AsH3 , который идентифицируют по почернению фильтровальной бумаги. Каким реактивом смачивают фильтровальную бумагу для идентификации газообразного мышьяковистого водорода? A. AgNO3 . B. NH3 . C. Pb(CH3 COO)2 . D. AgNO2 . E. Hg2 Cl2 . |
7)Для идентификации солей алюминия используют их свойство при прокаливании с Co( NO3 )2 образовывать кобальта алюминат. Какого цвета данное соединение? A. Синего. B. Красного. C. Зеленого. D. Желтого. E. Фиолетового. |
| 5) В химико-аналитической лаборатории исследовали раствор, содержащий смесь катионов IV аналитической группы. С помощью какого реактива можно идентифицировать катион Zn2+ в присутствии других катионов IV аналитической группы ? A. Ализарина. B. Натрия ацетата. C. Дитизона. D. Олова (II) хлорида. E. Кобальта нитрата. |
8) В химико-аналитической лаборатории идентифицировали катионы олова. В результате определенной реакции выпал белый осадок, который быстро почернел. Какой реактив использовался? A. NaOH + H2 O2 . B. Co(NO3 )2 . C. AgNO3 . D. Hg2 Cl2 . E. K4 [Fe(CN)6 ]. |
| 9) В химико-аналитической лаборатории для создания необходимого рН среды использовали ацетатный буферный раствор. Какое уравнение нужно применить для расчета рН буферного раствора? A. рН= pKa – lg (Скислоты / Ссоли ) B. рН= pKa + lg (Скислоты / Ссоли ) C. рН= pKa * lg (Скислоты / Ссоли ) D. рН= pKa – lg Скислоты E. рН= pKa – lg Ссоли |
10)Одним из часто применяемых буферов является формиатная буферная смесь. Из каких компонентов она состоит? A. CH3 COOH + CH3 COONa B. HCOOН + HCOONa C. C6 H5 COOH + C6 H5 COONa D. NН4 ОН + N4 HСl E. NaOH + NaCl |
Эталоны ответов к тестам.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
6 |
||
| 2 |
A |
7 |
A |
| 3 |
8 |
||
| 4 |
9 |
||
| 5 |
C |
10 |
В |
РАСЧЕТНЫЕ ЗАДАЧИ ПО ТЕМЕ:
«Равновесия в буферных растворах»
Пример решения задачи:
| Условие задачи |
Решение задачи |
| Вычислить рН ацетатной буферной смеси, содержащей в 1 дм3 раствора 0,2 моля каждого из компонентов. Как изменится рН при добавлении к 1 дм3 смеси: 0,01 моля HCl; 0,01 моля NaOH. |
В состав ацетатной буферной смеси входит уксусная кислота и натрия ацетат. Уксусная кислота – слабый электролит и диссоциирует по уравнению: CH3 COOH H+ + CH3 COO - (1) Ka = [H+ ] * [CH3 COO- ] / [CH3 COOH] pKa = 4,76 (2) Ацетат натрия – сильный электролит, диссоциирует полностью: CH3 COONa CH3 COO- + Na+ (3) В присутствии одноименных ионов равновесие (1) очень смещено влево, т.е. равновесную концентрацию молекул кислоты можно принять равной ее начальной концентрации: [CH3 COOH] = Скислоты Т.к. уксусная кислота – слабый электролит, то почти все ионы CH3 COO - образуются вследствие диссоциации соли: [CH3 COO- ] = Ссоли Из уравнения (2) вычислим [H+ ]: [H+ ] = Ка * [CH3 COOH] / [CH3 COO- ] (4) Прологарифмируем уравнение (4) и заменим знаки на противоположные: рН = - lg[H+ ] = pKa – lg (Скислоты / Ссоли ) (5) Скислоты = Ссоли = 0,2 моль/дм3 ; рН = 4,76 – lg 0,2 / 0,2 = 4,76 Если к 1 дм3 смеси прибавить 0,01 моля HCl, то вследствие реакции между HCl и CH3 COONa концентрация уксусной кислоты возрастает до 0,21 моль/дм3 , а концентрация CH3 COO- -ионов снизится до 0,19 моль/дм3 . Тогда: рН = 4,76 – lg 0,21/0,19 = 4,72. Если к 1 дм3 смеси прибавить 0,01 моля NaOH, то вследствие реакции между NaOH и CH3 COOH концентрация уксусной кислоты снизится до 0,19 моль/дм3 , а концентрация CH3 COO- -ионов возрастет до 0,21 моль/дм3 . Тогда: рН = 4,76 – lg 0,19/0,21 = 4,80. ОТВЕТ: рН = 4,76; рН = 4,72; рН = 4,80. В случае буферных растворов, в состав которых входит слабое основание и его соль, расчет рН проводят с помощью уравнения: рН = 14 – рКоснования + lg (Соснования / Ссоли . ) |
Пожалуйста, решите самостоятельно:
| Условие задачи |
Решение задачи: |
| 1) Вычислите рН ацетатной буферной смеси, содержащей в 1 дм3 раствора 0,2 моля CH3 COONa и 0,2 моля CH3 COOH. Как изменится рН этого раствора при добавлении 0,01 моля HCl? |
|
| 2) Вычислите рН аммиачной буферной смеси, содержащей по 0,5 моля NH3 *H2 O и NH4 Cl в 1 дм3 раствора. Как изменится рН этого раствора при добавлении 0,2 моля NaOH? |
|
| 3) Бензоатная буферная смесь содержит 0,35 моля C6 H5 COOH и 0,35 моля C6 H5 COONa в 1 дм3 раствора. Вычислить рН буферного раствора. |
|
| 4) Каким должно быть соотношение между компонентами в ацетатном буферном растворе, рН которого равно 5,0? |
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к задачам.
Задача 1. рН = 4,76, после добавления HCl рН = 4,72
Задача 4. Скислоты / Ссоли = 0,57
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие раствора NaOH. К 3-4 каплям отдельно взятых растворов солей алюминия, хрома, цинка, олова (II), олова (IV), мышьяка (III), мышьяка (V) приливают по 4 капли раствора натрия гидроксида. Помещают в две пробирки небольшое количество каждого из осадков и приливают в одну из пробирок избыток раствора натрия гидроксида, в другую – раствор минеральной кислоты. |
||
| 2.1. Изучение свойств растворов [ Al( OH)6 ]3- -, [ Cr( OH)6 ]3- -, [ Zn( OH)4 ]2- -, [ Sn( OH)4 ]2- -, [ Sn( OH)6 ]2- -ионов. К 5-6 каплям солей Al3+ , Zn2+ , Cr3+ , Sn2+ , Sn(IV) прибавляют избыток натрия гидроксида до растворения осадков гидроксидов, которые образуются в начале прибавления. Полученные растворы делят на три части: одну – нагревают, к другой – прибавляют немного твердого аммония хлорида, к третьей – прибавляют по капле раствор хлороводородной кислоты. |
||
| 3.1. Реакции идентификации соединений мышьяка. |
||
| 3.1.1. Реакция восстановления As ( III) и As ( V) до AsH3 . (СОЕДИНЕНИЯ МЫШЬЯКА – СИЛЬНЫЙ ЯД!) В пробирку помещают гранулу металлического цинка, приливают 0,5 мл 2М хлороводородной кислоты, 5 капель раствора натрия арсенита и в верхнюю часть пробирки помещают вату, смоченную раствором ацетата свинца. Вату используют для того, чтобы уловить сероводород и серы (IV) оксид (продукты возможного восстановления сульфатной кислоты), которые могут взаимодей-ствовать с меркурия дихлоридом с образо-ванием осадков Hg, HgS черного цвета. Пробирку закрывают полоской фильтро-вальной бумаги, смоченной 0,01М раствором хлорида ртути (II). |
||
| 3.2. Реакции идентификации катионов олова ( II). |
||
| 3.2.1. Реакция окисления солей Sn2+ солями Hg2+ . К 3-4 каплям соли олова (II) прибавляют 5 капель воды, а затем 3 капли раствора соли ртути (II). |
||
| 3.2.2. Реакция восстановления Fe3+ до Fe2+ . К 2-3 каплям раствора соли Fe3+ прибавляют по 2 капли 2 М растворов НСl и K3 [Fe(CN)6 ]. К полученной смеси прибавляют каплю раствора соли олова (II). |
||
| 3.3. Реакции идентификации катионов хрома ( III). |
||
| 3.3.1.Реакция окисление Cr3+ пероксидом водорода. К 2-3 каплям раствора соли хрома (III) прибавляют 5-6 капель 2М раствора натрия гидроксида, 2-3 капли 3%-ного раствора пероксида водорода и нагревают пробирку несколько минут на водяной бане до перехода зеленой окраски раствора в желтую |
||
| 3.3.2. Реакция образование надхромовой кислоты. 1-2 капли раствора калия хромата, разбавленного 5 каплями дистиллированной воды, подкисляют 2 каплями минеральной кислоты, прибавляют 4-5 капель амилового спирта и каплю раствора пероксида водорода. |
||
| 3.3.3. Образование окрашенных перлов буры. Прокаливают ушко платиновой (или нихромовой) проволоки до красного цвета, дотрагиваются им до твердого натрия тетрабората и прокаливают в пламени газовой горелки, пока масса не перестанет пениться. Охлаждают полученную стекловидную массу и, взяв немного осадка Cr(OH)3 , снова прокаливают. После охлаждения отмечают цвет перла в проходящем свете. |
||
| 3.4. Реакции идентификации катионов цинка. |
||
| 3.4.1. Действие раствора K4 [ Fe( CN)6 ]. К 2-3 каплям соли цинка добавляют 2 капли раствора K4 [Fe(CN)6 ]. Испытывают отношение полученного осадка к HCl. |
||
| 3.4.2. Действие дитизона. К 8 каплям раствора соли цинка прибавляют 5 капель аммиачного буферного раствора и 5 капель раствора дитизона. |
||
| 3.5. Реакции идентификации катионов алюминия. |
||
| 3.5.1. Действие ализарина. К 2-3 каплям раствора соли алюминия прибавляют 10 капель раствора аммиака раствора и 2 капли ализарина. При появлении фиолетовой окраски добавляют по каплям раствор CH3 COOH до перехода фиолетовой окраски в красную. |
||
| 3.5.2. Действие раствора натрия ацетата. К 2-3- каплям раствора соли алюминия добавляют 2 капли раствора натрия ацетата и нагревают на водяной бане. |
||
| 3.5.3. Действие кобальта нитрата. К 2-3 каплям раствора соли алюминия прибавляют 2 капли раствора аммиака, выпавший осадок Al(OH)3 отфильтровывают, фильтр осторожно высушивают, смачивают разбавленным раствором Co(NO3 )2 , подсушивают и прокаливают в пламени горелки. |
||
Эталон выполнения задания экспериментальной работы.
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие раствора NaOH. К 3-4 каплям отдельно взятых растворов солей алюминия, хрома, цинка, олова (II), олова (IV), мышьяка (III), мышьяка (V) приливают по 4 капли раствора натрия гидроксида. Помещают в две пробирки небольшое количество каждого из осадков и приливают в одну из пробирок избыток раствора натрия гидроксида, в другую – раствор минеральной кислоты. |
Sn2+ + 2OH- Sn(OH)2 [SnCl6 ]2- + 4OH- Sn(OH)4 + 6Cl- Cr3+ + 3OH- Cr(OH)3 Zn2+ + 2OH- Zn(OH)2 Al3+ + 3OH- Al(OH)3 Al(OH)3 + 3OH- [Al(OH)6 ]3- Sn(OH)4 + 2OH- [Sn(OH)6 ]2- Sn(OH)2 + 4OH- [Sn(OH)6 ]4- Cr(OH)3 + 3OH- [Cr(OH)6 ]3- Zn(OH)2 + 2OH- [Sn(OH)4 ]2- |
Выпадение белых кристаллических осадков Растворение осадков |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Решение задач. |
20 |
Целевые обучающие задания |
||
| 4. |
Инструктаж по технике безопасности. |
5 |
Инструкция по технике безопасности |
Учебная лаборатория. |
|
| 5. |
Самостоятельная работа. Выполнение лабораторной работы. |
85 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 6. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 7. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 8. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественные реакции катионов IV-ой аналитической группы Al3+ , Zn2+ , Cr3+ , Sn2+ , Sn4+ , As3+ , As5+ . Анализ смеси катионов IV-ой аналитической группы. Решение расчетных задач на равновесия в буферных растворах.
![]()
![]()
ЗАНЯТИЕ № 6
Тема: Качественные реакции катионов V-ой аналитической группы Mg2+ , Sb3+ , Sb5+ , Bi3+ , Fe2+ , Fe3+ , Mn2+ . Анализ смеси катионов V –ой аналитической группы. Решение задач на равновесия в растворах гидролизующихся солей .
Актуальность темы. К катионам V-ой аналитической группы относятся катионы s-элементов: Mg2+ , p-элементов – Sb3+ , Sb5+ , Bi3+ , и d-элементов: Fe2+ , Fe3+ , Mn2+ . Эти элементы входят в состав многих лекарственных средств, например, калия перманганат (антисептик), висмута нитрат основной, магния оксид (антидот при отравлении мышьяком, составная часть препарата «Альмагель»), магния сульфат (спазмолитик), магния карбонат основной (вяжущее), железа сульфат (источник поступления железа при анемиях). Реакции идентификации катионов V-ой аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Как вы убедились на предыдущих занятиях, многие соли являются лекарственными веществами. При растворении некоторые соли способны взаимодействовать с водой (подвергаться гидролизу), что необходимо учитывать при приготовлении и хранении различных лекарственных форм.
Общая цель. Уметь трактовать химико-аналитические свойства катионов V-ой аналитической группы, их реакции идентификации, а также равновесия в растворах гидролизующихся солей для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Интерпретировать химико-аналитические свойства катионов V-ой аналитической группы и действие группового реагента.
2. Проводить качественные реакции идентификации на катионы магния, сурьмы(III), сурьмы (V), висмута, железа (II), железа
(III), марганца в растворах.
4. Трактовать ход качественного анализа катионов V-ой аналитической группы при совместном присутствии.
5. Решать задачи на равновесия в растворах солей, подвергающихся гидролизу.
6. Интерпретировать свойства катионов V-ой аналитической группы в случаях их присутствия в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
1. Химико-аналитические свойства катионов V-ой аналитической группы, их положение в Периодической системе.
2. Действие группового реагента (2М раствора аммиака).
3. Действие растворов натрия гидроксида или калия гидроксида.
4. Реакции идентификации катионов V-ой аналитической группы в растворах.
4.1. Реакции идентификации катионов магния.
4.1.1. Действие натрия гидрофосфата.
4.1.2. Микрокристаллоскопическая реакция.
4.2. Реакции идентификации катионов железа (II).
4.2.1. Действие раствора калия гексацианоферрата (III).
4.2.2. Действие сульфосалициловой кислоты в кислой среде.
4.3. Реакции идентификации катионов железа (III).
4.3.1. Действие раствора калия гексацианоферрата (II).
4.3.2. Действие тиоционат-ионов.
4.3.3. Действие сульфосалициловой кислоты в кислой среде.
4.4. Реакции идентификации катионов марганца.
4.4.1. Окисление Mn2+ до MnO4 - с помощью раствора персульфата.
4.5. Реакции идентификации катионов висмута.
4.5.1. Действие свежеприготовленного раствора натрия гексагидроксостаннита (II).
4.5.2. Гидролиз солей висмута.
4.6. Реакции идентификации катионов сурьмы (III), (V).
4.6.1. Восстановление ионов сурьмы.
4.6.2. Гидролиз солей сурьмы (III), (V).
5. Систематический ход анализа катионов V-ой аналитической группы при совместном присутствии.
6. Гидролиз солей.
6.1. Константа гидролиза, степень гидролиза.
6.2. Гидролиз солей, образованных слабой кислотой и сильным основанием.
6.3. Гидролиз солей, образованных сильной кислотой и слабым основанием.
6.4. Гидролиз солей, образованных слабой кислотой и слабым основанием.
7. Свойства и использование катионов V-ой аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 82 – 97,
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-тво НФАУ Оригiнал, 2004 – C. 83 – 99.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – C. 235 – 272.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ .
ТЕСТЫ
| 1) В лаборатории исследовали раствор, содержащий следующие катионы: Mg2+ , Sb3+ , Sb5+ , Bi3+ , Fe2+ , Fe3+ , Mn2+ . К какой аналитической группе они относятся в соответствии с классификацией по кислотно-основному методу? A. IV. B. II. C. I. D. III. E. V. |
4) В химико-аналитической лаборатории вследствие гидролиза солей висмута, сурьмы ( III) и сурьмы ( V) образовались белые осадки основных солей SbOCl, SbO2 Cl, BiONO3 . В чем можно растворить образовавшиеся соли? A. щелочь. B. аммиак. C. спирт. D. ацетон. E. кислота. |
| 2) В химико-аналитической лаборатории необходимо провести анализ раствора, содержащего катионы V аналитической группы. Какой реактив является групповым реагентом для этих катионов? A. Групповой реагент отсутствует. B. Концентрированный раствор соляной кислоты. C. Концентрированный раствор аммиака. D. Концентрированный раствор гидроксида натрия. E. Концентрированный раствор серной кислоты. |
5) В химико-аналитической лаборатории идентифицировали катион магния с помощью реакции с натрия гидрофосфатом. Какой аналитический эффект наблюдается при этом? A. Окрашивание раствора в желтый цвет. B. Выпадение белого кристаллического осадка. C. Выпадение желтого кристаллического осадка. D. Окрашивание раствора в красный цвет. E. Окрашивание раствора в фиолетовый цвет. |
| 3) В систематическом ходе анализа раствора, содержащего катионы железа ( III), магния, висмута, сурьмы ( III) и сурьмы ( V), на него подействовали раствором натрия гидроксида, вследствие чего выпали осадки соответствующих гидроксидов. Какой катион после этого можно отделить действием хлорида аммония? A. Mg2+ . B. Sb (III). C. Fe3+ . D. Bi3+ . E. Sb (V). |
6) В химико-аналитической лаборатории исследовали раствор смеси катионов, при добавлении к которому тиоцианат-ионов он окрасился в красный цвет. О наличии какого катиона свидетельствует данный аналитический эффект? A. Fe2+ . B. Mg2+ . C. Fe3+ . D. Bi3+ . E. Mn2+ . |
| 7) В химико-аналитической лаборатории исследовали раствор смеси катионов Fe2+ и Fe3+ . Какой реагент можно использовать для определения катиона железа (ІІІ)? A. (NH4 )2 S2 О8 . B. Na4 [Sn(OH)6 ]. C. Na2 HPO4 . D. К4 [Fе(СN)6 ]. E. К3 [Fе(СN)6 ]. |
9) Известно, что в воде растворили соль, образованную сильной кислотой и слабым основанием. Какое уравнение нужно применить для расчета рН полученного раствора? A. рН = р KH 2 O + р Kкислоты B. рН = р KH 2 O + р Kкислоты – р Kоснования C. рН = р KH 2 O + р Kкислоты – р Kоснования D. рН = р KH 2 O + р Kоснования – р Kкислоты E. рН = р Kкислоты – р Kоснования |
| 8) Катионы железа ( II), ( III) образуют с сульфосалициловой кислотой комплексы различного цвета в зависимости от рН раствора. Какого цвета комплекс образуется при рН = 1,8 – 2,5? A. Красного. B. Синего. C. Фиолетового. D. Белого. E. Оранжевого. |
10) В химико-аналитической лаборатории исследовали раствор хлорида аммония. Какое выражение характеризует константу гидролиза этой соли? A. Кг = [NH4 OH] * [H+ ] / [NH4 + ] B. Кг = [NH4 OH] * [H+ ] * [NH4 + ] C. Кг = [NH4 OH] / [H+ ] * [NH4 + ] D. Кг = [NH4 OH] * [H2 O] * [H+ ] / [NH4 + ] E. Кг = [NH3 ] * [H2 O] * [H+ ] / [NH4 OH] |
Эталоны ответов к тестам.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
E |
6 |
|
| 2 |
7 |
D |
|
| 3 |
8 |
||
| 4 |
9 |
||
| 5 |
B |
10 |
А |
РАСЧЕТНЫЕ ЗАДАЧИ ПО ТЕМЕ:
«Равновесия в растворах гидролизующихся солей»
Пример решения задачи:
| Условие задачи |
Решение задачи |
| Вычислить константу гидролиза, степень гидролиза и рН 0,02 М раствора ацетата аммония. |
CH3 COONH4 – слабая соль, образованная катионом слабого основания и анионом слабой кислоты, поэтому она гидролизуется по катиону и аниону: NH4 + + CH3 COO- + H2 O NH3 *H2 O + CH3 COOH (1) Кг = [NH3 *H2 O] * [CH3 COOH] / [NH4 + ] * [CH3 COO- ] (2) Из выражения для констант диссоциации основания и кислоты можно получить соотношение: [NH3 *H2 O] / [NH4 + ] = [OH- ] / K NH 3 *H 2 O ; [CH3 COOH] / [CH3 COO- ] = [H+ ] / KCH 3 COOH ; Подставим полученные соотношения в уравнение (2): Кг = [H+ ]*[OH- ] / KCH 3 COOH * K NH 3* H 2 O ; Кг = KH 2 O / KCH 3 COOH * K NH 4 OН ; (3) Кг = 10-14 / 1,74 * 10-5 * 1,76 * 10-5 = 3,27 * 10-5 . Вследствие гидролиза 1 моль соли образует 1 моль кислоты и 1 моль основания. Концентрация гидролизованной соли равна CCH 3 COONH 4 * h, где h – степень гидролиза соли. Следовательно: [CH3 COOH]=[NH3 *H2 O] =CCH 3 COONH 4 * h (4) Тогда концентрация негидролизованной соли: CCH 3 COONH 4 – CCH 3 COONH 4 * h = CCH 3 COONH 4 *(1 – h) (5) Учитывая концентрацию негидролизованной соли и то, что соль практически полностью диссоциирует, можно написать равенство: [CH3 COO- ] = [NH4 + ] = CCH 3 COONH 4 *(1 – h) (6) Подставим эти значения концентраций в уравнение (2): Кг = CCH 3 COONH 4 * h * CCH 3 COONH 4 * h / CCH 3 COONH 4 *(1 – h) * CCH 3 COONH 4 *(1 – h) , (7) h2 / (1 – h)2 = Кг . (8) Для расчета h извлекаем корень квадратный из правой и левой частей равенства (8): (h2 / (1 – h)2 ) = Кг , Кг = h / (1 – h). (9) Если учесть, что h1, то уравнение (9) упрощается: h = Кг ; (10) h = (3,2 * 10-5 ) = 5,7 * 10-3 доли, или 0,57% Т.к. h = 5,7 * 10-3 1, то предположение справедливо, а применение уравнения (10) правомерно. Учитывая, что степень гидролиза мала, можно принять, что равновесные концентрации ионов соли при гидролизе практически не изменяются и равны концентрации соли: [CH3 COO- ] = [NH4 + ] = Cсоли (11) С учетом равенств (4) и (11) выражение (2) можно представить следующим образом: Кг = [CH3 COOH]2 / C2 соли (12) В соответствии с выражением константы диссоциации [CH3 COOH] равна: [CH3 COOH] = [CH3 COO- ] * [H+ ] / KCH 3 COOH (13) Из уравнений (11) и (13) получим: [CH3 COOH] = [H+ ] * Cсоли / KCH 3 COOH (14) С учето уравнения (14) уравнение (12) можно записать так: Кг = [H+ ]2 * C2 соли / K2 CH 3 COOH * C2 соли = [H+ ]2 / K2 CH 3 COOH (15) Подставив значение Кг из уравнения (3) в уравнение (15), получим: KH 2 O / KCH 3 COOH * K NH 3 *H 2 O = [H+ ]2 / K2 CH 3 COOH (16) Упрощаем уравнение (16) и решаем относительно [H+ ]: [H+ ] = (KH 2 O * KCH 3 COOH / K NH 3* H 2 O ) (17) После логарифмирования уравнения (17) изменяем знаки на противоположные и вычисляем рН: рН = р KH 2 O + р KCH 3 COOH – р K NH 3* H 2 O . рН = 7 + 2,38 – 2,38 = 7,0. (18) ОТВЕТ: Кг = 3,27 * 10-5 ; h = 0,57%; рН =7,00. |
Пожалуйста, решите самостоятельно:
| Условие задачи |
Решение задачи: |
| 1) Напишите уравнение реакции гидролиза натрия бензоата. Вычислите рН, константу и степень гидролиза для его 0,2 М раствора. |
|
| 2) Напишите уравнение реакции гидролиза натрия фторида. Вычислите константу и степень гидролиза, а также рН раствора, содержащего 32,5 мг этой соли в 500 см3 раствора. |
|
| 3) Напишите уравнение реакции гидролиза калия цианида. Вычислите рН, константу и степень гидролиза в растворе, содержащем 0,05 моля этой соли в 200 см3 раствора. |
|
| 4) Напишите уравнение реакции гидролиза натрия нитрита. Вычислите константу и степень гидролиза, а также рН раствора, содержащего 24,5 г этой соли в 500 см3 раствора |
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к задачам.
Задача 2. Кг = 1,6 * 10 - 14 ; h = 3,2* 10 - 4 %; рН = 5,8
Задача 4. Кг = 1,96* 10 - 11 ; h = 5,25* 10 - 4 %; рН = 7,9
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие 2М раствора NH3 * H2 O (группового реагента). К 2-3 каплям растворов солей магния; сурьмы(III), (V); висмута; железа (II), (III); марганца прибавляют по каплям 2М раствор аммиака. Испытывают отношение осадков к избытку раствора аммиака. |
||
| 3. Действие раствора 2М NaOH. К 6-8 каплям растворов солей магния; сурьмы(III), (V); висмута; железа (II), (III); марганца прибавляют по 5-6 капель 2М раствора натрия гидроксида. Каждый осадок делят на три части и исследуют их отношение к избытку щелочи, минеральной кислоты, насыщенного раствора аммония хлорида |
||
| 3.1. Реакции идентификации катионов магния. |
||
| 4.1.1. Действие раствора Na2 HPO4 . К 1-2 каплям раствора магния хлорида прибавляют 5 капель дистиллированной воды, по 2 капли раствора NH4 Cl, 2М раствора аммиака и 1 каплю раствора Na2 HPO4 . |
||
| 4.1.2. Микрокристаллоскопическая реак. К 1 капле раствора магния хлорида приба-вляют 5 капель дистиллированной воды, по 2 капли раствора NH4 Cl, 2М раствора аммиака, смесь перемешивают. На предметное стекло помещают каплю полученного Раствора, а рядом – каплю раствора натрия гидрофосфата, соединяют их стеклянной палочкой и рассматривают образовавшийся осадок под микроскопом. |
||
| 3.2. Реакции идентификации катионов железа ( II). |
||
| 4.2.1. Действие раствора K3 [ Fe( CN)6 ]. К 2-3 каплям раствора железа (II) хлорида прибавляют 2 капли раствора K3 [Fe(CN)6 ]. Испытывают отношение осадка к действию минеральной кислоты и щелочи. |
||
| 4.2.2. Действие сульфосалициловой кислоты в кислой среде. К 2-3 каплям раствора железа (II) хлорида прибавляют по каплям раствор HCl до рН 2-4 (контролируют с помощью универсальной индикаторной бумаги) и 2-3 капли раствора сульфосалициловой кислоты. |
||
| 3.3. Реакции идентификации катионов железа ( III). |
||
| 4.3.1. Действие раствора K4 [ Fe( CN)6 ]. К 2-3 каплям раствора железа (III) хлорида прибавляют 2 капли раствора K4 [Fe(CN)6 ]. Испытывают отношение осадка к действию минеральной кислоты и щелочи |
||
| 4.3.2. Действие раствора NH4 NCS. К 2-3 каплям раствора железа (III) хлорида прибавляют одну каплю раствора NH4 NCS. К окрашенному раствору прибавляют несколько кристаллов NaF. |
||
| 4.3.3. Действие сульфосалициловой кислоты в кислой среде. К 2-3 каплям раствора железа (III) хлорида прибавляют по каплям раствор HCl до рН 2-4 (контролируют с помощью универсальной индикаторной бумаги) и 2-3 капли р-ра сульфосалициловой кислоты. |
||
| 3.4. Реакции идентификации катионов марганца. |
||
| 4.4.1. Окисление Mn2+ до MnO4 - персульфатом аммония. К 4-5 каплям 2М раствора азотной кислоты прибавляют 2 капли раствора серебра нитрата, несколько кристаллов аммония персульфата и нагревают до 50-60 °С. В нагретую смесь вносят с помощью стеклянной палочки одну каплю разбавленного раствора соли марганца и перемешивают. |
||
| 3.5. Реакции идентификации катионов висмута. |
||
| 4.5.1. Действие свежеприготовленного раствора Na4 [ Sn( OH)6 ]. К 3 каплям раствора SnCl2 прибавляют раствор натрия гидроксида до образования осадка и его растворения. К полученному раствору прибавляют 1-2 капли раствора соли висмута. |
||
| 4.5.2. Гидролиз солей висмута. К 2-3 каплям раствора соли висмута прибавляют 10-12 капель дистиллированной воды. |
||
| 3.6. Реакции идентификации катионов сурьмы ( III), ( V). |
||
| Восстановление ионов сурьмы. На никелевую пластинку наносят 1-2 капли раствора соли сурьмы (III) или (V) и прибавляют гранулу цинка. Образовавшееся черное пятно промывают дистиллированной водой и исследуют его отношение к концентрированной хлороводородной кислоте. |
||
| 4.6.2. Гидролиз солей сурьмы ( III), ( V). К 2-3 каплям раствора соли сурьмы (III) или (V) прибавляют 10-12 капель дистиллированной воды. |
||
Эталон выполнения задания экспериментальной работы
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие 2М раствора NH3 * H2 O (группового реагента). К 2-3 каплям растворов солей магния; сурьмы(III), (V); висмута; железа (II), (III); марганца прибавляют по каплям 2М раствор аммиака. Испытывают отношение осадков к избытку раствора аммиака. |
Mg2+ + 2NH3 *H2 O Mg(OH)2 + 2NH4 + [SbCl6 ]- + 5NH3 *H2 O HSbO3 + 6Cl- + 5NH4 + + 2H2 O [SbCl6 ]3- + 3NH3 *H2 O Sb(OH)3 + 6Cl- + 3NH4 + Mn2+ + 2NH3 *H2 O Mn(OH)2 + 2NH4 + Fe2+ + 2NH3 *H2 O Fe(OH)2 + 2NH4 + Fe3+ + 2NH3 *H2 O Fe(OH)3 + 3NH4 + Bi2+ + 2NH3 *H2 O + Cl- Bi(OH)2 Cl + 2NH4 + Bi(OH)2 Cl BiOCl + H2 O |
Выпадение осадков белого цвета |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Решение задач. |
20 |
Целевые обучающие задания. |
||
| 4. |
Инструктаж по технике безопасности. |
5 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 5. |
Самостоятельная работа. Выполнение лабораторной работы. |
85 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 6. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 7. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 8. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественные реакции катионов V-ой аналитической группы Mg2+ , Sb3+ , Sb5+ , Bi3+ , Fe2+ , Fe3+ , Mn2+ . Анализ смеси катионов V –ой аналитической группы. Решение задач на равновесия в растворах гидролизующихся солей .
![]()
![]()
ЗАНЯТИЕ № 7
Тема: Качественные реакции катионов VI-ой аналитической группы Cu2+ , Hg2+ , Co2+ , Ni2+ . Анализ смеси катионов VI-ой аналитической группы. Решение расчетных задач на равновесия в растворах комплексных соединений.
Актуальность темы. К катионам VI-ой аналитической группы относятся катионы d-элементов: Cu2+ , Hg2+ , Co2+ , Ni2+ , электронная структура которых характеризуется наличием свободных d-орбиталей. Эти элементы используются в медицине, т.к. входят в состав многих лекарственных средств – сульфат меди, ртути оксид, ртути хлорид, которые применяются как антисептические средства. Катионы Co2+ , Ni2+ в больших количествах токсичны для организма человека, поэтому их наличие в лекарствах контролируется. Реакции идентификации катионов VI-ой аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Некоторые лекарственные средства представляют собой комплексные соединения или способны образовывать комплексы в растворах различных электролитов. Равновесия, устанавливающиеся в растворах комплексных соединений, а также способы их смещения применяют при расчете концентраций различных ионов, в том числе и составных частей лекарственных субстанций.
Общая цель. Уметь трактовать химико-аналитические свойства катионов VI-ой аналитической группы, их реакции идентификации, а также равновесия в растворах комплексных соединений для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Трактовать химические свойства катионов VI-ой аналитической группы и действие группового реагента.
2. Проводить качественные реакции идентификации на катионы меди, ртути (II), кобальта, никеля в растворах.
4. Трактовать ход качественного анализа катионов VI-ой аналитической группы при совместном присутствии.
5. Решать задачи на равновесия в растворах комплексных соединений
6. Интерпретировать свойства катионов VI-ой аналитической группы в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
1. Химико-аналитические свойства катионов VI-ой аналитической группы, их положение в Периодической системе.
2. Действие группового реагента (концентрированного раствора аммиака).
3. Действие растворов натрия или калия гидроксидов.
4. Действие раствора натрия тиосульфата.
5. Реакции идентификации катионов VI-ой аналитической группы в растворах.
5.1. Реакции идентификации катионов ртути (II).
5.1.1. Действие раствора калия йодида.
5.1.2. Действие раствора олова (II) хлорида.
5.2. Реакции идентификации катионов кобальта.
5.2.1. Действие раствора аммония тиоцианата.
5.3. Реакции идентификации катионов никеля.
5.3.1. Действие реактива Чугаева (диметилглиоксима).
6. Систематический ход анализа катионов VI-ой аналитической группы при совместном присутствии.
7. Комплексные соединения.
7.1. Строение комплексов (комплексообразователь, лиганд, координационные сферы).
7.2. Устойчивость комплексов, константы устойчивости и нестойкости.
7.3. Внутрикомплексные соединения (хелаты).
8. Свойства и использование катионов VI-ой аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей редакцией В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 97 – 108, 195 – 196.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною редакцiєю В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004 – C. 99 – 109, 191 – 192.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Лурье Ю.Ю. Справочник по аналитической химии: Справочник. Москва – Химия, 1989 – С. 307 – 330.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ
ТЕСТЫ
| 1) В химико-аналитической лаборатории определяли катионы VI-ой аналитической группы. Какой реактив является групповым реагентом для этих катионов? A. Концентрированный раствор аммиака. B. Концентрированный раствор соляной кислоты. C. Концентрированный раствор натрия гидроксида. D. Концентрированный раствор серной кислоты. E. Групповой реагент отсутствует. |
2) В лаборатории исследовали растворы со смесями катионов. Какой раствор содержит катионы только VI аналитической группы? A. Ca2+ , Hg2+ , Co2+ , Mn2+ . B. Cr3+ , Pb2+ , Mg2+ , Ni2+ . C. Zn2+ , Hg2+ , Co2+ , Ba2+ . D. Cu2+ , Hg2+ , Co2+ , Ni2+ . E. Ag+ , Hg2+ , Cu2+ , Ni2+ . |
| 3) В химико-аналитической лаборатории исследовали раствор со смесью катионов VI-ой аналитической группы, добавляя к нему раствор NaOH. При этом образовался осадок зеленого цвета. О присутствии какого катиона свидетельствует данная реакция? A. Ni2+ . B. Cr3+ . C. Co2+ . D. Cu2+ . E. Mg2+ . |
6) В химико-аналитической лаборатории идентифицировали катион ртути ( II) при помощи раствора калия йодида. Осадок какого цвета выпадает при действии этого реактива? A. Сине-зеленого. B. Желто-оранжевого. C. Красно-бурого. D. Сине-фиолетового. E. Оранжево-красного. |
| 4) В химико-аналитической лаборатории исследовали раствор со смесью катионов. Какой из катионов VI аналитической группы присутствует в растворе, если при добавлении тиоцианата аммония и амилового спирта образуется кольцо, окрашенное в синий цвет? A. Ni2+ . B. Cu2+ . C. Co2+ . D. Hg2+ . E. Cr2+ . |
7) В химико-аналитической лаборатории исследовали раствор со смесью катионов. Для обнаружения какого катиона используют диметилглиоксим (реактив Чугаева)? A. Hg2+ . B. Zn2+ . C. Сu2+ . D. Ni2+ . E. Fе3+ . |
| 5) На раствор, содержащий катионы Hg2+ , подействовали неизвестным реактивом. При этом выпал белый кристаллический осадок, который затем почернел. Какой реактив использовался в данной реакции? A. Калия йодид. B. Олова (II) хлорид. C. Аммония тиоцианата. D. Натрия тиосульфат. E. Натрия гидроксид. |
8) В систематическом ходе анализа катионов VI-ой аналитической группы необходимо разделить катионы Ni2+ и Н g2+ . С помощью какого реагента это можно сделать? A. Дитизона. B. 8-оксихинолина. C. Ализарина. D. Диметилглиоксима. E. Аммония прсульфата. |
| 9) Комплексные ионы диссоциируют в растворах. Заряды комплексных ионов зависят от зарядов комплексообразователя и лигандов и равных их: A. Сумме. B. Разности. C. Произведению. D. Отношению. E. ---. |
10) Констанкта диссоциации комплексного иона может быть охарактеризована величиной константы нестойкости. Как связаны между собой константа нестойкости и константа устойчивости комплекса? A. Кнест = 1 00/ Кустойчивости B. Кнест = 1 / Кустойчивости C. Кнест = Кустойчивости D. Кнест = Кустойчивости / E. Кнест = 1 0* Кустойчивости . |
Эталоны ответов к тестам.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
6 |
Е |
|
| 2 |
D |
7 |
|
| 3 |
А |
8 |
|
| 4 |
9 |
||
| 5 |
10 |
B |
РАСЧЕТНЫЕ ЗАДАЧИ ПО ТЕМЕ:
«Равновесие в растворах комплексных соединений»
Пример решения задачи:
| Условие задачи |
Решение задачи |
| Определите [Fe3+ ] и [CN- ] в 1М растворе K3 [Fe(CN)6 ] |
Диссоциация соли протекает по уравнению: K3 [Fe(CN)6 ] 3K+ + [Fe(CN)6 ]3- (1) [Fe(CN)6 ]3- Fe3+ + 6 CN- (2) Запишем выражение для константы нестойкости комплексного иона [Fe(CN)6 ]3- : Кнест = [Fe3+ ] * [CN- ]6 / [[Fe(CN)6 ]3- ] (3) Кнест = 1 / Кустойчивости ; lg Кустойчивости = 43,9; Кустойчивости = 1043,9 = 7,9*1043 ; Кнест = 1/(7,9*1043 ) = 1,6*10-44 . Обозначим [Fe3+ ] = Х моль/дм3 . Тогда из уравнения (2) [CN- ] = 6Х моль/дм3 , а [[Fe(CN)6 ]3- ] = (С – Х) моль/дм3 . Подставим эти значения в уравнение (3). Тогда уравнение (3) принимает вид: Кнест = Х*(6Х)6 / (С – Х) (4) Предположим, что С Х, тогда С – Х = С. Тогда уравнение (4) можно упростить: Кнест = Х*(6Х)6 /С = 46656 * Х7 / С (5) Следовательно: Х = 7 [Кнест *С / 46656] = 7 [(1,6*1044 *1) / 46656] = 8.6*10-7 моль/дм3 . Т.к. 1М 8,6*10-7 М, предположение С Х правомерно. Х = [Fe3+ ] = 8.6*10-7 моль/дм3 ; [CN- ] = 6Х = 5,2*10-6 моль/дм3 . ОТВЕТ: [Fe3+ ] = 8.6*10-7 моль/дм3 ; [CN - ] = 5,2*10 -6 моль/дм3 . |
Пожалуйста, решите самостоятельно:
| Условие задачи |
Решение задачи: |
| 1) Вычислите [Cu2+ ] и [NH3 ] в 1М растворе [Cu(NH3 )4 ]SO4 . |
|
| 2) Вычислите [Co2+ ] и [NH3 ] в 0,2М растворе [Co(NH3 )6 ]SO4 . |
|
| 3) Вычислите [Hg2+ ], [I- ], [K+ ] в 0,05М растворе K2 [HgI4 ]. |
|
| 4) Вычислите [Fe2+ ], [CN- ], [K+ ] в 0,1М растворе K3 [Fe(CN)6 ]. |
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к задачам.
Задача 1. [Cu2+ ] = 1,29 * 10 – 3 моль/дм3 ; [NH3 ] 1,= 5,16* 10 - 3 моль/дм3 .
Задача 3. [Hg2+ ] =1, 96* 10 – 7 моль/дм3 ; [I- ] =7, 84* 10 – 7 моль/дм3 ; [K+ ] = 0,1 моль/дм3
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие раствора аммиака. К 2-3 каплям растворов солей меди, ртути (II), кобальта, никеля прибавляют по 2-3 капли концентрированного раствора аммиака, а затем его избыток. (СОЛИ РТУТИ ЯДОВИТЫ!) |
||
| 3. Действие раствора NaOH. К 2-3 каплям растворов солей меди, ртути (II), кобальта, никеля прибавляют по 2-3 капли раствора натрия гидроксида. Испытывают отношение полученных осадков к избытку растворов натрия гидроксида и хлороводородной кислоты. (СОЛИ РТУТИ ЯДОВИТЫ!) |
||
| 4. Действие раствора Na2 S2 O3 . К 2-3 каплям растворов солей меди, ртути (II), кобальта, никеля прибавляют несколько кристаллов натрия тиосульфата и нагревают до 60-80°С. Испытывают отношение осадков Cu2 S, HgS к разведенной азотной кислоте при нагревании и HgS к бромной воде в присутствии хлороводородной кислоты при нагревании. |
||
| 5.1. Реакции идентификации катионов ртути ( II). (СОЛИ РТУТИ ЯДОВИТЫ!) |
||
| 5.1.1. Действие раствора KI. К 2-3 каплям раствора соли ртути (II) прибавляют 1-2 капли раствора калия йодида, а затем его избыток. |
||
| 5.1.2. Действие раствора SnCl2 . К 2-3 каплям раствора соли ртути (II) прибавляют по каплям раствор олова (II) хлорида, наблюдая за изменениями, которые происходят при добавлении каждой капли. |
||
| 5.2. Реакции идентификации катионов кобальта. |
||
| 5.2.1. Действие раствора аммония тиоцианата. К 2-3 каплям раствора соли кобальта прибавляют кристаллы аммония тиоцианата, 5 капель амилового спирта и перемешивают. |
||
| 5.3. Реакции идентификации катионов никеля. |
||
| 5.3.1. Действие реактива Чугаева (диметилглиоксима). К 2-3 каплям раствора соли никеля прибавляют 5 капель аммиачного буферного раствора и 2-3 капли реактива Чугаева. |
||
Эталон выполнения задания экспериментальной работы.
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие раствора аммиака. К 2-3 каплям растворов солей меди, ртути (II), кобальта, никеля прибавляют по 2-3 капли концентрированного раствора аммиака, а затем его избыток. (СОЛИ РТУТИ ЯДОВИТЫ!) |
2Cu2+ + 2NH3 *H2 O + SO4 2- (CuOH)2 SO4 + 2NH4 + Hg2+ + 2NH3 *H2 O + Cl - [NH2 Hg]Cl + NH4 + + H2 O 2Ni2+ + 2NH3 *H2 O + SO4 2- (NiOH)2 SO4 + 2NH4 + Co2+ + NH3 *H2 O + Cl - Co(OH)Cl + NH4 + Действие избытка аммиака Co(OH)Cl + 6NH3 *H2 O [Co(NH3 )6 ]2+ + Cl- + OH- + 6H2 O (NiOH)2 SO4 + 12NH3 *H2 O 2[Ni(NH3 )6 ]2+ + SO4 2- + 2OH- + 12H2 O (CuOH)2 SO4 +8NH3 *H2 O2[Cu(NH3 )4 ]2+ +SO4 2- +2OH- +8H2 O [NH2 Hg]Cl + 3NH3 *H2 O [Hg(NH3 )4 ]2+ + Cl- + OH- + 2H2 O |
Зеленый осадок Белый осадок Зеленый осадок Синий осадок Оранж.-коричн. р - р. Сиреневый раствор Синий раствор Бесцветный раствор |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Решение задач. |
20 |
Целевые обучающие задания. |
||
| 4. |
Инструктаж по технике безопасности. |
5 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 5. |
Самостоятельная работа. Выполнение лабораторной работы. |
85 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 6. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 7. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 8. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественные реакции катионов VI-ой аналитической группы Cu2+ , Hg2+ , Co2+ , Ni2+ . Анализ смеси катионов VI-ой аналитической группы. Решение расчетных задач на равновесия в растворах комплексных соединений .
.
|
![]()
ЗАНЯТИЕ № 8
Тема: Анализ смеси катионов I – VI - ой аналитических групп.
Актуальность темы. При изучении предыдущих занятий вы убедились, что катионы I –VI аналитических групп входят в состав различных соединений, среди которых много лекарственных средств, использующихся в медицине. На практике часто применяют лекарственные формы, представляющие собой смесь нескольких веществ. При этом необходимо идентифицировать различные катионы - составные части лекарственных веществ - при их совместном присутствии. Также испытание лекарственных средств на чистоту часто требует проведения реакций на несколько примесей, которые могут присутствовать одновременно. Поэтому понимание особенностей химико-аналитических свойств и проведение систематического хода анализа катионов I –VI аналитических групп при их совместном присутствии является важной аналитической задачей для фармацевта.
Общая цель. Уметь трактовать химико-аналитические свойства и ход систематического анализа катионов I – VI-ой аналитических групп при совместном присутствии для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Проводить предварительные испытания раствора, содержащего смесь катионов I –VI аналитических групп.
2. Интерпретировать последовательность определения отдельных катионов в смеси.
3. Проводить систематический ход анализа смесей катионов I –VI аналитических групп в растворе (без осадка).
4. Интерпретировать мешающее влияние катионов I –VI аналитических групп при их совместном присутствии и методы его устранения.
Содержание обучения.
Перечень теоретических вопросов:
1. Предварительные испытания и наблюдения.
1.1. Определение цвета раствора.
1.2. Определение запаха раствора.
1.3. Окрашивание пламени горелки.
1.4. Отношение раствора к нагреванию.
1.5. Определение рН раствора.
1.6. Отношение раствора к воде.
1.7. Отношение раствора к уксусной кислоте.
1.8. Отношение раствора к минеральным кислотам.
2 . Реакции идентификации на отдельные катионы и группы.
2.1. Обнаружение ионов NH4 + в отдельной пробе действием раствора щелочи при нагревании.
2.2. Обнаружение ионов Fe2+ в отдельной пробе действием раствора K3 [Fe(CN)6 ].
2.3. Обнаружение ионов Fe3+ в отдельной пробе действием раствора K4 [Fe(CN)6 ].
2.4. Обнаружение катионов калия.
2.5. Обнаружение катионов натрия.
2.6. Проба на присутствие в растворе катионов II аналитической группы.
2.7. Отделение катионов II аналитической группы.
2.8. Проба на присутствие в растворе катионов III аналитической группы.
2.9. Отделение катионов III аналитической группы.
2.10. Отделение PbSO4 .
2.11. Отделение катионов IV аналитической группы от катионов V и VI аналитических групп.
2.12. Анализ катионов IV аналитической группы.
2.13. Отделение сурьмы.
2.14. Определение катионов Sb (V).
2.15. Разделение катионов V и VI аналитических групп.
2.16. Анализ катионов V аналитической группы.
2.17. Анализ катионов VI аналитической группы.
3. Мешающее влияние катионов при совместном их присутствии, методы его устранение.
4. Анализ смесей катионов в контроле качества лекарственных веществ.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова.- Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 108 – 135.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004 – C. 109 – 132.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 557 – 564.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ .
| 1) При систематическом ходе анализа катионов I – IV аналитических групп проводят предварительные исследование, к которым относится окрашивание пламени горелки. Соли каких катионов окрашивают бесцветное пламя горелки в красный цвет? A. Бария и натрия. B. Кальция и стронция. C. Калия и натрия. D. Кальция и натрия. E. Калия и бария |
4) В химико-аналитической лаборатории исследовали раствор со смесью катионов. Действием какого реагента обнаруживают в исследуемом растворе катионы K+ , если известно, что катионы аммония отсутствуют? A. Zn(UO2 )3 (CH3 COO)8 . B. Na2 [Cu(NH3 )4 ]. C. Na2 [Ni(NH3 )6 ]. D. NaHC4 H4 O6 . E. Na2 [Co(NH3 )6 ]. |
| 2) При анализе смеси катионов I – IV аналитических групп (без осадка) дробными реакциями обнаруживают катионы NH4 + , Fe2+ , Fe3+ . С помощью какого реагента определяют катионы Fe3+ ? A. K4 [Fe(CN)6 ]. B. H2 SO4 . C. NaOH. D. K3 [Fe(CN)6 ]. E. Co(NO3 )2 . |
5) При проведении анализа смеси катионов необходимо отделить катионы II-ой аналитической группы. С помощью какого реагента проводят эту операцию? A. 2М раствор HCl. B. 0,2М раствор HCl. C. 6М раствор H2 SO4 . D. 3Н раствор NaOH. E. 0,1Н раствор H2 SO4 . |
| 3) В химико-аналитической лаборатории исследовали раствор со смесью катионов. При добавлении к испытуемому раствору K[ Sb( OH)6 ] после предварительного добавления КОН и нагревания выпал белый кристаллический осадок. О присутствии какого катиона говорит данный аналитический эффект? A. Al3+ . B. Zn2+ . C. Na+ . D. Cu2+ . E. Cr3+ . |
6) При проведении анализа смеси катионов на испытуемый раствор подействовали 1М раствором H2 SO4 , при этом образовался осадок, который свидетельствует о присутствии катионов III аналитической группы. О наличии какого катиона другой аналитической группы может свидетельствовать этот осадок? A. Zn2+ . B. Cu2+ . C. Pb2+ . D. Cr3+ . E. Sn2+ . |
| 7) На определенной стадии анализа смеси катионов необходимо отделить катионы IV аналитической группы от катионов IV – VI групп. С помощью какого реагента это проводят? A. 0,5М раствор NaOH, 30-% раствор Н2 О2 . B. 6М раствор NaOH, 30-% раствор Н2 О2 . C. 6М раствор H2 SO4 , 3-% раствор Н2 О2 . D. 0,1М раствор H2 SO4 , 30-% раствор Н2 О2 . E. 6М раствор NaOH, 3-% раствор Н2 О2 . |
9) К VI аналитической группе относятся Cu2+ , Hg2+ , Co2+ и Ni2+ . Какие из этих катионов в систематическом ходе анализа можно отделить с помощью натрия тиосульфата? A. Cu2+ и Co2+ . B. Ni2+ и Hg2+ . C. Hg2+ и Cu2+ . D. Co2+ и Hg2+ . E. Cu2+ и Ni2+ . |
| 8) На определенной стадии анализа смеси катионов необходимо отделить катионы Sb( V) от других катионов V и VI аналитических групп. Действием какого реагента это осуществляют? A. HNO3 с Н2 О2 . B. NaOH с Н2 О2 . C. H2 SO4 с Н2 О2 . D. HCl с Н2 О2 . E. CH3 COOH с Н2 О2 . |
10) При проведении анализа смеси катионов к испытуемому раствору прибавили избыток концентрированного раствора NH3 * H2 O. Катионы какой аналитической группы при этом осаждаются? A. II. B. III. C. IV. D. V. E. VI. |
Эталоны ответов к тестам.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
B |
6 |
C |
| 2 |
7 |
||
| 3 |
8 |
||
| 4 |
D |
9 |
C |
| 5 |
10 |
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
|
| 1. Предварительные испытания и наблюдения |
|||
| 1.1. Цвет |
|||
| 1.2. Запах |
|||
| 1.3. Окрашивание пламени На предметное стекло наносят 2-3 капли раствора, осторожно выпаривают досуха на водяной бане. Затем очищенной и раскаленной нихромовой петлей захватывают пробу и вносят в бесцветную часть пламени газовой горелки. |
|||
| 1.4. Отношение к нагреванию. Несколько капель испытуемого раствора переносят в чистую пробирку и нагревают над пламенем горелки. |
|||
| 1.5. Определение рН среды. 2-3 капли раствора наносят на универсальную индикаторную бумагу, по цвету определяют рН среды. |
|||
| 1.6. Отношение к воде. Несколько каплям испытуемого раствора прибавляют 2-3 см3 дист. воды. |
|||
| 1.7. Отношение к уксусной кислоте. К 2-3 каплям испытуемого раствора добавляют 2-3 капли ледяной уксусной кислоты. |
|||
| 1.8. Отношение к минеральным кислотам. К 2-3 каплям испытуемого раствора добавляют 2-3 капли предложенной минеральной кислоты (HCl, НNО3 ) . |
|||
| 2. Систематический ход анализа раствора (без осадка) |
|||
| 2.1. Обнаружение ионов NH4 + в отдельной пробе действием раствора щелочи при нагревании. К 3-4 каплям испытуемого раствора прибавляют 3-4 капли 2М раствора NaOH и нагревают. К отверстию пробирки подносят влажную красную лакмусовую бумагу. |
|||
| 2.2. Обнаружение Fe2+ действием K3 [ Fe( CN)6 ]. К 2-3 каплям испытуемого раствора прибавляют 2 капли раствора K3 [Fe(CN)6 ]. |
|||
| 2.3. Обнаружение ионов Fe3+ в отдельной пробе действием раствора K4 [ Fe( CN)6 ]. К 2-3 каплям испытуемого раствора прибавляют 2 капли раствора K4 [Fe(CN)6 ]. |
|||
| 2.4. Обнаружение катионов калия после предварительного удаления катионов аммония (в случае их присутствия). К 5-6 каплям анализируемого раствора прибавляют 4-5 капель 2М раствора натрия карбоната. Смесь нагревают на водяной бане до полного удаления аммиака. Образовавшиеся осадки оксидов, основных солей, карбонатов и гидроксидов катионов II – VI аналитических групп отделяют центрифугированием и в дальнейшем анализе не используют. Центрифугат нейтрализуют уксусной кислотой до нейтральной среды (проба на лакмус), концентрируют выпариванием, охлаждают и обнаруживают ионы калия реакциями с NaHC4 H4 O6 и Na3 [Co(NO2 )6 ]. |
|||
| 2.5. Обнаружение катионов натрия после предварительного удаления катионов аммония (в случае их присутствия). К 5-6 каплям анализируемого раствора прибавляют 4-5 капель 2М раствора калия карбоната. Смесь нагревают на водяной бане до полного удаления аммиака. Образовавшиеся осадки оксидов, основных солей, карбонатов и гидроксидов катионов II – VI аналитических групп отделяют центрифугированием и в дальнейшем анализе не используют. Центрифугат нейтрализуют уксусной кислотой до нейтральной среды (проба на лакмус), концентрируют выпариванием, охлаждают и обнаруживают ионы натрия. |
|||
| 2.6. Проба на присутствие в растворе катионов II аналитической группы. К 3-5 каплям исследуемого раствора прибавляют 5-6 капель 2М раствора HCl. Образование белого осадка или мути свидетельствует о присутствии в растворе катионов II аналитической группы. |
|||
| 2.7. Отделение катионов II аналитической группы. К 30-35 каплям анализируемого раствора прибавляют 3-4 капли концентрированного раствора HCl, перемешивают стеклянной палочкой и центрифугируют. Проверяют полноту осаждения. Осадок промывают дист. водой, подкисленной 2М раствором HCl. В осадке – хлориды катионов II аналитической группы, в центрифугате – катионы I, III – VI аналитических групп и примесь катионов Pb2+ . Осадок хлоридов катионов II аналитической группы анализируют в соответствии с систематическим ходом анализа смеси катионов этой группы. |
|||
| 2.8. Проба на присутствие в растворе катионов III аналитической группы. К 3-4 каплям центрифугата, полученного по пункту 2.7., прибавляют 3-5 капель этилового спирта и 1М раствора серной кислоты, перемешивают. Смесь нагревают на водяной бане. Образование осадка указывает на присутствие катионов III аналитической группы. |
|||
| 2.9.Отделение катионов III аналитической группы (в случае их присутствия). К центрифугату, полученному по пункту 2.7., прибавляют по 20-25 капель этилового спирта и 1М раствор серной кислоты, перемешивают. Смесь нагревают на водяной бане в течение 5 минут, центрифугируют и проверяют полноту осаждения. В осадке сульфаты катионов III аналитической группы и PbSO4 . В центрифугате – катионы I, IV – VI аналитических групп. |
|||
| 2.10. Отделение PbSO4 . Осадок, полученный по пункту 2.9., обрабатывают при нагревании на водяной бане 15-20 каплями 30%-ного раствора CH3 COONH4 , центрифугируют и промывают дист. водой до отрицательной реакции на ионы свинца. Осадок сульфатов катионов III аналитической группы анализируют в соответствии с систематическим ходом анализа смеси катионов этой группы. |
|||
| 2.11. Отделение катионов IV аналитической группы от катионов V и VI аналитических групп. Центрифугат, полученный по пункту 2.9., упаривают на 1/3. К нему прибавляют 6М раствор NaOH или KOH (1,5 избытка от объема этого раствора), 5 капель 3%-ного раствора пероксида водорода, перемеши-вают и нагревают на водяной бане до полного разрушения пероксида водорода (прекращение выделения пузырьков кислорода из раствора), охлаждают и центрифугируют. Центрифугат содержит гидроксо- и оксоанионы IV и катионы I аналитических групп, а осадок – оксиды, гидроксиды и основные соли катионов V и VI аналитических групп. |
|||
| 2.12. Анализ катионов IV аналитической группы. Центрифугат, полученный по пункту 2.11., анализируют в соответствии с систематическим ходом анализа смеси катионов IV аналитической группы. |
|||
| 2.13. Отделение сурьмы. Осадок, полученный по пункту 2.11., обрабатывают 2М раствором HNO3 (20-30 капель) и 10-15 каплями раствора H2 O2 , нагревают на водяной бане до полного разложения H2 O2 , смесь центрифугируют. В центрифугате – катионы V и VI аналитических групп, в осадке – HSbO3 . |
|||
| 2.14. Определение катионов Sb ( V). Осадок, полученный по пункту 2.13., растворяют в 10-15 каплях конц. хлороводородной кислоты. В растворе определяют Sb (V) реакцией с металлическим Zn. |
|||
| 2.15. Разделение катионов V и VI аналитических групп. К центрифугату, полученному по пункту 2.13., прибавляют 1,5-кратный объем конц. раствора аммиака, перемешивают и осторожно нагревают. Смесь центрифуги-руют. В центрифугате – катионы VI аналитической группы в виде аммиачных комплексов, в осадке – оксиды, гидроксиды и основные соли катионов V аналитической группы. |
|||
| 2.16. Анализ катионов V аналитической группы. Осадок, полученный по пункту 2.15., анализируют в соответствии с систематическим ходом анализа смеси катионов V аналитической группы. |
|||
| 2.17. Анализ катионов VI аналитической группы. Осадок, полученный по пункту 2.15., анализируют в соответствии с систематическим ходом анализа смеси катионов VI аналитической группы. |
|||
Эталон выполнения задания экспериментальной работы
| 2.1. Обнаружение ионов NH4 + в отдельной пробе действием раствора щелочи при нагревании. К 3-4 каплям испытуемого раствора прибавляют 3-4 капли 2М раствора NaOH и нагревают. К отверстию пробирки подносят влажную красную лакмусовую бумагу. |
|
Посинение влажной красной лакмусовой бумаги. |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
10 |
Учебная лаборатория. |
||
| 2. |
Инструктаж по технике безопасности. |
15 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 3. |
Самостоятельная работа. Выполнение лабораторной работы. |
120 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, мікроскоп, химическая посуда, реактивы. |
Учебная лаборатория. |
| 5. |
Подведение итогов. |
15 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Анализ смеси катионов I – VI - ой аналитических групп .
![]()
ЗАНЯТИЕ № 9
Тема: Контрольная работа на тему: « Качественный анализ катионов. Равновесия в растворах электролитов».
Цель. Уметь трактовать химико-аналитические свойства катионов I – VI аналитических групп, их реакции идентификации, систематический ход анализа смесей катионов, а также равновесия в растворах электролитов для качественного химического контроля лекарственных средств.
Содержание обучения.
Перечень теоретических вопросов:
1. Аналитические свойства веществ и аналитические реакции.
2. Принцип и методы определения веществ (качественный анализ).
3. Реакции идентификации катионов I-ой аналитической группы в растворах.
4. Систематический ход анализа катионов I-ой аналитической группы при совместном присутствии
5. Реакции идентификации катионов II -ой аналитической группы в растворах.
6. Систематический ход анализа катионов II -ой аналитической группы при совместном присутствии
7. Реакции идентификации катионов III-ой аналитической группы в растворах.
8. Систематический ход анализа катионов III -ой аналитической группы при совместном присутствии.
9. Реакции идентификации катионов IV-ой аналитической группы в растворах.
10. Систематический ход анализа катионов IV-ой аналитической группы при совместном присутствии.
11. Реакции идентификации катионов V-ой аналитической группы в растворах.
12. Систематический ход анализа катионов V-ой аналитической группы при совместном присутствии.
13. Реакции идентификации катионов VI-ой аналитической группы в растворах.
14. Систематический ход анализа катионов VI-ой аналитической группы при совместном присутствии.
15. Систематический ход анализа катионов I – VI аналитических групп в растворах.
16. Равновесия в растворах сильных и слабых электролитов.
17. Закон действия масс. Константы диссоциации электролитов.
18. Закон разбавления Оствальда. Степень диссоциации слабых электролитов.
19. Диссоциация воды. Водородный показатель.
20. Равновесия в гетерогенных системах.
21. Растворимость электролитов, насыщенные растворы.
22. Произведение растворимости электролитов.
23. Буферные растворы, буферная емкость, рН буферных растворов.
24. Гидролиз солей.
25. Константа гидролиза, степень гидролиза.
26. Гидролиз солей, образованных слабой кислотой и сильным основанием.
27. Гидролиз солей, образованных сильной кислотой и слабым основанием.
28. Гидролиз солей, образованных слабой кислотой и слабым основанием.
29. Комплексные соединения.
30. Строение комплексов (комплексообразователь, лиганд, координационные сферы).
31. Устойчивость комплексов, константы устойчивости и нестойкости.
32. Внутрикомплексные соединения (хелаты).
33. Качественный анализ катионов в контроле качества лекарственных средств.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей редакцией В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 5 – 135.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною редакцiєю В.В. Болотова. Харків, вид-во НФАУ Оригiнал, 2004 – C. 5 – 132.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Лурье Ю.Ю. Справочник по аналитической химии: Справочник. Москва – Химия, 1989 – С. 267 – 275.
2) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 71 – 471.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ.
Для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
| 1) В анализе смесей различного состава катионы делят по кислотно-основному методу на шесть аналитических групп. Какая из аналитических групп катионов не имеет группового реагента? A. II B. III. C. I. D. VI. E. IV. |
2) В лаборатории проводят исследование раствора соли серебра. После добавления 2М раствора НС l выпал белый осадок, который исследовали на отношение к раствору аммиака. Каким аналитическим эффектом сопровождается реакция взаимодействия хлорида серебра с аммиаком? A. Частичное растворение осадка. B. Образование черного осадка. C. Образование желтого осадка. D. Образование белого осадка, который быстро буреет. E. Растворение осадка. |
| 3) Провизор–аналитик проводит идентификацию лекарственной субстанции калия ацетата. С помощью какого реактива он подтверждает наличие катиона калия в исследуемом веществе? A. Винной кислоты. B. Натрия гидроксида. C. Калия перманганата D. Железа(Ш) хлорида E. Муравьиной кислоты. |
7) В контрольно-аналитической лаборатории проводят исследование лекарственного вещества, содержащего катионы цинка . Какой реактив нужно использовать для идентификации этого катиона? A. дитизон. B. сероводород. C. ализарин. D. аммиак. E. щелочь. |
| 4) Групповым реагентом III-ей аналитической группы является раствор серной кислоты. Какой осадок выпадает первым при добавлении серной кислоты к раствору, который содержит катионы Ва2+ , S г2+ , Са2+ в равных концентрациях? A. SrSО4 . B. BаSО4 . C. СаSО4. D. Одновременно все соли. E. SrSО4 и СаSО4. . |
8) Катион марганца (ІІ) относится к V-ой аналитической группе. Какие из предложенных реагентов можно использовать для определения этого катиона в случае его присутствия в лекарственном веществе? A. KIO3 +H2 SO4 . B. (NH4 )2 S2 О8 + HNO3 . C. H2 O2 +KOH. D. К2 СгO4 E. К2 Сг2 O7 . |
| 5) К VI аналитической группе относятся катионы Сu2+ , Нg2+ , Со2+ и Ni2+ , групповым реагентом для которых является конц. раствор аммиака. Какие соединения образуются при действии группового реагента на катионы VI -ой аналитической группы? A. Амфотерные гидроксиды. B. Гидроксиды, не растворимые в избытке щелочей. C. Гидроксиды, не растворимые в избытке аммиака. D. Аммиакаты, которые растворяются в воде. E. Аммиакаты, которые не растворяются в воде. |
9) Катион хрома (ІІІ) относится к четвертой аналитической группе. Какая из предложенных реакций характерна для этого катиона? A. С щелоччью или раствором аммиака. B. Образование надхромовой кислоты. C. Окисление до хромата в щелочной среде. D. Окисление до дихромата в щелочной среде. E. С сульфид-ионами. |
| 6) Групповым реагентом катионов V-ой аналитической группы является концентрированный раствор аммиака. Какие продукты образуются при добавлении избытка NH4 ОН к раствору BiС13 ? A. Bi2 О3 . B. Bi (метал.). C. Bi(ОН)3 . D. [Bi(ОН)6 ]3- . E. BiОС1. |
1 0) Большинство катионов VI аналитической группы окрашены и образуют окрашенные соединения. Какие катионы этой аналитической группы имеют неокрашенные растворы? A. Ni2+ . B. Cu2+ и Hg2+ . C. Co2+ . D. Hg2+ . E. Cu2+ и Co2 . |
| 9) Химик проводит идентификацию катионов Fе3+ с помощью неорганического соединения. Какие лиганды образуют с катионами Fе3+ комплексы темно-красного цвета? A. NН3 . B. ОН- . C. NСS- . D. СN- . E. I- . |
13) Для некоторых катионов является характерной реакция окрашивания пламени. Соли какого катиона окрашивают пламя в желтый цвет? A. Са2+ . B. Sг2+ . C. Ва2+ . D. Na+ . E. K+ . |
| 10) В аналитической лаборатории проводят исследование раствора на содержание катионов Zn2+ с помощью раствора К4 [ Fе(С N)6 ]. Какой кат ион мешает идентификации Zn2+ с этим реагентом? A. Sn2+ . B. Са2+ . C. Fе3+ . D. Со2+ . E. Рb2+ . |
14) Катион бария относится к третьей аналитической группе. Какой реагеннт используют для идентификации этого катиона? A. KI. B. HCl. C. NH4 Cl. D. СН3 СООН. E. К2 СгО4 . |
| 15) Для катионов магния характерной является реакция с натрия гидрофосфатом. В какой среде протекает эта реакция? A. В нейтральной. B. В сильно щелочной. C. В присутствии аммиачного буфера. D. В присутствии ацетатного буфера. E. В сильно кислой. |
16) В лаборатории проводят исследование раствора, который содержит катион К+ . При добавлении реагента образовался желтый кристаллический осадок. Какой реагент использовали для этой реакции? A. (NH4 )2 S2 О8 . B. Na3 [Co(NO2 )6 ]. C. К3 [Fе(СN)6 ]. D. К4 [Fе(СN)6 ]. E. [Сu(NH3 )4 ]С12 . |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
9 |
||
| 2 |
Е |
10 |
D |
| 3 |
А |
11 |
|
| 4 |
12 |
||
| 5 |
13 |
D |
|
| 6 |
14 |
||
| 7 |
А |
15 |
|
| 8 |
16 |
B |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Письменная контрольная работа. |
120 |
Наборы заданий для контрольной работы |
Учебная лаборатория. |
|
| 3. |
Анализ и коррекция контрольной работы. |
30 |
Учебная лаборатория. |
||
| 4. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Контрольная работа на тему: « Качественный анализ катионов. Равновесия в растворах электролитов».
![]()
ЗАНЯТИЕ № 10
Тема: Качественный анализ анионов. Характерные реакции анионов I-ой аналитической группы. Анализ смеси анионов I-ой аналитической группы.
Актуальность темы. К I-ой аналитической группе относятся следующие анионы: SO4 2- , SO3 2- , S2 O3 2- , CO3 2- , C2 O4 2- , CrO4 2- (Cr2 O7 2- ), PO4 3- , AsO4 3- , AsO3 3- , F- , SiO3 2- , BO2 - (B4 O7 2- ) и др. Они входят в состав соединений, среди которых много лекарственных средств (бикарбонат натрия, натрия тиосульфат, натрия сульфат, натрия гидрокарбонат, натрия тетраборат, магния сульфат, используют как спазмолитическое, слабительное средство, магния карбонат основной, бария сульфат, цинка сульфат и т.д.), применяемых в медицинской практике. Реакции на анионы I-ой аналитической группы используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Общая цель. Уметь трактовать химико-аналитические свойства анионов I-ой аналитических группы и их реакции идентификации для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Трактовать химические свойства катионов I-ой аналитической группы и действие группового реагента.
2. Проводить качественные реакции идентификации на сульфат-, сульфит-, тиосульфат-, карбонат-, фосфат-, оксалат-, арсенат-, арсенит-, хромат-, дихромат-, силикат-, тетраборат-, метаборат- и фторид-ионы в растворах.
3. Трактовать ход качественного анализа анионов I-ой аналитической группы при совместном присутствии.
4. Интерпретировать свойства анионов I-ой аналитической группы в случаях их присутствия в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
1. Химико-аналитические свойства анионов I-ой аналитической группы.
2. Действие группового реагента бария хлорида.
3. Реакции сульфат-ионов.
3.1. Действие солей стронция.
3.2. Действие солей свинца.
4. Реакции сульфит-ионов.
4.1. Действие минеральных кислот.
4.2. Действие окислителей.
4.3. Действие восстановителей.
5. Реакции тиосульфат-ионов.
5.1. Действие минеральных кислот.
5.2. Действие окислителей.
6. Реакции карбонат-ионов.
6.1. Действие минеральных кислот.
6.2. Действие раствора магния сульфата.
6.3. Действие раствора фенолфталеина.
7. Реакции фосфат-ионов.
7.1. Действие магнезиальной смеси.
7.2. Действие молибденовой жидкости.
8. Реакции оксалат-ионов.
8.1. Действие раствора кальция хлорида.
8.2. Действие раствора калия перманганата.
9. Реакции арсенат-ионов.
9.1. Действие магнезиальной смеси.
9.2. Действие раствора калия йодида.
10. Реакции арсенит-ионов.
10.1. Действие растворов сульфидов.
10.2. Действие раствора йода.
11. Реакции силикат-ионов (действие солей аммония).
12. Реакции хромат- и дихромат-ионов (действие калия йодида).
13. Реакции тетраборат- и метаборат-ионов (окрашивание пламени).
14. Реакции фторид-ионов (образование кремния фторида).
15. Систематический ход анализа анионов I-ой аналитической группы при совместном присутствии.
16. Свойства и использование анионов I-ой аналитической группы в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 135 – 146.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова.- Харків, вид-во НФАУ Оригiнал, 2004 – C. 132 – 143.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 484 – 503.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ .
| 1) Для упрощения аналитического анализа анионы делят на три группы. Какие анионы относятся к I аналитической группе? A. SO4 2- , SO3 2- , Cl- , NO3 2- . B. AsO4 3- , SiO3 2- , NO3 2- , CO3 2- . C. CH3 COO- , PO4 3- , BO2 - , F- . D. SO4 2- , CO3 2- , F- , BO2 - . E. Br - , S2 O3 2- , CrO4 2- , Cl- . |
4) Тиосульфат-ионы относятся к I аналитической группе и для их идентификации используют фармакопейную реакцию с раствором серебра нитрата. Какой аналитический эффект при этом наблюдается? A. Окрашивание раствора в желтый цвет. B. Выпадение осадка желтого цвета. C. Выделение газа. D. Выпадение осадка зеленого цвета. E. Выпадение осадка черного цвета. |
| 2) В химико-аналитической лаборатории идентифицировали раствор со смесью анионов различных аналитических групп. Какой раствор используют в качестве группового реагента для обнаружения анионов I-ой аналитической группы? A. бария хлорида или нитрата. B. серебра хлорида или нитрата. C. кальция хлорида или нитрата. D. кобальта хлорида или нитрата. E. группового реагента нет. |
5) Для их идентификации карбонат-ионов используют фармакопейную реакцию с раствором фенолфталеина (в отличие от гидрокарбонат-ионов). Какой аналитический эффект при этом наблюдается? A. Окрашивание раствора в желтый цвет. B. Окрашивание раствора в розовый цвет. C. Выделение пузырьков газа. D. Обесцвечивание раствора. E. Окрашивание раствора в оранжевый цвет. |
| 3) В химико-аналитической лаборатории идентифицировали раствор со смесью анионов. С помощью каких соединений можно определить сульфат-ионы? A. Солей свинца. B. Минеральных кислот. C. Окислителей. D. Восстановителей. E. Солей аммония. |
6) В лаборатории аналитик исследовал раствор со смесью анионов I-ой аналитической группы. Для идентификации арсенат-ионов он использовал магнезиальную смесь. Какие анионы I-ой аналитической группы мешают этой реакции? A. Арсениты. B. Сульфаты. C. Фториды. D. Силикаты. E. Фосфаты. |
| 7) В химико-аналитической лаборатории исследовали раствор со смесью анионов. При добавлении к раствору серебра нитрата образовался осадок коричневого цвета. О присутствии каких анионов свидетельствует данная реакция? A. Арсенатов. B. Фторидов. C. Карбонатов D. Оксалатов E. Сульфатов. |
9) При проведении анализа раствора со смесью анионов, химик добавил к раствору соль калия иодида, при этом хлороформный слой окрасился в красно-фиолетовый цвет. О присутствии каких анионов это свидетельствует? A. SO4 2- . B. AsO4 3- . C. BO2 - . D. CO3 2- . E. Cr2 O7 2- . |
| 8) Химик-аналитик проводил исследование раствора со смесью анионов и для определения арсенит-ионов использовал раствор сульфидов (реакция фармакопейная). Выпадение осадка какого цвета наблюдается при этом? A. белого. B. черного. C. желтого. D. зеленого. E. оранжевого. |
10) Борат-ионы в присутствии серной кислоты и этилового спирта окрашивают пламя горелки в зеленый цвет. Образование какого соединения вызывает окрашивание пламени? A. сульфата натрия. B. этилового спирта. C. метилового эфира. D. борноэтилового эфира. E. борной кислоты. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
D |
6 |
|
| 2 |
7 |
A |
|
| 3 |
8 |
||
| 4 |
9 |
E |
|
| 5 |
B |
10 |
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
|
| 2. Действие группового реагента. |
|||
| 2.1. Действие раствора бария хлорида. К 2-3 каплям растворов солей, содержащих анионы I аналитической группы, прибавляют по 2-3 капли 0,5М раствора BaCl2 . Испытывают отношение осадков к 2М раствору HCl. |
|||
| 3. Реакции сульфат-ионов. |
|||
| 3.1. Действие солей стронция. К 2-3 каплям раствора натрия сульфата прибавляют 2-3 капли раствора стронция хлорида. |
|||
| 3.2. Действие солей свинца. К 2-3 каплям раствора натрия сульфата прибавляют 2-3 капли раствора соли свинца. |
|||
| 4. Реакции сульфит-ионов. |
|||
| 4.1. Действие минеральных кислот. К 3-5 каплям раствора натрия сульфита прибавляют 2-3 капли 2М раствора HCl. Для обнаружения серы (IV) оксида используют йодкрахмальную бумагу, на которую предварительно наносят 1 каплю хлорной воды. |
|||
| 4.2. Действие окислителей. К 2-3 каплям раствора натрия сульфита прибавляют 1-2 капли раствора йода. |
|||
| 4.3. Действие восстановителей. К 2-3 каплям раствора натрия сульфита прибавляют 1-2 капли раствора H2 O2 , образовавшийся сероводород идентифицируют с помощью бумаги, пропитанной раствором соли свинца. |
|||
| 5. Реакции тиосульфат-ионов. |
|||
| 5.1. Действие минеральных кислот. К 2-3 каплям раствора натрия тиосульфата прибавляют 2-3 капли 2М раствора HCl. |
|||
| 5.2. Действие окислителей. К 2-3 каплям раствора натрия тиосульфата прибавляют 2-3 капли раствора йода. |
|||
| 6. Реакции карбонат-ионов. |
|||
| 6.1. Действие минеральных кислот. К 10-15 каплям раствора натрия карбоната прибавляют 10 капель 2М раствора HCl. Пробирку закрывают пробкой с газоотводной трубкой и пропускают выделившийся газ через известковую воду. |
|||
| 6.2. Действие раствора магния сульфата. К 2-3 каплям раствора натрия карбоната прибавляют 2-3 капли раствора магния сульфата. |
|||
| 6.3. Действие раствора фенолфталеина. К 10 каплям раствора натрия карбоната (1:10) прибавляют 2 капли раствора индикатора фенолфталеина |
|||
| 7. Реакции фосфат-ионов. |
|||
| 7.1. Действие магнезиальной смеси. К 2-3 каплям раствора натрия гидрофосфата прибавляют по 2 капли растворов аммония хлорида и аммиака, 1-2 капли раствора магния хлорида. |
|||
| 7.2. Действие молибденовой жидкости. К 2-3 каплям раствора натрия гидрофосфата прибавляют 8-10 капель молибденовой жидкости и нагревают на водяной бане. |
|||
| 8. Реакции оксалат-ионов. |
|||
| 8.1. Действие раствора кальция хлорида. К 2-3 каплям раствора натрия оксалата прибавляют 2-3 капли раствора кальция хлорида. Испытывают отношение осадка к растворам HCl и CH3 COOH. |
|||
| 8.2. Действие раствора калия перманганата. К 2-3 каплям раствора натрия оксалата прибавляют 2 капли 2М раствора H2 SO4 , нагревают и прибавляют по каплям разбавленный раствор калия перманганата. |
|||
| 9. Реакции арсенат-ионов (СОЛИ МЫШЬЯКА – ЯД!!!) |
|||
| 9.1. Действие магнезиальной смеси. К 2-3 каплям раствора натрия арсената прибавляют по 2 капли растворов аммония хлорида и аммиака, 1-2 капли раствора магния хлорида. |
|||
| 9.2. Действие раствора калия йодида. К 2-3 каплям раствора натрия арсената прибавляют 2-3 капли концентрированной HCl, 5-6 капель раствора калия йодида, 5 капель хлороформа и встряхивают. |
|||
| 10. Реакции арсенит-ионов (СОЛИ МЫШЬЯКА – ЯД!!!) |
|||
| 10.1. Действие растворов сульфидов. К 3-5 каплям раствора натрия арсенита прибавляют 1 каплю 2М раствора HCl и 2-3 капли раствора H2 S. Испытывают отношение осадка к концентрированной HCl и раствору аммиака. |
|||
| 10.2. Действие раствора йода. К 2-3 каплям нейтрализованного уксусной кислотой раствора натрия арсенита прибавляют 2-3 капли насыщенного раствора натрия гидрокарбоната и по каплям – разбавленный раствор йода. |
|||
| 11. Реакции силикат-ионов. |
|||
| 11.1. Действие солей аммония. К 5-6 каплям раствора натрия силиката прибавляют несколько кристаллов аммония хлорида и нагревают на водяной бане. |
|||
| 12. Реакции хромат- и дихромат-ионов. |
|||
| 12.1. Действие калия йодида. К 2-3 каплям раствора хромат- и дихромат-ионов, подкисленного 1М раствором H2 SO4 , прибавляют 5 капель хлороформа и 2 капли раствора калия йодида. |
|||
| 13. Реакции тетраборат- и метаборат-ионов. |
|||
| 13.1. Окрашивание пламени. А) В фарфоровой чашке смешивают неско-лько кристаллов натрия тетраборота и каль-ция фторида, смесь смачивают 3-4 каплями концентрированной серной кис-лоты. Небо-льшую часть смеси в петле нихромовой проволочки подносят к пламени газовой горелки. В) В тигель помещают несколько кристалл-лов натрия тетрабората, прибавляют 3-4 кап. конц. H2 SO4 , 5-6 капель этилового спи-рта, хорошо перемешивают и поджигают. |
|||
| 14. Реакции фторид-ионов. |
|||
| 14.1. Образование кремния фторида. Несколько кристаллов кальция фторида и песка SiO2 смешивают с 3-5 каплями конц. H2 SO4 . Смесь вносят в сухую пробирку и закрывают пробкой со вставленной в нее петлей, содержащей каплю дист. воды. |
|||
Эталон выполнения задания экспериментальной работы
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 2. Действие группового реагента. |
||
| 2.1. Действие раствора бария хлорида. К 2-3 каплям растворов солей, содержащих анионы I аналитической группы, прибавляют по 2-3 капли 0,5М раствора BaCl2 . Испытывают отношение осадков к 2М раствору HCl. |
SO4 2- + Ba2+ BaSO4 SO3 2- + Ba2+ BaSO3 S2 O3 2- + Ba2+ BaS2 O3 CO3 2- + Ba2+ BaCO3 2PO4 3- + 3Ba2+ Ba3 (PO4 )2 C2 O4 2- + Ba2+ BaC2 O4 2AsO4 3- + 3Ba2+ Ba3 (AsO4 )2 2AsO3 3- + 3Ba2+ Ba3 (AsO3 )2 SiO3 2- + Ba2+ BaSiO3 B4 O7 2- + Ba2+ + 3H2 O Ba(BO2 )2 + 2H3 BO3 2F- + Ba2+ BaF2 CrO4 2- + Ba2+ BaCrO4 Cr2 O7 2- + Ba2+ + H2 O 2BaCrO4 + 2H+ |
Выпадение белых осадков Выпадение желтых осадков |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудова-ние |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Инструктаж по технике безопасности. |
10 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 4. |
Самостоятельная работа. Выполнение лабораторной работы. |
100 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 5. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 6. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 7. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Качественный анализ анионов. Характерные реакции анионов I-ой аналитической группы. Анализ смеси анионов I-ой аналитической группы.
![]()
|
|
|
|
|
|
|
|
|
|
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
|
|
|
![]()
![]()
![]()
|
|
![]()
ЗАНЯТИЕ № 11
Тема: Характерные реакции анионов II- ой , III- ей аналитических групп и анионов органических кислот. Анализ смеси анионов II –ой и III- ей аналитических групп.
Актуальность темы. Ко II-ой аналитической группе относятся анионы: Cl- , I- , Br - , S2- , а к III-ей аналитической группе - NO3 - , NO2 - , CH3 COO- . Они входят в состав соединений, среди которых много лекарственных средств (кислота хлористово-дородная, натрия хлорид, калия хлорид, натрия бромид, калия бромид, натрия йодид, калия йодид, натрия нитрит, висмута нитрат основной, кальция хлорид, сулема, серебра нитрат, и т.д.), которые применяют в медицинской практике. Анионы органических кислот, такие как ацетаты, оксалаты, тартраты и др., являются составными частями лекарственных средств органической природы. Реакции данных групп анионов используют при установлении подлинности лекарственных препаратов, а также при исследовании их на содержание примесей.
Общая цель. Уметь трактовать химико-аналитические свойства анионов II- ой , III- ей аналитических групп и анионов органических кислот и их реакции идентификации для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Трактовать химические свойства катионов II-ой и III-ей аналитических групп.
2. Интерпретировать действие группового реагента на анионы II-ой аналитической группы.
3. Проводить качественные реакции идентификации на хлорид-, йодид-, бромид-, сульфид-, нитрат-, нитрит-, ацетет-ионов в растворах.
4. Проводить качественные реакции идентификации анионов органических кислот (тартрат-, цитрат-, бензоат-, салицилат-ионов).
5. Трактовать ход качественного анализа анионов II-ой и III-ей аналитической группы при совместном присутствии.
6. Интерпретировать свойства анионов II-ой и III-ей аналитических групп и анионов органических кислот в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
1. Химико-аналитические свойства анионов II-ой аналитической группы.
1.1. Действие группового реагента на анионы II-ой аналитической группы (серебра нитрата).
1.2. Реакции хлорид-ионов.
1.3. Реакции бромид-ионов (действие окислителей).
1.4. Реакции йодид-ионов.
1.4.1. Действие растворов солей свинца.
1.4.2. Действие окислителей.
1.5. Реакции сульфид-ионов.
1.5.1. Действие кислот.
1.5.2. Действие натрия нитропруссида.
1.5.3. Действие растворов солей кадмия.
1.5.4. Действие раствора йода.
2. Химико-аналитические свойства анионов III-ей аналитической группы.
2.1. Реакции нитрат-ионов.
2.1.1. Действие солей железа (II).
2.1.2. Действие раствора дифениламина.
2.2. Реакции нитрит-ионов.
2.2.1. Действие кислоты .
2.2.2. Действие раствора калия йодида.
2.2.3. Действие раствора антипирина.
2.2.4. Действие раствора калия перманганата.
2.2.5. Действие аммония хлорида.
2.3. Реакции ацетат-ионов.
2.3.1. Действие кислот.
2.3.2. Реакция этерификации.
2.3.3. Действие раствора железа (III) хлорида.
3. Реакции анионов органических кислот.
3.1. Реакции тартрат-ионов.
3.1.1. Действие раствора калия хлорида.
3.1.2. Действие резорцина.
3.2. Реакции цитрат-ионов.
3.2.1. Действие кальция хлорида.
3.2.2. Действие уксусного ангидрида.
3.3. Реакции бензоат- и салицилат-ионов (действие раствора железа (III) хлорида).
4. Систематический ход анализа анионов II-ой и III-ей аналитических групп при совместном присутствии.
5. Свойства и использование анионов II-ой и III-ей аналитических групп в лекарственных средствах.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 146 – 153.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. –Харків, вид-во НФАУ Оригiнал, 2004 – C. 143 – 153.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 504 – 549
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ .
| 1) В химико-аналитической лаборатории исследовали растворы со смесями анионов. В каком из указанных растворов находятся анионы II-ой аналитической группы? A. Cl- , I- , F- , S2- . B. Cl- , I- , Br - , S2- . C. F- , SO4 2- , I- , NO3 - . D. NO2 - , Cl- , PO4 3- , Br- . E. Br - , SO3 2- , CO3 2- , F- . |
4) В химико-аналитической лаборатории идентифицировали смесь анионов, чтобы обнаружить бромид-ионы к раствору добавили KMnO4 . В какой цвет окрашивается хлороформный слой, если присутствуют бромиды? A. Красный. B. Оранжевый. C. Зеленый. D. Желтый E. Фиолетовый. |
| 2) Для упрощения анализа анионы делят на три аналитические группы. Какие анионы относятся только к Ш-ей аналитической группе? A. NO3 - , NO2 - , CH3 COO- . B. SO4 2- , I- , CH3 COO- . C. Cl- , Br - , S2- . D. CO3 2- , PO4 3- , F- . E. NO2 - , SO4 2- , CH3 COO- . |
5) В химико-аналитической лаборатории исследовали раствор со смесью анионов. При добавлении раствора антипирина образовался изумрудно-зеленый осадок. О присутствии каких анионов свидетельствует данный аналитический эффект? A. Нитратов. B. Нитритов. C. Ацетатов. D. Тартратов. E. Цитратов |
| 3) В ходе систематического анализа смеси анионов используют групповые реагенты. Какое соединение является групповым реагентом для III-ей аналитической группы? A. Раствор BaCl2 . B. Раствор BaSO4 . C. Раствор AgCl. D. Раствор AgNO3 . E. Нет группового реагента. |
6) Раствор серебра нитрата является групповым реагентом на анионы II-ой аналитической группы. С какими анионами данный реактив дает черный осадок? A. Сульфидами. B. Бромидами. C. Йодидами. D. Хлоридами. E. Фторидами. |
| 7) Действие дифениламина на нитраты является фармакопейной реакцией, аналитическим эффектом при этом является образование ярко окрашенного соединения. Какого цвета соединение образуется? A. желтого. B. белого. C. красного. D. черного. E. синего. |
9) В химико-аналитической лаборатории исследовали раствор со смесью органических анионов. При добавлении раствора железа ( III) хлорида образовалось соединение красного цвета. О присутствии каких анионов свидетельствует данный аналитический эффект? A.Бензоатов. B. Формиатов. C. Ацетатов. D. Тартратов. E. Цитратов. |
| 8) Химик, исследуя смесь анионов, добавил к раствору соль свинца, при этом образовался желтый осадок. О наличии каких анионов свидетельствует данная реакция? A. Cl- . B. SO4 2- . C. I- . D. NO3 - . E. Br – |
10) Химик-аналитик исследовал раствор со смесью анионов. С помощью какого реагента можно определить салицилат-ионы, если другие органические анионы отсутствуют? A. Калия перманганата. B. Дифениламина. C. Калия хлорида. D. Железа (III) хлорида. E. Антипирина. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
B |
6 |
А |
| 2 |
7 |
||
| 3 |
8 |
||
| 4 |
В |
9 |
|
| 5 |
10 |
D |
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 1.1. Действие группового реагента. |
||
| 1.1. Действие серебра нитрата. К 2-3 каплям растворов солей, содержащих анионы II аналитической группы, прибавляют по 2-3 капли раствора серебра нитрата, подкисленного 2М раствором HNO3 . Испытывают отношение образовавшихся осадков к 12 %-ному раствору аммония карбоната и 2М раствору аммиака. |
||
| 1.3. Реакции бромид-ионов. |
||
| 1.3. Действие окислителей. К 2-3 каплям раствора натрия бромида прибавляют 2-3 капли 1М раствора серной кислоты, 5 капель хлороформа и приливают по каплям при постоянном встряхивании свежеприготовленную хлорную воду. |
||
| 1.4. Реакции йодид-ионов. |
||
| 1.4.1. Действие растворов солей свинца. К 2-3 каплям раствора калия йодида прибавляют 2-3 капли раствора соли свинца. Испытывают отношение осадка к нагреванию и последующему охлаждению. |
||
| 1.4.2. Действие окислителей. А) К 2-3 каплям раствора калия йодида прибавляют 2-3 капли 1М раствора серной кислоты, 5 капель хлороформа и приливают по каплям при постоянном встряхивании свежеприготовленную хлорную воду. |
||
| 1.5. Реакции сульфид-ионов. |
||
| 1.5.1. Действие кислот. К 2-3 каплям раствора натрия сульфида прибавляют 2 капли 2М раствора HCl. Сероводород обнаруживают по почернению бумаги, пропитанной раствором соли Pb. |
||
| 1.5.2. Действие натрия нитропруссида. К 2-3 каплям раствора натрия сульфида прибавляют 2 капли натрия гидроксида и 1-2 капли раствора Na2 [Fe(CN)5 NO] |
||
| 1.5.3. Действие растворов солей кадмия. К 2-3 каплям раствора натрия сульфида прибавляют 2 капли соли кадмия. |
||
| 1.5.4. Действие раствора йода. К 2-3 каплям раствора йода прибавляют 5-6 капель раствора аммония сульфида. |
||
| 2.1. Реакции нитрат-ионов. |
||
| 2.1.1. Действие раствора железа ( II) сульфата. К 3-5 каплям натрия нитрата прибавляют 3-4 кристаллика FeSO4 , перемешивают и осторожно по стенке пробирки прибавляют 2-3 капли концентрированной серной кислоты. |
||
| 2.1.2. Действие раствора дифениламина. К 2-3 каплям натрия нитрата прибавляют 2-3 капли раствора дифениламина. |
||
| 2.2. Реакции нитрит-ионов. |
||
| 2.2.1. Действие кислоты. К 5-6 каплям раствора натрия нитрита прибавляют 3-4 капли 1М раствора H2 SO4 . |
||
| 2.2.2. Действие раствора калия йодида. К 2-3 каплям раствора натрия нитрита прибавляют 1-2 капли 1М раствора H2 SO4 , и 5 капель хлороформа, 2-3 капли раствора калия йодида и энергично встряхивают. |
||
| 2.2.3. Действие раствора антипирина. В фарфоровой чашке растворяют несколько кристаллов антипирина в 2 каплях разведенной HCl и прибавляют 2 капли р-ра натрия нитрита. |
||
| 2.2.4. Действие раствора калия перманганата. К 2-3 каплям разбавленного раствора калия перманганата, подкисленного 2-3 каплями 1М раствора серной кислоты, прибавляют при встряхивании 2-5 капель раствора натрия нитрита. |
||
| 2.2.5. Действие аммония хлорида. К 3-5 каплям натрия нитрита прибавляют несколько кристаллов аммония хлорида и нагревают на водяной бане. |
||
| 2.2.6. Действие раствора железа ( II) сульфата. К 3-5 каплям раствора натрия нитрита прибавляют 3-4 кристалла железа (II) сульфата, перемешивают и прибавляют 3-5 капель 1М раствора H2 SO4 . |
||
| 2.3. Реакции ацетат-ионов. |
||
| 2.3.1. Действие кислот. К 5-6 каплям натрия ацетата прибавляют 2-3 капли 1М раствора H2 SO4 и осторожно нагревают. |
||
| 2.3.2. Реакция образования этилацетата. В пробирке смешивают несколько кристаллов натрия ацетата с 3-4 каплями концентрированной серной кислоты и 5-8 каплями этилового спирта. Смесь нагревают в течение 1-2 минут на водяной бане и выливают в стакан с холодной водой |
||
| 2.3.3. Действие раствора железа ( III) хлорида. К 2-3 каплям натрия ацетата прибавляют 2-3 капли FeCl3 . |
||
| 3.1. Реакции тартрат-ионов. |
||
| 3.1.1. Действие раствора калия хлорида. К 3-4 каплям раствора натрия гидротартрата прибавляют 10 капель этилового спирта, 3-4 капли раствора калия хлорида. Испытывают отношение осадка к действию минеральных кислот и щелочей. |
||
| 3.1.2. Действие резорцина. К 4-5 каплям раствора натрия гидротартрата прибавляют 20 капель концентрированной серной кислоты, кристаллический резорцин и нагревают на водяной бане. |
||
| 3.2. Реакции цитрат-ионов. |
||
| 3.2.1. Действие кальция хлорида. К 2-3 каплям раствора натрия цитрата прибавляют 2-3 капли раствора кальция хлорида и кипятят на водяной бане. Исследуют отношение осадка к 2М раствору HCl. |
||
| 3.2.2. Действие уксусного ангидрида. К 2-3 каплям раствора натрия цитрата прибавляют 4-5 капель уксусного ангидрида и нагревают на водяной бане. |
||
| 3.3. Реакции бензоат-ионов. |
||
| 3.3.1. Действие раствора железа ( III) хлорида. К 10-15 каплям раствора натрия бензоата прибавляют 1-2 капли раствора железа (Ш) хлорида. |
||
| 3.4. Реакции салицилат-ионов. |
||
| 3.4.1. Действие раствора железа ( III) хлорида. К 5-6 каплям раствора натрия салицилата прибавляют 2-3 капли раствора железа (Ш) хлорида. Испытывают отношение полученного раствора к растворам уксусной и хлороводородной кислот. |
||
Эталон выполнения задания экспериментальной работы
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 1.1. Действие группового реагента. |
||
| 1.1. Действие серебра нитрата. К 2-3 каплям растворов солей, содержащих анионы II аналитической группы, прибавляют по 2-3 капли раствора серебра нитрата, подкисленного 2М раствором HNO3 . |
Cl- + Ag+ AgCl Br - + Ag+ AgBr I- + Ag+ AgI S2- + 2Ag+ Ag2 S |
Белый осадок Бледно-желтый осадок Желтый осадок Черный осадок |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Инструктаж по технике безопасности. |
10 |
Инструкция по технике безопасности. |
Учебная лаборатория. |
|
| 4. |
Самостоятельная работа. Выполнение лабораторной работы |
100 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания. |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 5. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 6. |
Итоговый тестовый контроль. |
10 |
Наборы тестов. |
Учебная лаборатория. |
|
| 7. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Характерные реакции анионов II- ой , III- ей аналитических групп и анионов органических кислот. Анализ смеси анионов II –ой и III- ей аналитических групп
![]()
ЗАНЯТИЕ № 12
Тема: Анализ смеси анионов I-ой – III-ей аналитических групп.
Актуальность темы. При изучении предыдущих занятий вы убедились, что анионы I –III аналитических групп входят в состав соединений, среди которых много лекарственных средств, широко использующихся в медицине. На практике часто применяют лекарственные формы, представляющие собой смесь нескольких веществ. При этом появляется необходимость идентифицировать различные анионы - составные части лекарственных веществ - при их совместном присутствии. Также испытание лекарственных средств на чистоту часто требует проведения реакций на несколько примесей-анионов (фториды, нитраты, нитриты и др.), которые могут присутствовать одновременно. Поэтому понимание особенностей химико-аналитических свойств и проведение систематического хода анализа анионов I –III аналитических групп при их совместном присутствии является важной задачей для фармацевта.
Общая цель. Уметь трактовать химико-аналитические свойства и ход систематического анализа анионов I – III аналитических групп при совместном присутствии для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Проводить предварительные испытания раствора, содержащего смесь анионов I –III аналитических групп.
2. Проводить систематический ход анализа смеси анионов I –III аналитических групп в растворе
3. Интерпретировать мешающее влияние анионов I –III аналитических групп при их совместном присутствии и методы его устранения.
4. Интерпретировать ход анализа смеси анионов I –III аналитических групп в случае их присутствия в лекарственных средствах.
Содержание обучения.
Перечень теоретических вопросов:
1. Предварительные испытания и наблюдения.
1.1. Определение цвета раствора.
1.2. Определение запаха раствора.
1.3. Окрашивание пламени горелки.
1.4. Отношение раствора к нагреванию.
1.5. Определение рН раствора.
1.6. Отношение раствора к воде.
1.7. Отношение раствора к уксусной кислоте.
1.8. Отношение раствора к минеральным кислотам.
2. Проба на анионы I аналитической группы.
3. Проба на анионы II аналитической группы.
4. Пробы на анионы-восстановители.
4.1. Действие раствора йода в слабощелочной среде.
4.2. Действие раствора йода в слабокислой среде.
5. Пробы на анионы-окислители.
5.1. Действие калия йодида в концентрированной HCl.
5.2. Действие калия йодида в слабокислой среде.
6. Проба на анионы нестойких кислот.
7. Обнаружение и отделение оксалат-ионов.
8. Анализ галогенид -ионов при их совместном присутствии.
9. Обнаружение йодид- и бромид-ионов.
10. Анализ азотсодержащих ионов.
10.1. Обнаружение нитрит-ионов.
10.2. Удаление ионов, мешающих обнаружению нитрат-ионов.
10.2.1. Удаление нитрит-ионов.
10.2.2. Удаление бромид- и йодид-ионов.
10.3. Обнаружение нитрат-ионов.
11. Анализ серусодержащих ионов.
11.1. Обнаружение сульфид-ионов.
11.2. Удаление сульфид-ионов.
11.3. Отделение сульфит- и сульфат-ионов.
11.4. Обнаружение сульфит- и сульфат-ионов.
11.5. Обнаружение тиосульфат-ионов.
12. Обнаружение фторид-, тетраборат-, ацетат-ионов сухим способом.
13. Обнаружение других анионов.
13.1 Обнаружение силикат-ионов действием солей аммония.
13.2. Обнаружение хромат- (дихромат-) ионов действием калия йодида.
13.3. Обнаружение карбонат-ионов действием минеральных кислот.
14. Мешающее влияние анионов при их совместном присутствии, методы его устранения.
15. Анализ смесей анионов в контроле качества лекарственных веществ.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей редакцией В.В. Болотова. - Харьков, издательство НФАУ «Золотые страницы», 2001 – C. 154 – 175.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною редакцiєю В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004 – C. 153 – 173.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 464 – 567
2)
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ .
| 1)В ходе предварительных испытаний раствора, содержащего смесь анионов, было установлено, что рН раствора меньше единицы. Присутствие какого аниона возможно в данных условиях? A. CO3 2- . B. S2 O3 2- . C. Cl - . D. SO3 2- . E. NO2 - |
4) Оксалаты относятся к I аналитической группе анионов. Анионом какой кислоты являются оксалат-ионы? A. Щавелевой B. Муравьиной. C. Бензойной. D. Уксусной. E. Лимонной. |
| 2) В ходе систематического хода анализа анионов возникают сложности в связи с тем, что многие катионы мешают определе-нию тех или иных анионов. Какие катионы не мешают систематическому ходу анализа анионов? A. K+ , Na+ , NH4 + . B. Na+ , NH4 + , Ca2+ . C. NH4 + , Ca2+ , Со2+ . D. K+ , NH4 + , Ba2+ . E. Na+ , Co2+ , Ni2+ . |
5) В систематическом ходе анализа анионов после предварительных испытаний проводят пробу на анионы I-ой аналитической группы. С помощью какого реактива проводят данную реакцию? A. BaCl2 . B. AgNO3 . C. BaCO3 D. [Ag(NH3 )2 ]Cl E. KI |
| 3) Перед анализом анионов катионы тяжелых и щелочноземельных металлов следует удалить. С каким раствором для этого нужно прокипятить исследуемую смесь? A. NaOH. B. HCl. C. H2 SO4 . D. Na2 CO3 . E. CH3 COOH. |
6) В химико-аналитической лаборатории исследовали раствор со смесью анионов. При добавлении раствора серебра нитрата выпал осадок. Какие анионы присутствуют в исследуемом растворе? A. Анионы I аналитической группы. B. Анионы органических кислот. C. Анионы III аналитической группы. D. Анионы II аналитической группы. E. Анионы нестойких кислот. |
| 7) В ходе систематического анализа химик к исследуемому раствору прибавил несколько капель 1М раствора серной кислоты, хлороформ и свежеприготовленную хлорную воду. Какие анионы он определяет? A. I- и Br - . B. Cl - и Br - . C. CO3 2- и Cl - . D. I- и F - . E. SO4 2- и F - . |
9) Химик-аналитик определяет в исследуемом растворе сульфид-ионы при помощи натрия нитропруссида. Какой аналитический эффект свидетельствует о присутствии сульфидов? A. Выпадение черного осадка. B. Выпадение белого осадка. C. Зеленая окраска раствора. D. Выпадение изумрудно-зеленого осадка. E. Красно-фиолетовая окраска раствора. |
| 8) В ходе анализа лекарственной формы на примеси анионов аналитику необходимо определить нитрат-ионы. Какие анионы мешают данному обнаружению? A. Хлориды. B. Силикаты. C. Сульфаты. D. Сульфиды. E. Нитриты. |
10) В ходе обнаружения анионов в лекарственной субстанции после определения серусодержащих анионов к раствору прибавили несколько капель натрия гидроксида и упарили на водяной бане до сухого остатка. Какие анионы можно идентифицировать в сухом остатке? A. Сульфитов. B. Хлоридов. C. Фторидов. D. Тиосульфатов. E. Нитратов. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
C |
6 |
|
| 2 |
7 |
A |
|
| 3 |
D |
8 |
|
| 4 |
9 |
E |
|
| 5 |
10 |
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 1. Предварительные испытания и наблюдения |
||
| 1.1. Цвет |
||
| 1.2. Запах |
||
| 1.3. Окрашивание пламени На предметное стекло наносят 2-3 капли раствора, осторожно выпаривают досуха на водяной бане. Затем очищенной раскаленной нихромовой петлей захватывают пробу и вносят в бесцветную часть пламени газовой горелки. |
||
| 1.4. Отношение к нагреванию Несколько капель испытуемого раствора переносят в чистую пробирку и нагревают над пламенем горелки. |
||
| 1.5. Определение рН среды 2-3 капли раствора переносят на универсальную индикаторную бумагу, по цвету определяют рН среды. |
||
| 1.6. Отношение к воде Несколько крупинок сухого вещества растворить в нескольких каплях воды. |
||
| 1.7. Отношение к уксусной кислоте К 2-3 каплям испытуемого раствора добавляют 2-3 капли ледяной уксусной кислоты. |
||
| 1.8. Отношение к минеральным кислотам К 2-3 каплям испытуемого раствора добавляют 2-3 капли предложенной минеральной кислоты. |
||
| 2. Проба на анионы I аналитической группы |
||
| 2. Проба на анионы I аналит. группы. К 5-10 каплям предварительно нейтрализованного раствора (рН~7) прибавляют 2-3 капли раствора BaCl2 . образование осадка свидетельствует о присутствии анионов I аналитической группы. Его отделяют центрифугированием и прибавляют 5-10 капель 2М раствора HCl. Если осадок полностью не растворяется, то присутствуют сульфат-ионы и, возможно, тиосульфат-ионы (осадок серы). Отрицательная реакция на анионы I аналитической группы еще не свидетельствует об отсутствии фторид-, тетраборат-, тиосульфат-ионов. Эти анио -ны обнаруживают дробными реакциями. |
||
| 3. Проба на анионы II аналитической группы. |
||
| 3. Проба на анионы II аналит. группы. К 2 каплям исследуемого раствора прибавляют 2-3 капли серебра нитрата, подкисленного разведенной HNO3 . Образование осадка свидетельствует о присутствии анионов II аналитической группы. |
||
| 4. Пробы на анионы-восстановители. |
||
| 4.1. Действие раствора йода в слабощелочной среде. К 2-3 каплям исследуемого раствора прибавляют 2 капли насыщенного раствора натрия гидрокарбоната и по каплям разбавленный раствор йода. Обесцвечивание раствора свидетельствует о присутствии арсенит-ионов. |
||
| 4.2. Действие раствора йода в слабокислой среде. К 3 каплям исследуемого раствора, подкисленного 1М раствором серной кис-лоты, прибавляют по каплям разбавленный раствор йода. Обесцвечивание раствора свидетельствует о возможном присутствии тиосульфат-, сульфит- и сульфид-ионов. |
||
| 5. Пробы на анионы-окислители |
||
| 5.1. Действие калия йодида в конц. HCl. К 2-3 каплям исследуемого раствора прибавляют 2-3 капли конц. HCl, 5 капель хлороформа и 2-3 капли раствора калия йодида. Красно-фиолетовая окраска хлороформного слоя свидетельствует о присутствии арсенат-ионов. |
||
| 5.2. Действие калия йодида в слабокислой среде. К 2-3 каплям исследуемого раствора прибавляют 2-3 капли 1М раствора серной кислоты, 5 капель хлороформа и 2-3 капли раствора калия йодида. Красно-фиолетовая окраска хлороформного слоя свидетель-ствует о присутствии анионов-окислителей. |
||
| 6. Проба на анионы нестойких кислот. |
||
| 6. Проба на анионы нестойких кислот. К 2-3 каплям исследуемого раствора прибавляют 2-3 капли 1М раствора серной кислоты. Пробирку встряхивают. Выделение газов CO2 , NO2 , SO2 свидетельствуют о возможном присутствии карбонат-, нитрит- сульфит-, тиосульфат-ионов. |
||
| 7. Обнаружение и отделение оксалат-ионов. |
||
| 7. Обнаружение и отделение оксалат-ионов. К 2-3 каплям исследуемого раствора, подкисленного 2-3 каплями 2М раствора CH3 COOH, прибавляют 3-4 капли раствора кальция хлорида. Полученную смесь центрифугируют и проверяют полноту осаждения. Осадок CaC2 O4 отделяют, промывают дист. водой и растворяют в 1М растворе серной кислоты. Раствор нагревают на водяной бане и прибавляют 2-3 капли разведенного раствора калия перманганата. Обесцвечивание раствора указывает на присутствие оксалат-ионов. |
||
| 8. Анализ-, хлорид-, бромид-, йодид-ионов |
||
| 8. Анализ-, хлорид-, бромид-, йодид-ионов при их совместном присутствии. К 3-4 каплям исследуемого раствора, подкисленного 2М раствором азотной кислоты, прибавляют 3-4 капли раствора серебра нитрата. Смесь центрифугируют, проверяют полноту осаждения. Осадки AgCl, AgBr, AgI отделяют, промывают дистиллированной водой, обрабатывают 12-% раствором аммония карбоната. Смесь центрифугируют. В пробирку отбирают по 3-5 капель центрифугата и прибавляют 3-4 капли разведенной азотной кислоты. Образование творожистого осадка свидетельствует о присутствии ионов Cl- . |
||
| 9. Обнаружение йодид- и бромид-ионов. К 3-5 каплям исследуемого раствора прибавляют 2-3 капли 1М раствора серной кислоты, 10 капель хлороформа и приливают по каплям при постоянном встряхивании свежеприготовленную хлорную воду. Окраска хлороформного слоя в красно-фиолетовый цвет свидетельствует о присутствии I- -ионов. Для обнаружения Br - -ионов к раствору продолжают прибавлять хлорную воду. Если Br – ионы присутствуют, то хлороформный слой окрашивается в желтый цвет. |
||
| 10. Анализ нитрит- и нитрат-ионов. |
||
| 10.1. Обнаружение нитрит-ионов. В фарфоровой чашке растворяют несколько кристаллов антипирина в 2 каплях разведенной HCl и прибавляют 2 капли исследуемого раствора. Изумрудно-зеленая окраска свидетельствует о присутствии NO2 - - ионов. |
||
| 10.2.1. Удаление нитрит-ионов. К 8-10 каплям исследуемого раствора прибавляют несколько кристаллов аммония хлорида. Смесь нагревают на водяной бане до полного прекращения выделения пузырьков азота. Если нитрит-ионы полностью удалены, действие раствора KI в кислой среде не приводит к окрашиванию раствора. |
||
| 10.2.2. Удаление бромид- и йодид-ионов. К 2-4 каплям исследуемого раствора, полученного по пункту 10.2.1., если он содержит бромид- и йодид-ионы, прибавляют 2-3 капли 2М раствора HCl и по каплям хлорную воду. Смесь нагревают на водяной бане до прекращения выделения паров йода и брома. |
||
| 10.3. Обнаружение нитрат-ионов. К 3-4 каплям раствора, полученного по пункту 10.2.2., прибавляют 4-5 кристаллов железа (II) сульфата и осторожно, по стенке пробирки, 3-4 капли концентрированной серной кислоты. Образование бурого кольца свидетельствует о присутствии NO3 - – ионов. |
||
| 11. Анализ сульфид-, сульфит-, тиосульфат-, сульфат-ионов. |
||
| 11.1. Обнаружение сульфид-ионов. К 2-3 каплям исследуемого раствора прибавляют 2 капли 0,5М раствора натрия гидрокарбоната и 1-2 капли натрия нитропруссида. Красно-фиолетовая окраска свидетельствует о присутствии S2- - ионов. |
||
| 11.2. Удаление сульфид-ионов. Если сульфид-ионы обнаружены, то к 5 каплям исследуемого раствора прибавляют 5 капель раствора кадмия карбоната, смесь взбалтывают, центрифугируют и проверяют полноту осаждения, осадок отбрасывают. |
||
| 11.3. Отделение сульфит- и сульфат-ионов. К 5-7 каплям центрифугата, полученного по пункту 11.2., прибавляют раствор стронция нитрата. Смесь центрифугируют, проверяют полноту осаждения. Осадок промывают дистиллированной водой до отрицательной реакции на тиосульфат-ионы. |
||
| 11.4. Обнаружение сульфит- и сульфат-ионов. К осадку, полученному по пункту 11.3., прибавляют 3-5 капель 2М раствора HCl, а потом 2-3 капли раствора йода. Неполная растворимость осадка BaSO4 в растворе HCl свидетельствует о присутствии SO4 2- - ионов, а обесцвечивание раствора – о наличии SO3 2- - ионов. |
||
| 11.5. Обнаружение тиосульфат-ионов. В две пробирки отбирают по 2-3 капли центрифугата, полученного по пункту 11.3. в одну пробирку прибавляют 3-4 капли 2М раствора HCl, во вторую – раствор йода. Если в первой пробирке образуется S, а во второй – окраска раствора исчезает, то S2 O3 2- - ионы присутствуют. |
||
| 12. Обнаружение фторид-, тетраборат-, ацетат-ионов сухим способом. |
||
| 12. Обнаружение фторид-, тетраборат-, ацетат-ионов сухим способом. К 15-20 каплям исследуемого раствора прибавляют 3-5 капель 2М раствора натрия гидроксида и упаривают на водяной бане. Сухой остаток используют для обнаружения фторид-, тетраборат- и ацетат-ионов характерными реакциями. 1) фторид-ионы: Несколько кристаллов исследуемой смеси и песка SiO2 смешивают с 3-5 каплями концентрированной серной кислоты. Смесь вносят в сухую пробирку и закрывают пробкой со вставленной в нее металичес-кой петлей, содержащей каплю дист. воды. 2) тетраборат-ионы: В тигель помещают несколько кристаллов исследуемой смеси, прибавляют 3-4 капли конц. серной кислоты, 5-6 капель этилового спирта, хорошо перемешивают и поджигают. 3) ацетат-ионы: А) К 5-6 каплям исследуемой смеси прибавляют 2-3 капли 1М раствора H2 SO4 и осторожно нагревают. В) В пробирке смешивают несколько кристаллов натрия ацетата с 3-4 каплями конц. серной кислоты и 5-8 каплями этилового спирта. Смесь нагревают в течение 1-2 минут на водяной бане и выливают в стакан с холодной водой С) К 2-3 каплям натрия ацетата прибавляют 2-3 капли FeCl3 . |
||
| 13. Обнаружение других анионов. |
||
| 13.1 Обнаружение силикат-ионов действием солей аммония. К 5-6 каплям исследуемого раствора прибавляют несколько кристаллов аммония хлорида и нагревают на водяной бане. |
||
| 13.2. Обнаружение хромат- (дихромат-) ионов действием калия йодида. К 2-3 каплям исследуемого раствора, подкисленного 1М раствором H2 SO4 , прибавляют 5 капель хлороформа и 2 капли раствора калия йодида. |
||
| 13.3. Обнаружение карбонат-ионов действием минеральных кислот. К 10-15 каплям исследуемого раствора прибавляют 10 капель 2М раствора HCl. Пробирку закрывают пробкой с газоотводной трубкой и пропускают выделившийся газ через известковую воду. |
||
Эталон выполнения задания экспериментальной работы
| 3. Проба на анионы II аналит. группы. К 2 каплям исследуемого раствора прибавляют 2-3 капли серебра нитрата, подкисленного разведенной HNO3 . Образование осадка свидетельствует о присутствии анионов II аналитической группы. |
Cl- + AgNO3 + HNO3 AgCl Br- + AgNO3 + HNO3 AgBr I- + AgNO3 + HNO3 AgI |
Белый осадок Бледно-желтый осадок Желтый осадок |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Проверка готовности к занятию (устный опрос). |
20 |
Учебная лаборатория. |
||
| 3. |
Инструктаж по технике безопасности. |
10 |
Инструкция по технике безопасности |
Учебная лаборатория. |
|
| 4. |
Самостоятельная работа. Выполнение лабораторной работы. |
100 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания |
Центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 5. |
Анализ и коррекция усвоения материала. |
10 |
Учебная лаборатория. |
||
| 6. |
Итоговый тестовый контроль. |
10 |
Наборы тестов |
Учебная лаборатория. |
|
| 7. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Анализ смеси анионов I-III-ей аналитических групп .
![]()
ЗАНЯТИЕ № 13
Тема: Анализ смеси неизвестного состава (сухих солей).
Актуальность темы. Поскольку методики исследования растворов подробно рассматривались ранее, темой данного занятия является анализ твердых образцов, в частности, сухих солей неизвестного состава. При изучении предыдущих занятий вы убедились, что катионы I – VI и анионы I – III аналитических групп входят в состав соединений, среди которых много лекарств. На практике часто применяют лекарственные формы - твердые образцы, представляющие собой смесь нескольких веществ. При этом появляется необходимость идентифицировать различные катионы и анионы - составные части лекарственных веществ - при их совместном присутствии. Также испытание лекарственных средств на чистоту часто требует проведения реакций на различные примеси, как катионы, так и анионы, которые могут присутствовать одновременно. Поэтому для специалиста-провизора важно уметь интерпретировать химико-аналитические свойства и проведение систематического хода анализа сухой соли.
Общая цель. Уметь интерпретировать систематический ход анализа неизвестных сухих солей для качественного химического контроля лекарственных средств.
Конкретные цели. Уметь:
1. Проводить предварительные испытания и наблюдения.
2. Проводить систематический анализ катионов и анионов при совместном присутствии в растворе.
3. Интерпретировать мешающее влияние катионов и анионов при их совместном присутствии и методы его устранения.
4. Интерпретировать ход анализа сухих солей неизвестного состава – составных частей лекарственных форм.
Содержание обучения.
Перечень теоретических вопросов:
1. Предварительные испытания и наблюдения пробы.
1.1. Предварительные наблюдения и приготовление средней пробы.
1.1.1. Определение цвета и формы кристаллов под микроскопом.
1.1.2. Приготовление средней пробы.
1.2. Предварительные испытания твердого образца.
1.2.1. Проба на присутствие взрывоопасных веществ.
1.2.2. Проба окрашивания пламени.
1.2.3. Нагревание в тугоплавкой пробирке.
1.2.4. Проба на окислители.
1.2.5. Получение перлов.
1.2.6. Проба с концентрированной серной кислотой.
2. Переведение смеси в раствор.
3. Предварительные испытания раствора образца.
3.1. Определение цвета раствора.
3.2. Определение запаха раствора.
3.3. Отношение раствора к нагреванию.
3.4. Определение рН раствора.
3.5. Отношение раствора к уксусной кислоте.
3.6. Отношение раствора к минеральным кислотам.
4. Анализ смеси катионов (см. занятие № 8).
5. Анализ смеси анионов (см. занятие № 12).
6. Мешающее влияние катионов и анионов при их совместном присутствии и способы его устранения.
7. Анализ сухих солей в контроле качества лекарственных средств
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 108 – 183.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. –Харків, вид-во НФАУ Оригiнал, 2004 – C. 109 – 180.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 550 – 575.
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ
| 1) Анализ смеси неизвестного состава проводят в определенной последовательности. Что химику-аналитику нужно провести первым? A. предварительные испытания и наблюдения. B. анализ анионов. C. переведение смеси в раствор. D. анализ катионов. E. анализ анионов и катионов. |
2) При проведении анализа раствора, полученного после растворения сухой соли, подействовали 1М H2 SO4 , при этом образовался осадок. О присутствии катионов какой аналитической группы это свидетельствует? A. I. B. II. C. III. D. IV. E. VI. |
| 3) При проведении анализа смеси катионов необходимо отделить катионы II аналитической группы. С помощью какого раствора проводят эту операцию? A. 2М HCl. B. 0,2М HCl. C. 6М H2 SO4 . D. 3Н NaOH. E. 0,1Н H2 SO4 . |
7) В химико-аналитической лаборатории аналитик проводил систематический анализ неизвестной смеси и получил содовую вытяжку для определения анионов. Катионы каких аналитических групп находятся в растворенном виде в полученной вытяжке? A. I и III. B. I и V. C. II и V. D. III и IV. E. I и IV. |
| 4) На определенном этапе анализа смеси неизвестного состава необходимо сухое вещество перевести в раствор. Отношение к какому растворителю испытывают в начале? A. К воде (20-25°С). B. К горячей воде. C. К 2М HCl. D. К конц. HCl. E. К 2М HNO3 . |
8) В систематическом ходе анализа неизвестной смеси после обнаружения катионов получают содовую вытяжку и определяют в ней анионы. Какие анионы нужно определять первыми? A. NO3 - и NO2 - B. Cl- и Br - . C. Cl- и I- D. SO4 2- и SO3 2- . E. SO4 2- и Cl- . |
| 5) На определенной стадии анализа неизвестной смеси необходимо отделить катионы IV аналитической группы от катионов I, V, VI групп. С помощью какого реагента это проводят? A. 0,5М NaOH, 30-% Н2 О2 . B. 6М NaOH, 30-% Н2 О2 . C. 6М H2 SO4 , 3-% Н2 О2 . D. 0,1М H2 SO4 , 30-% Н2 О2 . E. 6М NaOH, 3-% Н2 О2 . |
9) В химико-аналитической лаборатории проводят сист. анализ раствора смеси анионов и используют раствор серебра нитрата, подкисленный разведенной HNO3 . Какие анионы определяют? A. Анионы I аналитической группы. B. Анионы-восстановители. C. Анионы-окислители. D. Анионы II аналитической группы. E. Анионы нестойких кислот. |
| 6) При обнаружении катионов в неизвестной смеси к испытуемому раствору прибавили избыток концентрированного раствора NH3 * H2 O. Катионы какой аналитической группы при этом осаждаются? A. II. B. III. C. IV. D. V. E. VI. |
10) В ходе анализа примесей анионов в лекарственном веществе к раствору прибавили несколько капель натрия гидроксида и упарили раствор на водяной бане до сухого остатка. Какие анионы определяют в сухом остатке? A. Нитраты. B. Хлориды. C. Ацетаты. D. Тиосульфаты. E. Сульфиты. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
C |
6 |
|
| 2 |
7 |
E |
|
| 3 |
A |
8 |
|
| 4 |
9 |
||
| 5 |
10 |
C |
ЭКСПЕРИМЕНТАЛЬНАЯ РАБОТА.
Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента |
Уравнения реакций |
Наблюдения и выводы |
| 1. Предварительные испытания и наблюдения пробы. |
||
| 1. 1. Предварительные наблюдения и приготовление средней пробы. |
||
| 1.1.1. Определение цвета и формы кристаллов под микроскопом. Смесь тщательно рассматривают с помощью лупы, а если необходимо, под микроскопом. |
||
| 1.1.2. Приготовление средней пробы Смесь тщательно перемешивают, растирают в ступке, просеивают сквозь сито, перемешивают и отбирают пробу массой ~ 0,5 г. Её разделяют на 4 части: для проведения предварительных испытаний, для анализа катионов, для анализа анионов, для проверки результатов анализа. |
||
| 1.2. Предварительные испытания твердого образца. |
||
| 1.2.1. Проба на присутствие взрывоопасных веществ. Небольшую часть сухой пробы размером приблизительно с зернышко проса помещают в тигель и нагревают в пламени газовой горелки в вытяжном шкафу. Если вспышка не возникает, то взрывоопасные соединения в пробе отсутствуют. |
||
| 1.2.2. Проба окрашивания пламени. При внесении в бесцветное пламя газовой горелки летучих соединений пламя окрашивается. |
||
| 1.2.3. Нагревание в тугоплавкой пробирке. Несколько кристаллов вносят в тугоплавкую пробирку и наблюдают за реакцией. Проба может возгоняться полностью, частично или не возгоняться вообще. Также может выделиться газ. |
||
| 1.2.4. Проба на окислители. Небольшое количество исследуемой смеси смешивают с углем и на шпателе вносят в пламя горелки. Вспышка смеси свидетельствует о присутствии нитратов, хлоратов, перманганатов и т.д. |
||
| 1.2.5. Получение перлов. Прокаливают петлю платиновой или нихромовой проволоки до красного цвета, касаются ею твердого натрия тетрабората и прокаливают в пламени газовой горелки, пока масса не перестанет пениться. Охлаждают полученную стекловидную массу, на нее кладут исследуемую смесь и снова прокаливают. После охлаждения отмечают цвет перла в проходящем свете. |
||
| 1.2.6. Проба с конц. серной кислотой. К нескольким каплям исследуемого раствора прибавляют 2-3 капли 1М раствора H2 SO4 . Возможно выделение газов |
||
| 2. Переведение смеси в раствор. |
||
| Растворение в: А) воде (20-25 С). В) горячей воде. С) 2М НСl. D) конц. НСl. Е) 2М НNO3 . |
||
| 3. Предварительные испытания раствора образца. |
||
| 3.1. Цвет |
||
| 3.2. Запах |
||
| 3.3. Отношение к нагреванию. Несколько капель испытуемого раствора переносят в чистую пробирку и нагревают над пламенем горелки. |
||
| 3.4. Определение рН среды. 2-3 капли раствора наносят на универсальную индикаторную бумагу, по цвету определяют рН среды. |
||
| 3.5. Отношение к уксусной кислоте. К 2-3 каплям испытуемого раствора добавляют 2-3 капли ледяной уксусной кислоты. |
||
| 3.6. Отношение к минеральным кислотам. К 2-3 каплям испытуемого раствора добавляют 2-3 капли предложенной минеральной кислоты (HCl, НNО3 ) . |
||
| 4. Анализ катионов. |
||
| 4.1. Обнаружение ионов NH4 + в отдельной пробе действием раствора щелочи при нагревании. К 3-4 каплям испытуемого раствора прибавляют 3-4 капли 2М раствора NaOH и нагревают. К отверстию пробирки подносят влажную красную лакмусовую бумагу. |
||
| 4.2. Обнаружение ионов Fe2+ в отдельной пробе действием раствора K3 [ Fe( CN)6 ]. К 2-3 каплям испытуемого раствора прибавляют 2 капли раствора K3 [Fe(CN)6 ]. |
||
| 4.3. Обнаружение ионов Fe3+ в отдельной пробе действием раствора K4 [ Fe( CN)6 ]. К 2-3 каплям испытуемого раствора прибавляют 2 капли раствора K4 [Fe(CN)6 ]. |
||
| 4.4. Обнаружение катионов калия после предварительного удаления катионов аммония (в случае их присутствия). К 5-6 каплям анализируемого раствора прибавляют 4-5 капель 2М раствора натрия карбоната. Смесь нагревают на водяной бане до полного удаления аммиака. Образовавшиеся осадки оксидов, основных солей, карбонатов и гидроксидов катионов II – VI аналитических групп отделяют центрифугированием и в дальнейшем анализе не используют. Центрифугат нейтрализуют уксусной кислотой до нейтральной среды (проба на лакмус), концентрируют выпариванием, охлаждают и обнаруживают ионы калия реакциями с NaHC4 H4 O6 и Na3 [Co(NO2 )6 ]. |
||
| 4.5. Обнаружение катионов натрия после предварительного удаления катионов аммония (в случае их присутствия). К 5-6 каплям анализируемого раствора прибавляют 4-5 капель 2М раствора калия карбоната. Смесь нагревают на водяной бане до полного удаления аммиака. Образовавшиеся осадки оксидов, основных солей, карбонатов и гидроксидов катионов II – VI аналитических групп отделяют центрифугированием и в дальнейшем анализе не используют. Центрифугат нейтрализуют уксусной кислотой до нейтральной среды (проба на лакмус), концентрируют выпариванием, охлаждают и обнаруживают ионы натрия реакциями с K[Sb(OH)6 ] и Zn[(UO2 )3 (CH3 COO)8 ]. |
||
| 4.6. Проба на присутствие в растворе катионов II аналитической группы. К 3-5 каплям исследуемого раствора прибавляют 5-6 капель 2М раствора HCl. Образование белого осадка или мути свидетельствует о присутствии в растворе катионов II аналитической группы. |
||
| 4.7. Отделение катионов II аналитической группы. К 30-35 каплям анализируемого раствора прибавляют 3-4 капли концентрированного раствора HCl, перемешивают стеклянной палочкой и центрифугируют. Проверяют полноту осаждения. Осадок промывают дист. водой, подкисленной 2М раствором HCl. В осадке – хлориды катионов II аналитической группы, в центрифугате – катионы I, III – VI аналитических групп и примесь катионов Pb2+ . Осадок хлоридов катионов II аналитической группы анализируют в соответствии с систематическим ходом анализа смеси катионов этой группы. |
||
| 4.8. Проба на присутствие в растворе катионов III аналитической группы. К 3-4 каплям центрифугата, полученного по пункту 4.7., прибавляют 3-5 капель этилового спирта и 1М раствора серной кислоты, перемешивают. Смесь нагревают на водяной бане. Образование осадка указывает на присутствие катионов III аналитической группы. |
||
| 4.9.Отделение катионов III аналитической группы (в случае их присутствия). К центрифугату, полученному по пункту 4.7., прибавляют по 20-25 капель этилового спирта и 1М раствор серной кислоты, перемешивают. Смесь нагревают на водяной бане в течение 5 минут, центрифугируют и проверяют полноту осаждения. В осадке сульфаты катионов III аналитической группы и PbSO4 . В центрифугате – катионы I, IV – VI аналитических групп. |
||
| 4.10. Отделение PbSO4 . Осадок, полученный по пункту 4.9., обрабатывают при нагревании на водяной бане 15-20 каплями 30%-ного раствора CH3 COONH4 , центрифугируют и промывают дист. водой до отрицательной реакции на ионы свинца. Осадок сульфатов катионов III аналитической группы анализируют в соответствии с систематическим ходом анализа смеси катионов этой группы. |
||
| 4.11. Отделение катионов IV аналитической группы от катионов V и VI аналитических групп. Центрифугат, полученный по пункту 4.9., упаривают на 1/3. К нему прибавляют 6М раствор NaOH или KOH (1,5 избытка от объема этого раствора), 5 капель 3%-ного раствора пероксида водорода, перемешивают и нагревают на водяной бане до полного разрушения пероксида водорода (прекращение выделения пузырьков кислорода из раствора), охлаждают и центрифугируют. Центрифугат содержит гидроксо- и оксоанионы IV и катионы I аналитических групп, а осадок – оксиды, гидроксиды и основные соли катионов V и VI аналитических групп. |
||
| 4.12. Анализ катионов IV аналитической группы. Центрифугат, полученный по пункту 4.11., анализируют в соответствии с систематическим ходом анализа смеси катионов IV аналитической группы. |
||
| 4.13. Отделение сурьмы. Осадок, полученный по пункту 4.11., обрабатывают 2М раствором HNO3 (20-30 капель) и 10-15 каплями раствора H2 O2 , нагревают на водяной бане до полного разложения H2 O2 , смесь центрифугируют. В центрифугате – катионы V и VI аналитических групп, в осадке – HSbO3 . |
||
| 4.14. Определение катионов Sb ( V). Осадок, полученный по пункту 4.13., растворяют в 10-15 каплях конц. хлороводородной кислоты. В растворе определяют Sb (V) реакцией с металлическим Zn. |
||
| 4.15. Разделение катионов V и VI аналитических групп. К центрифугату, полученному по пункту 4.13., прибавляют 1,5-кратный объем конц. раствора аммиака, перемешивают и осторожно нагревают. Смесь центрифугируют. В центрифугате – катионы VI аналитической группы в виде аммиачных комплексов, в осадке – оксиды, гидроксиды и основные соли катионов V аналитической группы. |
||
| 4.16. Анализ катионов V аналитической группы. Осадок, полученный по пункту 4.15., анализируют в соответствии с систематическим ходом анализа смеси катионов V аналитической группы. |
||
| 4.17. Анализ катионов VI аналитической группы. Осадок, полученный по пункту 2.15., анализируют в соответствии с систематическим ходом анализа смеси катионов VI аналитической группы. |
||
| 5. Анализ анионов. |
||
| 5.1. Приготовление содовой вытяжки. В тигле смешивают 0,1 г исследуемого вещества с 0,4 г Na2 CO3 и прибавляют 2,5 – 3 мл дистиллированной воды. Смесь кипятят 5 минут, прибавляют по мере упаривания воду, далее содержимое тигля переносят в коническую пробирку и центрифугируют. Объем центрифугата должен быть приблизительно 3 мл. при этом в осадок переходят катионы II, III, V, VI аналитических групп (виде оксидов, гидроксидов, карбонатов, основных солей), в растворе – анионы, которые входят в состав анализируемой смеси, а также гидроксоанионы, оксоанионы IV и катионы I аналиитческих групп. |
||
| 5.2. Обнаружение нитрит-ионов. В фарфоровой чашке растворяют несколько кристаллов антипирина в 2 каплях разведенной HCl и прибавляют 2 капли исследуемого раствора. Изумрудно-зеленая окраска свидетельствует о присутствии NO2 - - ионов |
||
| 5.3. Обнаружение нитрат-ионов. К 3-4 каплям раствора, полученного по пункту 10.2.2., прибавляют 4-5 кристаллов железа (II) сульфата и осторожно, по стенке пробирки, 3-4 капли концентрированной серной кислоты. Образование бурого кольца свидетельствует о присутствии NO3 - – ионов. |
||
| 5.4. Подготовка центрифугата к дальнейшему анализу. Оставшуюся порцию центрифугата нейтрализуют разведенной HNO3 . нейтрализацию проводят очень осторожно, кислоту прибавляют по каплям при постоянном перемешивании. Избытка кислоты не следует допускать, т.к. при этом некоторые анионы могут быть утеряны, кроме того, амфотерные гидроксиды, образованные в начале, будут растворяться и переходить в раствор в виде соответствующих катионов. Если при этом образуется осадок, его отделяют центрифугированием и отбрасывают. |
||
| 5.5. Проба на анионы I аналит. группы. К 5-10 каплям предварительно нейтрализованного раствора (рН~7) прибавляют 2-3 капли раствора BaCl2 . образование осадка свидетельствует о присутствии анионов I аналитической группы. Его отделяют центрифугированием и прибавляют 5-10 капель 2М раствора HCl. Если осадок полностью не растворяется, то присутствуют сульфат-ионы и, возможно, тиосульфат-ионы (осадок серы). Отрицательная реакция на анионы I аналитической группы еще не свидетельствует об отсутствии фторид-, тетраборат-, тиосульфат-ионов. Эти анионы обнаруживают дробными реакциями. |
||
| 5.6. Проба на анионы II аналитической группы. К 2 каплям исследуемого раствора прибавляют 2-3 капли серебра нитрата, подкисленного разведенной HNO3 . Образование осадка свидетельствует о присутствии анионов II аналитической группы. |
||
| 5.7. Действие раствора йода в слабощелочной среде. К 2-3 каплям исследуемого раствора прибавляют 2 капли насыщенного раствора натрия гидрокарбоната и по каплям разбавленный раствор йода. Обесцвечивание раствора свидетельствует о присутствии арсенит-ионов. |
||
| 5.8. Действие раствора йода в слабокислой среде. К 3 каплям исследуемого раствора, подкисленного 1М раствором серной кислоты, прибавляют по каплям разбавленный раствор йода. Обесцвечивание раствора свидетельствует о возможном присутствии тиосульфат-, сульфит- и сульфид-ионов. |
||
| 5.9. Действие калия йодида в конц. HCl. К 2-3 каплям исследуемого раствора прибавляют 2-3 капли концентрированной HCl, 5 капель хлороформа и 2-3 капли раствора калия йодида. Красно-фиолетовая окраска хлороформного слоя свидетельствует о присутствии арсенат-ионов. |
||
| 5.10. Действие калия йодида в слабокислой среде. К 2-3 каплям исследуемого раствора прибавляют 2-3 капли 1М раствора серной кислоты, 5 капель хлороформа и 2-3 капли раствора калия йодида. Красно-фиолетовая окраска хлороформного слоя свидетельствует о присутствии анионов-окислителей. |
||
| 5.11. Проба на анионы нестойких кислот. К 2-3 каплям исследуемого раствора прибавляют 2-3 капли 1М раствора серной кислоты. Пробирку встряхивают. Выделение газов CO2 , NO2 , SO2 свидетельствуют о возможном присутствии карбонат-, нитрит- сульфит-, тиосульфат-ионов. |
||
| 5.12. Обнаружение и отделение оксалат-ионов. К 2-3 каплям исследуемого раствора, подкисленного 2-3 каплями 2М раствора CH3 COOH, прибавляют 3-4 капли раствора кальция хлорида. Полученную смесь центрифугируют и проверяют полноту осаждения. Осадок CaC2 O4 отделяют, промывают дистиллированной водой и растворяют в 1М растворе серной кислоты. Раствор нагревают на водяной бане и прибавляют 2-3 капли разведенного раствора калия перманганата. Обесцвечивание раствора указывает на присутствие оксалат-ионов. |
||
| 5.13. Анализ-, хлорид-, бромид-, йодид-ионов при их совместном присутствии. К 3-4 каплям исследуемого раствора, подкисленного 2М раствором азотной кислоты, прибавляют 3-4 капли раствора серебра нитрата. Смесь центрифугируют, проверяют полноту осаждения. Осадки AgCl, AgBr, AgI отделяют, промывают дистиллированной водой, обрабатывают 12-% раствором аммония карбоната. Смесь центрифугируют. В пробирку отбирают по 3-5 капель центрифугата и прибавляют 3-4 капли разведенной азотной кислоты. Образование творожистого осадка свидетельствует о присутствии ионов Cl- . |
||
| 5.14. Обнаружение йодид- и бромид-ионов. К 3-5 каплям исследуемого раствора прибавляют 2-3 капли 1М раствора серной кислоты, 10 капель хлороформа и приливают по каплям при постоянном встряхивании свежеприготовленную хлорную воду. Окраска хлороформного слоя в красно-фиолетовый цвет свидетельствует о присутствии I- -ионов. Для обнаружения Br - -ионов к раствору продолжают прибавлять хлорную воду. Если Br – ионы присутствуют, то хлороформный слой окрашивается в желтый цвет. |
||
| 5.15. Удаление бромид- и йодид-ионов. К 2-4 каплям исследуемого раствора, свободного от нитрит-ионов, если он содержит бромид- и йодид-ионы, прибавляют 2-3 капли 2М раствора HCl и по каплям хлорную воду. Смесь нагревают на водяной бане до прекращения выделения паров йода и брома. |
||
| 5.16. Обнаружение сульфид-ионов. К 2-3 каплям исследуемого раствора прибавляют 2 капли 0,5М раствора натрия гидрокарбоната и 1-2 капли натрия нитропруссида. Красно-фиолетовая окраска свидетельствует о присутствии S2- - ионов. |
||
| 5.17. Удаление сульфид-ионов. Если сульфид-ионы обнаружены, то к 5 каплям исследуемого раствора прибавляют 5 капель раствора кадмия карбоната, смесь взбалтывают, центрифугируют и проверяют полноту осаждения, осадок отбрасывают. |
||
| 5.18. Отделение сульфит- и сульфат-ионов. К 5-7 каплям центрифугата, полученного по пункту 5.17., прибавляют раствор стронция нитрата. Смесь центрифугируют, проверяют полноту осаждения. Осадок промывают дистиллированной водой до отрицательной реакции на тиосульфат-ионы. |
||
| 5.19. Обнаружение сульфит- и сульфат-ионов. К осадку, полученному по пункту 5.18., прибавляют 3-5 капель 2М раствора HCl, а потом 2-3 капли раствора йода. Неполная растворимость осадка BaSO4 в растворе HCl свидетельствует о присутствии SO4 2- - ионов, а обесцвечивание раствора – о наличии SO3 2- - ионов. |
||
| 5.20. Обнаружение тиосульфат-ионов. В две пробирки отбирают по 2-3 капли центрифугата, полученного по пункту 5.18., в одну пробирку прибавляют 3-4 капли 2М раствора HCl, во вторую – раствор йода. Если в первой пробирке образуется S, а во второй – окраска раствора исчезает, то S2 O3 2- - ионы присутствуют. |
||
| 5.21. Обнаружение фторид-, тетраборат-, ацетат-ионов сухим способом. К 15-20 каплям исследуемого раствора прибавляют 3-5 капель 2М раствора натрия гидроксида и упаривают на водяной бане. Сухой остаток используют для обнаружения Фторид-, тетраборат- и ацетат-ионов характерными реакциями. 1) фторид-ионы: Несколько кристаллов исследуемой смеси и песка SiO2 смешивают с 3-5 каплями концентрированной серной кислоты. Смесь вносят в сухую пробирку и закрывают пробкой со вставленной в нее металлической петлей, содержащей каплю дистиллированной воды. 2) тетраборат-ионы: В фарфоровой чашке смешивают несколько кристаллов исследуемой смеси и кальция фторида, смесь смачивают 3-4 каплями концентрированной серной кислоты. Небольшую часть смеси в петле нихромовой проволочки подносят к пламени газовой горелки. В тигель помещают несколько кристаллов натрия тетрабората, прибавляют 3-4 капли концентрированной серной кислоты, 5-6 капель этилового спирта, хорошо перемешивают и поджигают 3) ацетат-ионы: - К 5-6 каплям исследуемой смеси прибавляют 2-3 капли 1М раствора H2 SO4 и осторожно нагревают. - В пробирке смешивают несколько кристаллов натрия ацетата с 3-4 каплями концентрированной серной кислоты и 5-8 каплями этилового спирта. Смесь нагревают в течение 1-2 минут на водяной бане и выливают в стакан с холодной водой - К 2-3 каплям натрия ацетата прибавляют 2-3 капли FeCl3 . |
||
| 5.22. Обнаружение силикат-ионов, действием солей аммония. К 5-6 каплям исследуемого раствора прибавляют несколько кристаллов аммония хлорида и нагревают на водяной бане. |
||
| 5.23. Обнаружение хромат- (дихромат-) ионов, действием калия йодида. К 2-3 каплям исследуемого раствора, подкисленного 1М раствором H2 SO4 , прибавляют 5 капель хлороформа и 2 капли раствора калия йодида |
||
| 5.24. Обнаружение карбонат-ионов, действием минеральных кислот. К 10-15 каплям исследуемого раствора прибавляют 10 капель 2М раствора HCl. Пробирку закрывают пробкой с газоотводной трубкой и пропускают выделившийся газ через известковую воду. |
||
Эталон выполнение заданий экспериментальной работы
| 4.3. Обнаружение ионов Fe3+ в отдельной пробе действием раствора K4 [ Fe( CN)6 ]. К 2-3 каплям испытуемого раствора прибавляют 2 капли раствора K4 [Fe(CN)6 ]. |
Fe3+ + K4 [Fe(CN)6 ] Fe4 [Fe(CN)6 ] + 4K+ |
Синее окрашивание раствора |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
10 |
Учебная лаборатория. |
||
| 2. |
Инструктаж по технике безопасности. |
15 |
Инструкция по технике безопасности |
Учебная лаборатория. |
|
| 3. |
Самостоятельная работа. Выполнение лабораторной работы. |
120 |
Граф логической структуры (приложение 1), алгоритм экспериментальной работы, целевые обучающие задания |
Микроскоп, центрифуга, водяная баня, химическая посуда, реактивы. |
Учебная лаборатория. |
| 4. |
Итоговый тестовый контроль. |
10 |
Наборы тестов |
Учебная лаборатория. |
|
| 5. |
Подведение итогов занятия. |
5 |
Учебная лаборатория. |
Граф логической структуры по теме : Анализ смеси неизвестного состава (сухих солей).
![]()
ЗАНЯТИЕ № 14
Тема: Контрольная работа на тему: « Качественный анализ анионов. Анализ смеси неизвестного состава».
Цель. Уметь трактовать химико-аналитические свойства анионов I – III аналитических групп и их реакции идентификации, а также систематический ход анализа смеси неизвестного состава для качественного химического контроля лекарственных средств.
Содержание обучения.
Перечень теоретических вопросов:
1. Систематический ход анализа анионов I-ой аналитической группы при совместном присутствии.
2. Химико-аналитические свойства анионов II-ой аналитической группы.
3. Химико-аналитические свойства анионов III-ей аналитической группы.
4. Реакции анионов органических кислот.
5. Систематический ход анализа анионов II-ой аналитической группы при совместном присутствии.
6. Систематический ход анализа анионов III-ей аналитической группы при совместном присутствии.
7. Свойства и использование анионов II-ой аналитической группы в лекарственных средствах.
8. Свойства и использование анионов III-ей аналитической группы в лекарственных средствах.
9. Систематический ход анализа смеси анионов I – III аналитических групп.
10. Систематический ход анализа смеси неизвестного состава.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Основные источники информации.
1) Аналитическая химия: Учебное пособие для студентов фармацевтических вузов и факультетов III – IV уровней аккредитации. Под общей ред. В.В. Болотова. - Харьков, изд-во НФАУ «Золотые страницы», 2001 – C. 135 – 183.
2) Аналiтична хiмiя: Навчальний посiбник для студентiв фармацевтичних вузiв та факультетiв III – IV рiвня акредитацii. Пiд загальною ред. В.В. Болотова. – Харків, вид-во НФАУ Оригiнал, 2004 – C. 132 – 180.
3) Лекции по аналитической химии.
4) Граф логической структуры (Приложение 1).
Дополнительные источники информации.
1) Алексеев В.Н. Курс качественного химического полумикроанализа. Под редакцией П.К. Агасаняна. Москва – «Химия», 1973 – С. 464 – 567
После изучения темы для самопроверки усвоения материала ответьте на следующие вопросы, заполнив таблицу с эталонами ответов.
ЦЕЛЕВЫЕ ОБУЧАЮЩИЕ ЗАДАНИЯ .
| 1) При анализе фармпрепарата были обнаружены анионы III аналитической группы, причем реакция „бурого кольца” была положительной. Какие анионы присутствуют в фармпрепарате? A. Нитраты. B. Нитриты. C. Фосфаты D. Фосфиты E. Арсениты |
2) При анализе лекарственного вещества необходимо перевести сульфаты катионов III аналитической группы в карбонаты. Укажите реагент, с помощью которого можно провести такое переосаждение. A. Гипсовая вода. B. Насыщенный раствор натрия карбоната. C. Баритовая вода. D. Натрия гидрокарбонат. E. Натрия хлорид. |
| 3) К подкисленному серной кислотой раствору, который содержит анионы III аналитической группы, добавили раствор КІ. Наблюдается выделение свободного йода. Какие анионы присутствуют в растворе? A. Сульфиты. B. Бромиды. C. Нитраты. D. Ацетаты. E. Нитриты. |
6) Исследуемый раствор с лекарственным веществом содержит ацетаты, оксалаты, сульфиты, сульфиды, нитриты. Какой из перечисленных анионов не реагирует с перманганатом калия в кислой среде? A. Оксалат. B. Сульфит. C. Сульфид. D. Ацетат. E. Нитрит. |
| 4) Для идентификации нитрат-анионов к раствору добавили реагент дифениламин. Какой аналитический эффект наблюдается при этой реакции? A. Выпадение желтого осадка. B. Выпадение синего осадка. C. Окрашивание раствора в синий цвет. D. Выпадение белого осадка. E. Окрашивание раствора в красный цвет. |
7) К исследуемому раствору добавили хлороформ и по каплям хлорную воду. Хлороформный слой окрасился в оранжевый цвет. О присутствии каких анионов свидетельствует данный аналитический эффект? A. Сульфитов. B. Бромидов. C. Йодидов. D. Сульфатов. E. Нитратов. |
| 5) В химико-аналитической лаборатории необходимо идентифицировать нитрит-ионы в присутствии нитрат-ионов, которые находятся в исследуемом фармпрепарате. С помощью какого реактива это можно сделать? A. Железа (ІІ) сульфат (разб.) и калия йодид. B. Антипирин и соляная кислота (разб.). C. Железа (ІІІ) сульфат (конц) и калия бромид. D. Железа (ІІ) сульфат. E. Железа (ІІІ) хлорид. |
8) При идентификации фосфат-ионов к исследуемому раствору прибавили раствор серебра нитрата (фармакопейная реакция). Осадок какого цвета при этом образовался? A. Желтого. B. Белого. C. Черного. D. Красного. E. Оранжевого. |
| 9) В ходе анализа смеси анионов в лекарственной субстанции к исследуемому раствору прибавили раствор соли аммония, при этом образовался гелеобразный осадок. О присутствии каких анионов свидетельствует данный аналитический эффект? A. B4 O7 2- . B. F- . C. NO3 - . D. PO4 3- . E. Si2 O3 2- . |
12) Реакция окрашивания бесцветного пламени газовой горелки является одним из методов идентификации примесей в лекарственных веществах. Какие анионы можно определить по окрашиванию пламени в зеленый цвет? A. Бораты. B. Арсенаты. C. Фториды. D. Хлориды. E. Ацетаты. |
| 10) К исследуемому раствору прибавили реактив, содержащий ионы железа ( III), при этом раствор приобрел розово-желтый цвет. О наличии каких органических анионов свидетельствует данная реакция? A. Цитратов. B. Салицилатов. C. Бензоатов. D. Тартратов. E. Ацетатов |
13) Сульфат-ионы относятся к первой аналитической группе анионов. С помощью какого соединения можно осадить данные анионы? A. Солей свинца. B. Минеральных кислот. C. Щелочей. D. Аммиака. E. Солей аммония. |
| 11) Йодид-ионы относятся ко второй аналитической группе анионов. При добавлении реактива выпал желтый осадок, который при нагревании растворился, а при дальнейшем охлаждении выпал в виде золотистых чешуек. Какой реактив использовали? A. серебра нитрат. B. свинца нитрат. C. калия нитрат. D. натрия нитрат. E. кальция нитрат. |
14) Сульфид-ионы относятся ко второй аналитической группе анионов. С помощью какого реактива можно идентифицировать сульфиды? A. серебра нитрата. B. серной кислоты. C. натрия нитропруссида. D. калия хромата. E. калия йодида. |
| 15) Реакция этерификации является фармакопейной для идентификации ацетат-ионов. Присутствие какого вещества необходимо для проведения этой реакции? A. щелочи. B. конц. азотной кислоты. C. аммиака. D. конц. серной кислоты. E. конц. соляной кислоты. |
16) Хлорид натрия используют в медицине для приготовления изотонического раствора. Для идентификации данного соединения используют реакцию окрашивания пламени катионом натрия. В какой цвет окрашивает пламя изотонический раствор? A.Красный. B.Зеленый. C. Фиолетовый. D. Желтый. E. Оранжевый. |
Эталоны ответов к целевым обучающим заданиям.
| № ВОПРОСА |
ОТВЕТ |
№ ВОПРОСА |
ОТВЕТ |
| 1 |
A |
9 |
|
| 2 |
10 |
C |
|
| 3 |
E |
11 |
|
| 4 |
12 |
||
| 5 |
13 |
A |
|
| 6 |
14 |
||
| 7 |
B |
15 |
|
| 8 |
16 |
D |
Технологическая карта занятия
| № ПП |
Этапы |
Время в мин. |
Учебные пособия. Средства обучения |
Оборудование |
Место проведения |
| 1. |
Организация занятия. |
5 |
Учебная лаборатория. |
||
| 2. |
Письменная контрольная работа. |
120 |
Наборы заданий для контрольной работы |
Учебная лаборатория. |
|
| 3. |
Анализ и коррекция контрольной работы. |
30 |
Учебная лаборатория. |
||
| 4. |
Подведение итогов. |
5 |
Учебная лаборатория. |
Приложение 1
Граф логической структуры по теме: Контрольная работа на тему: « Качественный анализ анионов. Анализ смеси неизвестного состава».
![]()