Методы получения дисперсных систем
СОДЕРЖАНИЕ: Определение молекулярности и порядок химической реакции. Изменение свободной энергии, сопровождающее химическую реакцию, ее связь с константой равновесия. Расчет теплового эффекта. Метод диспергирования. Физические методы конденсации. формула мицеллы.9. Определить изменение изобарно-изотермического потенциала реакции
N2(г)
+ 2Н2
О(ж)
= NH4
NO2 (ж)
и дать заключение о направлении ее протекания при стандартных условиях, если ![]() для Н2
О(ж)
равна – 237,4 кДж/моль, а для NH4
NO2(ж)
равна – 115,8 кДж/моль.
для Н2
О(ж)
равна – 237,4 кДж/моль, а для NH4
NO2(ж)
равна – 115,8 кДж/моль.
Решение:
![]()
![]() Изменение изобарно-изотермического потенциала меньше 0, следовательно, процесс может протекать самопроизвольно в сторону прямой реакции.
Изменение изобарно-изотермического потенциала меньше 0, следовательно, процесс может протекать самопроизвольно в сторону прямой реакции.
14. Определить молекулярность и порядок химической реакции на конкретных примерах.
Молекулярность реакции определяется минимальным числом молекул, одновременно участвующих в элементарном акте данной реакции. Молекулярность и порядок реакции численно совпадают только для простейших реакций. Для сложных процессов эти характеристики реакции будут отличаться (порядок реакции меньше ее молекулярности). Следовательно, формальное понятие о порядке реакции в большинстве случаев не отражает ее сложного механизма, т.е. наличия нескольких промежуточных элементарных реакций (стадий). Однако знание экспериментального порядка реакции позволяет судить о ее предполагаемом механизме путем сопоставления расчетных и экспериментально наблюдаемых значений величины n. Когда порядок реакции, найденный экспериментально, не соответствует числу моль реагентов, участвующих в реакции, то это говорит о том, что реакция не является элементарным процессом, а протекает по сложному механизму. Для сложного механизма скорость суммарной реакции определяется скоростью наиболее медленной стадии многоступенчатого процесса. Таким образом, если реакция протекает в одну стадию, то порядок ее равен молекулярности; если реакция протекает в несколько стадий, то порядок каждой из стадий реакции равен молекулярности только этой стадии. Следовательно, экспериментальное определение порядка реакции может служить методом изучения ее механизма.
Если для осуществления элементарного акта необходима всего одна частица (молекула), то такая реакция называется мономолекулярной.
Для элементарного процесса с одновременным участием двух частиц реакция будет называться бимолекулярной и т.д.
Например:
![]()
Реакция мономолекулярна, порядок реакции равен 1/3.
С(т)
+ Н2
О(г)
![]() СО(г)
+ Н2 (г)
СО(г)
+ Н2 (г)
Реакция бимолекулярна, порядок реакции равен 2/2= 1.
![]()
Реакция тримолекулярна, порядок реакции равен 2/3 (из трех молекул реагирующих веществ получают две молекулы продукта реакции).
29. Изменение свободной энергии, сопровождающее химическую реакцию, ее связь с константой равновесия. Расчет теплового эффекта реакции.
Изменение свободной энергии Гиббса![]() , или изменение изобарно-изотермического потенциала - это та максимальная часть энергии системы, которая в данных условиях может превратиться в полезную работу. При
, или изменение изобарно-изотермического потенциала - это та максимальная часть энергии системы, которая в данных условиях может превратиться в полезную работу. При ![]() реакция протекает самопроизвольно.
реакция протекает самопроизвольно.
В соответствии с законом действующих масс для произвольной реакции
а A + bB = cC + dD (1)
уравнение скорости прямой реакции можно записать:
![]() , (2)
, (2)
а для скорости обратной реакции
![]() . (3)
. (3)
По мере протекания реакции (1.33) слева направо концентрации веществ А и В будут уменьшаться и скорость прямой реакции будет падать. С другой стороны, по мере накопления продуктов реакции C и D скорость реакции справа налево будет расти. Наступает момент, когда скорости 1 и 2 становятся одинаковыми, концентрации всех веществ остаются неизменными, следовательно,
![]() , (4)
, (4)
ОткудаKc
= k1
/ k2
= ![]() .
.
Постоянная величина Кс , равная отношению констант скоростей прямой и обратной реакций, количественно описывает состояние равновесия через равновесные концентрации исходных веществ и продуктов их взаимодействия (в степени их стехиометрических коэффициентов) и называется константой равновесия. Константа равновесия является постоянной только для данной температуры, т.е. Кс = f (Т). Константу равновесия химической реакции принято выражать отношением, в числителе которого стоит произведение равновесных молярных концентраций продуктов реакции, а в знаменателе – произведение концентраций исходных веществ.
Если компоненты реакции представляют собой смесь идеальных газов, то константа равновесия (Кр ) выражается через парциальные давления компонентов:
Kp
= ![]() . (5)
. (5)
Или![]() . (6)
. (6)
Из уравнения (6) следует, что Кр = Кс при условии, если реакция идет без изменения числа моль в газовой фазе, т.е. когда (с + d) = (a + b).
Если реакция (1) протекает самопроизвольно при постоянных Р и Т или V и Т, то значения G и этой реакции можно получить из уравнения:
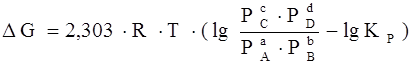 , (7)
, (7)
где Р А , Р В , Р С , РD – парциальные давления исходных веществ и продуктов реакции.
Уравнение (7) называются уравнениями изотермы химической реакции Вант-Гоффа. Это соотношение позволяет рассчитать значения G и F реакции, определить ее направление при различных концентрациях исходных веществ.
Необходимо отметить, что как для газовых систем, так и для растворов, при участии в реакции твердых тел (т.е. для гетерогенных систем) концентрация твердой фазы не входит в выражение для константы равновесия, поскольку эта концентрация практически постоянна. Так, для реакции
2 СО (г) = СО 2 (г) + С (т)
константа равновесия записывается в виде
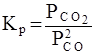 .
.
Зависимость константы равновесия от температуры (для температуры Т2 относительно температуры Т1 ) выражается следующим уравнением Вант-Гоффа:
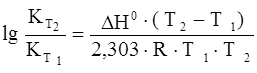 , (8)
, (8)
гдеН0 – тепловой эффект реакции.
34. Осмос, осмотическое давление. Уравнение Вант-Гоффа и осмотический коэффициент.
Осмос – самопроизвольное движение молекул растворителя через полупроницаемую мембрану, разделяющую растворы разной концентрации, из раствора меньшей концентрации в раствор с более высокой концентрацией, что приводит к разбавлению последнего. В качестве полупроницаемой мембраны, через маленькие отверстия которой могут селективно проходить только небольшие по объему молекулы растворителя и задерживаются крупные или сольватированные молекулы или ионы, часто служит целлофановая пленка – для высокомолекулярных веществ, а для низкомолекулярных – пленка из ферроцианида меди. Процесс переноса растворителя (осмос) можно предотвратить, если на раствор с большей концентрацией оказать внешнее гидростатическое давление (в условиях равновесия это будет так называемое осмотическое давление, обозначаемое буквой ). Для расчета значения в растворах неэлектролитов используется эмпирическое уравнение Вант-Гоффа:
= C · R · T,
где С – моляльная концентрация вещества, моль/кг;
R – универсальная газовая постоянная, Дж/моль · К.
Величина осмотического давления пропорциональна числу молекул (в общем случае числу частиц) одного или нескольких веществ, растворенных в данном объеме раствора, и не зависит от их природы и природы растворителя. В растворах сильных или слабых электролитов общее число индивидуальных частиц увеличивается вследствие диссоциации молекул, поэтому в уравнение для расчета осмотического давления необходимо вводить соответствующий коэффициент пропорциональности, называемый изотоническим коэффициентом.
i · C · R · T,
где i – изотонический коэффициент, рассчитываемый как отношение суммы чисел ионов и непродиссоциировавших молекул электролита к начальному числу молекул этого вещества.
Так, если степень диссоциации электролита, т.е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, равна и молекула электролита распадается при этом на n ионов, то изотонический коэффициент рассчитывается следующим образом:
i = 1 + (n – 1) · ,(i 1).
Для сильных электролитов можно принять = 1, тогда i = n, и коэффициент i (также больше 1) носит название осмотического коэффициента.
Явление осмоса имеет большое значение для растительных и животных организмов, поскольку оболочки их клеток по отношению к растворам многих веществ обладают свойствами полупроницаемой мембраны. В чистой воде клетка сильно набухает, в ряде случаев вплоть до разрыва оболочки, а в растворах с высокой концентрацией солей, наоборот, уменьшается в размерах и сморщивается из-за большой потери воды. Поэтому при консервировании пищевых продуктов к ним добавляется большое количество соли или сахара. Клетки микроорганизмов в таких условиях теряют значительное количество воды и гибнут.
Осмотическое давление обеспечивает движение воды в растениях за счет различия осмотических давлений между клеточным соком корней растений (5-20 бар) и почвенным раствором, дополнительно разбавляемом при поливе. Осмотическое давление обусловливает в растении подъем воды от корней до вершины. Таким образом, клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние берут ее из клеток корня.
49. Рассчитать ЭДС медно-цинкового гальванического элемента, в котором концентрация ионов С u 2 + равна 0,001 моль/л, а ионов Zn 2+ 0,1 моль/л. При расчетах учтите стандартные значения ЭДС:
о (Zn 2+ /Zn 0 ) = – 0,74 В и о (Cu 2 + /Cu0 ) = + 0,34 В.
Для расчета величины ЭДС используется уравнение Нернста 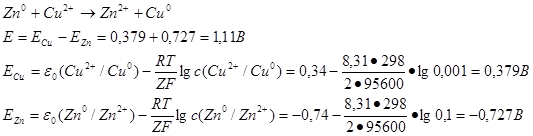
54. Методы получения дисперсных систем, их классификация и краткая характеристика. Какой метод получения дисперсных систем с термодинамической точки зрения наиболее выгоден?
Метод диспергирования. Заключается в механическом дроблении твердых тел до заданной дисперсности; диспергирование ультразвуковыми колебаниями; электрическое диспергирование под действием переменного и постоянного тока. Для получения дисперсных систем методом диспергирования широко используют механические аппараты: дробилки, мельницы, ступки, вальцы, краскотерки, встряхиватели. Жидкости распыляются и разбрызгиваются с помощью форсунок, волчков, вращающихся дисков, центрифуг. Диспергирование газов осуществляют главным образом с помощью барботирования их через жидкость. В пенополимерах, пенобетоне, пеногипсе газы получают с помощью веществ, выделяющих газ при повышенной температуре или в химических реакциях.
Несмотря на широкое применение диспергационных методов, они не могут быть применимы для получения дисперсных систем с размером частиц -100 нм. Такие системы получают кондесационными методами.
В основе конденсационных методов лежит процесс образования дисперсной фазы из веществ, находящихся в молекулярном или ионном состоянии. Необходимое требование при этом методе – создание пересыщенного раствора, из которого должна быть получена коллоидная система. Этого можно достичь при определенных физических или химических условиях.
Физические методы конденсации:
1) охлаждение паров жидкостей или твердых тел при адиабатическом расширении или смешивании их с большим объемом воздуха;
2) постепенное удаление (выпаривание) из раствора растворителя или замена его другим растворителем, в котором диспергируемое вещество хуже растворяется.
Так, к физической конденсации относится конденсация водяного пара на поверхности находящихся в воздухе твердых или жидких частиц, ионов или заряженных молекул (туман, смог).
Замена растворителя приводит к образованию золя в тех случаях, когда к исходному раствору добавляют другую жидкость, которая хорошо смешивается с исходным растворителем, но является плохим растворителем для растворенного вещества.
Химические методы конденсации основаны на выполнении различных реакций, в результате которых из пересыщенного раствора осаждается нерастворенное вещество.
В основе химической конденсации могут лежать не только обменные, но и окислительно-восстановительные реакции, гидролиза и т.п.
Дисперсные системы можно также получить методом пептизации, который заключается в переводе в коллоидный «раствор» осадков, частицы которых уже имеют коллоидные размеры. Различают следующие виды пептизации: пептизацию промыванием осадка; пептизацию поверхностно – активными веществами; химическую пептизацию.
Например, свежеприготовленный и быстро промытый осадок гидроксида железа переходит в коллоидный раствор красно-бурого цвета от добавления небольшого количества раствора FeCl3 (адсорбционная пептизация) или HCl (диссолюция).
Механизм образования коллоидных частиц по методу пептизации изучен довольно полно: происходит химическое взаимодействие частиц на поверхности по схеме:
![]()
Далее агрегат ![]() адсорбирует ионы Fe+3
или FeO+
, последующие образуются в результате гидролиза FeCl3
и ядро мицеллы получает положительный заряд. Формулу мицеллы можно записать в виде:
адсорбирует ионы Fe+3
или FeO+
, последующие образуются в результате гидролиза FeCl3
и ядро мицеллы получает положительный заряд. Формулу мицеллы можно записать в виде:
![]()
или
![]()
С точки зрения термодинамики, наиболее выгодным является метод диспергирования.
69. Рассчитать величину среднеквадратичного смещения частицы гидрозоля с радиусом частиц 10-6 м за 5 с при температуре 283 К и вязкости дисперсионной среды 1,7·10-7 Па·с.
Решение.
1) Коэффициент диффузии для сферической частицы рассчитывается по уравнению Эйнштейна:
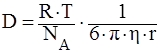 ,
,
где NА – число Авогадро, 6 10 23 молекул/моль;
h – вязкость дисперсионной среды, Н · с/м2 (Па · с);
r – радиус частицы, м;
R – универсальная газовая постоянная, 8,314 Дж/моль · К;
T – абсолютная температура, К;
число 3,14.
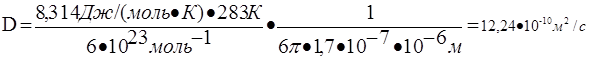
2) Среднее квадратичное смещение:
![]() ·D·
·D·
где ![]() среднее квадратичное смещение (усредненная величина сдвига) дисперсной частицы, м2
;
среднее квадратичное смещение (усредненная величина сдвига) дисперсной частицы, м2
;
время, за которое происходит смещение частицы (продолжительность диффузии), с;
D коэффициент диффузии, м2 . с-1 .
![]() ·D·=2*12,24*10-10
*5=12,24*10-9
м2
·D·=2*12,24*10-10
*5=12,24*10-9
м2
Ответ: ![]() 12,24*10-9
м2
.
12,24*10-9
м2
.
74. Поверхностно-активные вещества. Описать причины и механизм проявления их поверхностной активности.
При малых концентрациях ПАВ образуют истинные растворы, т.е. частицы диспергированы а них до отдельных молекул (или ионов). по мере увеличения концентрации возникают мицеллы. в водных растворах органические части молекул в мицеллах объединяются в жидкое углеводородное ядро, а полярные гидратированные группы находятся в воде, при этом общая площадь контакта гидрофобных частей молекул с водой резко сокращается. Благодаря гидрофильности полярных групп, окружающих мицеллу, поверхностное (межфазное) натяжение на границе ядро-вода понижено до значений, обеспечивающих термодинамическую устойчивость таких агрегатов по сравнению с молекулярным раствором и макрофазой ПАВ.
При малых мицеллярных концентрациях образуются сферические мицеллы (мицеллы Гартли) с жидким аполярным ядром.
Поверхностная активность связана с химическим составом вещества. Она, как правило, увеличивается с уменьшением полярности ПАВ (для водных растворов).
Согласно Ленгмюру, при адсорбции полярная группа, обладающая большим сродством к полярной фазе, втягивается в воду, а углеводородный неполярный радикал выталкивается наружу. происходящее при этом уменьшение энергии Гиббса ограничивает размеры поверхностного слоя толщиной в одну молекулу. при этом образуется так называемый мономолекулярный слой.
В зависимости от строения молекулы ПАВ подразделяются на неионогенные, построенные на основе эфиров, включающих этоксигруппы, и ионогенные – на основе органических кислот и оснований.
Ионогенные ПАВ диссоциируют в растворе с образованием поверхностно-активных ионов, например:
![]()
Если при диссоциации образуются поверхностно – активные анионы, ПАВ называют анионоактивными (соли жирных кислот, мыла). Если при диссоциации образуются поверхностно-активные катионы, ПАВ называют катионно-активными (соли первичных, вторичных и третичных аминов).
Существуют ПАВ которые в зависимости от рН раствора могут быть как катионноактивными, так и аниноактивными (белки, аминокислоты).
Особенность молекул ПАВ заключается в том, что они обладают большой поверхностной активностью по отношению к воде, что отражает сильную зависимость поверхностного натяжения водного раствора ПАВ от его концентрации.
При малых концентрациях ПАВ адсорбция пропорциональна концентрации.
Поверхностная активность связана с химическим составом вещества. Она, как правило, увеличивается с уменьшением полярности ПАВ (для водных растворов). Например, для карбоновых кислот величина активности выше, чем для их солей.
При исследовании гомологических рядов была обнаружена четкая зависимость активности от длины углеводородного радикала.
На основании большого количества экспериментального материала в конце 19 века Дюкло и Траубе сформулировали правило: поверхностная активность в ряду гомологов увеличивается в 3-3,5 раза при увеличении углеводородной цепи на одну СН2 группу.
По мере увеличения концентрации адсорбция на поверхности жидкости сначала резко возрастает, а затем приближается к некоторому пределу, называемому предельной адсорбцией.
На основании этого факта и большого числа исследований, Ленгмюр выдвинул представление об ориентации молекул в поверхностном слое. Согласно Ленгмюру, при адсорбции полярная группа, обладающая большим сродством к полярной фазе – воде, втягивается в воду, а углеводородный неполярный радикал выталкивается наружу. Происходящее при этом уменьшение энергии Гиббса ограничивает размеры поверхностного слоя толщиной в одну молекулу. При этом образуется так называемый мономолекулярный слой.
Мономолекулярные пленки на поверхности воды могут находиться в трех состояниях: газообразном, жидком и твердом. Жидкие и твердые поверхностные пленки называются также конденсированными.
Если силы, действующие между молекулами в пленке, сравнительно невелики, то молекулы ПАВ свободно распределяются по поверхности воды, максимально удаляясь друг от друга, что обусловливает поверхностное давление, действующее в направлении, противоположном поверхностному натяжению, такую пленку можно считать двумерным газом, так как молекулы этого газа не могут оторваться от поверхности воды и могут двигаться только в двух измерениях. К веществам, образующим на воде двумерные газообразные пленки, относятся, например, жирные кислоты с числом углеводородных атомов от 12 до 20-22, алифатические спирты и амины с не очень большой молекулярной массой.
Если тангенциально действующие силы между углеводородными радикалами молекул ПАВ в поверхностной пленке велики, то молекулы слипаются, образуя крупные конденсированные «острова», в которых тепловое движение молекул затруднено. В таких «островах» молекулы обычно ориентируются параллельно друг другу и перпендикулярно поверхности воды. Следует, однако, заметить, что, например, при повышении температуры конденсированные пленки могут переходить в газообразные.
Конденсированные пленки обычно жидкие, и молекулы в них перемещаются довольно свободно. если же силы взаимодействия между радикалами настолько велики, что молекулы не могут перемещаться, то конденсированные пленки можно рассматривать как твердые. Такие пленки образуют карбоновые кислоты с числом углеродных атомов более 20-24.
О наличии у поверхностных пленок свойств твердого тела можно убедиться, напыляя на поверхность порошок. Если пленка твердая, то при осторожном сдувании порошок остается неподвижным, если жидкая -порошок перемещается по поверхности.
Следует отметить, что помимо газообразных и конденсированных пленок существуют еще так называемые растянутые пленки, занимающие промежуточное положение.
Такие пленки могут образовываться из конденсированных при повышении температуры. Полагают, что в растянутых пленках углеводородные радикалы молекул ПАВ не ориентированы параллельно, а переплетены между собой, лежат «плашмя» на воде, что препятствует неограниченному растеканию пленки, в то время как полярные группы относительно свободно перемещаются в поверхностном слое.
Способность веществ образовывать те или иные пленки для ионогенных ПАВ зависит от рН раствора. Высшие жирные кислоты в кислых и нейтральных растворах (т.е. при практически недиссоциированных группах) при определенной температуре дают на поверхности раздела с воздухом растянутые пленки. При той же температуре в щелочной среде на поверхности раствора образуются газообразные пленки, что обусловлено отталкиванием одноименных зарядов соседних групп, появившихся в результате их диссоциации.
89. Написать формулу строения мицеллы золя, образованного в результате взаимодействия указанных веществ(избытка одного, затем другого вещества): CdCl 2 + Na 2 S ; FeCl 3 + NaOH . Назвать составляющие компоненты мицеллы.
1) CdCl2 + Na2 S
Избыток CdCl2 дает мицеллу:
[ (CdCl2 ) Cd2+ · Cl– ]+ x Cl–
![]()
зародыш: (CdCl2 )
![]()
ядро: [ (CdCl2 ) Cd2+
![]()
гранула: [ (CdCl2 ) Cd2+ · Cl– ]+
Избыток Na2 S дает мицеллу:
[2 (NaCl) 2 Cl– · Na+ ]– x Na+
зародыш: (NaCl )
![]()
ядро: (NaCl ) 2 Cl-
![]()
гранула: [ (CdCl2 ) Cd2+ · Cl– ]+
2) FeCl3 + NaOH
Избыток FeCl3 даетмицеллу:
[ (FeCl3 ) Fe3+ · 2Cl– ]+ x Cl–
зародыш: (FeCl3 )
ядро: (FeCl3 ) Fe3+
гранула: [ (FeCl3 ) Fe3+ · 2Cl– ]+
Избыток NaOH даетмицеллу:
[3 (NaCl) 3 Cl– · 2Na+ ]– x Na+
зародыш: (NaCl )
ядро: 3 (NaCl) 3 Cl–
гранула: [3 (NaCl) 3 Cl– · 2Na+ ]–
94. Защита коллоидных частиц с использованием ВМС. Механизм защитного действия. Белки, углеводы, пектины как коллоидная защита.
Коллоидная защита – стабилизация дисперсной системы путем образования адсорбционной защитной оболочки вокруг частиц дисперсной фазы. Белки, пектины и углеводы выступают как стабилизаторы дисперсных систем, предохраняющих системы от дальнейшей коагуляции или седиментации.
110. Пены, условия их образования и свойства. Роль пенообразования для продуктов питания и примеры использования пен.
Пены – высококонцентрированные дисперсные системы (объемная доля газа более 60-80%), в которых дисперсная фаза – газ, а дисперсионная среда – жидкость или твердое тело (пенобетон, пеногипс, пенополимеры и т.д.). Пены – грубодисперсные системы, размер пузырьков в которых от 0,01 см до 0,1 см и более. Чаще всего пены с жидкой дисперсионной средой получают диспергированием газа в жидкости в присутствии стабилизатора, который в этом случае называют пенообразователем.
В качестве продуктов питания, представляющих собой пены можно привести такие пены как взбитые сливки в баллонах, молочные коктейли тоже получают методом взбивания и первоначально его составляющие образуют пену. При помощи пенообразования в пищевой промышленности добиваются извлечением из растворов ценных примесей, что является особенно эффективным в сухих пенах. Но при производстве сахара пена мешает нормальному протеканию процессов и в этом случае производят пеногашение.
ЛИТЕРАТУРА
Ахметов Б. В. Задачи и упражнения по физической и коллоидной химии. – Л.: Химия, 1989.
Гамеева О. С. Физическая и коллоидная химия. – М.: Высшая школа, 1983.
Евстратова К. И., Купина Н. А., Малахова Е. М. Физическая и коллоидная химия. – М.: Высшая школа, 1990.
Зимон А. Д., Лещенко Н. Ф. Коллоидная химия. – М.: Химия, 2001.
Зимон А. Д., Лещенко Н. Ф. Физическая химия. – М.: Химия, 2000.
Киселев Е. В. Сборник примеров и задач по физической химии. – М.: Высшая школа, 1983.
Кнорре Д. Г. Физическая химия. – М.: Высшая школа, 1990.
Стромберг А. Г. Физическая химия. – М.: Высшая школа, 2001.
Степин Б. Д. Международные системы единиц физических величин в химии. – М.: Высшая школа, 1990.
Фридрихсберг Д. А. Курс коллоидной химии. – Л.: Химия, 1995.
Хмельницкий Р. А. Физическая и коллоидная химиия. – М.: Высшая школа, 1988.