Микроэлементы (цинк, железо, марганец) в системе почва-растение при возрастающих дозах внесения фосфорных удобрений
СОДЕРЖАНИЕ: Металлы в почвах: цинк, железо, марганец. Взаимодействие Zn-P в почве и растениях. Коррекция дефицита цинка и микроудобрения. Агрохимическая характеристика почвы. Способы определения эффективности удобрений. Содержание металлов и фосфора в растениях.Дипломная работа
«Микроэлементы (цинк, железо, марганец) в системе «почва-растение» при возрастающих дозах внесения фосфорных удобрений»
Содержание
Введение
Глава 1. Обзор литературы
1.1 Металлы в почвах
1.1.1 Цинк
1.1.2 Железо
1.1.3 Марганец
1.2 Микроэлементы в растениях
1.2.1 Цинк
1.2.2 Железо
1.2.3 Марганец
1.3 Взаимодействие Zn – Pв почве и растениях
1.4 Коррекция дефицита цинка. Микроудобрения
Глава 2. Объекты и методы исследования
Глава 3. Экспериментальная часть
3.1 Агрохимическая характеристика почвы
3.2 Определение эффективности удобрений
3.3 Содержание элементов в почве опыта
3.4 Содержание подвижных форм металлов в растениях
3.5 Содержание кислоторастворимого цинка в растениях
3.6 Содержание металлов и фосфора в растениях
Выводы
Список литературы
Введение
Цинк – один из восьми микроэлементов, необходимых для нормального здорового роста и размножения растений; остальными приходятся бор, хлор, медь, железо, марганец, молибден и никель. Эти элементы относятся к «необходимым микроэлементам», так как они требуются в сравнительно малых количествах для растительных тканей (5 – 100 мг/кг). Некоторые из этих элементов, а именно: медь, железо, марганец и цинк, вдобавок с кобальтом, хромом, йодом и селеном, являются также необходимыми для животных.
Цинковое голодание нарушает углеводный обмен у растений, процесс образования хлорофилла, изменение морфологических признаков растения (в частности, образование розеточности - побегов с укороченными междоузлиями и мелкими листьями) (Минеев, 2004).
Основным источником цинка для растений является почва. Элемент легко адсорбируется как минералами, так и органическими компонентами, поэтому в большинстве типов почв наблюдается его аккумуляция в поверхностных горизонтах (Ермохин, Синдирёва, Трубина, 2002). Недостаток цинка в почвах приводит к нарушению обмена веществ, снижению продуктивности растений и качества их продукции.
Причинами дефицита цинка могут служить низкие природные концентрации доступного растениям цинка в почвах, которые связаны:
- с низким валовым содержанием элемента в почвах;
- с факторами, обуславливающими низкую подвижность металла в почвах (высокое содержание гидроксидов железа, карбонатов, органических соединений, фосфатов). Так же отрицательно на подвижность в почвах и поступление цинка в растения влияют фосфаты почвы.
По данным А. Н. Аристархова (2000), 95.5% от площади 44 млн. га плодородных почв страны содержат недостаточное количество подвижных форм Zn.
Поскольку фосфор – один из главных элементов питания растений и постоянно вносится в возделываемую почву, его взаимодействие с цинком, как в самой почве, так и в растениях, становится одной из основных причин дефицита цинка в последних.
По данным ВНИИА на 1 января 2005 года пахотные почвы России характеризуются в основном средней обеспеченностью подвижным фосфором.Доля пахотных почв со средним и повышенным содержанием подвижного фосфора составляет 57.0% от обследованной площади. Вместе с тем, ещё имеются отдельные регионы, где преобладают почвы с низким содержанием подвижного фосфора. Всего пахотных почв с низким содержанием подвижного фосфора было 23.0 млн. га, что составляет 21.5% от обследованной площади.
Все субъекты Северо-Западного округа (кроме Вологодской области), где преобладают дерново-подзолистые почвы, имеют значительные пахотные площади с высоким и очень высоким содержанием подвижного фосфора (от 40.2% в Псковской области до 82.4% в Республике Карелия). В Центральном округе только 3 субъекта имеют более 40% таких почв (Московская область - 76.0%, Брянская - 62.0%, Тверская 47.3%).
Казалось бы, что в последнее время изучение проблем, связанных с интенсивным применением минеральных удобрений в нашей стране, не вполне актуально. Однако даже при общем резком снижении уровня применения минеральных удобрений, остались регионы (Кубань, Татарстан), где применение удобрений сохранилось на прежнем уровне. По данным Бакирова (2009) на 90-е годы ХХ века (когда в большинстве регионов удобрения не применяли) приходился пик применения удобрений в Татарстане – до 130 кг д.в. на га.
В 13 субъектах России одновременно с сокращением площадей пахотных почв с высоким содержанием подвижного фосфора увеличиваются площади с очень низким и низким содержанием. В общей сложности по 27 субъектам площадь пахотных почв с низкой обеспеченностью фосфором увеличилась на 478.7 тыс. га.
Около 30% территорий мира, занятых под сельское хозяйство, обладают почвами с низкой доступностью для растений железа (Chen, Barak, 1982) и около 50% территорий, используемых для выращивания зерновых культур, - низкой доступностью цинка (Graham, Welch, 1996).
Состояние в почвах и обеспеченность растений цинком, марганцем и железом зависит от уровня фосфатов в почве, от доз внесения фосфорных удобрений. Наиболее часто встречающаяся ситуация (по данным Аристархова) – недостаточное количество цинка, обуславливающее дефицит его в растениях. По тем же данным, даже на хорошо обеспеченных подвижными формами цинка почвах при интенсивном ведении сельскохозяйственного производства рекомендуется применять цинковые микроудобрения. В существующих градациях по обеспеченности почв к группе высоко обеспеченных относятся почвы, содержащие более 5 мг/кг наиболее мобильных соединений элемента. Верхняя граница допустимого количества – ПДК, равная 23 мг/кг. Большинство исследователей изучает состояние цинка в системе почва-растение либо при выраженной недостаточности цинка в почвах, либо при моделировании его загрязнения в единицах, кратных ПДК. Диапазон значений содержания цинка в почве от 5 до 23 мг/кг, как правило, выпадает. Однако, при попадании концентрации цинка в этот диапазон возможно проявление его фитотоксического действия, особенно на чувствительные культуры, что может служить поводом для пересмотра существующих ПДК.
В связи с этим, целью работы послужило изучение состояния цинка, железа и марганца в дерново-подзолистой высоко обеспеченной элементом почве и их накопления растениями ячменя при внесении возрастающих доз фосфорных удобрений.
Задачами работы стали:
· оценка влияния возрастающих доз фосфорных удобрений на агрохимическую характеристику дерново-подзолистой почвы
· оценка состояния цинка, железа и марганца в почве опыта (валовое содержание и подвижные формы)
· изучение эффективности цинковых микроудобрений для ячменя на высоко обеспеченных элементом и фосфатами почвах
· изучение эффективности возрастающих доз фосфорных удобрений для растений ячменя на высоко обеспеченной цинком и фосфатами почве
· оценка накопления микро- и макроэлементов растениями ячменя на высоко обеспеченной цинком и фосфатами почве
· изучение влияния возрастающих доз фосфорных удобрений и Zn-микроудобрения на содержание Zn, Fe, Mn, P и N в растениях ячменя.
Глава 1. Обзор литературы
1.1 Металлы в почве
1.1.1. Цинк
Основным источником цинка в почве являются материнские породы. Дополнительными источниками служат атмосферные осадки (пыль и аэрозоли – коллоидные частицы в сухом состоянии или с дождями) и агрохимические средства (удобрение, известкование). Почвы на речных поймах получают микроэлементы из потока воды и оседающих частиц. Все из этих источников могут сильно отличаться по значимости и приводить к тому, что в почвах будут широкие диапазоны содержания микроэлементов. Пространства в почве, в которых сконцентрирован цинк, доступный для корней растений или миграционноспособный, определяются рядом почвенных свойств (Alloway, 2004).
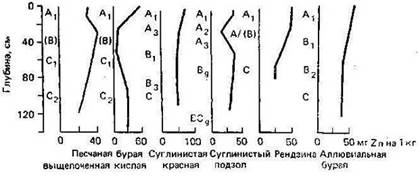
Рисунок 1
При растворении минералов Zn в процессе выветривания образуется подвижный ион Zn2+ , особенно в кислых окислительных средах. Однако Zn легко адсорбируется как минералами, так и органическими компонентами, поэтому в большинстве типов почв наблюдается его аккумуляция в поверхностных горизонтах (рис.) (Кабата-Пендиас, Пендиас, 1989).
Дополнительный приход цинка в почву возможен в зонах воздействия различных промышленных производств (Софронов, 2003). Как отмечают И. И. Судницын и И. И. Сашина, загрязнение почв веществами, содержащими цинк, систематически происходит вблизи автомагистралей. С дождевыми осадками и ветром мелкие частицы, содержащие цинк, могут переноситься на различные расстояния и оседать на поверхности почвы, листьях растений. Затем (в процессах реакций обмена и замещения, адсорбции, аккумуляции, миграции) происходит поглощение цинка растениями либо его накопление в почве и перемещение вниз по профилю. Накопление происходит в виде гидроксидов, карбонатов, сульфидов и органических комплексов. Однако кислотность среды способствует растворимости цинка, и при высокой концентрации его подвижные формы выщелачиваются, что приводит к дефициту цинка для растений. Органическое вещество способно связывать цинк в устойчивые формы, вследствие чего он накапливается в верхних горизонтах культурных и органогенных почв (Судницын, Сашина, 2006).
По обобщённым данным А. Кабата-Пендиас и Х. Пендиаса (1989), средние содержания Zn в поверхностных слоях почв различных стран изменяются в пределах 17—125 мг/кг. Эти значения могут рассматриваться как фоновые содержания Zn. Наибольшие средние величины установлены для некоторых аллювиальных почв, солончаков и каштанозёмов, а наиболее низкие — для светлых минеральных и органических почв. Баланс Zn в поверхностных слоях почв в различных экосистемах показывает, что атмосферное поступление этого металла превышает его вынос за счет выщелачивания и образования биомассы.
Основной и наиболее подвижной формой Zn в почвах считается Zn2+ , однако в почвах могут присутствовать и некоторые другие ионные формы (рис.2) (Кабата-Пендиас, Пендиас, 1989)
Рисунок 2
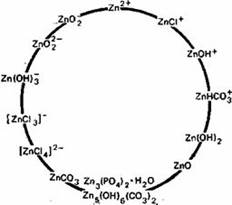 |
Цинк наиболее подвижен и биологически доступен в кислых легких минеральных почвах. Как установлено Норришем (цитировано по Кабата-Пендиас, Пендиасу, 1989), фракция Zn, связанная с оксидами Fe и Mn, по-видимому, более доступна растениям. Растворимость и доступность Zn в почвах обнаруживают отрицательную корреляцию со степенью насыщенности кальцием и с содержанием соединений фосфора. Эти соотношения могут отражать как влияние адсорбции и осаждения, так и взаимодействие между этими элементами. Кроме того, в области высоких значений pH необходимо учитывать влияние на растворимость и доступность Zn, образования растворимых Zn-органических комплексов и комплексных анионных форм Zn (рис.3).
Однако твёрдой и жидкой фазами почв может осуществляться иммобилизация цинка в процессах изоморфного замещения ионов в первичных и вторичных минералах, образования труднорастворимых соединений элемента, специфической адсорбции его органическими и неорганическими компонентами почвы с образованием прочных связей координационного типа, окклюзии оксидами и гидроксидами железа, алюминия, марганца и кремния, поглощения и включения в состав тканей живой фазы почвы (Переломов, Пинский, 2005). Как отмечает И. Г. Юлушев (1999), недостаток цинка возможен в первую очередь на карбонатных почвах.
 |
Рисунок 3
Расчёт факторов биологической доступности и коэффициента биологического поглощения в работе Л. В. Переломова и Д. Л. Пинского (2005) показал, что способность почв прочно связывать цинк играет важную роль в доступности металла растениям. Несмотря на увеличение потенциальной доступности цинка с ростом дозы вносимого элемента, относительные показатели поглощения металла растениями в целом максимальны в контрольных вариантах, при концентрациях, к которым растения эволюционно адаптированы. Это также свидетельствует о том, что растение поглощает цинк не только из подвижных, но и из прочносвязанных форм металла. По данным Стивенсона и Ардакани (Stevenson, Ardakani, 1972), такие прочносвязанные формы образуют распространённые в почвенном растворе алифатические и ароматические кислоты.
В своей работе А. Ю. Кудеярова (2005) отмечает, что способность почвы связывать поступающие извне соединения цинка в основном определяется реакциями координации, которые происходят на поверхностях раздела твёрдых и жидких фаз (сорбент – почвенный раствор). Как правило, химическое связывание (хемосорбция) экзогенных соединений осуществляется на поверхностях, представленных металлогумусовыми комплексами, которые способны связывать катионы и анионы почвенного раствора. Большой вклад в связывание катионов цинка вносят железогумусовые комплексы, свойственные кислым почвам.
По данным Я. В. Пейве (цитировано по Минееву, 2004), почвы по обеспечённости их подвижным цинком делятся на следующие группы (мг/кг почвы):
0.2 – очень бедные,
0.3 – 1.0 – бедные,
1.1 – 3.0 – среднеобеспеченные,
3.1 – 5.0 – богатые,
5.1 – очень богатые.
Эта группировка почв ориентировочная и должна уточняться в конкретных почвенно-климатических условиях путём закладки полевых опытов.
1.1.2 Железо
Железо – один из главных компонентов литосферы и составляет приблизительно 5% её массы (Кабата-Пендиас, Пендиас, 1989). Поведение железа в окружающей среде во многом определяется его способностью легко изменять валентность в зависимости от физико-химических условий среды и тесно связано с геохимическими циклами кислорода, серы и углерода. Как правило, сообщают Кабата-Пендиас и Пендиас (1989), окислительные и щелочные условия среды способствуют осаждению железа, а кислые и восстановительные – растворению его соединений. Свободное железо фиксируется, образуя оксиды и гидроксиды, органо-комплексы и замещая магний и алюминий в минералах.
В почвах железо присутствует главным образом в виде оксидов и гидроксидов, находящихся в форме небольших частиц или связанных с поверхностью некоторых минералов. Однако в богатых органическим веществом горизонтах Fe находится преимущественно в хелатной форме. По данным А. Кабата-Пендиас и Х. Пендиаса (1989), микроорганизмы также могут принимать участие в преобразовании железа, вовлекаясь в круговорот элемента и аккумулируя его на поверхности живых клеток.
В растворении почвенного железа участвуют многие реакции, но наиболее значимыми из них являются гидролиз и процессы комплексообразования. По данным В. Л. Линдсея (цитировано по Кабата-Пендиас, Пендиасу, 1989), подвижность железа в почвах во многом определяется растворимостью аморфных водных оксидов Fe3+ и Fe2+ . Однако на растворимость железа может существенно влиять образование других его соединений, таких, как фосфаты, сульфиды и карбонаты.
Минимальные содержания растворимого железа отмечаются при щелочных значениях pH. Поэтому кислые почвы более обогащены растворимым неорганическим железом, нежели нейтральные и щелочные (Кабата-Пендиас, Пендиас, 1989). Таким образом, катионы Fe2+ в кислых анаэробных почвах могут достигать токсичных для растений уровней, а в щелочных хорошо аэрируемых почвах низкие концентрации растворимого железа не могут удовлетворить потребности растений в этом элементе.
Подобно соединениям марганца, соединения железа активно влияют на поведение некоторых элементов питания и многих микроэлементов. Степень ответственности железа за растворимость микроэлементов и их доступность для растений во многом зависят от некоторых почвенных факторов.
Для почвенного железа характерно сильное сродство к подвижным органическим комплексам и хелатам. Эти соединения ответственны за миграцию и перераспределение железа в почвенных горизонтах, а также выщелачивание его из почвенных профилей. Кроме того, комплексные соединения играют большую роль в обеспечении железом корневых систем растений (Кабата-Пендиас, Пендиас, 1989).
Количество железа в почвах определяется как составом материнских пород, так и характером почвенных процессов. Как правило, сообщают Кабата-Пендиас и Пендиас (1989), содержание железа изменяется от 0.5 до 5%. На бедных железом почвах не отмечается его абсолютного дефицита для растений, а фиксируется лишь недостаток его легкорастворимых форм.
1.1.3 Марганец
Марганец – один из наиболее распространённых микроэлементов в литосфере, его содержание в горных породах изменяется в пределах 350 – 2000 мг/кг (Кабата-Пендиас, Пендиас, 1989).
Марганец образует ряд минералов, в которых он обычно присутствует в виде ионов Mn2+ , Mn3+ и Mn4+ , однако наиболее распространённым в породообразующих силикатных минералах является его окисленное состояние +2. Катион Mn2+ обладает способностью замещать двухвалентные катионы некоторых элементов (Fe2+ , Mg2+ ) в силикатах и оксидах (Кабата-Пендиас, Пендиас, 1989). При выветривании в атмосферных условиях соединения марганца окисляются, а образующиеся при этом оксиды вновь осаждаются и формируют вторичные минералы. Поведение марганца в почвах исключительно сложное и зависит от различных факторов, из которых наибольшее значение имеют pH и Eh среды.
Маккензи (цитировано по Кабата-Пендиас, Пендиасу, 1989) отметил, что Mn распространён в почвах в виде оксидов и гидроксидов, осаждённых как на почвенных частицах, так и в виде конкреций различного диаметра, способных концентрировать железо и некоторые другие микроэлементы почв.
Значение соединений марганца для состояния почв очень велико, поскольку этот элемент не только жизненно необходим растениям, но и контролирует поведение ряда других питательных микроэлементов. Соединения марганца способны быстро окисляться и восстанавливаться в изменчивых условиях почвенной среды. Следовательно, окислительные условия могут заметно снижать доступность марганца и связанных с ним питательных веществ, тогда как восстановительные способствуют увеличению их доступности для растений даже до токсичных значений. (Кабата-Пендиас, Пендиас, 1989).
Растворимость марганца в почвах зависит от pH и Eh среды, поэтому наиболее распространёнными являются реакции окисления-восстановления и гидролиза (Кабата-Пендиас, Пендиас, 1989). Из-за низкой растворимости соединений марганца в окислительных условиях при значении pH, близких к нейтральным, даже незначительные изменения Eh – pH могут оказать существенное влияние на содержание элемента в почвенном растворе.
С помощью экстрагирующих растворителей установлено (Кабата-Пендиас, Пендиас, 1989), что наиболее активно поглощаются растениями водорастворимые, способные к обмену и легко восстанавливаемые формы марганца.
Растворимые формы марганца имеют важно е экологическое значение, поскольку его содержание в растениях определяется пулом растворимого в почвах Mn (Кабата-Пендиас, Пендиас, 1989). В хорошо дренируемых почвах растворимость Mn всегда возрастает с увеличением кислотности почв. Однако способность марганца образовывать анионные комплексы и комплексы с органическими лигандами может приводить к увеличению его растворимости и в щелочных условиях.
Распределение марганца в почвенной толще весьма неоднородно. Марганец может накапливаться в различных почвенных горизонтах, особенно в обогащённых оксидами и гидроксидами железа, однако обычно элемент аккумулируется в верхнем слое почв за счёт фиксации органическим веществом (Кабата-Пендиас, Пендиас, 1989).
По данным А. Кабата-Пендиас и Х. Пендиаса (1989), содержание марганца в почвах Мира изменяется от 10 до 9000 мг/кг, а общее среднее оценивается в 545 мг/кг.
1.2 Микроэлементы в растениях
1.2.1 Цинк
Форма поступления Zn в корни растений точно не установлена. Однако в целом мнения сходятся на том, что преобладает поглощение иона Zn2+ и гидратированных форм Zn. А. Д. Халворсен и В. Л. Линдсей (цитировано по Кабата-Пендиас, Х. Пендиасу, 1989) пришли к заключению, что корни кукурузы поглощают только Zn2+ и что даже очень низкие концентрации этого иона достаточны для развития растений.
Среднее содержание цинка в растениях – 0.002%.
В растениях цинк не участвует в окислительно-восстановительных реакциях, поскольку не меняет степень окисления. Он входит в состав более 30 ферментов, в т. ч. фосфатазы, карбоангидразы, алкогольдегидрогеназа, РНК-полимераза и др. Карбоангидраза катализирует разложение гидрата окиси углерода на воду и углекислый газ. Эта реакция важна для процесса фотосинтеза. Фермент карбоангидраза, катализируя высвобождение CO, из гидрата окиси углерода, способствует его использованию в процессе фотосинтеза. Кроме того, цинк активирует такие ферменты, как енолаза, альдолаза, гексокиназа, триозофосфатдегидрогеназа. В этой связи понятно значение цинка для процессов дыхания и фотосинтеза.
Цинк играет важную роль при образованиифитогормона ауксина. Это связано с тем, что цинк, повышая активность триптофансинтетазы, влияет на образование аминокислоты триптофана — предшественника ауксина. Внесение цинка повышает содержание ауксинов и заметно сказывается на темпах роста растений. При дефиците цинка возрастает проницаемость мембран, что свидетельствует о роли этого элемента в структуре мембран, в поддержании их интеграции.
Цинк влияет на белковый синтез, на активность РНКазы. Обнаружены белки, содержащие цинк и участвующие в репликации ДНК и транскрипции. Цинк входит в состав одного из факторов регуляции транскрипции в соединении с остатками гистидина и цистеина («цинковые пальцы») (Якушина, Бахтенко, 2005).
Кочиан (Kochian, цитировано по Alloway, 2004) предложил, что перемещение цинка через плазматическую мембрану направлен мощным отрицательным зарядом, и, следовательно, этот процесс термодинамически пассивен. Этот отрицательный заряд плазматической мембраны движет цинк во множестве потоков дивалентных катионов в двудольных и однодольных за исключением злаков. Кочиан (Kochian, цитировано по Alloway, 2004) предположил, что безбелковые аминокислоты, именуемые «фитосидерофорами» или «фитометаллофорами», создают комплексное соединение с цинком и выводят его на поверхность плазматической мембраны корневой клетки. Эти фитосидерофоры выделяются из корней в результате дефицита железа и цинка. Получившийся комплекс в дальнейшем транспортируется в клетку с помощью белка-транспортёра.
Цинк поглощается в форме Zn2+ или Zn(OH)2 при высоких значениях pH. По причине низкой концентрации цинка в почвенном растворе поглощение происходит преимущественно через прямой корневой контакт, и оно метаболически контролируемо. Пространственные взаимодействия возможны между поглотительными процессами цинка и других микроэлементов, например цинк – медь, которые обоюдно задерживают друг друга, указывая на то, что они оба абсорбированы по одинаковому механизму транспортных узлов. Рис с цинковым дефицитом показывает повышенное впитывание кадмия, но количество перемещённого цинка в надземные органы оказывается значительно выше количества кадмия в этих органах. Добавление цинка в пропитанные водой почвы выявило увеличение количества экстрагируемого диэтилентриаминпентауксусной кислотой марганца и уменьшение поступления и перемещения меди, железа и фосфора (Alloway, 2004)
Чодри и Лонераган (Chaudry, Loneragan) сообщают, что щелочноземельные катионы неконкурирующе задерживают абсорбцию цинка (по значимости: Mg2+ Ba2+ Sr2+ = Ca2+ ) (цитировано по Alloway, 2004).
Растворимые формы Zn доступны для растений, и, по имеющимся данным А. Кабата-Пендиас и Х. Пендиаса (1989), потребление Zn линейно возрастает повышением его концентрации в питающем растворе и в почвах (рис.4).
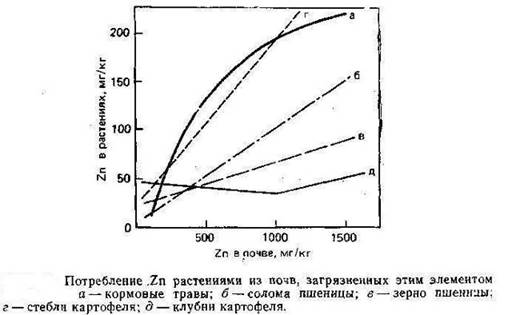
Рисунок 4
Скорость поглощения Zn сильно колеблется в зависимости от вида растений и условий среды роста. Большое значение имеет состав питающего раствора, в особенности присутствие Ca. По вопросу о том, является ли потребление Zn активным или пассивным процессом, существуют разногласия. При всей дискуссионности результаты явно свидетельствуют о том, что потребление Zn контролируется метаболизмом растений, но может участвовать и неметаболический процесс.
По мнению А. Кабата-Пендиас и Х. Пендиаса (1989), связывание Zn низкомолекулярными органическими соединениями в соках ксилемы и в экстрактах из других растительных тканей может означать, что он очень подвижен в растениях. Доля Zn, связанного в комплексы с отрицательным зарядом, составляет более половины его общего содержания в растениях.
Некоторые авторы считают Zn очень подвижным элементом, другие же полагают, что он обладает умеренной подвижностью (Кабата-Пендиас, Х. Пендиас, 1989). В действительности, при оптимальном поступлении Zn некоторые виды растений перемещают заметные количества этого элемента из старых листьев в генеративные органы, но в условиях дефицита Zn эти же виды мобилизовали только небольшие количества или вообще не мобилизовали цинк из старых листьев.
Корневые системы часто содержат гораздо больше Zn, чем надземные части, в особенности, если растение выросло на почве, богатой Zn. При оптимальном уровне содержания Zn в почве этот элемент может перемещаться из корней и накапливаться в верхних частях растений. По опубликованным данным Zn концентрируется в хлоропластах. У некоторых видов это особенно заметно, например у шпината. Цинк, вероятно, накапливается также в жидкости, заполняющей вакуоли, и в клеточных мембранах (Кабата-Пендиас, Пендиас, 1989).
Намбиар (Nambiar, цитировано по Alloway, 2004) показал, что растения могут получать цинк из сухой почвы с помощью выделенного клейкого вещества, но результаты подобного питания составляют лишь 40% от результатов питания во влажной почве. Как отмечают Лавадо, Поркелли и Альварес (Lavado, Porcelli, Alvarez, 1998), в их опыте экстрагируемая концентрация и стратификация цинка были связаны с органическим веществом и pH.
Растительные виды и разновидности сильно различаются по чувствительности к дефициту Zn. Хотя такой дефицит относительно обычен, установить его довольно сложно. Наилучший диагноз получается при совместном использовании визуальных симптомов, анализов химического состава растений и почвенных тестов. Следует отметить, что для ряда культур и почв два экстрагента-хелатообразователя (ДТПА и ЭДТА) дают линейную зависимость между содержанием Zn в растении и запасом его растворимых форм в почве (Кабата-Пендиас, Пендиас, 1989).
Согласно Намбиару и Мотирамани (цитировано по Кабата-Пендиас, Пендиасу, 1989), при использовании для предсказания дефицита цинка содержаний его в тканях часто получаются неверные результаты, тогда как отношение Fe/Zn в тканях представляется более перспективным для предсказания даже скрытого дефицита Zn. Критическое значение отношения Fe к Zn в кукурузе составляет примерно 0,6. Линдсей (цитировано по Кабата-Пендиас и Х. Пендиасу, 1989) опубликовал обзор данных о проявлениях дефицита Zn и его распространении на Земле. Согласно этому автору, наиболее важными факторами, участвующими в создании дефицита цинка, являются:
1) низкое содержание Zn в почве;
2) карбонатность почв и значения pH больше 7;
3) низкие содержания органических веществ в почве;
4) слабая микробиологическая активация Zn в почве;
5) ограниченное поглощение Zn корнями, вызванное сужением зоны развития корневых систем и холодными весенними сезонами;
6) различия свойств видов и генотипов растений;
7) антагонистические эффекты.
Внесение цинка в почву снижает концентрации Fe, Mn и Cu в растениях и повышает содержание цинка. Обогащение зерна Zn, Fe и Mn (в сбалансированном соотношении) благоприятно для здоровья человека. Однако, как сообщает Ареф (Aref, цитировано по Zhu и др., 2007), при стрессе от дефицита цинка растения абсорбируют большие количества Fe и Mn, усугубляя неблагоприятный эффект дефицита.
Несмотря на то, что дефицит цинка известен как наносящий вред широкому ряду злаков в разных частях Света, генотипические отличия между хлебами делают некоторые виды более восприимчивыми к дефициту, чем остальные (табл.1). Отдельно от внешних отличий существуют также важные внутренние, которые могут быть в некоторых случаях более значимыми, чем просто различия между видами. На примере пшеницы, твёрдая пшеница (Triticumdurum) более устойчива к нехватке цинка, чем мягкая (Triticumaestivum). Однако имеются важные сортовые отличия в обоих видах пшеницы (Alloway, 2004).
Сорта хлебов, пшеницы или риса, которые, как выяснилось, более толерантны к нехватке цинка, были описаны как рационально расходующие цинк.
Из таблицы видно, что кукуруза, рис и бобовые культуры наиболее чувствительны к нехватке цинка, и только пшеница имеет низкий показатель. Тем не менее, пшеница во многих местах на Земле подвержена цинковому дефициту, несмотря на врождённую низкую восприимчивость к недостатку в сравнении с кукурузой и подобными. Цинковая недостаточность, до сих пор, - главная проблема пшеницы. Если кукуруза или бобовые росли на той же почве, что и пшеница, они, скорее всего, будут жёстко поражены. Следовательно, градацию из таблицы можно использовать для сравнения чувствительностей к недостатку и откликов на цинковые удобрения, но не для определения пределов поражения этих злаков цинковым дефицитом в разных районах мира (Alloway, 2004).
Таблица 1. Врождённая чувствительность к дефициту цинка ( Alloway . 2004)
| высокая | средняя | низкая |
| бобовые | ячмень | люцерна |
| цитрусовые | хлопчатник | спаржа |
| лён | салат-латук | морковь |
| фруктовые деревья (лиственные) | картофель | клевер |
| виноград | соя | петрушка, укроп |
| хмель | сахарный тростник | овёс |
| кукуруза | суданская трава | горох |
| луковичные | свёкла | рожь |
| орех пекан | томат | пшеница |
| рис | ||
| сорго | ||
| сладкая кукуруза |
Браун и Джонс (Brown, Jones, цитировано по Alloway, 2004) отметили в своей статье, что отклик растения на микроэлементный стресс – генетически контролируемая адаптация. Сложные механизмы могут содержать способность впитывания питательных веществ в количестве ниже оптимума, мобилизировать элементы в почве с помощью секреции корневых выделений и усиливать их впитывание корнями и перемещать впитанные вещества внутри растения. Грэм и др. (Grahametal., цитировано по Alloway, 2004) сообщили, что в пшенице, ячмене и овсе могут быть обнаружены различные вариации цинковой усвояемости. Это качество может быть плохо связано с усвояемостями других микроэлементов, таких как марганец, который вызывает независимый механизм и генетический контроль цинковой продуктивности. Работая с различными типами почв в Южной Австралии, они обнаружили, что характерные черты цинковой усвояемости в бедных питательными веществами песчаных и в богатых ими глинистых почвах были генетически различными. Генотипы цинковой усвояемости обуславливают потребление большего количества цинка из дефицитных почв, производят больше сухого вещества и больше урожая зерна, но не обязательно имеют высокие концентрации цинка в листьях или зёрнах. Высокое содержание цинка в зёрнах выглядит генетически контролируемым, но не связано напрямую с цинковой усвояемостью. Оно же влияет на развитие побега и важно для человеческих диет, основанных на крупах (Alloway, 2004).
Известно, что некоторые виды и генотипы обладают большой толерантностью к Zn и большой способностью к селективному поглощению его из почв. Таким образом, по данным Е. А. Софронова (2003), овёс концентрирует цинк и имеет значительные коэффициенты биоаккумуляции его в зерне (от 4.9 до 11.7) и соломе (в большинстве 1.0).
Изменения содержания Zn в среде роста обычно отражаются на составе растений, поэтому растения — хороший индикатор для биогеохимических исследований. Некоторые генотипы, растущие на богатых цинком почвах или в областях с большим его поступлением из атмосферы, могут накапливать экстремально высокие количества этого элемента без видимых симптомов токсикоза. Выносливые виды могут ослаблять действие избыточных концентраций Zn либо путем метаболической адаптации и комплексообразования, либо путем ограничения присутствия элемента в клетках, либо переводя его в нерастворимую форму в запасающих тканях (А. Кабата-Пендиас, Х. Пендиас, 1989).
Большинство растительных видов и генотипов обладает высокой толерантностью к избыточным количествам цинка. Обычные симптомы токсикоза Zn — хлороз, особенно у молодых листьев, и ослабление роста растений.
Цинк не считается сильно фитотоксичным. Предел токсичности Zn зависит как от видовой принадлежности и генотипа растения, так и от стадии развития. Например, есть данные, что 300 мг Zn на 1 кг почвы ядовиты для молодого ячменя, в то время как для овса в начале стадии кущения токсичны примерно 400 мг/кг. В тканях корней, где Zn иммобилизован в стенках клеток или связан в комплексы с неспособными к диффузии протеинами, его критические концентрации гораздо выше (А. Кабата-Пендиас, Х. Пендиас, 1989).
Ренджел (Rengel, цитировано по Alloway, 2004) суммировал различные возможные механизмы улучшения поглощения цинка и его перераспределения в растении:
1) большее равномерное распределение длинных, тонких корней (0.2 мм в диаметре),
2) характеристические изменения в химии и биологии ризосферы, включая внушительное выделение хелатов – фитосидерофоров,
3) повышенное впитывание, приводящее к увеличению роста аккумуляции цинка,
4) более продуктивная утилизация и компартментализация цинка внутри клеток, тканей и органов, включение повышенной активности углеродной ангидразы и антиокислительных ферментов, поддержание сульфгидрильных групп в корневых клеточных мембранах в истощённом состоянии и различных моделях биосинтеза.
1.2.2 Железо
Железо один из важнейших микроэлементов растений. Оно способно формировать 6 координационных связей с атомами-донорами электронов, такими как азот и кислород (Marschner, 1997). Поэтому оно входит в состав активных центров многих металлопротеинов в виде различных простетических групп, включающих гем и Fe-Sкластеры. Наличие в растениях форм железа с различной валентностью объясняет его участие в основных окислительно-восстановительных реакциях, таких как фотосинтез и дыхание, в составе многих белков хлоропластных и митохондриальных электрон-транспортных цепей. Железо также вовлечено во многие ферментные реакции, необходимые для фиксации азота, синтеза ДНК и растительных гормонов (Briat, 2007).
Хлоропласты - основное место утилизации железа в растениях. В них сосредоточено до 80% от общего железа в листьях (Smith, 1984). В зеленых тканях арабидобсиса 70% от общего железа находится в хлоропластах, а 40% - в тилакоидах (Shikanaietal., 2003). Доказана необходимость железа для биосинтеза хлорофилла (Pushniketal., 1984). В фотосинтезе железо участвует, ассоциируясь с металлопротеинами, в электрон-транспортной цепи тилакоида. Эта ассоциация достигается посредством двух простетических групп: гема и железо-серного кластера.
В электрон-транспортных цепях принимает также участие ферредоксин, относится к группе Fe-Sбелков (Kapazoglouetal., 2002). В таких белках металл координирован в кластеры тиоловыми группами цистеина или неорганической серой. Биосинтез Fe-Sкластеров, как и биосинтез гема, осуществляется в пластидах и митохондриях растений (Briat, 2007). Ферредоксин - кислый гидрофильный белок, содержит два или четыре атома трехвалентного железа и четыре атома серы в качестве лигандов в расчете на один каталитический центр (Рубин, Кренделева, 2003). Ферредоксин - конечный акцептор и переносчик электронов в фотосинтетических электрон-транспортных цепях (Toshiharuetal., 2006). Он входит в состав ферредоксин-НАДФ-редуктазы - компонента электрон-транспортной цепи.
Ферредоксин может быть восстановителем для целого ряда биохимических процессов, не относящихся к фотосинтезу. Он вовлечен в реакции восстановления нитрата до нитрита и нитрита до аммония в составе ферредоксинзависимой нитрат- и нитритредуктаз (Toshiharuetal., 2006). Эти ферменты используют ферредоксин в качестве донора электрона. Впоследствии в цикле восстановления. катализируемом системой глутаминсинтаза - глутамин-оксоглутарат-аминотрансфераза, образуются аминокислоты, вовлекаемые в синтез белка. Электрон, поступающий с ферредоксина, может также участвовать в восстановлении сульфатов и кислорода (Рубин, Кренделева, 2003).
Железо входит в состав пероксидазы и каталазы, которые задействованы в трансформации пероксида водорода (Passardietal., 2005; Bartosz, 2005). В пероксидазе гемовая часть фермента играет роль активного центра, участвующего в разложении или активации пероксида водорода. Этот фермент катализирует окисление различных веществ (фенолов, ароматических кислот, нитритов) в присутствии пероксида водорода, действующего как акцептор водорода и превращающегося в воду в ходе такой химической реакции. Пероксидазы могут катализировать образование поперечных связей между фенольными компонентами клеточных стенок (Marschner, 1997). Реакции с участием пероксидаз ведут к образованию множества активных форм кислорода, способных влиять на активность различных процессов или участвовать в передаче сигналов (Passardietal., 2005).
Одна из форм аккумуляции железа в растении представлена ферритином, который представляет собой железо- и фосфорсодержащий пептид (Briat, Lobreaux, 1997). Ферритин аккумулируется главным образом в «бесцветных» пластидах, таких как этиопласты и амилопласты, в то время как в зрелых зеленых хлоропластах, где фотосинтетический процесс активен, его концентрация находится на низком уровне (Briat, 2007). Однако распределение железа в листьях зависит от стадия развития. Регулирование синтеза ферритина в к-ченис жизненною цикла подтверждено фактами увеличения его содержания в развивающихся и стареющих листьях (Briat, Lobreaux, 1997). В корнях ферритин может быть вовлечен в модулирование потока железа в верхние части растения через загрузку ксилемы с помощью не описанных в данное время транспортеров (Briat, 2007).
Железо вступает в реакции со свободными радикалами (Briat, 2002). Поэтому накопление и буферность соединений Fe- ключевые элементы защитных механизмов у живых организмов в борьбе с окислительным стрессом. Ферритины играют активную роль в этих механизмах, благодаря их способности запасать большое количество железа в безопасной форме (Harrison, Arosio, 1996).
Железо поступает в растение в основном в восстановленной форме Fe2+ (может затем вновь окисляться до Fe3+ ) yрастений стратегии 1 (двудольные и незлаковые однодольные), либо в виде Fe3+ -фитосидерофорного комплекса у растений стратегии II (злаки) (Hell, Stephan, 2003). Поступление в симпласт клеток сопровождается восстановлением Fe3+ до Fe2+ (Kim, Guerinot, 2007). Предполагают, что подвижность железа в корне зависит от его Fe3+ -редуктазной способности, подавляемой при высоких значениях pH в апопласте (Kosegarten, Коуго, 2001). При такой реакции среды концентрация железа в апопласте может увеличиваться до 2000 мкг/г, главным образом за счет аккумуляции в форме Fe3+ . Инактивация в апопласте эпидермальных клеток корней вследствие окисления железа может сопровождаться ослаблением его транспорта в побег. Увеличению pH апопласта способствуют повышенные концентрации бикарбоната, характерные для обогащенных карбонатами почв, а также поглощение растениями азота в форме нитрата (Kosegarten, Koyro, 2001).
Поглощенное корнями железо транспортируется в другие органы растения по ксилеме. Попадая в сосуды ксилемы, оно окисляется до Fe3+ и далее передвигается в форме Fe-цитратного комплекса (Kochian, 1991, Lopez-Millanetal., 2000; Kim, Guerinot, 2007). В листьях комплексы железа восстанавливаются Fe-хелатредуктазами, связанными с плазматическими мембранами мезофилла (Lopez-Millanetal., 2000). Активность Fe-хелатредуктаз зависит от реакции среды (pH) апопласта, и может снижаться с увеличением значений pH. Этот процесс сопровождается снижением скорости поступления Fe2+ в симпласт и, как следствие, появлением у растений признаков хлороза.
1.2.3 Марганец
Марганец, как железо и цинк, относится к группе необходимых для растений микроэлементов. Он является активатором ферментов, вовлеченных в фотосинтез, дыхание, синтез белков и углеводов (Mukhopadhyay, Sharma, 1991; Kabata-Pendias, Pendias, 2002).
Марганец - кофактор Mn-супероксиддисмутазы (Mn-СОД) и Mn-каталазы (Laszlo, 2008). Фермент Mn-СОД локализован в основном в митохондриях (Buettner, 2006). Оба фермента входят в состав антиоксидантной системы растений.
Марганец - часть Mn4 -Ca-кластера комплекса фотосистемы II. выделяющего кислород (Barber, Murray, 2007). При дефиците марганца в питательной среде отмечено значительное снижение интенсивности фотосинтеза у пресноводной водоросли Ankistrodesmus. Причем, вследствие возобновления снабжения растений Mn2+ уровень фотосинтеза восстанавливался. В условиях освещения потребность водорослей этого вида в марганце намного выше, чем в темноте. Такой же эффект впоследствии описан для других видов водорослей и высших растений (Barber, Murray, 2007).
Марганец активирует многочисленные ферменты в процессах фосфоролирования. Известно более 35 ферментов, активируемых марганцем. Большинство из них катализируют реакции окисления-восстановления, декарбоксилирования, гидролиза (Burnell, 1986). Марганец участвует в белковом обмене через регулирование активности ДНК- и РНК-полимераз (Marschner, 1997).
1.3 Взаимодействие Zn – P в почве и растениях
Во всём мире высокий уровень содержания фосфора в почве является достаточно распространённой причиной дефицита цинка в культурных растениях. Несмотря на то, что этот признак известен давно, фактический механизм такого взаимодействия до сих пор не вполне определён.
Фосфор в почве способен создать с цинком:
1. труднорастворимые соединения;
2. комплексные соединения (металл-органофосфатные) с разным соотношением лигандов и металла, что, в свою очередь, приводит к различию в подвижности этих комплексов
А. Ю. Кудеяровой (2005) установлено, что степень связывания цинка в почве усиливается на фоне внесения в почву как орто-, так и пирофосфатов. Под воздействием фосфат-ионов изменяется структура сорбирующих металлогумусовых соединений. Согласно проведённым ей исследованиям, связывание фосфат-ионов в почве сопровождается деструктивной трансформацией железогумусовых сорбентов, следствием которой являлось увеличение способности сорбентов связывать цинк. Содействие фосфатов связыванию металла осуществлялось через изменение структуры и свойств гумусовых макролигандов в почвенных желозогумусовых комплексах-сорбентах. При использовании железогуминового комплекса в качестве модели почвенного сорбента было установлено, что в трансформированном с участием орто- и пирофосфатов гуминовом макролиганде накапливались фосфоросодержащие функциональные группы, способные к прочному связыванию цинка.
Как показала работа Р. Р. Кинжаева (2004), усиление иммобилизации цинка в почве под влиянием высокого содержания подвижных форм фосфора приводило к возникновению дефицита Zn в растениях.
Однако, как утверждает Ю. И. Ермохин (1995), улучшение фосфатного питания картофеля и овощных культур до оптимального способствовало большому потреблению ими цинка. По данным Ю. И. Ермохина (1995), внесение фосфора под картофель в дозе 200 мг/кг почвы способствовало усиленному поглощению цинка растениями в фазу цветения с 2,96 до 11,3 мг. Таким образом, при улучшении фосфатного режима обыкновенного тяжелосуглинистого чернозема до оптимального путем внесения суперфосфата проявляется синергизм между P и Zn. А при превышении оптимальной концентрации фосфора отношения между названными элементами могут перейти в антагонистические. Фосфорные удобрения при неправильной дозировке способны нарушить микроэлементный обмен в листьях растений и изменить внутренний баланс элементов питания в овощах и клубнях в сторону увеличения или снижения (Ермохин, 1995).
Установлено, что антагонизм Zn — P в растениях не может быть объяснен исключительно взаимным ограничением миграционной способности. Это взаимодействие является главнымобразом физиологическим свойством (Кабата-Пендиас и Пендиас, 1989).
Маршнер (Marschner) указывает (цитировано по Alloway, 2004), что при наличии в почве фосфора или внесении фосфорных удобрений растения быстро преодолевают дефицит цинка, зачастую даже выше того уровня, который мог бы быть определён как следствие быстрого роста растения. Тем не менее, количество извлекаемого из почвы цинка либо значительно (по причине образования труднорастворимых соединений), либо в очень малой степени снижается при внесении фосфорных удобрений (из-за образования подвижных форм). В кислых почвах риск дефицита цинка из-за наличия фосфора возрастает с внесением фосфорных удобрений в комплексе с известкованием. Известкование подавляет загрязнение алюминием и, таким образом, усиливает образование корней, но резкое падение концентрации цинка в почве, в сочетании с возросшей потребностью в нём из-за быстро растущих побегов, требует дополнительного внесения цинка, чтобы предотвратить задержку роста при высоком содержании фосфора и извести.
Лонераган и Уэбб (Loneragan, Webb, 1993) определяют два различных типа взаимодействия Zn – P:
1) при котором увеличение доз фосфора снижает концентрацию цинка в побегах;
2) при котором увеличение доз фосфора не снижает концентрацию цинка в побегах.
Наиболее распространённым является первый тип взаимодействия Zn – P, при котором соли фосфора вызывают снижение концентрации цинка. Обычно это происходит, когда почвы бедны и фосфором и цинком, и внесение фосфорных удобрений приводит к достаточному росту растений и вызывает снижение концентрации цинка в тканях растения и приводит к дефициту цинка.
Тем не менее, существует иная ситуация, при которой дефицит цинка индуцируется фосфором без уменьшения концентрации цинка в тканях растения. Вероятно, что фосфор может подавлять абсорбцию цинка корнями растения или же его транслокацию из корней в стебель.
Существует четыре возможных причины, по которым фосфор мог бы понижать абсорбцию цинка из почвы:
III. H+ ионы, генерируемые солями фосфора, могут препятствовать абсорбции цинка из раствора
Роль ПДМ в усвоении фосфора растениями хорошо известна. Микориза очень эффективно увеличивает поглощающую способность адсорбции всех элементов из почвы, т.е. не только фосфора. Таким образом, при высокой концентрации в почве фосфора и соответствующем подавлении развития микоризы, снижается абсорбция других ионов, например Zn2+ . Большинство растений имеют микоризу (83% двудольных и 79% однодольных), но ни маревые (свёкла, шпинат), ни крестоцветные (капуста, турнепс) её не имеют. Тем не менее, микориза не образуется, если почва слишком богата азотом или очень суха, засолена (солончак) или заболочена.
На капусте не образуется колоний ПДМ, поэтому культуры, высаженные после капусты, скорее всего, будут иметь низкий уровень ПДМ колонизации, и это может привести к дефициту цинка в плодах, выращенных на почвах с низким Zn – P статусом.
Растения с хорошо развитой корневой системой, как злаковые и травы, в основном не очень зависимы от наличия ПДМ для усвоения питательных веществ. Однако, растения со слабо развитой корневой системой и малым количеством корневых волосков, как большинство овощей, могут получать значительное количество питательных веществ посредством ПДМ.
Такие культуры, как лён, очень зависят от ПДМ в получении цинка и фосфора. Сокращения количества колоний ПДМ, являющиеся следствием длительного пребывания (более 12 месяцев) почвы «под парами», приводит к ослаблению питания цинком и фосфором последующих посадок (болезнь долгого пара). Низкая колонизация ПДМ может также являться результатом засухи или излишне обильного применения растворимых фосфорных удобрений.
Механизмы II и IIIотносятся не столько к состоянию почвы, сколько к режиму полива. Последний механизм (IV) определяется несколькими факторами, при которых цинк может быть абсорбирован, в их числе – гидрооксиды железа и алюминия и pH почвы. Ситуацию, при которой фосфор напрямую подавлял бы абсорбцию цинка, трудно смоделировать (Alloway, 2004).
Итак, в растении существуют несколько механизмов, которыми фосфор может влиять на мобильность и наличие цинка. Они следующие:
- подавление перемещения цинка из корней в стебель;
- снижение количества растворимого цинка;
- связывание цинка фосфором – содержание фитата;
- фосфорное истощение мембран клеток.
Теория о том, что перемещения цинка из корней в стебель подавляется избытком фосфора, по мнению Лонерагана и Уэбба (Loneragan, Webb, 1993), не подтверждается экспериментами. Тем не менее, было показано на многих видах культур, что при условии большого поступления цинка, фосфор может нейтрализовать цинк в корнях растения путём образования фитата, но, возможно, это не может быть отнесено к нехватке цинка.
Некоторые добавки и фосфорные удобрения способны повысить концентрацию цинка в растении. Это может объясняться повышением кислотности корневого окружения (и, как следствие, увеличение потребления цинка) или наличием примесей цинка в удобрении. Коммерческие удобрения, как например суперфосфат, содержат значительные количества Zn (и Cd), а также закисляют почву из-за своего высокого содержания сульфат-иона.
Получил широкое признание тот факт, что дефицит цинка может вызвать отравление фосфором в стеблях. Это было отмечено у клевера, картофеля, пшеницы и хлопчатника. В данных случаях это была концентрация фосфора в листьях, находящихся в определённом соотношении с содержанием цинка.
Полагают, что накопление высокой концентрации фосфора при низком уровне содержания цинка вызывает синдром «фосфорной повышенной потребности в цинке». В некоторых культурах, таких, как картофель и хлопчатник, низкое содержание цинка в сочетании с высокой подачей фосфора приводит к отравлению фосфором из-за усиления его потребления, что приводит к накоплению P в листьях. Однако в пшенице можно видеть процесс аккумуляции фосфора в отмирающих листьях с последующим удалением его из растения (Alloway, 2004).
При исследовании риса, Нойе и Мармариль (Neue, Marmaril, цитировано по Alloway, 2004) отметили, что применение фосфора снижает в основном количество получаемого из почвы цинка, нежели получаемого из удобрений. При этом в почве образуются органические комплексы металл-фосфат.
1.4 Коррекция дефицита цинка. Микроудобрения
Основным способом компенсации цинкового дефицита является внесение микроудобрений. Формирование нормативной базы по их эффективному использованию целесообразно проводить по той же системе, как и по макроудобрениям, т.е. на уровне природно-сельскохозяйственных зон, провинций, подпровинций и областей. Объективность нормативной базы обусловлена качеством и количеством полевых опытов, необходимость которых актуальна и по сей день. В результате обобщения и анализа множества полевых опытов А. Н. Аристарховым составлена таблица доз цинковых удобрений для внесения под основные культуры.
Из приведённой таблицы видно, что зональные дозы микроудобрений под одни и те же культуры имеют существенные различия, что обуславливает их дифференцированное применение. Для большинства культур установлена общая тенденция увеличения доз применения микроудобрений от более северных зон к южным, за исключением пропашных культур (сахарная свёкла, картофель) (Аристархов, 2000).
Таблица 2. Дозы цинковых удобрений под основные культуры.
Культуры |
Южно-таёжно-лесная зона | Лесостепная зона | Степная зона | Сухостепная зона |
| Зерновые | 2.9 (2.3 – 3.2) | 2.7 (2.7 – 3.2) | 3.3 (3.0 – 3.7) | 2.5 (2.3 – 2.6) |
| кукуруза (з. м.) | 2.5 (2.0 – 3.0) | 2.9 (2.0 – 3.0) | 5.0 (4.0 – 5.0) | 5.5 (5.5 – 6.5) |
| кукуруза (зерно) | - | 3.9 (3.5 – 4.5) | 4.1 (4.0 – 5.0) | 6.3 (5.5 – 6.5) |
| зернобобовые | - | 4.2 (4.0 – 5.0) | - | - |
| сахарная свёкла | 4.1 (3.5 – 4.5) | 3.3 (3.0 – 4.0) | 3.0 (3.0 – 4.0) | - |
| картофель | 4.3 (4.0 – 5.0) | 3.5 (3.0 – 4.0) | - | 3.7 (3.0 – 4.0) |
При выявлении дефицита цинка у растений наряду с основным применением микроудобрений, достаточно эффективны и экономичные способы – предпосевная обработка семян и некорневые подкормки растений. Кроме того, целесообразно обрабатывать семена и посевы микроудобрениями на полях, с которых ожидают получение высоких урожаев сельскохозяйственных культур, и на почвах с повышенным общим содержанием микроэлементов (Аристархов, 2000). В подобной практике применения микроудобрений предпосевной обработки семян и некорневой подкормки при экономном расходовании препаратов хорошо совмещаются с протравливанием семян, борьбой с вредителями и болезнями вегетирующих растений. Как сообщает А. Н. Аристархов (2000), цинковые удобрения больше тяготеют к основному внесению, но в степной и сухостепной зонах обработка семян и некорневые подкормки более эффективны или не уступают основному внесению.
Глава 2. Объекты и методы исследования
Вегетационный опыт был заложен на дерново-подзолистой легкосуглинистой почве, отобранной на территории УО ПЭЦ Чашниково.
Погодные условия за период проведения вегетационного опыта описаны в табл.3.
Таблица 3. Погодные условия во время проведения вегетационного опыта
| месяц | средняя to C воздуха | сумма осадков, мм |
| июнь | 18,1 | 21,7 |
| июль | 19,3 | 56,3 |
| август | 20,7 | 76,2 |
Почвой набивались сосуды ёмкостью 5 кг. Схема опыта представлена в табл.4. Контрольный вариант – почва без удобрений. В почву вариантов NPK вносилось полное минеральное удобрение в порошке с постоянным количеством азота и калия (100 мг/кг) и разными дозами фосфора (100, 200 и 300 мг/кг). Через сутки в соответствующие сосуды было добавлено микроудобрение в виде раствора соли ZnSO4 в рекомендованном Аристарховым количестве (3 мг/кг) и повышенной дозе (10 мг/кг) (все вышеуказанные единицы – в расчёте на действующее вещество). Ещё через двое суток были высажены растения ячменя сорта «Сонет» по 10 семян на сосуд.
Все варианты выполнялись в четырёхкратной повторности.
Сбор урожая был произведён в период восковой спелости. Растения срезались на уровне 2 см от почвенной поверхности. Колосья были отделены от стеблей, весь материал был высушен и впоследствии взвешен.
Таблица 4. Варианты опыта
| Вариант | номер образца |
| Контроль | 21, 2, 62, 81 |
| Zn 3 мг/кг | 88, 86, 87, 85 |
| Zn 10 мг/кг | 17, 18, 16, 84 |
| NPK | 4, 89, 3, 20 |
| NP2 K | 78, 82, 83, 79 |
| NP3 K | 80, 40, 11, 49 |
| NPK+ Zn 3 мг/кг | 12, 13, 32, 14 |
| NP2 K+ Zn 3 мг/кг | 36, 52, 90, 47 |
| NP3 K+ Zn 3 мг/кг | 48, 51, 31, 22 |
| NPK+ Zn 10 мг/кг | 53, 95, 96, 54 |
| NP2 K+ Zn 10 мг/кг | 1, 77, 23, 35 |
| NP3 K+ Zn 10 мг/кг | 37, 50, 25, 24 |
Почвенные образцы были отобраны в количестве 500 г из каждого сосуда со всей его глубины, высушены и растёрты (диаметр частиц 1 мм).
Агрохимические исследования проводились по общепринятым методам (Минеев (ред.), 2001):
· почва: определение pH в водных вытяжках с помощью pH-метра, суммы поглощённых оснований – методом титрования по Каппену-Гильковицу, содержания гумуса – методом Тюрина, валового содержания цинка, железа и марганца – эмиссионным спектральным методом, содержания подвижных форм цинка, железа и марганца – в ацетат-аммонийных вытяжках (pH=4,8) с соотношением почва-раствор 1:10, и содержания кислоторастворимых форм цинка в вытяжках HCl 1н 1:10 – атомно-абсорбционным методом, содержания калия и фосфора – в вытяжках 0.2М HCl 1:5 (по Кирсанову): K пламенно-фотометрическим методом и P фотоколориметрическим методом;
· солома и зерно озолялись при t=450o C; зола растворялась в 10% HCl при нагревании; в растворе определяли Zn, Fe, Mn методом ААС и P фотоколориметрическим методом, N в зерне – методом Кьельдаля.
Глава 3. Результаты и их обсуждение
почва растение металл удобрение
3.1 Агрохимическая характеристика почвы
Сумма поглощённых оснований в исходной почве составила 8.4 мг-экв./100 г. Степень насыщенности основаниями – 75%.
Показатели агрохимического состояния почвы опыта приведены в табл.5.
Таблица 5. Агрохимические свойства почвы
| вариант | содержание гумуса, % | pHводн | гидролитическая кислотность, мг-экв./100 г | K2 O мг/100г | P2 O5 мг/100г |
| контроль | 2,49 | 6,4 | 2,8 | 12,3 | 47 |
| Zn 3 мг/кг | 2,65 | 6,3 | 2,6 | 13,7 | 45 |
| Zn 10 мг/кг | 2,56 | 6,7 | 3,0 | 11,5 | 26 |
| NPK | 2,65 | 6,8 | 4,2 | 10,2 | 47 |
| NP2 K | 2,58 | 6,2 | 4,4 | 12,0 | 65 |
| NP3 K | 2,41 | 6,2 | 4,5 | 12,1 | 69 |
| NPK+ Zn 3 мг/кг | 2,57 | 7,2 | 4,2 | 10,4 | 56 |
| NP2 K+ Zn 3 мг/кг | 2,69 | 6,3 | 4,4 | 10,5 | 60 |
| NP3 K+ Zn 3 мг/кг | 2,49 | 6,1 | 4,5 | 9,4 | 73 |
| NPK+ Zn 10 мг/кг | 2,51 | 5,8 | 4,2 | 12,1 | 51 |
| NP2 K+ Zn 10 мг/кг | 2,45 | 5,8 | 4,4 | 9,5 | 51 |
| NP3 K+ Zn 10 мг/кг | 2,49 | 6,0 | 4,5 | 8,9 | 74 |
Содержание подвижных соединений калия в почве опыта изменялось от 9.5 до 13.7 мг/100 г. Согласно группировкам почв по их содержанию (Минеев (ред.), 1989) данная дерново-подзолистая почва повышенно обеспечена калием (повышенная обеспеченность: 10 – 15 мг/100г).
Количество подвижных форм фосфора в почве опыта варьирует от 26 до 74 мг/100 г и относит почву к группе очень высоко обеспеченных фосфором (очень высокая обеспеченность: 30 мг/100г). Внесение соединений цинка (особенно 10 мг/кг) в исходную почву привело к снижению концентрации подвижных соединений фосфора до минимальной (26 мг/100 г), что, вероятно, может быть связано с образованием труднорастворимых соединений фосфатов цинка. При применении возрастающих доз фосфорных удобрений наблюдается увеличение количества подвижных фосфатов, что может быть подтверждением гипотезы А. Ю. Кудеяровой (2005) об образовании подвижных цинк-фосфатных или цинк-органофосфатных комплексов.
Гидролитическая кислотность возросла в вариантах с внесением макроудобрений по сравнению с контрольным вариантом пропорционально увеличению доз фосфора, что связано с процессами гидролиза при взаимодействии удобрений с почвенным раствором.
3.2 Определение эффективности внесения макро- и микроудобрений
Урожай основной и побочной продукции ячменя по вариантам опыта распределился следующим образом (табл.6).
Таблица 6. Урожайные данные
| вариант | масса зерна, г | масса соломы, г |
| контроль | 2,3 | 2,3 |
| NPK | 8,9 | 9,8 |
| NP2 K | 10,1 | 10,9 |
| NP3 K | 9,4 | 11,6 |
| Zn 3 мг/кг | 2,5 | 2,7 |
| Zn 10 мг/кг | 1,5 | 2,2 |
| NPK+ Zn 3 мг/кг | 9,9 | 10,8 |
| NP2 K+ Zn 3 мг/кг | 8,2 | 10,9 |
| NP3 K+ Zn 3 мг/кг | 8,8 | 11,1 |
| NPK+ Zn 10 мг/кг | 5,0 | 8,3 |
| NP2 K+ Zn 10 мг/кг | 7,8 | 10,1 |
| NP3 K+ Zn 10 мг/кг | 8,7 | 10,2 |
| НСР0,5 | 1,4 | 0,8 |
Внесение микроудобрения достоверно не повлияло на урожай по сравнению с контролем.
В вариантах с внесением полного минерального удобрения произошло достоверно значимое увеличение урожая при всех дозах фосфора (по закону Либиха лимитирующими факторами урожайности являются содержания N и K). Также подействовало внесение полного минерального удобрения в сочетании с рекомендованной дозой Zn 3 мг/кг. Данная доза цинка не обеспечила прибавку урожая в сравнении с внесением полного минерального удобрения. Следовательно, внесение цинковых удобрений в высоко обеспеченную фосфором дерново-подзолистую почву при выращивании ячменя неэффективно.
Повышение дозы Zn до 10 мг/кг повлияло на урожай негативно. Несоблюдение норм микроудобрений может привести к негативным экологическим последствиям – снижению урожая продукции. Повышенные концентрации вносимого фосфора снижают фитотоксическое действие избыточных концентраций микроэлемента.
3.3 Содержание элементов в почве опыта
Валовое содержание цинка в контрольном варианте, равное 98 мг/кг, является повышенным для дерново-подзолистых почв московского региона и приближается к ОДК (110 мг/кг). По данным Е. А. Карповой (2006) в среднесуглинистой почве полевого опыта на ОУПЭЦ «Чашниково» содержание варьируется от 44 до 76 мг/кг.
Валовые содержания железа в контроле – 2.9%. По данным Е. А. Карповой (2006), опытные поля окрестностей Чашникова в среднем содержат 2.6% железа. В работе Н. Ф. Гомоновой и В. Г. Минеева (2003) в среднесуглинистой дерново-подзолистой почве длительного полевого опыта в Чашникове общее количество железа находится в диапазоне 2.30 – 2.80%. Следовательно, количество металла в почве нашего опыта фактически не отличается от свойственного ему значения.
Содержание марганца в почве контрольного варианта – 392 мг/кг, что несколько ниже кларка (545 мг/кг), приводимого в работе А. Кабата-Пендиас и Х. Пендиаса (1989). В работе Е. А. Карповой (2006) этот показатель для дерново-подзолистых почв разного гранулометрического состава находится в диапазоне 580 – 850 мг/кг. Таким образом, исследуемая почва характеризуется пониженным общим содержанием марганца.
3.4 Содержание подвижных форм металлов в почве опыта
Содержание наиболее мобильных соединений цинка в почве варьируется в пределах от 6.0 до 10.3 мг/кг (табл.7) и свидетельствует о принадлежности почвы к группе высоко обеспеченных цинком (5 мг/кг) (Савин и др., 2004). Также концентрации цинка не превышают ПДК для почв равную 23 мг/кг.
В литературе приводятся неоднозначные данные о влиянии фосфатов на подвижность цинка, железа и марганца. По данным А. Н. Аристархова (2000), внесение фосфорных удобрений обуславливает снижение подвижных соединений этих металлов.
Однако в монографии А. Ю. Кудеяровой (1995) приводятся сведения, что под влиянием фосфатов происходила сильно выраженная трансформация природного металлогуматного комплекса. Она сопровождалась высвобождением в раствор значительных количеств железа, алюминия и цинка. В связи с этим способность пирофосфат-анионов образовывать растворённые комплексы с ионами металлов лежит в основе методов извлечения из почв железа и алюминия (Кудеярова, 1995).
Внесение полного минерального удобрения достоверно не повлияло на подвижность цинка в почве исследуемого опыта.
При внесении полного минерального удобрения в сочетании с микроудобрением наблюдается тенденция увеличения количества подвижного цинка. Снижение подвижности вследствие применения возрастающих доз фосфорных удобрений не произошло. Вероятно, это подтверждает гипотезу А. Ю. Кудеяровой (2005) об образовании подвижных цинк-фосфатных или цинк-органофосфатных комплексов в почвах с высоким содержанием фосфора.
Таблица 7. Подвижные металлы в почве
| Вариант | Zn мг/кг | Fe мг/кг | Mn мг/кг |
| Контроль | 7,2± 0,56 | 10,0 ± 2,13 | 96,9 ± 13,8 |
| NPK | 6,6± 2,28 | 11,3 ± 3,23 | 92,6 ± 9,1 |
| NP2 K | 7,0± 3,03 | 14,3 ± 0,21 | 80,1 ± 1,7 |
| NP3 K | 6,7± 2,10 | 9,0 ± 2,70 | 97,3 ± 11,0 |
| Zn 3 мг/кг | 6,0± 1,35 | 21,2 ± 0,33 | 82,7 ± 0,5 |
| Zn 10 мг/кг | 6,9± 2,60 | 18,1 ± 0,41 | 51,6 ± 1,2 |
| NPK+ Zn 3 мг/кг | 8,8± 2,78 | 10,5 ± 2,85 | 88,8 ± 8,2 |
| NP2 K+ Zn 3 мг/кг | 10,3± 4,15 | 9,2 ± 2,13 | 101,2 ± 0,7 |
| NP3 K+ Zn 3 мг/кг | 9,9± 1,67 | 6,2 ± 0,37 | 87,0 ± 8,4 |
| NPK+ Zn 10 мг/кг | 7,5 ± 0,61 | 15,3 ± 0,22 | 60,5 ± 4,5 |
| NP2 K+ Zn 10 мг/кг | 9,0± 1,59 | 11,0 ± 1,19 | 77,6 ± 6,7 |
| NP3 K+ Zn 10 мг/кг | 9,3± 2,97 | 8,0 ± 2,74 | 72,3 ± 3,0 |
При внесении только цинкового микроудобрения в рекомендуемой дозе Zn 3 мг/кг концентрация наиболее подвижных форм имеет тенденцию к снижению. Единственное объяснение сложившейся ситуации может заключаться в следующем: если мы обратимся к опытам по статической сорбции металлов почвой, то увидим, что в области низких значений концентраций происходит полное поглощение почвой элементов, что связано с безобменной специфической сорбцией.
Содержание железа в ААБ-вытяжке в контрольном варианте составило 10 мг/кг. В дерново-подзолистой почве длительного полевого опыта, описываемого в работе Н. Ф. Гомоновой и В. Г. Минеева (2003), количество подвижных соединений железа попало в диапазон 50 – 74 мг/кг. Относительно низкое значение этого показателя в исследуемом нами опыте может быть связано с кислотно-основными условиями среды: pH почвы контрольного варианта близок к 7.
Концентрация подвижных форм железа в обоих вариантах внесения чистого цинкового микроудобрения значимо возросла по сравнению с контролем: 21.2 мг/кг при 3 мг/кг Zn и 18.1 мг/кг при 10 мг/кг. И в этих же вариантах значение pH уменьшилось, что подтверждает прямую зависимость подвижности железа от кислотности почвы.
Внесение полного минерального удобрения, как в чистом виде, так и совместно с микроудобрением в рекомендованной дозе Zn 3 мг/кг, достоверно не повлияло на подвижность соединений железа. Но при повышении доз применения фосфора прослеживается тенденция к снижению подвижности железа. Количество металла, извлекаемого ААБ, уменьшается от 11.3 и 10.5 мг/кг при внесении 100 мг/кг д.в. фосфора до 9.0 и 6.2 мг/кг – при 300.
Варианты внесения минерального удобрения в сочетании с микроудобрением в повышенной дозе 10 мг/кг Zn указывают на ту же тенденцию, с той лишь разницей, что при меньшей дозе внесения фосфора (100 мг/кг на д.в.) концентрация подвижного железа выше – 15.3 мг/кг. Это ещё раз указывает на то, что вносимый сульфат цинка, будучи гидролитически кислой солью, позитивно влияет на обеспеченность почвы подвижным железом.
Концентрация подвижных форм марганца составила 96.9 мг/кг. По классификации Г.А.Соловьева (Минеев (ред.), 1989) такая почва относится к группе повышенной обеспеченности элементом.
Внесение возрастающих доз фосфатов в составе полного минерального удобрения не приводило к достоверным изменениям подвижности марганца.
3.5 Содержание кислоторастворимого цинка в почве опыта
В пахотных горизонтах дерново-подзолистых почв Подмосковья содержится 20 мг/кг цинка, извлекаемого 1М раствором HCl(Карпова, 2006). Полученное значение для почвы контрольного варианта исследуемого опыта – 26 мг/кг. Почва относится к группе избыточно обеспеченных элементом (Справочник агрохимика, 2007).
Результаты внесения раствора сульфата цинка указывают на тенденцию повышения этого показателя. Причем увеличение содержания кислоторастворимых соединений металла в этом случае несколько больше, чем обусловлено его внесением, что может быть связано с возрастанием количества кислоторастворимого цинка в почве и за счет подкисления среды.
Применение полного минерального удобрения в сочетании с Zn-микроудобрением в дозе 3 мг/кг привело к некоторому снижению (тенденция) количества кислоторастворимых форм микроэлемента по сравнению с вариантами внесения только микроудобрения. Причем, от возрастания доз фосфатов эта тенденция не усиливалась.
Применение полного минерального удобрения в сочетании с Zn-микроудобрением в дозе 10 мг/кг привело к еще большему снижению количества кислоторастворимого цинка (тенденция).
Причем, как и в предыдущем случае, максимальное снижение содержания кислоторастворимого цинка отмечено в варианте NPK, а при возрастании доз фосфорных удобрений этот показатель несколько увеличивается. Т.е. высокие дозы фосфорных удобрений, применяемые на высокообеспеченных цинком почвах практически не снижают количество кислоторастворимых соединений цинка.
Таблица 8. Кислоторастворимый цинк в почве опыта
| Вариант | Zn мг/кг |
| Контроль | 26,0 ± 1,7 |
| NPK | 30,6 ± 8,3 |
| NP2 K | 30,5 ± 2,7 |
| NP3 K | 25,7 ± 1,4 |
| Zn 3 мг/кг | 35,3 ± 13,7 |
| Zn 10 мг/кг | 39,4 ± 18,5 |
| NPK+ Zn 3 мг/кг | 24,2 ± 1,8 |
| NP2 K+ Zn 3 мг/кг | 32,8 ± 0,4 |
| NP3 K+ Zn 3 мг/кг | 29,4 ± 1,6 |
| NPK+ Zn 10 мг/кг | 21,5 ± 0,3 |
| NP2 K+ Zn 10 мг/кг | 25,3 ± 0,3 |
| NP3 K+ Zn 10 мг/кг | 28,2 ± 5,4 |
3.6 Содержание микроэлементов, фосфора и азота в растениях опыта
Результаты анализа органов исследуемых растений представлены в табл.9 и 10. В контрольном варианте концентрация цинка в зерне составила 38.9 мг/кг и попадает в диапазон часто встречающихся для зерна ячменя, который, по данным Т. Н. Кулаковской (1990), составляет от 9.6 до 50 мг/кг.
Таблица 9. Микроэлементы, фосфор и азот в зерне
| Вариант | Zn мг/кг | Fe мг/кг | Mn мг/кг | P2 O5 % | N % |
| Контроль | 38,9 ± 6,9 | 39,3 ± 7,7 | 5,5 ± 4,2 | 0,88 | 2,9 |
| NPK | 35,3 ± 13,6 | 50,5 ± 1,6 | 6,5 ± 3,8 | 0,75 | 2,9 |
| NP2 K | 33,9 ± 11,1 | 42,8 ± 11,2 | 5,0 ± 0,3 | 0,77 | 2,9 |
| NP3 K | 36,8 ± 12,0 | 62,2 ± 17,7 | 11,5 ± 2,6 | 0,68 | 2,9 |
| Zn 3 мг/кг | 33,3 ± 5,7 | 43,7 ± 2,0 | 6,6 ± 0,4 | 0,76 | 2,6 |
| Zn 10 мг/кг | 34,5 ± 9,0 | 46,1 ± 8,2 | 6,1 ± 2,8 | 0,75 | 2,2 |
| NPK+ Zn 3 мг/кг | 40,9 ± 18,2 | 51,6 ± 8,8 | 7,8 ± 2,7 | 0,61 | 2,9 |
| NP2 K+ Zn 3 мг/кг | 46,4 ± 9,5 | 52,1 ± 9,1 | 9,5 ± 2,0 | 0,74 | 4,7 |
| NP3 K+ Zn 3 мг/кг | 34,9 ± 3,0 | 65,3 ± 17,9 | 9,8 ± 0,8 | 0,67 | 3,4 |
| NPK+ Zn 10 мг/кг | 72,5 ± 13,8 | 73,1 ± 8,1 | 10,5 ± 0,4 | 0,92 | 4,6 |
| NP2 K+ Zn 10 мг/кг | 56,4 ± 23,8 | 62,3 ± 4,5 | 9,2 ± 1,1 | 0,63 | 3,1 |
| NP3 K+ Zn 10 мг/кг | 47,4 ± 11,7 | 64,4 ± 5,6 | 9,2 ± 4,7 | 0,87 | 3,1 |
В справочной таблице Практикума по агрохимии (Минеев (ред.), 1989) приводимый диапазон значительно уже – от 15 до 20 мг/кг. ПДК для цинка в зерне равна 50 мг/кг (Минеев (ред.), 1989).
На концентрацию цинка в зерне ячменя не повлияло ни применение возрастающих доз фосфатов в составе полного минерального удобрения, ни внесение микроудобрений в рекомендованной и повышенной дозах. Что может подтверждать гипотезу В. Б. Ильина (1977) о влиянии фактора наследственности, обеспечивающего стабильность химического состава семян растений.
В вариантах с внесением 10 мг/кг Zn совместно с NPK привело к тенденции возрастания концентрации цинка в зерне (72 мг/кг) и несоответствию продукции гигиеническим нормам (ПДК). При внесении возрастающих доз фосфорной составляющей полного минерального удобрения концентрация микроэлемента имеет тенденцию к снижению, и при дозе P3 содержание его в зерне приближается к норме (47.4 мг/кг).
Содержание железа в зерне в контрольном варианте составило 39.3 мг/кг. В сравнении с приводимым В. Б. Ильиным (1977) значением концентрации Fe в зерне зерновых на дерново-подзолистой почве (54 мг/кг), содержание Fe в зерне исследуемого опыта оказывается пониженным, что согласуется с низким уровнем подвижных соединений железа в почве опыта. По данным А. Кабата-Пендиас и Х. Пендиаса (1989), диапазон среднего содержания железа в зерне ячменя, возделываемого в разных странах севера Европы, ограничивается значениями 33 и 52 мг/кг.
На концентрацию железа в зерне ячменя применение возрастающих доз фосфатов в составе полного минерального удобрения и внесение микроудобрений в рекомендованной и повышенной дозах также не повлияли. Это тоже может быть связано с вышеупомянутой гипотезой о доминирующем наследственном факторе накопления химических элементов (Ильин, 1977).
В вариантах внесения полного минерального удобрения совместно с повышенной дозой цинка (10 мг/кг) содержание железа увеличилось (в среднем до 60 мг/кг). Но при возрастающих дозах внесения фосфатов данные показатели достоверно не отличаются. Следовательно, обуславливающим увеличение концентрации Fe фактором служит действие повышенной дозы внесения соли цинка на кислотность почвы.
Накопление марганца растениями контрольного варианта остановилось на отметках: 5.5 мг/кг в зерне. Данный показатель не достигает нижней границы диапазона наиболее часто встречающихся значений для зерна ячменя на территории Европы, приводимых в работе А. Кабата-Пендиас и Х. Пендиаса (1989): 13 – 48 мг/кг. Т.е. низкий уровень накопления металла в зерне ячменя в исследуемом опыте проявляется при относительно повышенном содержании в почве подвижных соединений марганца. Это может быть связано с сортовой спецификой элементного состава зерна (сорт «Сонет»), а также с явлениями антагонизма цинка и марганца в растениях, особенно при избыточной обеспеченности растений цинком (в нашем случае). Об антагонизме цинка и марганца в растениях свидетельствуют данные А. Кабата-Пендиас и Х. Пендиаса (1989).
Применение минеральных удобрений и микроудобрений (как по отдельности, так и в сочетании) практически не оказало влияния на концентрацию марганца в зерне.
Количество азота в зерне вариантов опыта варьируется от 2.2 до 4.7%, что несколько больше среднего для зерна ячменя (2.04%, Кулаковская, 1990) Сочетание цинкового микроудобрения с полным минеральным способствовало увеличению этого показателя (на абсолютно сухую массу) (2.9 – 4.7%) по сравнению с остальными вариантами. Возможно, это связано с сортовыми особенностями культуры (ячмень, «Сонет») и с повышением образования белковых соединений вследствие увеличения содержания цинка в растении.
Содержания фосфора в зерне составили диапазон от 0.63 до 0.92% и были близки к свойственным ячменю значениям (0.93%, Кулаковская, 1990). Сравнительно низкое варьирование содержания фосфора в зерне является естественным и связано с генотипически закреплённым стабильным химическим составом генеративных органов растений. Применение фосфорных и цинковых удобрений на дерново-подзолистой почве, исходно богатой и фосфором, и цинком, не привело к изменению накопления фосфора в зерне ячменя.
При рассмотрении закономерностей накопления цинка в соломе ячменя в исследуемом опыте в первую очередь обращает на себя внимание этот показатель для контрольного варианта (59.9 мг/кг), который превышает ВМДУ для сельскохозяйственных растений равный 50 мг/кг (Минеев (ред.), 2001). Притом, что почва входит в класс безопасных по содержанию цинка (ПДК по подвижным соединениям – 23 мг/кг – не превышена). Это может свидетельствовать не в пользу существующих нормативов (ПДК) для почвы.
Внесение минеральных удобрений в исходную почву приводит к получению экологически безопасной кормовой продукции с концентрацией цинка от 32 до 44 мг/кг.
В вариантах внесения рекомендованной и повышенной доз Zn без применения NPK-удобрений была получена продукция не соответствующая ВМДУ по содержанию цинка в соломе, притом, что в почве ПДК по подвижной форме Zn не достигнута.
При внесении цинка в дозе 3 мг/кг в сочетании с полным минеральным удобрением в соломе ячменя наблюдалось накопление металла до 110.2 мг/кг, что почти в 2 раза выше ВМДУ. Внесение максимальной дозы фосфорных удобрений приводило к снижению содержания цинка почти до нормы.
Совместное внесение удобрений NPK + Zn 10 мг/кг привело к тому же результату. Применение возрастающих доз фосфатов улучшает качество продукции по этому показателю пропорционально увеличению этих доз. Но даже при максимальной дозе P ВМДУ по цинку оказывается превышен.
Таблица 10. Микроэлементы и фосфор в соломе
| Вариант | Zn мг/кг | Fe мг/кг | Mn мг/кг | P2 O5 % |
| Контроль | 59,9 ± 18,2 | 90,7 ± 46,8 | 12,1 ± 3,4 | 0,71 |
| NPK | 43,9 ± 10,8 | 94,6 ± 0,4 | 9,2 ± 2,1 | 0,47 |
| NP2 K | 33,7 ± 23,3 | 55,0 ± 12,5 | 7,2 ± 1,1 | 0,38 |
| NP3 K | 32,4 ± 15,1 | 70,6 ± 35,9 | 11,3 ± 4,3 | 0,42 |
| Zn 3 мг/кг | 50,8 ± 1,2 | 70,3 ± 7,2 | 10,0 ± 2,3 | 1,36 |
| Zn 10 мг/кг | 54,2 ± 24,2 | 60,3 ± 8,7 | 7,7 ± 2,1 | 1,48 |
| NPK+ Zn 3 мг/кг | 76,5 ± 37,8 | 93,3 ± 27,4 | 9,8 ± 0,1 | 1,50 |
| NP2 K+ Zn 3 мг/кг | 110,2 ± 19,6 | 69,9 ± 10,1 | 10,7 ± 1,9 | 1,95 |
| NP3 K+ Zn 3 мг/кг | 50,9 ± 18,2 | 56,5 ± 4,2 | 14,2 ± 0,4 | 1,40 |
| NPK+ Zn 10 мг/кг | 109,0 ± 30,2 | 125,8 ± 5,2 | 16,2 ± 5,1 | 1,13 |
| NP2 K+ Zn 10 мг/кг | 89,5 ± 30,2 | 105,7 ± 7,6 | 13,3 ± 0,9 | 1,78 |
| NP3 K+ Zn 10 мг/кг | 71,1 ± 18,2 | 65,8 ± 9,7 | 15,0 ± 2,2 | 1,20 |
В соломе растений исследуемого опыта содержание железа образует диапазон 55 – 126 мг/кг. По классификации уровней содержания микроэлементов в сельскохозяйственных культурах, приводимой В. В. Церлинг (1990), полученные значения концентрации железа характеризуют его уровень как низкий (120 мг/кг). Однако этот параметр входит в диапазон содержаний железа 15 – 150 мг/кг (Pestana, Faria, 2004), ниже которого происходят функциональные нарушения и появляются визуальные симптомы недостатка Fe.
При внесении возрастающих доз фосфатов в составе полного минерального удобрения, особенно при сочетании их с микроудобрениями цинка, выявляется тенденция пропорционального снижения накопления железа в соломе.
Концентрация марганца в соломе составляет диапазон 7.2 – 16.2 мг/кг. По данным R. J. Hannam и K. Ohki (1988) критически минимальная концентрация марганца в зрелых листьях растений варьирует от 10 до 20 мг/кг. Следовательно, как в зерне, так и в соломе наблюдается марганцевый дефицит. Таким образом, при повышенной обеспеченности почвы марганцем растения испытывают Mn-недостаточность, что может быть следствием проявления антагонизма марганца с цинком и фосфором. Диагностика обеспеченности почвы марганцем в этом случае не обеспечивает точный прогноз получения полноценной продукции и должна быть совмещена с анализом растений.
Внесение возрастающих доз фосфатов и цинковых микроудобрений на концентрацию марганца в соломе ячменя исследуемого опыта достоверно не повлияли, так как при высокой исходной обеспеченности почвы фосфором и цинком ситуация с накоплением растениями марганца – критическая.
В соломе растений опыта концентрация фосфора изменялась в диапазоне от 0.38 до 1.95% и превысила среднее значение, приводимое Т. Н. Кулаковской (1990), равное 0.28%. Повышенное содержание подвижных соединений фосфора в почве приводит к интенсивному накоплению его в соломе ячменя. Применение цинкового микроудобрения привело к увеличению концентрации фосфора в соломе, что требует дальнейшего изучения.
Выводы
1. При внесении возрастающих доз фосфорных удобрений в почве увеличилась гидролитическая кислотность на 1 – 1.5 мг-экв./100 г почвы.
2. Внесение цинковых микроудобрений в высоко обеспеченную фосфором и цинком дерново-подзолистую почву при выращивании ячменя неэффективно и не приводит к увеличению урожая.
3. Внесение повышенных доз фосфорных удобрений на почвах с относительно высоким фитотоксическим содержанием цинка позволяет восстановить продуктивность ячменя.
4. Снижение подвижности цинка в дерново-подзолистой почве, обогащённой подвижным фосфором, при применении возрастающих доз фосфорных удобрений не происходит, что подтверждает гипотезу Кудеяровой об образовании относительно подвижных цинк-фосфатных или цинк-органофосфатных комплексов.
5. Внесение цинка в дозе 10 мг/кг приводит к превышению ПДК металла в зерне и соломе ячменя. С увеличением доз вносимого фосфора содержание цинка в растениях снижается, достигая нормативного уровня при дозе фосфора 300 мг/кг.
Список литературы
1. А. Н. Аристархов, Эколого-агрохимическое обоснование оптимизации питания растений и комплексного применения макро- и микроудобрений в агроэкосистемах // диссертация в виде научного доклада … доктора биологических наук, МГУ, Москва, 2000, 88 с.
2. Н. Б. Бакиров, Почвенно-агрохимические параметры и урожайность яровой пшеницы в лесостепи Среднего Поволжья // автореферат … доктора биологических наук, КГУ, Киров, 2009, 32 с.
3. Бюллетень метеостанции МГУ // МГУ, Москва, 2007
4. Б. А. Доспехов, «Методика вегетационного опыта» // «Агропромиздат», Москва, 1985, 352 с.
5. Ю. И. Ермохин, «Диагностика питания растений» // ОмГАУ, Омск, 1995, 208 с.
6. Ю. И. Ермохин, А. В. Синдирёва, Н. К. Трубина, «Агроэкологическая оценка действия кадмия, никеля, цинка в системе «почва-растение-животное» // монография, ОмГАУ, Омск, 2002, 117 с.
7. В. Б. Ильин, М. Д. Степанова, А. А. Трейман, Ассоциации элементов-биофилов в вегетирующей массе и плодах злаковых и бобовых растений // «Этюды по биогеохимии и агрохимии элементов-биофилов», «Наука» (сибирское отделение), Новосибирск, 1977, с. 90 – 100
8. А. Кабата-Пендиас, Х. Пендиас, «Микроэлементы в почвах и растениях» // «Мир», Москва, 1989, 439 с.
9. Е. А. Карпова, Влияние длительного применения минеральных удобрений на состояние железа и тяжёлых металлов в дерново-подзолистых почвах // Почвоведение, 2006, №9, с. 1059-1067
10. Е. А. Карпова, Эколого-агрохимические аспекты длительного применения удобрений: состояние тяжёлых металлов в агроэкосистемах // автореферат … доктора биологических наук, Москва, 2006, 47 с.
11. Р. Р. Кинжаев, Влияние длительного применения удобрений на состояние биогенных и токсичных элементов в агроценозе на дерново-подзолистой почве // автореферат … кандидата биологических наук, Москва, 2004, 25 с.
12. А. Ю. Кудеярова, Влияние орто- и пирофосфатов на трансформацию железогумусовых сорбентов и их способность связывать калий и цинк // Агрохимия, 2005, №6, с. 66 – 75
13. А. Ю. Кудеярова, «Фосфатогенная трансформация почв» // «Наука», Москва, 1995, 288 с.
14. Т. Н. Кулаковская, «Оптимизация агрохимической системы почвенного питания растений» // «Агропромиздат», Москва, 1990, 220 с.
15. В. Г. Минеев, «Агрохимия» // МГУ, Москва, 2004, 720 с.
16. В. Г. Минеев (ред.), «Практикум по агрохимии» // МГУ, Москва, 1989, 512 с.
17. В. Г. Минеев (ред.), «Практикум по агрохимии» // МГУ, Москва, 2001, 688с.
18. М. С. Панин, Е.Н. Бирюкова, Закономерности аккумуляции меди и цинка в ризосфере растений // Агрохимия, 2005, № 1, с. 53 - 59
19. М. С. Панин, Е.Н. Бирюкова, Динамика содержания меди и цинка в почве прикорневой зоны ячменя и пшеницы в период вегетации // Агрохимия, 2005, №8, с. 39 - 44
20. Л. В. Переломов, Д. Л. Пинский, Иммобилизация водорастворимых солей цинка в почве // Агрохимия, 2005, №7, с. 66 – 72
21. Реестр «Агрохимическая характеристика почв сельскохозяйственных угодий РФ» // ГНУ ВНИИА, Москва, 2006, 180 с.
22. А. Б. Рубин, Т. Е. Кренделева, Регуляция первичных процессов фотосинтеза // Успехи биологической химии, т. 43, 2003, с. 225 – 266
23. В. В. Савич, Л. Л. Шишов, Х. А. Амергужин, Ж. Норовсурен, Н. Л. Поветкина, «Агрономическая оценка и методы определения агрохимических и физико-химических свойств почв» // «АкПол», Астана, 2004, 620 с.
24. Е. А. Софронов, Тяжёлые металлы (цинк и кадмий) в почвах Северо-Востока Нечерноземья // автореферат диссертации на соискание учёной степени кандидата сельскохозяйственных наук, ГУ ТатНИИ АиП РСХАН, Казань, 2003, 18 с.
25. И. И. Судницын, И. И. Сашина, Закономерности распределения меди, цинка, свинца и никеля в почвах московской области // Агрохимия, 2006, №2, с. 30 – 37
26. В. В. Церлинг, «Диагностика питания сельскохозяйственных культур: справочник» // «Агропромиздат», Москва, 1990, 235 с.
27. И. Г. Юлушев, «Система применения удобрений в севооборотах» // «Кирово-Чепецкий химический комбинат», Киров, 1999, 154 с.
28. Б. А. Ягодин (ред.), «Практикум по агрохимии» // «Агропромиздат», Москва, 1987, 304 с.
29. Н. И. Якушина, Е. Ю. Бахтенко, «Физиология растений» // «Владос», Москва, 2005, 464 с.
30. B. J. Alloway, “Zinc in soils and crop nutrition” // International Zinc Association (IZA) – Международнаяцинковаяассоциация, Брюссель, 2004, 116 с.
31. F. Aref, The effect of zink and boron interaction on the concentration and total uptake of iron and marganese in corn grain // Y. G. Zhu, N. Lepp, R. Naidu (eds), “Biogeochemistry of trace elements: environmental protection, remediation and human health”, Tsinghua University Press, Пекин, 2007, с. 600
32. J. Barber, J. W. Murray, Revealing the structure of the Mn-cluster of photosystem II by X-ray crystallography // Coordination Chemistry Reviews, vol. 252, 2007, с. 233 – 243
33. G. Bartosz, Superoxide dismutases and catalase // The handbook of environmental chemistry, Haidelberg: Springer-Verlag, vol. 2, Берлин, 2005, с. 109 – 149
34. J.-F. Briat, Iron dynamics in plants // ABR, vol. 46, 2007, с. 138-180
35. J.-F. Briat, Metal-ion-mediated oxidative stress and its control // Oxidative stress in plants (M. Montagu, D. Inze – eds.), Taylor and Francis Publishers, Лондон, Нью-Йорк, 2002, с. 171 – 189
36. J.-F. Briat, S. Lobreaux, Iron transport and storage in plants // Trends in Plant Sciences, vol. 2, 1997, с. 187 – 193
37. G. R.Buettner, A new paradigm: manganese superoxide dismutase influences the production of H2 O2 in cell and thereby their biological state // Free Radical Biology and medicine, vol. 41, 2006, с.1338 – 1350
38. J. N. Burnell, Purification and properties of phosphoenolpyruvatecarboxylase from C4 -plants // AJPP, vol. 13, 1986, с. 577 – 587
39. P. M. Harrison, P. Arosio, The ferritins: molecular properties, iron storage function and cellular regulation // BBA, vol. 1275, 1996, с. 161 – 203
40. R. Hell, U. W. Stephan, “Iron uptake, trafficking and homeostasis in plants” // Planta, vol. 216, 2003, с. 541 – 551
41. A. Kapazoglou, R. M. Mould, J. C. Gray, Assembly of the Rieske ironsulphur protein into the cytochrome of complex in thylakoid membranes of isolateted pea chloroplasts // European Biochemistry, vol. 267, с. 352 – 360
42. S. A. Kim, M. L. Guerinot, Mining iron: uptake and transport in plants // FEBS Letters, vol. 581, 2007, с. 2273 – 2280
43. L. V. Kochian, Mechanisms of micronutrient uptake and translocation in plants // Micronutrients in agriculture (S. Segoe – ed.), SSSA Book Series, #4, 1991, с. 291-304
44. H. Kosegarten, H. W. Koyro, Apoplastic accumulation of iron in the epidermis of maize roots grown in calcareous roots // PP, vol. 113, 2001, с. 515 – 522
45. M. Laszlo, Manganese requirement of sunflower, tobacco and triticale at early stage of growth // European Journal of Agronomy, vol. 28, 2008, с. 586 – 596
46. R. S. Lavado, C. A. Porcelli, R. Alvarez, Concentration and distribution of extractable elements in a soil as affected by tillage system and fertilization // “The Science of The Total Environment”, vol. 232, issue 3, Буэнос-Айрес, 1999, с. 185 - 191
47. J. F. Loneragan, M. J. Webb, Interactions between Zinc and Other Nutrients Affecting the Growth of Plants // Robson, A.D. (ed), Zinc in Soils and Plants, Kluwer Academic Publishers, Дордрехт, 1993, с. 119 – 134
48. A. F. Lpez-Milln, F. Morales, A. Abadia, J. Abadia, Effects of iron deficiency on the composition of the leaf apoplastic fluid and xylem sap in sugar beet. Implications for iron and carbon transport // Plant Physiology, vol. 124, 2000, с. 873 – 884
49. H. Marschner, “Mineral plant nutrition” // Academic Press, Лондон, 1997, 889 с.
50. M. J. Mukhopadhyay, A. Sharma, Manganese in cell metabolism of higher plants // Botanic, rev. 57, 1991, с. 117 – 149
51. F. Passardi, C. Cosio, C. Penel, C, Dunand, “Peroxidases have more functions than a Swiss army-knife” // Plant Cell, vol. 25, 2005, с. 255 – 265
52. M. Pestana, E. A. Faria, A. de Varennes, Lime-induced iron chlorosis in fruit trees // Production practices and quality assessment of food crops, vol. 2, Plant mineral nutrition and pesticide management, Kluwer Academic Publishers, 2004, с. 171 - 215
53. J. C. Pushnik, G. W. Miller, J. H. Manwaring, The role of iron in higher plants chlorophyll biosynthesis, maintenance and chloroplast biogenesis // Journal of Plant Nutrition, vol. 7, 1984, с. 733 – 758
54. T. Shikanai, P. Muller Moul, Y. Munekage, K. K. Niyogi, M. Pilon, PAA1, a P-type ATPase of Arabidopsis, functions in copper transport in chlooplasts // The Plant Cell, vol. 15, 2003, с. 1333 – 1346
55. B. N. Smith, Iron in higher plants: storage and metabolic role // Journal of Plant Nutrition, vol. 7, 1984, с. 759-766
56. F. V. Stevenson, M. S. Ardakani, Organic matter reactions involving micronutrients in soil // Mortvedt, J.J. (ed), “Micronutrients in Agriculture”, SSSA, Мэдисон, Вашингтон, США, 1972, с. 79 – 114
57. H. Toshiharu, P. Shurmann, D. B. Knaff, The interaction of ferredoxin with ferredoxin-dependent enzymes // Photosystem I: the light-driven plastocyanin: ferredoxin oxidoreductase (J. H. Golbeck ed.), 2006, с. 477 – 498