Модульная технология ускоренного размножения новых перспективных сортов картофеля
СОДЕРЖАНИЕ: Представлены результаты исследований по усовершенствованию приемов оздоровления и ускоренного размножения клубней картофеля. Раскрыта современная технология получения оздоровленных клубней на основе применения метода апикальной меристемы и клонального микроразмножения in vitro. Показаны возможности ускоренного размножения с использованием микрофрагментов клубня и агротехнических приемов.Н.Н.Семчук, А.Д.Шишов, А.С.Сердюк, Е.А.Симаков, А.В.Митюшкин, Е.В.Овэс
Институт сельского хозяйства и природных ресурсов НовГУ, Всероссийский НИИ картофельного хозяйства им. А.Г.Лорха, Красково, Московская область
Одним из главных факторов, гарантирующих достижение потенциально возможного урожая картофеля в любых почвенно-климатических условиях, является высококачественный, свободный от вирусной и бактериальной инфекции посадочный материал [1-3]. Растения, содержащие патологии различного происхождения, в своем урожае образуют клубни низкого качества (по содержанию сухого вещества, крахмала, витаминов), а также существенно (на 1980%) снижают урожайность. В таком материале количество крахмала может уменьшиться на 3-5%, а содержание витаминов — в 2-3 раза [4-7].
Основой современного элитного семеноводства картофеля в странах с развитой экономикой является получение качественного исходного оздоровленного материала на основе применения метода апикальной меристемы и клонального микроразмножения in vitro, что позволяет освободить от вирусной инфекции как новые, так и старые сорта [8-12].
В последние годы большое значение приобрела культура in vitro и для поддерживающей селекции картофеля. Создание банка здоровых сортов позволяет вовлечь в селекционный процесс родительские формы, свободные от вирусов, бактерий и грибов, и получать в результате скрещивания новые генотипы с высокими качественными характеристиками.
Одной из важнейших задач интенсивного семеноводства картофеля является ускоренное размножение оздоровленных клубней. В модульной технологии ускоренного размножения семенного картофеля сочетаются два взаимозависимых компонента современного семеноводства — освобождение клубней от инфекции и размножение полученного высококачественного материала с минимально возможным накоплением патогенов. Она может включать как все модули, так и часть из них.
Модуль I. Оздоровление исходного материала, размножение in vitro, получение меристемных пробирочных растений, получение мини-клубней.
Модуль II. Размножение оздоровленного материала на основе микроспорофита, а также управления процессом роста апикальной меристемы этиолированных побегов (патенты РФ №№ 2261587, 2365089 и 2415558).
Модуль III. Получение клубней с использованием ярусного способа размножения (оформлена заявка на изобретение).
Модуль IV. Использование агротехнических приемов для увеличения коэффициента размножения семенного материала в производственных условиях.
Основные принципы работы при поддержании банка здоровых сортов картофеля в полевой культуре и in vitro
В современной классификации семенного картофеля к категории исходного материала относится картофель, освобожденный от вирусной и других инфекций методами биотехнологии и клонового отбора. Применение биотехнологического метода заключается в использовании лабораторного способа оздоровления перспективных сортов и гибридов картофеля, получении новых линий in vitro и их ускоренном микрокло- нальном размножении. Преимущества данного метода по сравнению с традиционным клоновым отбором состоит в сокращении периода получения здоровых линий, их ускоренном микроклональном размножении в искусственных лабораторных условиях и производства необходимого количества мини-клубней. Однако применение исключительно биотехнологического метода, по мнению ряда исследователей, может привести к проявлению различных модификаций и соответственно сказаться на сортовой чистоте производимого семенного материала. Метаморфозы могут проявиться как при оздоровлении сортов, так и в результате их длительного депонирования in vitro.
Учитывая многолетнюю практику ведения работы в этом направлении, в настоящее время в условиях северной фитогигиены сформирован и поддерживается банк здоровых сортов картофеля (БЗСК) на основе полевой коллекции и в культуре in vitro. Поддержание и формирование БЗСК в полевой культуре проводится на базе АПК «Любовское» Приморского района Архангельской области, работа по оздоровлению сортов, введение в культуру ткани, получение исходного оздоровленного материала и его ускоренное размножение проводится во Всероссийском НИИ картофельного хозяйства им. А.Г.Лорха (ВНИИКХ), расположенном в Подмосковье.
Технологический процесс введения в культуру in vitro основан на применении метода ростовых черенков (рис.1). Подготовку образцов к введению в культуру начинают по мере прорастания клубней. Проросшие клубни нумеруют и индивидуально тестируют на наличие вирусной инфекции методом им- муноферментного анализа (ИФА). Клубни, свободные от фитопатогенной инфекции, размещают в темноте для получения этиолированных ростков. К черенкованию приступают при достижении ростков длиной не менее 10-20 см. Снятые с каждого клубня ростки индивидуально стерилизуют, в асептических условиях разрезают на черенки и размещают в пробирки с питательной средой.
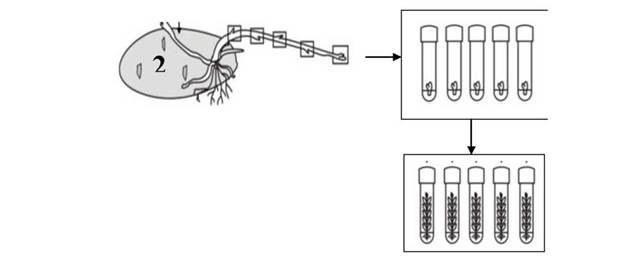
Рис.1. Применение метода ростовых черенков при введении новых линий в культуру ткани
Через 20-30 дней после введения в культуру ткани формируются растения с 5-6 листочками. При использовании метода ростковых черенков с одного клубня удается получить не более 10-15 микрорастений. Данный исходный материал проходит повторное тестирование на наличие скрытой зараженности. Свободные по результатам диагностики линии in vitro черенкуют, и часть микрорастений (10-15) поступают для формирования банка in vitro на основе БЗСК, остальные — для клонального микроразмножения, включения в семеноводческие программы и производства исходного материала в виде микрорастений.
Преимущество применяемого метода отбора базовых клонов с использованием многократного улучшающего отбора и ускоренного размножения оздоровленного исходного материала картофеля состоит в систематическом мониторинге качества сорто- образцов в полевых питомниках БЗСК и в культуре in vitro. Главным критерием оценки материала по сравнению с проведением отбора в питомниках первичного семеноводства (традиционный метод) является применение непрерывного многократного улучшающего отбора в питомниках БЗСК в сочетании с высокочувствительными диагностическими методами оценки материала на наличие фитопатогенной инфекции и получении здорового клубневого материала.
Получение здорового исходного материала на основе БЗСК и его ускоренное клональное микроразмножение в культуре in vitro позволяет с максимальной эффективностью поддерживать биологический потенциал сортов картофеля, сохранять типичность сортов на том уровне, на котором они были созданы селекционерами, и производить необходимый объем пробирочного материала для оригинального семеноводства.
В 2011 г. во время проведения Международной научно-практической конференции, посвященной 80- летию ВНИИКХ (12-14 июля), была осуществлена независимая экспертная оценка качества сортов и линий in vitro из БЗСК. Оздоровленный исходный материал ВНИИКХ в виде микрорастений был протестирован по шести основным вирусам картофеля представителями европейской компании Bioreba (Швейцария). Данная компания является одной их ведущих на европейском рынке по производству оборудования, реактивов и диагностике сельскохозяйственных культур на наличие патологий различного происхождения. По результатам проведенной экспертизы весь набор протестированных сортов и линий in vitro (94 образца) оказался свободным от вирусной инфекции. Проведенная экспертная оценка позволяет приравнивать полученный исходный материал из БЗСК к категории предбазисного (Pre-Basic Seed) семенного материала по стандарту ЕЭК ООН.
Исходный материал в виде микрорастений, полученных на основе полевого питомника БЗСК в 2010-2011 гг., был высажен в горшочной культуре в условиях защищенного грунта на экспериментальной базе ВНИИКХ «Апариха» Раменского района Московской области. Количественный выход миниклубней зависел от сортовых особенностей. Высоким коэффициентом размножения характеризовались сорта Жуковский ранний, Метеор, Брянский деликатес, Ильинский и Голубизна. При их возделывании в условиях защищенного грунта они образовали 6-8 миниклубней на одно растение.
Проведение лабораторного тестирования ИФА по листовым пробам в период вегетации микрорастений и послеуборочного зимнего клубневого контроля мини-клубней подтвердило высокое исходное качество производимого материала. По результатам диагностики исследуемые партии оказались свободными от вирусной инфекции.
В 2011 г. полученный урожай мини-клубней использовали для закладки питомника первого полевого поколения. Контроль качества производимой высокой категории семенного картофеля в период вегетации растений подтвердил надежное качество исходного материала, полученного на основе БЗСК.
Результаты исследований отражают преимущество применяемого метода отбора базовых клонов в полевом питомнике БЗСК с использованием многократного улучшающего отбора и ускоренного размножения оздоровленного исходного материала на основе БЗСК в культуре in vitro. Внедрение данного элемента технологии в семеноводство позволяет обеспечивать систематический мониторинг качества сортообразцов в полевых питомниках, в культуре in vitro и на первых этапах размножения семенного картофеля в оригинальном семеноводстве.
Использование микроспорофита в качестве единицы размножения
Потенциальные возможности вегетативного способа размножения клубней практически безграничны и лимитируются лишь факторами времени и возможностями материальной базы для процессов регенерации растений из частей клубня или побега, укоренения эксплантантов в субстрате и вегетации полученных организмов при формировании нового урожая.
Для изучения возможности укоренения непосредственно в субстрате элементов морфологии клубня, обладающих малой массой и размерами, нами были проведены опыты с апексами, протоспорофитами и микроспорофитами.
В качестве контроля использовали этиолированные ростки длиной 15-20 мм, у которых были сформированы корешки длиной 2-5 мм и более. Для получения апексов срезали верхушки этиолированных ростков длиной 4-5 мм и массой 0,03-0,09 г.
Протоспорофит получали посредством отчуждения зачатка бокового этиолированного побега с участком покровных тканей и основной паренхимы коры этиолированного побега предыдущего порядка. На протоспорофите отсутствовали корешки или корневые бугорки. Масса протоспорофита 0,05-0,2 г.
Микроспорофит получали так же, как и протоспорофит, однако в отличие от протоспорофита он имел 1-5 и более корешков длиной от 1 до 3 мм. Масса микроспорофита 0,09-0,3 г.
Анализируя качественные характеристики по- беговых фрагментов, представленных апексами и протоспорофитами, можно сказать, что они являют собой промежуточное звено между технологиями регенерации частей растений in vitro и укоренения ростковых микрофрагментов непосредственно в субстрате. Как исходный материал для культуры меристем они обладают слишком большими размерами (около 5 мм) и массой (0,05-0,2 г). Если же целью является размножение уже освобожденного от инфекции материала, то эффективность использования апексов и протоспорофитов слишком низка, так как их приживаемость непосредственно в субстрате (0,50,8%) не может быть признана достаточной для получения положительных конечных результатов. Попытки укоренения апексов и протоспорофитов показали, что длительность процесса формирования корневой системы превышает возможности поддержания их жизнеспособности. Недостаточное поступление влаги из субстрата приводит к увяданию, а затем высыханию тканей, что в итоге завершается их отмиранием. Увеличение же влажности воздуха создает гораздо большую опасность в связи с началом быстрого процесса побурения и загнивания паренхимных тканей стеблевой части апекса и протоспорофита.
Некоторые модификации микроспорофита обладают повышенной жизнеспособностью. При устойчивом функционировании даже одного корешка после высадки в субстрат у микроспорофита происходит быстрое формирование корневой системы. Анализ особенностей онтогенеза микроспорофитов показал, что после укоренения они обладали практически одинаковыми свойствами независимо от исходных данных (количества имеющихся корешков). Вместе с тем именно процесс укоренения качественно разделял исходные формы по их потенциальным возможностям.
Для ускоренного размножения возможно использование росткового микрофрагмента (микроспорофита), представляющего собой отделенный от этиолированного ростка зачаток бокового побега с участком покровных тканей и основной паренхимы коры этиолированного побега предыдущего порядка массой 0,09-0,3 г. Модификационный вариант микроспорофита с 5 и более корешками длиной от 1 до 3 мм обладает повышенной жизнеспособностью. За счет возможности получения большого количества микроспорофитов от одного материнского клубня коэффициент размножения превышает 1:300.
Ярусный способ размножения
Исследование проведено на опытном участке кафедры растениеводства ИСХПР НовГУ. Способ основан на стимуляции ветвления базовых ростков клубня картофеля до посадки с последующим увеличением зоны столоно- и клубнеобразования. Для подготовки клубней их апикальную часть надрезают и обрабатывают раствором тиомочевины. Проращива-
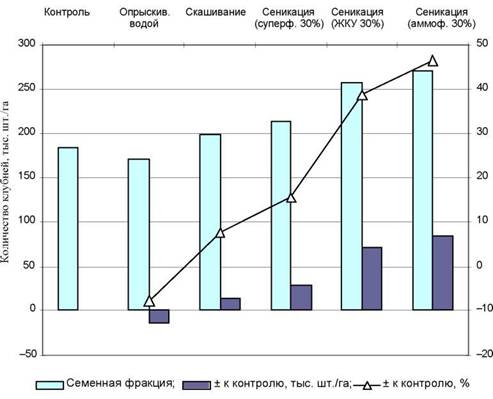
Рис.2. Влияние предуборочной обработки семенных участков на выход клубней семенной фракции (сорт Невский, среднее за 4 года; в варианте «Опрыскивание водой» — среднее за 3 года)
ние проводят в темноте при температуре 14-16°С и относительной влажности воздуха 90-95%. При формировании на базовых этиолированных ростках первого порядка 3-4 узлов проводят отчуждение апексов, что стимулирует ветвление побегов.
После посадки клубни присыпают перегнойной землей слоем 10 см, а по достижении высоты побегов 21-25 см над уровнем перегнойной земли побеги присыпают питательным субстратом разной плотности.
Подсыпку повторяют несколько раз по мере достижения высоты побегов 21-25 см над уровнем субстрата.
При подсыпке оставляют свободными над поверхностью субстрата вершины побегов длиной 1-5 см, а плотность субстрата уменьшают с каждой подсыпкой.
За счет многократного подсыпания субстрата происходит формирование клубней на вегетативных побегах растения, при этом коэффициент размножения в опытном варианте увеличивается до 30,9 против 21,7 на контроле.
Увеличение коэффициента размножения семенных клубней в производственных условиях за счет использования агротехнических приемов
Для увеличения коэффициента размножения на семенных участках применяют загущенную посадку клубней. Раннее удаление наземной массы способствует снижению инфицированности клубней, а также увеличивает удельный выход семенной фракции. За счет проведения сеникации можно в 1,6-1,7 раза увеличить количество клубней семенной фракции. В наших опытах с проведением предуборочной обработки максимальный эффект был получен с применением в качестве сениканта 30%-го раствора аммофоса (рис.2).
Существенно значимым показателем эффективности выращивания семенного картофеля является выход с гектара клубней семенной фракции не только в массе, но и в количественном выражении. Общее количество клубней, полученных на гектаре посадок, зависит от вида предуборочной обработки. Так, при проведении скашивания за 10 дней до уборки остановка в прибавлении массы привела к тому, что некоторые клубни достигли к моменту проведения обработки размеров и массы семенной фракции, в то время как на контроле рост их продолжался до параметров крупной (продовольственной) фракции.
В варианте с проведением обработки растений картофеля 30%-м настоем суперфосфата за 30 дней до уборки, а также при использовании в качестве се- никанта 30%-го раствора ЖКУ и 30%-го раствора аммофоса общее число клубней по сравнению с контролем возросло на 56,7-127,6 тыс. на одном гектаре. Некоторые зачатки клубней за счет интенсификации оттока пластических веществ из листьев и стеблей и вследствие этого быстрого роста увеличились в массе до параметров фракции мелких клубней (фуражной). По этой же причине часть клубней из фуражной фракции увеличила массу до фракции семенной.
Применение модульной технологии ускоренного размножения клубней картофеля при прочих равных условиях позволяет получить нужное количество посадочного материала в более короткие сроки и, следовательно, снизить уровень поражения клубней патогенами.
Список литературы
Анисимов Б.В. Качество семенного картофеля — на уровень мировых стандартов: Информ. бюл. М.: МСХ РФ, 2000. 20 с.
Шпаар Д., Иванюк В., Шуман П., Постиков А. и др. Картофель. Минск : ФУА информ, 1999. С.211-213.
Карманов С.Н., Коршунов В.П. Пути интенсификации картофелеводства. М., 1988. С.16-26.
Коршунов А.В., Анисимов Б.В. Семеноводство картофеля, контроль качества и сертификации / Россельхозака- демия, ВНИИКХ. М., 2003. 291 с.
Анисимов Б.В. Элитное семеноводство картофеля: обеспечение качества в процессе производства. Ситуация в России и международный опыт // Вопросы картофелеводства: Мат. науч.-практ. конф. «Научное обеспечение картофелеводства России: состояние, проблемы». Москва, 8-10 окт. 2001. М., 2001. С.19-35.
Анисимов Б.В. Сортовые ресурсы и передовой опыт семеноводства картофеля. М.: Росинформагротех, 2000. 148 с.
Жукова М.И. Борьба с вирусными болезнями в Белоруссии // Защита и карантин растений. 1998. №6. С.19-20.
Муромцев Г.С. Биотехнология в растениеводстве // Селекция и семеноводство. 1990. №4. С.2-9.
Трофимец Л.Н., Анисимов Б.В., Меличенко Г.И. Развитие безвирусного семеноводства картофеля // Селекция и семеноводство. 1990. №4. С.44-49.
Поспиши П.Ф. Методы биотехнологии в растениеводстве // Междунар. агропром. журн. 1989. №3. С.91-95.
Коршунов А.В. Картофелеводство должно развиваться интенсивно // Картофель и овощи. 1997. №2. С.2-4.
Волкова Р.И., Бурова В.В., Курлович М.М. Технология производства элиты картофеля, оздоровленного методом апикальных меристем // Разработки и совершенствование методов селекции первичного семеноводства картофеля: Сб. науч. тр. ЛСХИ. Л., 1988. С.110-114.