Национальные Рекомендации внок и оссн по диагностике и лечению хсн (второй пересмотр) рекомендации по лечению
СОДЕРЖАНИЕ: Беленков Ю. Н., Васюк Ю. А., Галявич А. С., Глезер М. Г., Даниелян М. О., Коц Я. И., Лазебник Л. Б., Лопатин Ю. М., Маколкин В. И., Мартынов А. И., Мартыненко А. В., Моисеев В. С., Ольбинская Л. И., Соколов Е. И., Сторожаков Г. И., Сидоренко Б. А., Терещенко С. Н., Фомин И. В., Шляхто Е. ВНациональные Рекомендации ВНОК и ОССН по диагностике и лечению ХСН (второй пересмотр)
РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ
Комитет по подготовке текста:
Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П., Коротеев А.В., Ревишвили А.Ш.
Комитет экспертов:
Беленков Ю.Н., Васюк Ю.А., Галявич А.С., Глезер М.Г., Даниелян М.О., Коц Я.И., Лазебник Л.Б., Лопатин Ю.М., Маколкин В.И., Мартынов А.И., Мартыненко А.В., Моисеев В.С., Ольбинская Л.И., Соколов Е.И., Сторожаков Г.И., Сидоренко Б.А., Терещенко С.Н., Фомин И.В., Шляхто Е.В.
Акчурин Р.C., Аронов Д.М., Барт Б.Я., Белоусов Ю.Б., Бойцов С.А., Васюк Ю.А., Волкова Э.Г., Гендлин Г.Е., Гиляревский С.Р., Голиков А.П., Голицин С.П., Гуревич М.А., Довгалевский П.Я., Задионченко В.С., Карпов Р.С., Карпов Ю.А., Кательницкая Л.И., Кобалава Ж.Д., Люсов В.А., Насонов Е.Л., Недогода С.В., Никитин Ю.П., Оганов Р.Г., Панченко Е.П., Перепеч Н.Б., Подзолков В.И., Поздняков Ю.А., Раков А.Л., Руда М.Я., Рылова А.К., Сидоренко Б.А., Симоненко В.А., Ситникова М.Ю., Староверов И.И., Сулимов В.А., Фомина И.Г., Чазова И.Е.
Введение
В короткой преамбуле хочется предпослать этому документу несколько определяющих позиций:
- Принятие в 2003 году съездом ВНОК национальных рекомендаций по диагностике и лечению ХСН позволили реально улучшить и унифицировать диагностику и лечение декомпенсации сердечной деятельности в России и приблизиться к международным стандартам и технологиям лечения, хотя на этом пути все еще имеется немало резервов.
- Рекомендации – не догма, а руководство к действию. Смысл рекомендаций: возможно более краткое по объему и насыщенное, конкретное по содержанию изложение принципов правильной диагностики и рационального лечения декомпенсации сердечной деятельности, ни в коем случае не подменяющих индивидуализированного подхода к каждому пациенту, опыта и возможностей каждого врача. Цель – дать докторам путеводную нить в море современных исследований (медицине, основанной на доказательствах), а не выстроить китайскую стену указаний, за которыми должна прятаться безынициативность и отсутствие клинического мышления.
- Учитывая, что ВНОК, его секция по СН и ОССН являются частью Европейского общества кардиологов, данные Российские рекомендации основываются на положениях Европейских рекомендаций (2005 г) [1], а также рекомендациях Американской коллегии кардиологов и Американской ассоциации сердца (2005 г) [2]. В дополнение учтены некоторые позиции Общества СН Америки (ОСНА) 2006 года, в частности касающиеся организации процесса лечения больных с ХСН [3]. Естественно, имеет место целый ряд уточнений, дополнений и изменений, учитывающих как национальные особенности, так и несколько отличную трактовку некоторых отнюдь не бесспорных положений крупных многоцентровых исследований.
- При подготовке первой версии Национальных Рекомендаций они были открыты для широкого обсуждения, что позволило существенно уточнить многие позиции, упростить и улучшить текст. Однако, как было объявлено секцией по СН ВНОК и ОССН, в быстро меняющемся мире необходим своевременный пересмотр текста рекомендаций каждые 2–3 года. В соответствии с этим представляется проект второго пересмотра Национальных Рекомендаций по диагностике и лечению ХСН 2006 года, который является эволюцией рекомендаций 2003 года [4].
- Мы попытались учесть многочисленные критические замечания, поступившие в ОССН уже после принятия первой версии 2003 года, а также в процессе открытого обсуждения проекта второго пересмотра Национальных Рекомендаций и те из них, которые были конструктивными и способствующими реальному улучшению документа, использованы при подготовке настоящего текста.
Эпидемиология СН в Российской Федерации
По данным эпидемиологических исследований последних 5 лет, проведенных в нашей стране, было выявлено, что:
- в 2002 году в РФ насчитывалось 8,1 миллионов человек с четкими признаками ХСН, из которых 3,4 миллиона имели терминальный, III–IV ФК заболевания [5];
- в 2003 году декомпенсация ХСН стала причиной госпитализаций в стационары, имеющие кардиологические отделения, почти каждого второго больного (49 %), а ХСН фигурировала в диагнозе у 92 % госпитализированных в такие стационары больных [6].
- У 4/5 всех больных с СН в России это заболевание ассоциируется с АГ и у 2/3 больных – с ИБС [5].
- Более чем 55 % пациентов с очевидной СН имеют практически нормальную сократимость миокарда (ФВ ЛЖ50 %) и число таких больных будет неуклонно увеличиваться [7, 8]
- Однолетняя смертность больных с клинически выраженной СН достигает 26–29 %, то есть за один год в РФ умирает от 880 до 986 тысяч больных СН [9].
Терминология, используемая при описании СН
Различают острую и хроническую СН. Под острой СН принято подразумевать возникновение острой (кардиогенной) одышки, связанной с быстрым развитием легочного застоя вплоть до отека легких или кардиогенного шока (с гипотонией, олигурией и т. д.), которые, как правило, являются следствием острого повреждения миокарда, прежде всего острого ИМ.
Чаще встречается хроническая форма СН, для которой характерны периодически возникающие эпизоды обострения (декомпенсации), проявляющиеся внезапным или, что бывает чаще, постепенным усилением симптомов и признаков ХСН. Данные Рекомендации посвящены в основном диагностике и лечению ХСН, определение которой приведено ниже.
Помимо острой и хронической, различают также систолическую и диастолическую СН. Традиционно СН и ее тяжесть ассоциируют со снижением сократительной способности сердца (систолическая СН), которую чаще оценивают по величине ФВ ЛЖ. Однако значительная часть больных с СН имеет нормальную или почти нормальную ФВ ЛЖ [10]. В таких случаях целесообразно говорить о СН с сохраненной систолической функцией (СН–ССФ). Частота встречаемости больных СН–ССФ зависит от тяжести обследуемой популяции и критериев оценки систолической функции. Так, среди тяжелых декомпенсированных стационарных больных с СН, доля СН–ССФ очень незначительна и как правило не превышает 20 % [11, 12]. Среди всех больных с диагнозом СН в стационарной и поликлинической практике доля СН–ССФ может достигать 30–50 % [10, 13]. В обсервационных популяционных исследованиях, например, в Российском исследовании ЭПОХА–О–ХСН [7] среди всех больных с СН, верифицированной по Фремингемским критериям, уже 56,8 % пациентов имели ФВ ЛЖ50 %, а 85,6 % – ФВ ЛЖ40 %. Близкие этим данные (84.1 %) были получены в другом Российском популяционном исследовании – IMPROVEMENT, в котором приняли участие 100 терапевтов из 10 городов РФ [14].
Патофизиология СН–ССФ, вероятно, гетерогенна. Более чем в 90 % случаев, особенно в старших возрастных группах, где высока доля пациентов с повышенной жесткостью миокарда, с АГ и гипертрофией ЛЖ, СД, СН–ССФ может быть обусловлена собственно диастолической дисфункцией [15], но у отдельных пациентов также быть связана с повышенной жесткостью артериального сосудистого русла. Наличие у больного с СН–ССФ подтвержденных объективными методами диастолических расстройств позволяет говорить о нем, как о больном с диастолической СН (ДСН), а при абсолютно нормальных показателях сократимости – как о больном с изолированной ДСН.
Следует учесть, что если ДСН бывает изолированной, то систолическая СН, как правило, протекает не только с систолическими, но и с диастолическими расстройствами [16], т. е. чаще носит смешанный характер.
С патофизиологической точки зрения при повреждении миокарда нарушение диастолического расслабления обычно предшествует нарушению систолы, которое присоединяется позже, но именно появление (в дополнение к диастолическим расстройствам) систолической дисфункции часто манифестирует клиническую картину СН.
Среди других терминов встречается деление ХСН на право– и левожелудочковую, в зависимости от преобладания застойных явлений в малом или большом круге кровообращения; ХСН с низким или высоким сердечным выбросом: следует помнить, что высокий СВ встречается при ряде заболеваний (тиреотоксикозе, анемии, и др.), не имеющих прямого отношения к повреждению миокарда; антеградную (forward failure) и ретроградную (backward failure) формы СН, определяемые неспособностью сердца прокачивать кровь в артериальное русло или откачивать кровь из венозного русла, соответственно. Последние три варианта деления ХСН носят описательный характер, в связи с чем не рекомендуется использование этих терминов при формулировании диагноза и в других документах, используемых для отчетности, статистики и т. д.
В отечественной практике часто используются термины застойная СН – ЗСН и хроническая недостаточность кровообращения – ХНК, которые нередко конкурируют с термином ХСН, что и продолжает оставаться предметом дискуссий. По сути, ЗСН является синонимом клинически выраженной ХСН с отчетливой симптоматикой застоя жидкости. Термин ХНК, предложенный А. Л. Мясниковым и получивший распространение только в нашей стране, также можно рассматривать как синоним ХСН, поскольку оба термина фактически призваны обозначить одно и то же заболевание. В этой связи (исключительно для унификации терминологии) также рекомендуется не применять термины ЗСН и ХНК при формулировании диагноза и в других документах, используемых для отчетности, статистики и т. д.
Определение ХСН
К настоящему времени было предложено несколько патофизиологических определений ХСН, однако все они имеют один общий недостаток – акцентирование внимания на отдельной стороне этого сложного явления (табл. 1).
Таблица 1. Патофизиологические определения ХСН.
| Годы |
Определение ХСН как… |
Модель патогенеза |
| 1908 J. MacKenzie |
…следствие истощения резервной силы сердечной мышцы… |
Кардиальная (сердце-насос) |
| 1964 А.Л. Мясников |
…следствие ослабления сократительной способности сердечной мышцы… |
|
| 1978 P. Poole-Wilson |
…совокупность гемодинамических, почечных, нервных и гормональных реакций… |
Кардио-ренальная (сердце, почки) |
| 1982 J. Cohn |
… заболевание, вовлекающее сердце, периферические сосуды, почки, симпатическую нервную систему, ренин-ангиотензиновую систему… |
Циркуляторная (периферические сосуды) |
| 1989 E. Braunwald |
…комплекс гемодинамических и нейрогуморальных реакций на дисфункцию сердца… |
Нейрогуморальная (РААС, САС) |
Формулировка, данная в Европейских рекомендациях по диагностике и лечению ХСН, определяет СН как патофизиологический синдром, при котором в результате того или иного заболевания сердечно–сосудистой системы происходит снижение насосной функции, что приводит к дисбалансу между гемодинамической потребностью организма и возможностями сердца. Современная нейрогуморальная модель патогенеза доказала, что развитие ХСН происходит по единым патофизиологическим законам вне зависимости от этиологии повреждения. С клинической точки зрения это дает формальные основания обозначить ХСН не только как сложный симптомокомплекс, осложняющий течение того и ли иного заболевания сердечно–сосудистой системы, но и как самостоятельную нозологическую форму.
Таким образом, с современных клинических позиций ХСН представляет собой заболевание с комплексом характерных симптомов (одышка, утомляемость и cнижение физической активности, отеки и др.), которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме.
Первопричиной является ухудшение способности сердца к наполнению или опорожнению, обусловленное повреждением миокарда, а также дисбалансом вазоконстрикторных и вазодилатирующих нейрогуморальных систем.
1. Принципы диагностики ХСН
Постановка диагноза ХСН возможна при наличии 2–х ключевых критериев (табл. 2):
- характерных симптомов СН (главным образом, одышки, утомляемости и ограничении физической активности, отеков лодыжек);
- объективного доказательства того, что эти симптомы связаны с повреждением сердца, а не каких–либо других органов (например, с заболеваниями легких, анемией, почечной недостаточностью).
Таблица 2. определение ХСН. Наличие критериев 1 и 2 обязательно во всех случаях
| 1 |
Наличие симптомов и / или клинических признаков СН (в покое или при нагрузке) |
| 2 |
Наличие объективных признаков дисфункции cердца (в покое) |
| 3 |
Положительный ответ на терапию ХСН |
Следует подчеркнуть, что симптомы ХСН могут присутствовать в покое и / или при нагрузке. В то же время объективные признаки дисфункции сердца должны обязательно выявляться в покое. Это связано с тем, что появление такого признака (например, низкой ФВ ЛЖ) на нагрузке (например, у больного ИБС) может быть признаком не СН, а коронарной недостаточности. По аналогии с ФВ ЛЖ, это касается и других объективных признаков повреждения миокарда.
В сомнительных случаях подтверждением диагноза СН может служить положительный ответ на терапию, в частности, на применение диуретиков.
При установлении диагноза ХСН следует уточнить причину ее развития, а также факторы и возможные сопутствующие заболевания, провоцирующие декомпенсацию и прогрессирование ХСН.
СН может развиться в результате различных заболеваний сердечно–сосудистой системы – поражения миокарда любой этиологии, нарушений ритма и проводимости сердца, патологии клапанов, заболеваний перикарда и т. д.
Самыми частыми причинами ХСН в Европе и в России в последние годы стали ИБС и ИМ, которые встречаются у 60–70 % стационарных больных и ассоциируются прежде всего с нарушением систолической функции ЛЖ. Среди других причин развития ХСН следует отметить также дилатационную кардиомиопатию, ревматические пороки сердца. В старших возрастных группах (старше 60 лет) в основе развития СН наряду с ИБС ведущую роль приобретает АГ и гипертоническое сердце, связанные, в первую очередь, с развитием диастолических нарушений, чему способствует также возрастное уменьшение мышечного элемента и повышенное отложение фиброзной ткани в миокарде пожилых. Третьей важнейшей причиной ХСН и также в старших возрастных группах является СД 2 типа, который вместе с АГ определяет все возрастающии количество пациентов с ХСН – ССФ [6, 7, 17–19].
В ряде случаев своевременная диагностика причины декомпенсации и специфическое воздействие на нее позволяет существенно (а иногда и радикально) воздействовать на развитие и прогрессирование СН: например, своевременное оперативное устранение порока сердца или восстановление синусового ритма у больных с тахиформой мерцательной аритмии устраняют субстрат для возникновения (прогрессирования) ХСН.
Важно выявить потенциально обратимые факторы развития и прогрессирования ХСН.
Понятно, что ИБС и перенесенный ИМ сопряжены с необратимыми изменениями миокарда и представляют собой постоянный субстрат для развития и прогрессирования СН. Однако нередко развитие симптомов СН происходит при отсутствии значимого поражения сердечной мышцы под влиянием так называемых обратимых факторов, которые могут провоцировать появление / усугубление симптомов и / или признаков СН, даже при отсутствии миокардиальной дисфункции. Профилактика, выявление и устранение таких факторов являются важнейшими диагностической и лечебной задачами.
К таким факторам можно отнести транзиторную ишемию миокарда, тахи–брадиаритмии, тромбоэмболии легочной артерии, увеличение митральной регургитации, дисфункцию почек, патологию щитовидной железы, побочные эффекты лекарственных средств, чрезмерное употребление поваренной соли и воды. Особо важную роль для России с ее холодным климатом и неразвитой системой сезонных профилактик имеет такой фактор, как респираторная инфекция и другой традиционный фактор – злоупотребление алкоголем. Вклад злоупотребления алкоголем в заболеваемость ХСН обычно недооценивается; относительно инфекций известно, что каждая четвертая декомпенсация сердечной деятельности происходит на фоне простудных заболеваний.
Роль симптомов и объективных признаков в диагностике ХСН
По данным исследования ЭПОХА–О–ХСН, средние цифры АД во всей популяции больных с ХСН превышают 150 / 90 мм рт. ст. Наличие повышенных цифр АД не противоречит диагнозу ХСН, поскольку в общей практике сопутствующая АГ является, скорее, правилом, чем исключением. И лишь у больных с клинически выраженной декомпенсацией, особенно на конечных стадиях болезни, АД снижается, вплоть до тяжелой гипотонии.
Опорными точками в постановке диагноза ХСН являются: (1) характерные симптомы СН или жалобы больного; (2) данные физикального обследования (осмотр, пальпация, аускультация) или клинические признаки; (3) и данные объективных (инструментальных) методов обследования (табл. 3).
Таблица 3. Критерии, используемые при определении диагноза ХСН.
| I. Симптомы (жалобы) |
II. Клинические признаки |
III. Объективные признаки дисфункции сердца |
|
|
|
| * – в сомнительных случаях – эффективность лечения (ex juvantibus) |
||
Значимость симптомов и клинических признаков чрезвычайно велика, поскольку именно они заставляют врача подозревать наличие у больного СН.
По данным исследования IMPROVEMENT (2000г.), самые частые жалобы больных с ХСН – одышка и быстрая утомляемость (98,4 и 94,3 %, соответственно). Третьим по частоте симптомом является сердцебиение (80,4 %), а такие классические симптомы застоя, как периферические отеки, кашель, хрипы в легких и ортопное вместо ожидаемых высоких мест занимают в списке более скромные позиции – лишь с четвертой по седьмую (с 73 % до 28 %).
Важно отметить, что практически все симптомы и клинические признаки, даже классическая триада – одышка, отеки ног и влажные хрипы в легких, не говоря уже об утомляемости и сердцебиении, нередко встречаются и при других заболеваниях или нивелируются проводимым лечением, что делает их малочувствительными и / или низкоспецифичными для диагностики ХСН (табл. 4).
Таблица 4. Чувствительность, специфичность и предсказующее значение основных клинических симптомов при ХСН.
| Симптомы и признаки |
Чувствительность (%) |
Специфичность (%) |
Предсказующее значение (%) |
| Одышка |
66 |
52 |
23 |
| Ночное удушье |
33 |
76 |
26 |
| Ритм галопа (S3) |
31 |
95 |
61 |
| Отек легких |
23 |
80 |
22 |
| Ортопноэ |
21 |
81 |
2 |
| Хрипы в легких |
13 |
91 |
27 |
| Периферические отеки |
10 |
93 |
3 |
| Пульсация яремных вен |
10 |
97 |
2 |
| Тахикардия (100 уд / мин) |
7 |
99 |
6 |
| ФВЛЖ 45 % |
66 |
- |
- |
| Кардиомегалия |
62 |
67 |
32 |
| Rh признаки застоя |
50 |
- |
- |
| ДЗЛЖ 22 мм Hg |
42 |
- |
- |
| Harlan W. R. et al., 1977; Aguirre F. V., 1989; Chakko S., 1992 |
|||
Бесспорно, наличие сразу нескольких признаков СН, таких как, например, латеральное смещение верхушечного толчка, отеки, пульсация яремных вен и четко различимый третий тон, на фоне характерных жалоб делает диагноз ХСН высоко вероятным. Тем не менее, на основании одного лишь клинического осмотра бывает невозможно прогнозировать эффективность того или иного лечения. Помимо этого, всегда следует учитывать элемент субъективизма врачебной оценки, а также нерешительность многих врачей в вопросе выставления окончательного диагноза.
Поэтому в каждом случае предварительный диагноз ХСН должен быть подтвержден объективными методами, и прежде всего теми, которые позволяют оценить состояние сердца.
Электрокардиография
Это самый доступный инструментальный метод, позволяющий объективно оценить состояние сердца.
Дисфункция миокарда, так или иначе всегда найдет отражение на ЭКГ: нормальная ЭКГ при ХСН – исключение из правил (отрицательное предсказующее значение 90 %).
По данным исследования ЭПОХА–О–ХСН, наиболее частым отклонением от нормы на стандартной ЭКГ у больных ХСН являются признаки гипертрофии ЛЖ (ГЛЖ) и отклонение электрической оси сердца влево, которые встречаются у 50–70 % обследованных. Преобладание этих ЭКГ признаков может быть проявлением того, что АГ является одной из частых причин или одним из частых сопутствующих заболеваний у больных с СН.
Наиболее важными для объективизации ХСН служат: признаки рубцового поражения миокарда, блокада левой ножки пучка Гиса (ЛНПГ) при ИБС, как предикторы низкой сократимости ЛЖ; ЭКГ признаки перегрузки левого предсердия (ЛП) и ГЛЖ – свидетельство как систолической, так и диастолической дисфункции (но при низкой прогностической ценности); диагностика аритмий, особенно мерцательной аритмии (МА) – частой причины декомпенсации; ЭКГ признаки электролитных расстройств и медикаментозного влияния.
Диагностическая значимость данных ЭКГ возрастает при наличии клинических признаков ХСН и особенно ЭхоКГ признаков дисфункции миокарда. Повторная регистрация ЭКГ необязательна при отсутствии изменений клинического состояния.
Суточное мониторирование ЭКГ (Холтеровское мониторирование)
Стандартное Холтеровское мониторирование ЭКГ имеет диагностический смысл лишь в случае наличия симптоматики, вероятно, связанной с наличием аритмий (субъективных ощущений перебоев, сопровождающихся головокружениями, обмороками, синкопэ в анамнезе и др.)
Холтеровское мониторирование позволяет судить о характере, частоте возникновения и продолжительности предсердных и желудочковых аритмий, которые могут вызывать появление симптомов СН или усугублять ее течение. Более того, обнаружение асимптоматических желудочковых нарушений ритма сердца даже высоких градаций не служит основанием для инициации антиаритмической терапии или отбора кандидатов на постановку электрокардиостимулятора.
Вариабельность ритма сердца
Вариабельность ритма сердца (ВСР) не является обязательной методикой для диагностики ХСН, поскольку клиническая значимость этого метода пока еще до конца не определена. Было показано существование корреляции между параметрами ВРС, с одной стороны, и клиническими и гемодинамическими показателями, с другой. При этом параметры ВСР предсказывали выживаемость вне зависимости от клинических и гемодинамических данных.
Гематологический и биохимический анализы крови и общий анализ мочи
Стандартный диагностический набор лабораторных исследований у пациента с СН должен включать определение уровня гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, концентрации электролитов плазмы, креатинина, глюкозы, печеночных ферментов и общий анализ мочи.
Также по мере необходимости возможно определение уровня С–реактивного белка (исключение воспалительной этиологии заболевания сердца), тиреотропного гормона (исключение гипер– или гипотиреоза), мочевины и мочевой кислоты плазмы. При резком ухудшении состояния пациента целесообразно оценить содержание кардиоспецифических ферментов с целью исключения острого ИМ.
Анемия относится к фактору, усугубляющему течение ХСН. Повышенный гематокрит может свидетельствовать о легочном происхождении одышки, а также быть следствием цианотических пороков сердца или легочной артерио–венозной фистулы.
Повышение уровня креатинина у больного ХСН может быть:
- связано с первичной патологией почек;
- следствием сопутствующего заболевания или состояния (АГ, СД, пожилой возраст);
- следствием СН (гипоперфузия почки, застойная почка);
- связано с избыточным приемом диуретиков и / или иАПФ.
В таблице 5 представлена формула расчета клиренса креатинина (КК) – показателя, более точно, чем сывороточный креатинин, определяющего функциональное состояние почек.
Таблица 5. расчет клиренса креатинина согласно модифицированному уравнению Cockroft и Gault
| КК = (140 – возраст) x масса (кг) 22 / креатинин плазмы (мкмоль / л) |
| *У женщин полученное значение следует уменьшить на 15% |
При застое крови в печени может наблюдаться повышение активности печеночных ферментов.
Проведение анализа мочи целесообразно для выявления протеинурии и глюкозурии, что позволит сделать заключение о возможном наличии независимой первичной почечной патологии или СД – состояний, провоцирующих развитие или усугубляющих течение СН.
Гипонатриемия и признаки дисфункции почек при СН указывают на неблагоприятный прогноз.
Эхокардиография
Это визуализирующая методика, которой отводится первостепенная роль в диагностике ХСН в силу простоты выполнения, безопасности и повсеместной распространенности.
ЭхоКГ позволяет решить главную диагностическую задачу – уточнить сам факт дисфункции и ее характер, а также провести динамическую оценку состояния сердца и гемодинамики (табл. 6).
Таблица 6. Возможности ЭхоКГ и допплер-ЭхоКГ в диагностике ХСН.
| Уточнение причины и осложняющих моментов: |
Оценка в покое и динамике: |
|
|
Важнейшим гемодинамическим параметром является ФВ ЛЖ, отражающая сократительную способность миокарда ЛЖ.
Определение ФВ ЛЖ позволяет дифференцировать пациентов с систолической дисфункцией от тех, у кого систолическая функция сохранена. В качестве показателя, с высокой вероятностью свидетельствующего о сохранности систолической функции, можно рекомендовать уровень ФВ ЛЖ 50 %, подсчитанный методом 2–х мерной ЭхоКГ по Simpson. Степень снижения ФВ ЛЖ ассоциируется с выраженностью систолической дисфункции, используется для определения риска оперативного лечения; динамика ФВ ЛЖ является показателем прогрессирования заболевания и эффективности терапии, низкая ФВ ЛЖ является маркером негативного прогноза.
Популярное в нашей стране вычисление ФВ ЛЖ с использованием формулы Teiccholz по данным М–модальной ЭхоКГ при сферичной форме ЛЖ или нарушении локальной сократимости часто оказывается не точным. Вычисление ФВ ЛЖ с помощью 2х–мерной ЭхоКГ (модифицированный метод Симпсона) отличается достаточно высокой точностью, однако зависит от четкости визуализации эндокардиальной поверхности ЛЖ. В раннем постинфарктном периоде или в условиях явной митральной регургитации величина ФВ ЛЖ не совсем точно отражает истинную степень систолической дисфункции.
Важно помнить, что нормальная ФВ ЛЖ не исключает наличия СН. Следует помнить, что в российской популяции более половины всех пациентов с СН имеют показатель ФВ ЛЖ50 %.
При подозрении на СН наряду с определением ФВ ЛЖ оценивается состояние диастолической функции ЛЖ.
Оценка диастолической функции ЛЖ
Для суждения о наличии и степени тяжести диастолической дисфункции ЛЖ используется комбинированная оценка трансмитрального диастолического потока (ТМДП) и скорости движения митрального кольца. Выделяют три типа наполнения ЛЖ: с замедленной релаксацией, псевдонормальный и рестриктивный, которые соответствуют незначительной, умеренной и тяжелой диастолической дисфункции (табл. 7).
Таблица 7. Стадии диастолической дисфункции (по данным ЭхоКГ)
| Норма |
Замедленная релаксация |
Псевдонормализация |
Рестрикция |
|||
| Молодые |
Взрослые |
Пожилые |
||||
| Стадия |
- |
- |
- |
I |
II |
III |
| E/A |
1 (часто 2) |
1 |
1 |
1 |
1–2 |
2 |
| DT, мсек |
220 |
220 |
220 |
220 |
150–200 |
150 |
| ВИВР, мсек |
70–100 |
70–100 |
70–100 |
100 |
70–100 |
70 |
| S/D |
1 |
1 |
1 |
1 |
1 |
1 |
| Ar, см/сек |
35 |
35 |
35 |
35 |
35 |
25 |
| VP, см/сек |
55 |
55 |
55 |
55 |
45 |
45 |
| Em, см / сек |
10 |
8 |
8 |
8 |
8 |
8 |
| Условные обозначения: ВИВР – время изоволюметрического расслабления ЛЖ; Em – подъем основания ЛЖ во время раннего наполнения ЛЖ; Ar – максимальная скорость диастолического ретроградного кровотока в легочных венах; DT – время замедления кровотока раннего диастолического наполнения ЛЖ; E/A – соотношение скоростей раннего диастолического наполнения и наполнения в систолу предсердий; S/D – соотношение максимальных скоростей систолического и диастолического антеградного кровотока в легочных венах; VP – скорость распространения раннего диастолического кровотока в ЛЖ |
||||||
Рабочей группой Европейского общества кардиологов предлагаются следующие ультразвуковые диагностические нормативы определения диастолической дисфункции:
- Увеличение времени изоволюмического расслабления ЛЖ: ВИВР 30л 92 ms, ВИВР 30–50л 100 ms, ВИВР50 л 105 ms
- Замедление заполнения ЛЖ в раннюю диастолу: E / A50 л 1,0 и DT 50 л 220 ms; E / A50 л 0,5 и DT50 л 280 ms и / или S / D 50 л 1,5; S / D 50 л 2,5
- Уменьшение диастолической растяжимости (податливости) камеры ЛЖ PV – A 35 cm. s–1 и / или PV–AtМК – At + 30 ms, где МК–At – длительность предсердной А–волны ТМДП.
Для диагностики первичной диастолической СН требуются три условия:
- Наличие симптомов и признаков СН.
- Нормальная или незначительно нарушенная систолическая функция ЛЖ (ФВ ЛЖ 50 %).
- Выявление нарушения релаксации ЛЖ и / или его растяжимости.
Индексы заполнения ЛЖ и легочного венозного потока крайне вариабельны, поскольку находятся под влиянием целого ряда физиологических параметров, таких как скорость релаксации, податливость стенки, ЧСС, возраст пациента и величина давления заполнения ЛЖ. Помимо этого, интерпретация результатов может быть затруднена из–за недостаточно качественного изображения потоков и просто невозможна из–за наличия аритмии, особенно мерцательной. В целях более четкой интерпретации допплеровских спектров предлагаются новые методические подходы, например, использование холодовой или изометрической нагрузочных проб, или определение диастолического заполнения ЛЖ в цветном М–модальном режиме и скоростей движения стенки миокарда с помощью цветного тканевого допплеровского режима. Однако говорить о создании достоверных универсальных ультразвуковых критериев диагностики диастолической дисфункции представляется преждевременным.
Выявление нарушений диастолического наполнения сердца важно не только для определения патогенеза СН: доказано, что расстройства диастолы более тесно, чем расстройства систолы, ассоциируются с тяжестью клинического состояния пациентов, степенью снижения толерантности к нагрузкам, качеством жизни. Динамика диастолических параметров может служить критерием эффективности лечения и маркером прогноза больных ХСН.
Повторное выполнение ЭхоКГ исследования показано в случае значимого изменения клинического статуса пациента, что может свидетельствовать об утяжелении дисфункции сердца или, наоборот, об улучшении ситуации.
Чреспищеводная ЭхоКГ
Чреспищеводная ЭхоКГ не должна рассматриваться в качестве рутинного диагностического метода; к ней обычно прибегают лишь в случае получения недостаточно четкого изображения при трансторакальном доступе, осложненном клапанном поражении, подозрении на неисправность протеза митрального клапана, для исключения тромбоза ушка левого предсердия при высоком риске тромбоэмболий.
В случае недостаточной информативности ЭхоКГ, выполненной в условиях покоя, а также при ИБС (например, при наличии тяжелой или рефрактерной СН в сочетании с ИБС) можно рассмотреть целесообразность проведения дополнительных исследований.
Стресс–ЭхоКГ
Нагрузочная или фармакологическая стресс–ЭхоКГ является высокоинформативной методикой для уточнения ишемической или неишемической этиологии СН, а также для оценки эффективности лечебных мероприятий (реваскуляризации, медикаментозного восстановления сократительного резерва). Однако, несмотря на высокую чувствительность и специфичность этой методики для выявления жизнеспособного миокарда у пациентов с ИБС и систолической СН, она не может быть рекомендована в качестве метода рутинной диагностики.
Магнитно–резонансная томография
Магнитно–резонансная томография (МРТ) – наиболее точный метод с максимальной воспроизводимостью расчетов по вычислению объемов сердца, толщины его стенок и массы ЛЖ, превосходящий по этому параметру ЭхоКГ и РИА. Помимо этого, метод позволяет выявлять утолщение перикарда, оценивать протяженность некроза миокарда, состояние его кровоснабжения и особенности функционирования. При этом, учитывая высокую стоимость и малую доступность, проведение диагностической МРТ оправдано только в случаях недостаточно полной информативности прочих визуализирующих методик.
Радиоизотопные методы
С помощью радиоизотопной ангиографии (РИА) можно довольно точно оценить ФВ ЛЖ, объемы камер сердца, а также динамику диастолического наполнения ЛЖ. Однако при мерцательной аритмии точность всех этих расчетов уменьшается. Тем не менее, воспроизводимость результатов РИА превосходит таковую при ЭхоКГ.
Оценка функции легких
Данный тест полезен для исключения легочного генеза одышки. При ХСН параметры пиковой объемной скорости экспираторного потока (PEFR) и FEV1 могут быть снижены, однако не до такой степени, как при симптоматических обструктивных дыхательных заболеваниях. Определение прочих параметров функции легких с целью диагностики СН и оценки динамики течения заболевания не имеет большого смысла.
Нагрузочные тесты
Проведение нагрузочных тестов у пациентов с ХСН оправдано не для диагностики, а с целью оценки функционального статуса пациента и эффективности лечения, а также для определения степени риска. Тем не менее нормальный результат нагрузочного теста у пациента, не получающего специфического лечения, практически полностью исключает диагноз ХСН.
У пациентов с ХСН оправдано длительное выполнение нагрузки (8–12 мин до достижения критериев остановки) с минимальным приростом нагрузки при переходе от одной ступени к другой. С этой целью лучше всего использовать нагрузки, моделирующие постепенное увеличение крутизны наклона условной дистанции (тредмил или велоэргометр), особенно под контролем показателей газообмена (спироэргометрия).
Потребление кислорода на максимуме нагрузки (VO2max ) более точно отражает толерантность к нагрузкам и ФК ХСН, нежели любой другой показатель, в том числе время нагрузки или выполненный объем работы (табл. 8). Величина VO2max 10 мл • кг-1 • мин-1 указывает на высокий прогностический риск, в то время как 18 мл • кг-1 • мин-1 соответствует минимальному риску.
Таблица 8. Параметры физической активности и потребления кислорода у больных с различными ФК ХСН (по NYHA)
| ФК ХСН по NYHA |
Дистанция 6-минутной ходьбы, м |
Потребление кислорода, (VO 2 max ) мл x кг -1 x мин -1 |
| 0 |
551 |
22,1 |
| 1 |
426–550 |
18,1–22,0 |
| 2 |
301–425 |
14,1–18,0 |
| 3 |
151–300 |
10,1–14,0 |
| 4 |
150 |
10 |
В рутинной практике и при отсутствии специального оборудования для оценки физической толерантности и объективизации функционального статуса больных ХСН можно использовать тест ходьбы в течение 6 минут, соответствующий субмаксимальной нагрузке. Условия проведения этой пробы крайне просты: размеченный через 1 метр коридор, часы с секундной стрелкой и четкое объяснение задачи больному: он должен пройти по этому коридору в приемлемо быстром для него темпе максимальную дистанцию за 6 минут (если больной остановится для отдыха, затраченное на это время включается в общий зачет). Данные исследований свидетельствуют о высокой корреляционной связи теста с ФК ХСН и прогностической значимости: пройденная дистанция 300 м соответствует неблагоприятному прогнозу.
Проведение нагрузочных тестов у пациентов с ХСН достаточно безопасно и не сопряжено с риском развития серьезных осложнений.
Рентгенография органов грудной клетки
К сожалению, рентгенография органов грудной клетки имеет высокую вариабельность и низкую воспроизводимость.
Главное внимание при подозрении на ХСН следует уделять кардиомегалии (кардио–торакальный индекс 0 %) и венозному легочному застою. Кардиомегалия – свидетельство вовлеченности сердца в патологический процесс. Наличие венозного застоя и его динамика могут быть использованы для характеристики тяжести заболевания и служить объективным критерием эффективности терапии.
По данным исследования ЭПОХА–О–ХСН, наиболее частой находкой при рентгенологическом исследовании грудной клетки является увеличение ЛЖ, которое встречается у 18– 36 % больных и может косвенно свидетельствовать о высокой распространенности ГЛЖ среди больных с ХСН.
Кардиомегалия, венозный легочный застой, альвеолярный и интерстициальный отек – признаки низкой ФВ и / или высокого давления заклинивания легочной артерии (ДЗЛА), однако эти выводы требуют подтверждения другими методами (например, ЭхоКГ). Следует помнить, что нормальные размеры сердца не исключают наличия диастолических расстройств, как причины ХСН.
Результаты рентгенологического исследования грудной клетки всегда трактуются в контексте клиники ХСН и ЭКГ.
Определение уровня натрий–уретических пептидов
- В настоящее время полностью доказана тесная связь между тяжестью сердечной дисфункции (прежде всего, ЛЖ) и содержанием натрий–уретических пептидов (НУП) в плазме, что позволяет рекомендовать определение концентрации этих пептидов в качестве лабораторного теста ХСН.
В настоящее время наиболее полно охарактеризованы N–концевой предсердный натрий–уретический пептид (ПНП), мозговой натрий–уретический пептид (МНУП или BNP) и его предшественник, N–концевой МНУП (NT–pro BNP).
Определение НУП (МНУП, NT–pro BNP) позволяет:
- проводить эффективный скрининг среди ранее нелеченных больных, подозрительных в плане наличия дисфункции ЛЖ
- проводить дифференциальную диагностику сложных форм ХСН (диастолической, асимптоматической)
- точно оценивать выраженность ЛЖ дисфункции
- определять показания к терапии ХСН и оценивать ее эффективность
- оценивать долгосрочный прогноз ХСН
Показано, что наиболее оправданным с клинической точки зрения представляется использование этого теста не столько для подтверждения, сколько для исключения диагноза сердечной недостаточности, поскольку тест обладает исключительно высокой отрицательной прогностической ценностью: низкий уровень НУП имеет отрицательное предсказующее значение 90%: т.е. при нормальном уровне НУП вероятность ХСН у нелеченных больных близка к 0. Известно, что нормальный уровень НУП зависит от возраста, пола обследуемого, методики измерения и т.д. и в Европейской популяции составляет 0,5–30 pg/ml.
Для учреждений первичной медицинской помощи и поликлиник первым диагностическим шагом при подозрении на сердечную недостаточность уже сейчас можно рассматривать определение содержания НУП, и только в случае обнаружения повышенного их содержания (для МНУП100 pg/ml; для NT– pro BNP125 pg/ml1) пациент должен пройти ЭхоКГ или любое другое исследование по оценке функции сердца. При содержании пептидов менее указанной величины следует рассмотреть другие причины одышки.
Следует помнить, что уровень НУП может быть повышен и при ряде других сердечно–сосудистых патологий (гипертрофии ЛЖ, поражении клапанов сердца, ишемии миокарда, артериальной гипертонии, тромбоэмболии лёгочной артерии).
Оценка тяжести ХСН
Классификация ХСН
Классификация ХСН (см. также приложение 1 и разъяснения по терминам в классификации), предложенная ОССН и утвержденная Российским съездом кардиологов в 2003 году предусматривает объединение существующей по настоящее время классификации стадий ХСН Стражеско–Василенко и ФК NYHA.
Стадийность болезни (поражения сердца), которая может усугубляться со временем, несмотря на проводимое лечение, не связана напрямую с ФК (способностью пациентов к выполнению нагрузок, т.е. физической активности). Классификация ОССН (2002 г.) подразумевает выделение врачом стадии болезни (степени поражения сердца) и ФК (динамической способности больных к активности). Выставление в диапазоне стадии ХСН и ФК позволяет разделить тяжесть болезни и субъективное самочувствие пациента. Таким образом стадия болезни и ФК, как правило не параллельны. Приведем некоторые примеры: больной с тяжелыми расстройствами гемодинамики и дезадаптивным ремоделированием сердца и сосудов, соответствующим IIБ стадии, на фоне адекватного лечения способен выполнять нагрузку на уровне II ФК NYHA. При ухудшении состояния может отмечаться прогрессирование как стадии (например, до III ст.), так и ФК ХСН (например, до III ФК). Наоборот, на фоне относительно мало измененных сердца и сосудов, соответствующих IIА стадии, если больной не лечен и поэтому декомпенсирован, то функционально он может соответствовать и IV ФК ХСН. Адекватная терапия может улучшить состояние больного и, несмотря на сохранение IIA стадии, его ФК может уменьшиться вплоть до I ФК ХСН.
Шкала оценки клинического состояния при ХСН (ШОКС) (табл. 9)
Таблица 9. Шкала оценки клинического состояния при ХСН (ШОКС) (модификация Мареева В. Ю., 2000)
| 1. Одышка: 0 – нет, 1 – при нагрузке, 2 – в покое |
| 2. Изменился ли за последнюю неделю вес: 0 – нет, 1 – увеличился |
| 3. Жалобы на перебои в работе сердца: 0 – нет, 1 – есть |
| 4. В каком положении находится в постели: 0 – горизонтально, 1 – с приподнятым головным концом (2+ подушки), 2 – плюс просыпается от удушья, 3 – сидя |
| 5. Набухшие шейные вены: 0 – нет, 1 – лежа, 2 – стоя |
| 6. Хрипы в легких: 0 – нет, 1 – нижние отделы (до 1/3), 2 – до лопаток (до 2/3), 3 – над всей поверхностью легких |
| 7. Наличие ритма галопа: 0 – нет, 1 – есть |
| 8. Печень: 0 – не увеличена, 1 – до 5 см, 2 – более 5 см |
| 9. Отеки: 0 – нет, 1 – пастозность, 2 – отеки, 3 – анасарка |
| 10. Уровень САД: 0 – 120, 1 – (100-120), 2 – 100 мм. Hg |
Для более точной оценки тяжести клинических проявлений болезни неоднократно делались попытки создания шкал с бальной оценкой тяжести ХСН. С этой целью было предложена Российская система ШОКС [20]. Смысл в том, что для определения всех пунктов, включенных в шкалу не нужно применения инструментальных методов и ответы на все вопросы можно получить при сборе анамненза и обычном физикальном исследовании. Кроме того, расспрос и осмотр больного в соответствии с пунктами ШОКС напоминает врачу о всех необходимых исследованиях, которые он должен предпринять для правильного и аккуратного обследования больного с ХСН. Во время осмотра больного врач задает вопросы и проводит исследования соответственно пунктам от 1 до 10. В карте отмечается число баллов, соответствеющее ответу, которые в итоге суммируются. Всего максимально больной может набрать 20 баллов (терминальная ХСН), 0 баллов – полное отсутствие признаков ХСН. По ШОКС баллы соответствуют: I ФК 3 баллов; II ФК 4–6 баллов; III ФК 7–9 баллов; IV ФК 9 баллов. Кроме того, использование этой шкалы в динамике позволяет оценивать эффективность проводимого лечения ХСН, что было подтверждено в ходе Российских многоцентровых исследований ФАСОН, БЕЗЕ, СНЕГОВИК и др.
Инвазивные процедуры
В целом нет особой необходимости в проведении инвазивных исследований у пациентов с уже установленным диагнозом СН, однако в ряде случаев они показаны для уточнения генеза СН или прогноза больного.
Из существующих инвазивных процедур обычно используются коронарная ангиография (КАГ) с вентрикулографией (ВГ), мониторинг гемодинамики (с помощью катетера Свана– Ганса) и эндомиокардиальная биопсия. Ни один из указанных методов не должен применяется рутинно.
КАГ и ВГ позволяют в сложных случаях уточнить генез СН, определить степень участия коронарной недостаточности и тем самым дифференцировать ишемическую кардиомиопатию от других специфических заболеваний, сопровождающихся дилатацией полостей, врожденные пороки сердца. Они также показаны в случае рефрактерной СН неизвестной этиологии, тяжелой митральной регургитации или поражения аортального клапана. КАГ и ВГ не следует проводить на конечных стадиях СН; у пациентов, у которых не планируется проведение процедур по реваскуляризации миокарда, операции на клапанах или пересадки сердца.
Инвазивный мониторинг гемодинамики с помощью катетера Свана–Ганса чаще используется при острой СН (кардиогенном шоке, отеке легких). Мониторинг гемодинамики не рекомендован для рутинного использования с целью коррекции терапии.
Алгоритм постановки диагноза ХСН
Примерный алгоритм постановки диагноза ХСН представлен на рисунке 1 и в таблице 10. Установление правильного диагноза начинается с самого первого контакта врача с пациентом: предъявляемые больным жалобы и / или определяемые у него клинические признаки должны быть характерными для ХСН (табл. 3). Если симптоматика не соответствует критериям ХСН, диагноз СН маловероятен. Второй ступенью является доказательство наличия у больного сердечного заболевания. Лучшим методом на этом этапе может служить ЭКГ или определение МНУП: отсутствие отклонений от нормы свидетельствует против ХСН. Однако если обнаружены какие–либо признаки повреждения миокарда (в том числе, например, кардиомегалия или застой в легких), то следует направить больного на ЭхоКГ (РИА или МРТ) для уточнения характера поражения сердца, состояния гемодинамики, систолических и / или диастолических расстройств и. т. д. На 4 и 5 этапах речь пойдет о таких важных деталях, как этиология, тяжесть ХСН, провоцирующие факторы, обратимость изменений, которые в конечном итоге определяют выбор оптимальной терапии. Если существуют веские причины предполагать улучшение состояния пациента после проведения процедуры по реваскуляризации миокарда, такому пациенту следует выполнить КАГ. При отсутствии патологических изменений на ЭхоКГ диагноз ХСН маловероятен и следует искать другую причину одышки (утомляемости, отеков и. т. д.). Дополнительные тесты позволят установить возможный альтернативный диагноз (заболевания легких, анемия, заболевания щитовидной железы и т. д.). Наличие сомнений в точности диагноза или подозрение на обратимый характер СН должно служить основанием для проведения дополнительных исследований (табл. 11).
|
|
| Рисунок 1. Диагностический алгоритм СН |
Таблица 10. Определение вероятности присутствия СН и причины ее развития
| Оценочный параметр |
Диагноз СН |
Предполагает альтернативный или дополнительный диагноз |
||
| Требуется обязательно |
Поддерживает |
Опровергает |
||
| Типичные симптомы |
+++ |
++ (при отсутствии) |
||
| Типичные признаки |
+++ |
+ (при отсутствии) |
||
| Дисфункция сердца по одной из визуализирующих методик (обычно ЭхоКГ) |
+++ |
+++ (при отсутствии) |
||
| Уменьшение симптомов или признаков в ответ на терапию |
+++ |
+++ (при отсутствии) |
||
| ЭКГ |
+++ (в случае нормы) |
|||
| Рентгенография органов грудной клетки |
При кардиомегалии или застое в легких |
+ (в случае нормы) |
Заболевания легких |
|
| Общий анализ крови |
Анемия / Вторичная полицитемия |
|||
| Биохимический анализ крови и анализ мочи |
Заболевания почек, печени / Диабет |
|||
| Содержание в плазме натрийуретического пептида у нелеченных пациентов (по возможности) |
+ (при увеличении) |
+++ (в случае нормы) |
||
| + – небольшая значимость; +++ – существенная значимость |
||||
Таблица 11. Дополнительные тесты, позволяющие подтвердить или опровергнуть диагноз СН.
| Тест |
Диагноз СН |
Предполагает альтернативный или дополнительный диагноз |
|
| Поддерживает |
Опровергает |
||
| Нагрузочный тест |
+ (при выявлении нарушения) |
+++ (в случае нормы) |
|
| Оценка функции легких |
Заболевания легких |
||
| Оценка функции щитовидной железы |
Заболевания щитовидной железы |
||
| Инвазивное исследование и ангиография |
ИБС, ишемия |
||
| Сердечный выброс |
+++ (при снижении в покое) |
+++ (в случае нормы, особенно при нагрузке) |
|
| Давление в левом предсердии |
+++ (при увеличении в покое) |
+++ (в случае нормы; в отсутствии терапии) |
|
| + – небольшая значимость; +++ – существенная значимость |
|||
Последовательность мероприятий по ведению больного ХСН представлена в таблице 12.
Таблица 12. Перечень мероприятий по ведению больного с СН.
|
2. Лечение ХСН
Цели при лечении ХСН
Можно сформулировать шесть очевидных целей при лечении ХСН:
- Предотвращение развития симптомной ХСН [для I стадии ХСН]
- Устранение симптомов ХСН [для стадий IIА–III]
- Замедление прогрессирования болезни путем защиты сердца и других органов–мишеней (мозг, почки, сосуды) [для стадий I–III]
- Улучшение качества жизни [для стадий IIA–III]
- Уменьшение госпитализаций (и расходов) [для стадий I–III]
- Улучшение прогноза [для стадий I–III]
При постановке диагноза бессимптомной дисфункции ЛЖ (I стадия ХСН) главной целью является недопущение развития клинически выраженных симптомов декомпенсации.
Конечно, когда мы имеем дело с симптомной ХСН, главная задача на начальном этапе лечения – избавить больного от тягостных симптомов (одышки, удушья, отеков) дать возможность просто лежать, спать, отдыхать. Однако если ограничиться лишь этой начальной целью, например, применить эффективные диуретики в виде курса терапии, то у такого пациента уже через несколько дней (недель) вновь проявятся признаки тяжелой декомпенсации, требующие интенсивной терапии.
Поэтому важнейшее значение приобретает замедление прогрессирования ХСН, связанное с защитой органов–мишеней, прежде всего сердца, от прогрессирующих патологических изменений (ремоделирования). А поскольку ХСН – это системный процесс, при котором происходит ремоделирование не только сердца, но и почек, сосудов, мышц и т. д., мы говорим именно о системной защите органов–мишеней.
Сегодня Европейское общество кардиологов ориентирует каждого врача, лечащего ХСН, ответить на вопрос о назначении того или иного вида терапии: Зачем я это делаю?. Предполагается, что ответ должен содержаться во второй и третьей из поставленных целей – либо добиваюсь устранения симптомов болезни, либо достигаю замедления прогрессирования болезни. Если врач не способен отнести назначаемое лечение ни к одной из этих категорий возникает вопрос о целесообразности такого вида терапии ХСН.
Естественно, что применяемое лечение, кроме объективной эффективности, должно хорошо субъективно переноситься больными, улучшать или, по крайней мере, не ухудшать их качества жизни. Этот аспект определяет и приверженность пациентов с ХСН к проводимым процедурам, без которой невозможно рассчитывать на успешную борьбу с синдромом декомпенсации.
Уменьшение числа госпитализаций имеет двоякий смысл. Во–первых, это свидетельствует о стабильном течении заболеваний и отсутствии экстренных декомпенсаций, требующих повторных обращений к врачу. С другой стороны, госпитализации вносят основной вклад в структуру затрат на лечение ХСН. По результатам российской программы ФАСОН (2001 год) подтвердились данные Института здоровья США о том, что лечение ХСН – это крайне дорогостоящее дело. В России (данные по 30 городам, участвовавшим в программе ФАСОН) затраты на типичного больного с ХСН в 2001 году составляли 45 рублей / сут / б–го [72]. При примерной распространенности ХСН в России, равной 7,0 % (исследование ЭПОХА–ХСН, госпитальный этап, 2006), речь идет о более чем 7 млн. человек и затратах в 118 млрд. руб / год. Причем в России почти 1/3 этой суммы (62,5 %) приходится на оплату именно госпитального лечения. В США сообщается о затратах до 38 млрд. долл. / год [73].
Наконец, последняя и, может быть самая важная, хотя одновременно и самая трудная задача при лечении ХСН – это продление жизни пациентов, поскольку, как следует из предыдущего раздела рекомендаций, декомпенсация сердца является болезнью с крайне плохим прогнозом и средняя продолжительность жизни больных не превышает 5 лет [74].
Перефразируя рекомендации Европейского общества кардиологов, можно сказать: любой, применяемый вид лечения ХСН должен помочь достижению, по крайней мере, двух любых из шести основных целей борьбы с болезнью [1].
Существует шесть путей достижения поставленных целей при лечении декомпенсации:
- Диета
- Режим физической активности
- Психологическая реабилитация, организация врачебного контроля, школ для больных с ХСН
- Медикаментозная терапия
- Электрофизиологические методы терапии
- Хирургические, механические методы лечения
Как видно, медикаментозное лечение представляет собой хотя и очень важную составляющую, но находящуюся в этом списке на четвертой позиции. Игнорирование немедикаментозных методов борьбы с ХСН затрудняет достижение конечного успеха и снижает эффективность лечебных (медикаментозных) воздействий.
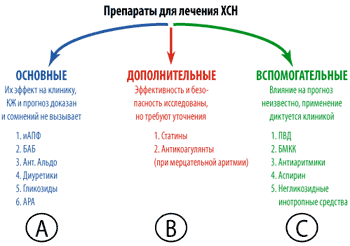
Для оценки степени доказанности каждого из предлагаемых методов лечения Европейским обществом кардиологов предложена трехбалльная шкала. Применение предлагаемого метода абсолютно доказано, по меньшей мере, в двух независимых крупных контролируемых исследованиях – это степень доказанности А.
Если эффективность предлагаемого лечения уже получила подтверждение в одном крупном исследовании или если результаты исследований противоречивы, то есть требуются дополнительные исследования – степень доказанности снижается и обозначается как В.
Когда рекомендации по лечению базируются на результатах отдельных, пусть и положительных, исследований и приближаются к эмпирике, т. е. строго полагаться на них трудно, это самая низкая степень доказанности – С.
Кроме того, выделяются классы рекомендаций: I – лечение показано всем, IIа – лечение скорее показано, IIб – лечение скорее противопоказано, III– лечение строго противопоказано.
Учитывая, что ХСН является одним из заключительных этапов сердечно–сосудистого континуума (или непрерывного развития ССЗ), а также осложнением большинства болезней сердца, то успешное лечение этих заболеваний можно рассматрривать как профилактику развития декомпенсации сердечной деятельности. По классификации ХСН (или вернее классификации континуума), предложенной АКК / ААС (2005), выделены четыре стадии, первая из которых (стадия А) относится к той ситуации, когда еще не имеется дисфункции сердца и, тем более, не наступило развитие самой клинически выраженной декомпенсации сердечной деятельности. Поэтому, признавая важность профилактики и лечения основных ФР ХСН, как предтечи развития декомпенсации сердечной деятельности, необходимо констатировать, что эти аспекты остаются за рамками настоящих рекомендаций . Задача данного документа представить алгоритмы диагностики и лечения собственно ХСН.
Период В (бессимптомная дисфункция ЛЖ) в Американской классификации соответствует I стадии ХСН по классификации ОССН 2002 года, период С (клинически выраженная ХСН) соответствует II стадии по классификации ОССН 2002 года и здесь в Российской классификации выделены периоды II A и II Б (начальная и клинически выраженная ХСН). Наконец стадия D в Американской классификации, относящаяся к финальной стадии ХСН, соответствует III стадии болезни по классификации ОССН 2002 года.
Профилактика ХСН
Учитывая все большую распространенность ХСН в мире и в том числе в Российской Федерации, а также крайнюю тяжесть и злокачественность течения этого синдрома и принимая во внимание колоссальные затраты на его лечение, нельзя обойти вниманием проблему профилактики развития ХСН . В отличие от Американской коллегии кардиологов и Американской Ассоциации сердца, настоящий раздел не призван заменить соответствующие руководства по борьбе с ФР сердечно–сосудистых заболеваний. Наша цель – лишь заострить внимание на важности предотвращения поражения сердца и развития симптомов ХСН в случае успешного лечения соответствующих патологических состояний. Поэтому в новую редакцию Рекомендаций ВНОК и ОССН 2006 года и включен этот раздел.
Современный взгляд на проблему предполагает наличие возросшей роли комбинации различных факторов, которые способны многократно увеличивать риск развития ИМ и ХСН [21]. Сочетание АГ, ожирения, которое существенно увеличивается, в том числе и в Российской популяции, инсулинорезистентности, дислипидемии, нередко определяемое, как метаболический синдром является основой развития многих сердечно– сосудистых заболеваний и в том числе ХСН. Обратимся к наиболее очевидным фактам, подтверждающим успешное предотвращение ХСН при нивелировании основных ФР.
Артериальная гипертония
Как известно, повышенное АД является самой частой причиной развития ХСН. Это было продемонстрировано как в США [22], так и в Европе [17]. В России, по результатам эпидемиологических и когортных исследований последних лет, повышенное АД ассоциируется с развитием ХСН не менее чем в 80 %, что отражает малую эффективность лечения АГ [18, 19]. Соответственно постулатом можно считать тот факт, что успешное лечение АГ – это наиболее эффективная профилактика развития ХСН (уровень доказанности А) . Это доказано как для систолической, так и диастолической АГ [23, 24]. Нормализация АД позволяет на 50 % снижать риск развития ХСН [25]. Среди препаратов для лечения АГ, позволяющих эффективно предотвращать развитие ХСН можно выделить иАПФ, АРА, БАБ, диуретики и их комбинации, в то время как использование блокаторов кальциевых каналов и альфа–адреноблокаторов выглядит менее предпочтительным [26–28]. Особенно важен контроль давления у больных, перенесших ОИМ, пациентов с наличием гипертрофии ЛЖ, перенесенным инсультом и другими осложнениями, т. к. это наиболее обоснованный способ предотвращения развития ХСН [24, 29–32]. Более подробно с принципами диагностики и лечения АГ можно ознакомиться в соответствующих рекомендациях ВНОК [33].
Лечение ИБС
Лечение пациентов с ИБС, которая является вторым по значимости ФР ХСН, также крайне важно в плане профилактики ХСН [17, 18]. В настоящем разделе речь идет о пациентах с ИБС не имеющих структурных изменений сердца (нормальную ФВ ЛЖ). Следует подчеркнуть, что не имеется данных о профилактике ХСН с помощью трех классов лекарств, наиболее часто применяемых для лечения стенокардии – нитратов, БАБ и блокаторов медленных кальциевых каналов (класс рекомендаций III, уровень доказанности А). В то же время имеются неопровержимые доказательства предотвращения ХСН при применении различных иАПФ (уровень доказанности А). Это касается в первую очередь периндоприла, т. к. одной из конечных точек исследования EUROPA являлось предотвращение развития ХСН [34]. Во вторую очередь рамиприла, т. к успешная профилактика ХСH в исследовании HOPE не предполагалась заранее [35].
После перенесенного ОИМ в качестве профилактики ремоделирования сердца и развития ХСН можно использовать различные нейрогормональные модуляторы БАБ [36, 37], иАПФ [38, 40], АРА [41] и антагонисты альдостерона [42]. Причем сочетание БАБ с блокадой ренин–ангиотензиновой блокады, увеличивает эффект терапии [41, 43].
Сведений о профилактике ХСН при применении аспирина у больных, перенесших ОИМ и, тем более с ХИБС нет. Наоборот его использование может приводить к росту числа госпитализаций, в связи с обострением ХСН (уровень доказанности В). [44, 45].
Еще одним важнейшим средством профилактики ХСН у больных с различными формами ИБС являются статины, что доказано в исследованиях с симва– и правастатином [46– 48]. Сегодня статины строго рекомендуются в качестве профилактики ХСН у пациентов с коронарной болезнью сердца (уровень доказанности А) и исследуются на предмет эффективности уже развившейся ХСН. Более подробно ознакомиться с принципами лечения коронарной болезни сердца можно в соответствующих рекомендациях ВНОК по лечению ИБС, и по лечению дислипидемий [49, 50].
Сахарный диабет
Нет сомнений, что наличие СД, и даже просто инсулинорезистентности предрасполагает к развитию ХСН, причем в максимальной степени увеличение риска отмечается у женщин [51, 52]. Сочетание ХСН с СД усугубляет неблагоприятный прогноз пациентов [53–55]. Поэтому успешное лечение пациентов с СД и его осложнениями позволяет существенно уменьшать риск развития ХСН (уровень доказанности А). [30, 56–59]. Необходимо отметить важность контроля уровня гликемии с использованием препаратов, улучшающих чувствительность тканей к инсулину, в частности метформина (уровень доказанности В) [60], а также иАПФ и АРА. В то же время применение БАБ и дуретиков может ухудшать течение СД (уровень доказанности В). [30, 61].
Клапанные пороки сердца
Одна из наиболее обсуждаемых в России проблем в связи с ХСН – определение типа расстройств гемодинамики и вариантов лечения больных с клапанными порками сердца. Хотя никаких реальных обсуждений тут быть не может. Стенозы клапанов, приводящие к перегрузке давлением, перенапряжению стенок вышележащих отделов сердца и их гипертрофии требуют обязательного хирургического лечения, вне зависимости от степени изменения гемодинамики и выраженности симптомов ХСН [62]. Никаких терапевтических (медикаментозных) альтернатив для больных с митральным и аортальным стенозом нет (уровень доказанности А).
При недостаточности клапанов оперативное лечение также является средством выбора, даже при относительной недостаточности митрального клапана у больных с ДКМП [62, 63]. Хотя в случаях аортальной и митральной недостаточности терапия артериолярными вазодилататорами (гидралазин, нифедипин) может уменьшать степень регургитации и структурных изменений камер сердца на предоперационном этапе лечения (уровень доказанности В). [64–67].
Другие факторы риска
Специальных исследований по профилактике ХСН с помощью ограничения курения, приема алкоголя или снижения массы тела не проводилось, поэтому уровень доказанности этих мероприятий не превышает степени доказанности С. В то же время, имеются сведения о прямой зависимости ожирения и развития ХСН [68]. Это позволяет рекомендовать снижение индекса массы тела ниже 30 кг/м всем пациентам с риском декомпенсации сердечной деятельности. Причем в России эта проблема приобретает особое значение, т. к. число больных с ожирением нарастает, параллельно увеличению ФК ХСН [69].
Еще более опасной выглядит связь приема алкоголя с развитием ХСН, в особенности не ишемической этиологии [70, 71]. Поэтому больным с риском развития ХСН необходимо рекомендовать строгий отказ от приема алкоголя, что особенно важно в реальных Российских условиях [69].
Также не вызывает никаких сомнений рекомендация по отказу от курения в качестве профилактики развития ХСН у пациентов с множественными ФР, хотя специальных исследований по связи отказа от курения и развития ХСН не проводилось.
3. Немедикаментозное лечение ХСН
Для всех немедикаментозных методов лечения больных ХСН уровень доказанности является низким и опирается на результаты отдельных, хотя и довольно многочисленных контролируемых исследований (уровень С).
Диета больных с ХСН
На сегодняшний день рекомендации по диете больных ХСН носят весьма конкретный характер. Основные позиции заключаются в следующем:
- При ХСН рекомендуется ограничение приема поваренной соли, причем тем большее, чем выраженнее симптомы болезни и застойные явления
I ФК – не употреблять соленой пищи (до 3 г NaCl);
II ФК – плюс не досаливать пищу (до 1,5 г NaCl);
III ФК – плюс продукты с уменьшенным содержанием соли и приготовление без соли (1,0 г NaCl). - Ограничение потребления жидкости актуально только в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в/в введения диуретиков. В обычных ситуациях объем жидкости не рекомендуется увеличивать более 2 л/сутки (минимум приема жидкости – 1,5 л/сут).
- Пища должна быть калорийной, легко усваиваться, с достаточным содержанием витаминов, белка.
Прирост веса кг за 1–3 дня, скорее всего, свидетельствует о задержке жидкости в организме и риске развития декомпенсации!
Сегодня контроль массы тела пациентов с ХСН или контроль трофологического статуса приобретают важнейшее значение.
Трофологический статус – понятие, характеризующее состояние здоровья и физического развития организма, связанное с питанием.
Необходимо различать следующие патологические состояния у пациента с ХСН: ожирение, избыточный вес, нормальный вес, кахексия. Наличие ожирения или избыточного веса ухудшает прогноз больного с ХСН и во всех случаях индекса массы тела (ИМТ) более 25 кг/м требует специальных мер и ограничения калорийности питания.
Патологическая потеря массы тела (явные или субклинические признаки обнаруживаются у 50 % больных с ХСН). Прогрессивное уменьшение массы тела, обусловленное потерей как жировой ткани, так и мышечной массы, называется сердечной кахексией. Клиницист верифицирует патологическую потерю массы тела во всех случаях:
- документированной непреднамеренной потери массы тела на 5 и более кг или более чем на 7,5 % от исходной (вес без отеков, т. е. вес пациента в компенсированном состоянии) массы тела за 6 месяцев [75, 76];
- при исходном ИМТ менее 19 кг / м. [Индекс массы тела рассчитывается как: ИМТ = масса тела (кг) / рост (м )]
Развитие кахексии, как правило, свидетельствует о критической активации нейрогормональных систем (прежде всего ренин– ангиотензин–альдостероновой), задействованных в прогрессировании декомпенсации и неадекватном росте активности цитокинов (прежде всего фактора некроза опухоли–) [77–79]. В лечении таких больных необходимым является сочетание медикаментозной коррекции нейрогормональных расстройств (степень доказательности А), блокады цитокинов (степень доказанности С) и нутритивной поддержки (степень доказательности С) [80–84].
Назначение нутритивной поддержки
Перед назначением нутритивной поддержки необходимо произвести расчет истинной потребности в энергии (ИПЭ). ИПЭ определяется, как произведение величины основного обмена (ООЭ) и фактора активности пациента. ООЭ рассчитывается по уравнению Харриса–Бенедикта [85]:
Мужчины: ООЭ = 66,47 + 13,75 x вес (кг) + 5 x рост (м) – 6,77 x возраст (годы)
Женщины: ООЭ = 66,51 + 9,56 x вес (кг) + 1,85 x рост (м) – 4,67 x возраст (годы)
Фактор активности (ФА) определяется в зависимости от физической активности больного: постельный режим – 1,2, умеренная физическая активность – 1,3, значительная физическая активность – 1,4.
При массе тела менее 10–20 % от нормы дефицит массы тела (ДМТ) равен 1,1, 20–30 % – 1,2, больше 30 % – 1,3.
ИПЭ = ООЭ х ФА х ДМТ
Принципы введения энтерального питания в рацион
- Начинать нутритивную поддержку с малых доз (не более 5–10% от уровня истинной энергопотребности).
- Обязательно добавлять ферментные препараты (1–2 таблетки/сут).
- Постепенно увеличивать объем энерговосполнения за счет питательной смеси (объем вводимой смеси увеличивать 1 раз в 5–7 дней).
Рекомендуется следующая процедура титрации дозы:
1–я неделя – 5–10 % энергопотребности
2–я неделя – 10–20 % энергопотребности
3–я неделя – 20–30 % энергопотребности
Контроль эффективности нутритивной поддержки должен осуществляться уже с первой недели терапии и включать в себя динамику антропометрических показателей (ИМТ, ТМТ, окружность мышц плеча), лабораторный контроль и оценку переносимости питательных смесей.
У больных с декомпенсацией кровообращения, когда резко ухудшаются показатели всасывания, оптимальным является применение олигомерных питательных смесей (Peptamen, уровень доказательности С) [86]. В период стабилизации состояния для ежедневного приема можно рекомендовать высокомолекулярные сбалансированные смеси в количестве 25–50 % от суточной энергопотребности [87–90] (Унипит, Нутриэн–стандарт, Берламин модуляр, Клинутрен; уровень доказательности С) [91, 92]. Вопрос о сочетании энтерального и парентерального питания ставится при выраженной сердечной кахексии, когда применение лишь энтерального питания невозможно или недостаточно эффективно [93, 94].
Алкоголь
Алкоголь строго запрещен для больных с алкогольной кардиопатией. У пациентов с ишемическим генезом ХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза. Для всех остальных больных с ХСН ограничение приема алкоголя имеет вид обычных рекомендаций, хотя по возможности следует ограничивать применение больших объемов (например, пива).
Режим физической активности
Сегодня очевидно, что покой не показан любым больным с ХСН вне зависимости от стадии заболевания. Физическая реабилитация рекомендуется всем пациентам с I–IV ФК ХСН, единственным требованием можно считать стабильное течение ХСН, когда нет необходимости в экстренном приеме мочегонных и внутривенном введении вазодилататоров и положительных инотропных средств [95].
Физическая реабилитации противопоказана при:
- активном миокардите
- стенозе клапанных отверстий
- цианотических врожденных пороках
- нарушениях ритма высоких градаций
- приступах стенокардии у пациентов с низкой ФВ ЛЖ
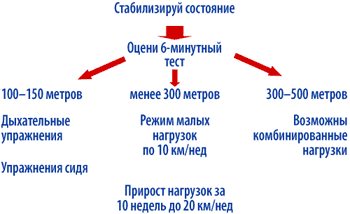
Основным для выбора режима нагрузок является определение исходной толерантности при помощи 6–минутного теста (рис. 2).
|
|
| Рисунок 2. Алгоритм проведения физических нагрузок у больных ХСН |
Для пациентов, прошедших менее 150 м, т. е. находящихся в III–IV ФК, а также имеющих выраженный дефицит массы тела, кахексию, общепринятые физические нагрузки не показаны (по крайней мере, на начальном этапе). В этих случаях на первом этапе (период стабилизации состояния) пациент выполняет упражнения для тренировки мышц вдоха и выдоха. Это может быть простое раздувание шарика или резиновой игрушки в зависимости от самочувствия по нескольку раз в день. При возможности проводится тренировка вдоха и выдоха с помощью специальных спирометров (INSPIR и РД–01) по обычным методикам [96, 97].
Доказано, что через 3–4 недели регулярные физические нагрузки в форме дыхательных упражнений с затрудненным выдохом приводят к системному влиянию на организм. Увеличивается толерантность к физическим нагрузкам, улучшается качество жизни, замедляется прогрессия кахексии, улучшается течение ХСН, достоверно замедляется прогрессия заболевания [98, 99].
При стабилизации состояния пациента необходимо предпринять попытку провести 6–мин тест. Дальнейшая тактика зависит от полученных результатов (рис. 3). Если пройденное расстояние менее 200 м, то пациентам рекомендуется продолжить дыхательные упражнения. Если пройденное расстояние более 200 м, то целесообразно рекомендовать физические нагрузки в форме ходьбы. Ухудшение состояния – усиление одышки, тахикардия, прогрессия усталости, снижение общей массы тела – является основанием для перехода на предыдущую ступень, либо возврата к дыхательным упражнениям. Полный отказ от физических нагрузок нежелателен и должен рассматриваться как крайняя мера. Для пациентов, прошедших при 6–минутном тесте ходьбы хотя бы 350 м, показаны динамические нагрузки (прежде всего в виде ходьбы) [100].
|
|
| Рисунок 3. Объем физических нагрузок для больных с ХСН I–IV ФК |
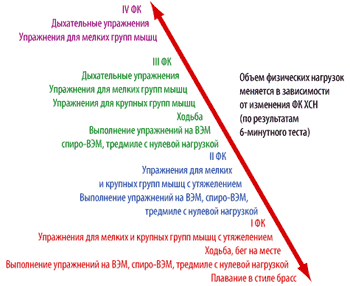
Методика проведения физических нагрузок в форме ходьбы
I этап. Вхождение. Продолжительность этапа – 6–10 недель. Частота занятий 5 раз в неделю. Скорость движения – 25 мин / 1 км. Расстояние – 1 км.
При стабильной клинической картине возможен переход к II этапу.
II этап. Продолжительность этапа 12 недель. Частота занятий 5 раз в неделю. Скорость движения – 20 мин / 1 км. Расстояние – 2 км.
При стабильном клиническом состоянии – переход на постоянную форму занятий.
Для пациентов, прошедших 500 и более метров за 6 минут, показаны динамические физические нагрузки, например, ходьба с прогрессивным повышением нагрузки до скорости 6 км / ч и продолжительностью до 40 минут в день. Титрация нагрузки до 6–8 месяцев.
Учитывая национальные особенности: а) прерывистые физические нагрузки (велоэргометр, тредмил) в силу своей неактуальности для большинства пациентов не рекомендуются; б) в связи с невозможностью широко определить максимальное потребление кислорода расчет нагрузок дан в конкретных цифрах – расстояние, нагрузка, продолжительность.
Учитывая, что положительный эффект физических тренировок исчезает через 3 недели после введения ограничения физических нагрузок – введение физических нагрузок в длительную (пожизненную) программу ведения пациента с ХСН является необходимым стандартом.
Проведение курсов физических тренировок сроком от 3 мес позволяет увеличить толерантность и максимальное потребление кислорода до 33 %! При этом доказано восстановление структуры и функции скелетной мускулатуры у больных с ХСН. При проведении нагрузок пациенты лучше реагируют на проводимую терапию. Доказано влияние физической реабилитации на прогноз декомпенсированных больных [101, 102].
Режим. Общие рекомендации
Вакцинация. Нет доказательств влияния вакцинации на исходы ХСН. Тем не менее использование вакцины против гриппа и гепатита В является целесообразным.
Путешествия. Не рекомендуется пребывание в условиях высокогорья, высоких температур, влажности. Желательно проводить отпуск в привычной климатической зоне. При выборе транспорта предпочтение отдается непродолжительным (до 2–2,5 часов) авиационным перелетам. Длительные перелеты чреваты обезвоживанием, усилением отеков нижних конечностей и / или развитием тромбоза глубоких вен голени. При любой форме путешествий противопоказано длительное вынужденное фиксированное положение. Специально рекомендуется вставание, ходьба или легкая гимнастика каждые 30 минут.
Коррекция доз мочегонных при пребывании в необычном для больного, прежде всего жарком и влажном (хуже всего – вместе) климате, носит обязательный, хотя и строго индивидуальный характер.
Курение. Строго и абсолютно однозначно не рекомендуется всем пациентам с ХСН.
Сексуальная активность. Вопросы либидо находятся в компетенции врача–сексопатолога. Врач–кардиолог предпринимает усилия для предотвращения развития декомпенсации ХСН. Как правило, улучшение течения декомпенсации восстанавливает сниженные сексуальные возможности. Ограничения актуальны для больных IV ФК ХСН и носят общий характер:
- избегать чрезмерного эмоционального напряжения;
- в ряде случаев принимать нитраты сублингвально перед половым актом;
- применение виагры не противопоказано (за исключением сочетаний с длительно действующими нитратами);
- для пациентов с ХСН I–III ФК риск развития декомпенсации ХСН при регулярной половой активности носит весьма умеренный характер.
В таблице 13 представлен распорядок дня пациента с СН.
Таблица 13. Распорядок дня пациента с СН.
| Показатели |
ФК |
||
| I–II |
III |
IV |
|
| Дневная полноценная активность (часы) |
10-12 |
6-8 |
1-2 |
| Дневная сниженная активность (часы) |
3-4 |
6-8 |
Более 8 |
| Дневной сон |
- |
1-2 |
Более 2 |
| Ночной сон |
7-8 |
8 |
Более 8 |
| Обязательная продолжительность динамической физической нагрузки |
45 минут |
30 минут |
10–15 минут |
| McMurrey J., 2000 |
|||
Психологическая реабилитация и создание школ амбулаторного наблюдения для больных ХСН
Сегодня пациент с ХСН, выписывающийся из клиники или покидающий врача амбулаторной практики после устранения обострения декомпенсации, должен, кроме рекомендаций по оптимальному медикаментозному лечению, иметь возможность контролировать свое состояние и быть под наблюдением специально обученного персонала. Этот своеобразный принцип диспансерного наблюдения имеет различные названия: мультидисциплинарного подхода в ведении больных ХСН или школы для больных с декомпенсацией, или клиник для больных ХСН, или домашнего сестринского контроля за больными с декомпенсацией. Но дело не в названиях, а в том, что задача врачей – обучить больного и его ближайших родственников приемам контроля за течением ХСН, методам самопомощи и дать возможность регулярного контакта со специалистами для своевременной коррекции состояния и недопущения экстренных декомпенсаций.
Эпидемиологические исследования последних лет, включавшие больных с ХСН в Западной Европе и США показали, что, несмотря на повсеместное внедрение во врачебную практику самых эффективных средств терапии ХСН смертность больных в течение года в этой популяции остается по–прежнему высокой [103–106].
Среди возможных причин такого несоответствия доказанной высокой эффективности современных препаратов и сохраняющегося в популяции высокого уровня смертности больных с ХСН, особая роль отводится низкой приверженности пациентов предписанному терапевтическому режиму и отсутствию строгого выполнения врачебных рекомендация, касающихся диеты и образа жизни.
Целью обучения является помощь пациентам и их родственникам в получении информации о заболевании, приобретении навыков самоконтроля, касающихся диетических рекомендаций, физической активности, строгого соблюдения режима медикаментозной терапии, наблюдения за симптомами СН и обращения за медицинской помощью в случае их усиления [107].
С пациентами проводятся структурированные занятия по следующим темам:
- общая информация о ХСН;
- симптомы ХСН и принципы самоконтроля;
- диета при ХСН;
- медикаментозная терапия ХСН;
- физические нагрузки при ХСН.
Пациенты должны получать обучающие материалы по самоконтролю (брошюра Жизнь с СН, Дневник самоконтроля пациента с СН). Обучающие материалы должны содержать сведения о диете, контроле веса, физической активности, правильном приеме препаратов и т. д. Целесообразно с пациентами группы осуществлять регулярные телефонные контакты: первый месяц после выписки из стационара – еженедельно; еще 2 месяца – 1 раз в 2 недели; далее – 1 раз в месяц. Во время которых врач должен проводить контроль самочувствия пациента, отвечать на вопросы, при необходимости, приглашать на дополнительный визит или госпитализировать пациента.
Первым крупным российским многоцентровым исследованием эффективности использования обучения и мониторинга пациентов с ХСН стало исследование ШАНС (Школа и Амбулаторное Наблюдение больных с СН), организованное Обществом специалистов по СН (ОССН) [108]. В котором статистически достоверно в группе вмешательства увеличилась дистанция в ходе проведения 6–минутного теста, также отмечена положительная динамика улучшения качества жизни и снижение ЧСС в покое [108]. Главным итогом программы ШАНС явилось достоверное уменьшение количества повторных госпитализаций из–за обострения декомпенсации и снижение смертности больных с 13 до 8,3 % (р=0,044). Это позволяет рекомендовать внедрение этой методики мультидисциплинарного воздействия на больных с ХСН в широкую медицинскую практику. Такой подход позволяет существенно снизить число повторных госпитализаций, снизить затраты на лечение, а по данным некоторых авторов, даже снизить смертность больных ХСН. Однако последнее утверждение имеет низкую степень доказанности (степень доказанности В).
Медико–социальная работа
Медико–социальная работа в комплексном ведении больного с ХСН должна включать мероприятия социально–медицинского, психолого–педагогического и социально–правового характера.
Эти мероприятия выполняет специалист социальной работы, участвующий в оказании медико–социальной помощи больному. Такому специалисту целесообразно:
- провести комплексную оценку социального статуса больного, а также оценку качества его жизни совместно с другими специалистами;
- формировать у больного здоровый образ жизни с учетом состояния его здоровья;
- обеспечить выбор режима физических нагрузок и организовать физическую активность пациента;
- вести психологическое консультирование и психокоррекционную работу;
- организовать совместно с другими специалистами работу школы для больных с ХСН;
- участвовать в медико–социальной экспертизе больного, разработке, реализации и оценке результатов индивидуальной программы реабилитации;
- провести социально–правовое консультирование по вопросам прав больного на получение медико–социальной помощи, включая выплату пенсий, пособий и льгот на получение различных видов помощи;
- организовать социальное обслуживание больного на дому;
- организовать трудовое обучение и обеспечить трудовую занятость, адекватную состоянию здоровья больного;
- вести реадаптацию пациента в семье и обществе;
- способствовать больному в реализации его прав, представлять интересы больного в органах государственной власти и судебных органах.
Специалисту социальной работы необходимо обеспечить взаимодействие больного с членами семьи и ближайшим окружением. Рекомендуется провести социальную экспертизу семьи с целью выявления проблем социально–медицинского характера, разрешить возникшие проблемные ситуации и содействовать устранению ФР с мобилизацией личностных резервов пациента.
Необходимо оказать психологическую поддержку и провести психологическое консультирование членов семьи и ближайшего окружения больного в разрешении микросоциальных проблем, содействовать сохранению семейных связей и переориентации семейных ролей в связи болезнью члена семьи.
Социальный работник должен обеспечить членам семьи и ближайшему окружению доступность в необходимой медико– социальной информации, информации о льготах и видах социальной защиты. Рекомендуется оказать помощь семье в организации адекватной состоянию здоровья больного реабилитационной социально–бытовой среды, способствующей его автономному существованию.
В том числе при необходимости заниматься организацией надомного труда для члена семьи, осуществляющего уход за больным для улучшения материального положения семьи.
Необходимо проводить санитарно–гигиеническое просвещение с целью формирования установок на здоровый образ жизни с учетом наличия в семье больного, содействовать в организации семейного досуга и отдыха путем предоставления возможности временного устройства больного в стационарное учреждение социального обслуживания.
Социальный работник должен способствовать членам семьи больного в выработке адекватных стереотипов поведения в трудных жизненных ситуациях.
4. Медикаментозное лечение ХСН. Общие принципы
Принципы медикаментозной терапии любого заболевания и ХСН, в частности, в первой декаде XXI века строятся на основе медицины доказательств. Иными словами, только препараты, эффективность (в том числе и по влиянию на прогноз больных) и безопасность которых доказана в длительных многоцентровых двойных слепых, плацебо–контролируемых исследованиях, могут быть рекомендованы к широкому клиническому применению. Точно так же все рекомендации по дозам лекарственных средств и кратности их приема даются на основании контролируемых исследований , доказавших эффективность того или иного метода терапии. Лишь при отсутствии подобных исследований в расчет принимаются результаты фармакокинетических исследований. На основании имеющихся в настоящее время сведений и формируются современные принципы медикаментозной терапии ХСН.
Все лекарственные средства для лечения ХСН можно разделить на три основные категории, соответственно степени доказанности (рис. 4).
|
|
| Рисунок 4. Препараты для лечения ХСН |
Основные средства – это лекарства, эффект которых доказан, сомнений не вызывает и которые рекомендованы именно для лечения ХСН (степень доказанности А):
- Ингибиторы АПФ, которые показаны всем больным с ХСН вне зависимости от этиологии, стадии процесса и типа декомпенсации.
- адреноблокаторы – нейрогормональные модуляторы, применяемые сверху (дополнительно) к иАПФ.
- Антагонисты рецепторов к альдостерону применяемые вместе с иАПФ и БАБ у больных с выраженной ХСН.
- Диуретики – показаны всем больным при клинических симптомах ХСН, связанных с избыточной задержкой натрия и воды в организме.
- Сердечные гликозиды – в малых дозах и с осторожностью при синусовом ритме, хотя при мерцательной аритмии они остаются средством выбора.
- Антагонисты рецепторов к АII могут применяться не только в случаях непереносимости иАПФ (рекомендации ВНОК / ОССН 2003 года, [4]), но и наряду с иАПФ в качестве средства первой линии для блокады РААС у больных с клинически выраженной декомпенсацией.
Как видно, к основным средствам лечения ХСН относятся шесть классов лекарственных средств. По сравнению с рекомендациями 2003 года повышен статус антагонистов рецепторов к ангиотензину (АРА), в первую очередь кандесартана, эффективность которого подтверждена в многоцентровой многонациональной программе CHARM [109–111]. Причем, учитывая нейрогормональную концепцию развития и прогрессирования ХСН четыре из шести классов основных препаратов для лечения ХСН – иАПФ, БАБ, антагонисты альдостерона и АРА относятся к нейрогормональным модуляторам.
В литературе имеются данные двух исследований о возможности улучшения прогноза больных при применении комбинации вазодилататоров (нитратов {изосорбида динитрат} с гидралазином {апрессином}). Однако результаты небольшого исследования V–HeFT [112] были подтверждены только для лиц негроидной расы (A–HeFT) [113], что не является основанием для включения подобной комбинации в число основных средств лечения для российской популяции. Побочные же реакции подобного лечения (тахикардия, гипотония, головная боль) столь выражены, что в эру иАПФ рекомендовать подобный метод лечения нецелесообразно. В 1997 году в Европейских рекомендациях указывалось, что такая комбинация может быть правомочной заменой иАПФ при непереносимости последних. Однако сегодня обоснованной заменой при плохой переносимости иАПФ выглядят другие нейрогормональные модуляторы – АРА, а кандесартан может использоваться наравне с иАПФ.
Дополнительные средства , эффективность и (или) безопасность которых показана в отдельных крупных исследованиях, но требует уточнения (степень доказанности В):
- статины, рекомендуемые к применению у всех больных с ишемической этиологий ХСН; кроме того, обладающие способностью предотвращать развитие ХСН у больных с разными формами ИБС.
- непрямые антикоагулянты, показанные к использованию у большинства больных с ХСН, протекающей на фоне мерцательной аритмии, а также в некоторых случаях у пациентов с ХСН и синусовым ритмом.
Этот раздел наиболее динамичен и переменчив, т. к. составляющие его препараты, подтвердив свою эффективность и безопасность, переходят в разряд основных, а не подтвердив, остаются лишь вспомогательными средствами лечения ХСН. Так, еще в Российском формуляре по лечению ССЗ за 1999 год эту группу составляли наряду с АРА антагонисты альдостерона (спиронолактон) и длительнодействующие дигидропиридины (амлодипин). Однако за прошедшие годы все сомнения о целесообразности использования спиронолактона были сняты, и он перешел в группу основных средств лечения ХСН [114]. Для амлодипина ситуация обратная – его эффективность не была подтверждена и препарат может быть отнесен лишь к вспомогательным средствам лечения ХСН [115, 116].
За три года, прошедшие со времени опубликования предыдущих рекомендаций по диагностике и лечению ХСН, в группу основных средств лечения переместились АРА. Исключены из списка дополнительных средств лечения ингибиторы вазопептидаз, хотя исследования, посвященные этому классу препаратов, продолжаются.
Вспомогательные средства, эффект и влияние которых на прогноз больных с ХСН не известны (не доказаны), что соответствует III классу рекомендаций, или уровню доказательности С. Собственно, этими препаратами не нужно (да и невозможно) лечить саму ХСН, и их применение диктуется определенными клиническими ситуациями, осложняющими течение собственно декомпенсации:
- периферические вазодилататоры (ПВД) = (нитраты), применяемые только при сопутствующей стенокардии;
- блокаторы медленных кальциевых каналов (БМКК) – длительнодействующие дигидропиридины при упорной стенокардии и стойкой АГ;
- антиаритмические средства (кроме БАБ, входящих в число основных препаратов, в основном III класса) при опасных для жизни желудочковых аритмиях;
- аспирин (и другие антиагреганты) для вторичной профилактики после перенесенного ИМ;
- негликозидные инотропные стимуляторы – при обострении ХСН, протекающей с низким сердечным выбросом и упорной гипотонией.
К сожалению, хотя вспомогательные препараты не относятся собственно к средствам лечения декомпенсации, полностью обойтись без этого раздела не удается, хотя в него на сегодняшний день включен минимум препаратов, по данным эпидемиологического исследования ЭПОХА наиболее часто сочетающихся с основными и дополнительными средствами лечения декомпенсации [69, 117].
По данным Европейских исследований (Euroaspire I и II, Improvement HF, Euroheart Survey), в которых принимала участие и Россия, показана явная полипрагмазия в лечении ХСН – большинству больных назначается 6–7 (максимум до 14) различных лекарственных средств [118–121]. Поэтому задача сегодняшнего дня – критическое отношение к назначению каждого препарата для лечения декомпенсации. Хотя, как сведетельствуют результаты российского эпидемиологического исследования ЭПОХА, при переходе на амбулаторный этап лечения больные ХСН получают в среднем всего лишь 2,4 препарата [69, 117]. Поэтому критическое отношение к назначению необходимых лекарственных средств может подразумевать как разумное уменьшение, так и обоснованное увеличение количества необходимых лекарств.
5. Основные препараты для медикаментозного лечения ХСН
5.1. Ингибиторы АПФ
Этот класс лекарств, безусловно, относится к первой линии в лечении ХСН. Еще в 1995 году в классическом мета–анализе, включавшем более 7100 больных, была продемонстрирована способность иАПФ к снижению риска смерти больных с ХСН на 23 %, причем за первые 90 дней лечения этот эффект еще более выражен (снижение риска 44 %) [122]. Эти результаты неоднократно подтверждены во множестве исследований и анализов, показавших, что положительные эффекты иАПФ не зависят от возраста, сохраняются в большинстве клинических ситуаций и при любой степени тяжести ХСН. По этим позициям класс рекомендаций I, уровень доказанности – А.
Следует отметить, что эффективность использования иАПФ может несколько снижаться при ишемической этиологии ХСН [9, 122–123] и у женщин [122, 123], а также ослабляться одновременным применением НПВП (в меньшей степени, малыми дозами аспирина) [124]. Эти данные пришли в основном из результатов ретроспективных мета–анализов и имеют уровень доказанности С, однако полностью их игнорировать невозможно.
Эффекты иАПФ могут ослабляться одновременным применением НПВП, за счет конкурентной блокады синтеза простациклина, стимулируемого кининовой системой [125, 126]. Поэтому нужно избегать назначения НПВП больным с ХСН, находящимся на приеме иАПФ, особенно при перегрузке жидкостью (в период декомпенсации) . В меньшей степени этими свойствами обладают малые дозы аспирина, хотя и в этом случае описаны негативные воздействия аспирина с иАПФ [127]. Это также может быть связано с блокадой синтеза вазодилатирующих простаноидов в результате блокады фермента циклооксигеназы [128]. Негативное взаиомдействие аспирина и иАПФ при ХСН отмечено и в ретроспективных анализах крупных плацебо– контролируемых исследований [129, 130] и в специально спланированных проспективных протоколах [126, 127]. Причем очевидно, что антиагреганты с другим механизмом действия (тиклопидин, клопидогрел) не ослабляют эффектов иАПФ в той степени, как аспирин [131, 132]. Этот сложный вопрос неоднократно подробно обсуждался на конференциях ОССН [128, 133, 134]. Однако по данным двух мета–анализов не выявлено существенного достоверного снижения эффектов иАПФ при одновременном применении аспирина [135, 136]. Поэтому совместное применение иАПФ и малых доз аспирина при ХСН возможно. Однако доказательств эффективности аспирина при длительном лечении ХСН не имеется [137] и, как говорилось выше, назначение аспирина может быть чревато увеличением количества декомпенсаций в результате обострения ХСН [44, 45].
Неправильно лечить иАПФ, впрочем, как и другими лекарственными средствами, больных с ХСН на почве пороков сердца с преобладающими стенозами клапанных отверстий. Такие пороки должны корригироваться хирургическим путем. Однако для достижения компенсации до хирургической коррекции подобные больные должны лечиться в соответствии с общими принципам, хотя дозы всех препаратов, влияющих на пред– и посленагрузку (включая иАПФ) должны титроваться крайне медленно при тщательном контроле за состоянием и уровнем АД.
Основные позиции по применению иАПФ в лечении ХСН:
- иАПФ показаны всем больным ХСН (при любой этиологии и стадии процесса);
- иАПФ улучшают клиническую симптоматику, качество жизни (КЖ), замедляют прогрессирование болезни, снижают заболеваемость и улучшают прогноз больных с ХСН, а также предотвращают наступление клинически выраженной декомпенсации, т. е позволяют достичь всех шести целей в лечении ХСН.;
- эти препараты эффективны от самых начальных стадий ХСН, включая бессимптомную дисфункцию ЛЖ, до самых поздних стадий декомпенсации;
- чем раньше начинается лечение, тем больше шансов на успех и продление жизни пациентов;
- иАПФ являются наиболее обоснованным способом лечения и ХСН с сохраненной систолической функцией сердца (степень доказанности В);
- неназначение иАПФ не может считаться оправданным и ведет к сознательному повышению риска смерти декомпенсированных больных;
- иАПФ в меньшей степени способны снижать смертность у женщин, особенно с бессимптомной дисфункцией ЛЖ. При наличии клинических признаков ХСН иАПФ оказывают положительный эффект, хотя и несколько менее выраженный, чем у мужчин (мета–анализ исследований SAVE, SOLVD, CONSENSUS, SMILE, TRACE [138]).
В России зарегистрировано 11 иАПФ, имеющих в качестве показания ХСН: беназеприл, зофеноприл, каптоприл, квинаприл, лизиноприл, периндоприл, спираприл, рамиприл, фозиноприл, цилазаприл, эналаприл (табл. 14). Хотя общепринята точка зрения, что имеет место так называемый класс – эффект при использовании иАПФ в лечении ХСН, с точки зрения медицины, основанной на доказательствах, степень доказанности их эффективности при лечении ХСН весьма различна. Ниже приведены данные, характеризующие иАПФ с максимальной степенью доказанности по лечению и профилактике именно ХСН с указанием контролируемых исследований, подтвердивших эту эффективность.
Таблица 14. Ингибиторы АПФ, доказавшие способность предотвращать развитие ХСН и/или успешно лечить больных ХСН*
| Профилактика ХСН |
I ФК начальная ХСН |
II ФК Клинически выраженная ХСН |
III–IV ФК Тяжелая ХСН |
|
| Эналаприл |
SOLVD prev [139] |
SOLVD treat [140], V-HeFT II [141], RESOLVD [142] |
CONSENSUS [143] |
|
| Каптоприл |
SAVE [48], VALIANT [41], OPTIMAAL [144] |
Munich MHF [145, 146] |
Captopril-Degoxin [147], ELITE-II [148], САДКО ХСН [160] |
|
| Фозиноприл |
FAMIS [149] |
FEST [150], SHF без глик. [151], Fosinopril-Enalapril [152], ФАСОН [53] |
||
| Периндоприл |
PROGRESS [31], EUROPA [34] |
PEP-CHF [153] |
||
| Лизиноприл |
GISSI–III [39] |
ATLAS [154], Лизиноприл – Каптоприл [155] |
||
| Рамиприл |
AIRE [156], HOPE [35] |
|||
| Квинаприл |
Riegger [157], QHFTI [158], Квинаприл – Каптоприл [159], САДКО ХСН [160] |
|||
| Спираприл |
CASSIS [161], КВАНК [162] |
|||
| * – не считая коротких исследований по подбору доз и оценке гемодинамики |
||||
Как видно максимальную степень доказанности в лечении ХСН всех стадий имеют только классические иАПФ абсолютно не потерявшие своего значения – эналаприл и каптоприл (степень доказанности А) . Именно этим препаратам правильно отдавать предпочтение в терапии ХСН.
Также доказана лечебная эффективность фозиноприла , исследованного и в Российских условиях, лизиноприла и периндоприла (степень доказанности В) . Причем способность периндорила достоверно уменьшать количество госпитализаций было доказана в группе пожилых больных с сохранной систолической функцией ЛЖ [153]. Это единственное проспективное исследование показавшее перспективность иАПФ (периндоприла) в лечении больных СН–ССФ.
Учитывая, что лизиноприл не метаболизирует в печени и выводится на 100 % почками в неизменном виде, его применение должно быть ограничено при тяжелой ХСН, когда большинство больных имеет ухудшение функции почек [163, 164]. В этих случаях выгоднее использовать фозиноприл и спироприл, имеющие два пути выведения из организма . Кроме этого исследование ALLHAT продемонстрировало, что лизиноприл достоверно уступает диуретикам в предотвращении развития ХСН, что не выгодно отличает его от других иАПФ [28].
Для профилактики ХСН у больных, перенесших острый ИМ могут применяться каптоприл, рамиприл, и фозиноприл (степень доказанности А) . Периндоприл в исследовании PRE–AMI продемонстрировал способность достоверно блокировать процессы постынфарктного ремоделирования ЛЖ, что является основным механизмом в предотвращении развития ХСН [165].
Еще два иАПФ, исследованны только у пациентов с ОИМ – трандолаприл (TRACE) и зофеноприл (SMILE). Однако эффективность этих препаратов у больных с ХСН не достаточно исследована. К тому же трандолаприл не показал способности предотвращать развитие ХСН у больных с ИБС и сохранной функцией сердца (PEACE) в отличие от рамиприла и периндоприла [166].
Для профилактики ХСН у пациентов с хроническими заболеваниями сердечно–сосудистой системы , в частности ИБС возможно использование только двух иАПФ – периндоприла и рамиприла (степень доказанности А) . Причем степень доказанности профилактики ХСН при ИБС максимальна для периндоприла. [34]. Рамиприл продемонстрировал способность предотвращать развитие декомпенсации у смешанной группы больных с ИБС, АГ, СД, периферическим атеросклерозом и перенесенным инсультом, что не позволяет дифференцировать его эффект у каждой из этих подгрупп пациентов [35]. К тому же периндоприл в исследовании EUROPA достоверно уменьшал риск развития ХСН на 39 %, превосходя по этому показателю другие иАПФ [35, 167]. Кроме того, у пациентов с инсультами в анамнезе (половина с АГ) применение периндоприла и его комбинации с индапамидом сопровождалось достоверным снижением риска развития ХСН на 26 % [31].
В дополнение к шести препаратам с полностью доказанной эффективностью в крупных международных многоцетровых исследованиях, добавлены еще два иАПФ, показавшие свою эффективность в лечении ХСН на меньшем числе пациентов квинаприл и спираприл [157–162]. Важную роль играет и тот факт, что эти препараты показали свою эффективность и в многоцентровых Российских программах ВНОК и ОССН по лечению больных с ХСН. Порядковый номер в таблице, характеризует степень доказанности эффектов каждого из иАПФ в лечении и профилактике ХСН и соответствует степени рекомендованности по мнению экспертов ОССН.
Следует напомнить, что максимальная информация по лечению ХСН иАПФ была получена в серии классических исследований с эналаприлом (CONSENSUS, SOLVD treatment, SOLVD prevention, V–HeFT II) у пациентов со всеми стадиями декомпенсации.
Побочные эффекты (требующие остановки лечения) осложняют применение иАПФ достаточно редко:
5.1.1 Повышение креатинина
возможно у 5–15 % больных с ХСН и связано с основным механизмом действия иАПФ – блокаде влияния АII на уровень почечной фильтрации, при этом может развиваться функциональная почечная недостаточность, что особенно опасно у больных с исходной гипонатриемией [168, 169]. Однако, при медленном титровании доз иАПФ стойкая высокая азотемия (повышение креатинина более чем вдвое выше нормы) и усугубление почечной недостаточности встречается у 1–2 %. В этих случаях показано применение иАПФ, имеющих два пути выведения из организма – фозиноприла – степень доказанности В и спираприла – степень доказанности С . Следует избегать назначения лизиноприла (степень доказанности А).
5.1.2 Сухой кашель
Типичный побочный эффект всех иАПФ (2–3 % леченных иАПФ больных), связанный с блокадой деградации брадикинина и минимально выраженный у фозиноприла (степень доказанности В) [170]. При развитии упорного кашля иАПФ должно быть заменены на АРА, которым не свойственно развитие этого осложнения.
5.1.3 Симптомная гипотония
Объясняется основными механизмами действия иАПФ, однако может затруднять начало терапии иАПФ. В небольшом количестве случаев (3–4 %) это может требовать прекращения терапии иАПФ. Имеются сведения, что в наименьшей степени гипотония первой дозы развивается на фоне применения периндоприла (степень доказанности В) [171, 172]. Следует помнить, что при развитии гипотонии на фоне лечения иАПФ дозу нужно уменьшить, а при остановке лечения сделать все возможное для сохранения терапии иАПФ.
5.1.4 Непереносимость иАПФ
Абсолютными противопоказаниями к назначению иАПФ являются непереносимость (ангионевротический отек), двусторонний стеноз почечных артерий, беременность.
Непереносимость в связи с развитием ангионевротического отека при применении рекомендованных доз иАПФ в терапевтических дозах не превышает 0,4 %.
В случаях непереносимости иАПФ могут быть заменены антагонистами рецепторов к АII (АРА), хотя при развитии почечной недостаточности и повышении креатинина, скорее всего и назначение АРА может быть безуспешным.
5.1.5. Практические вопросы применения иАПФ при ХСН (дозы, тактика лечения, меры предосторожности)
Назначение всех иАПФ начинается с маленьких доз, при их постепенном (не чаще одного раза в 2–3 дня, а при системной гипотонии еще реже – не чаще одного раза в неделю) титровании до оптимальных (средних терапевтических) доз.
При отсутствии клинических противопоказаний (и снижения АД) необходимо пытаться увеличивать дозу, однако не стремясь достигнуть максимума, т. к. при этом снижается число обострений ХСН (уровень доказанности В), но растет число осложнений. В исследовании NETWORK увеличение дозы иАПФ эналаприла в терапевтических пределах (5–20 мг / сут) не сопровождалось улучшением прогноза или снижением числа госпитализаций, в связи с обострением ХСН [173]. Необходимо отметить, что исследование ATLAS с лизиноприлом сравнивало эффективность малых (2,5–5 мг / сут) и очень высоких (32,5–35 мг / сут) препарата, Это исследование показало, что 7–10 кратное повышение доз лизиноприла не улучшает выживаемости больных с ХСН, хотя уменьшает число повторных госпитализаций, одновременно достоверно увеличивая риск побочных реакций (гиперкалиемии, гипотонии) [154].
Следует помнить, что титрование дозы иАПФ – процесс сугубо индивидуальный и у каждого пациента свой оптимум и максимум в эффективных и переносимых дозах лекарств. Кроме того, следует помнить, что жители России не всегда переносят дозировки, характерные для исследований в США, поэтому слепое копирование рекомендаций по применению гигантских доз иАПФ больным ХСН должно восприниматься с осторожностью. Однако помните, что останавливаться на минимальных дозах иАПФ, если пациент их хорошо переносит, и у него нет снижения АД – это ошибка. При этом вы лишаете своего больного дополнительных шансов на уменьшение обострений болезни.
Ингибиторы АПФ можно назначать больным с ХСН при уровне САД выше 85 мм рт. ст. При исходно низком CАД (85–100 мм. Hg) эффективность иАПФ сохраняется, поэтому их всегда и обязательно следует назначать, снижая стартовую дозу в два раза (для всех иАПФ).
Риск гипотонии возрастает у наиболее тяжелых больных с ХСН IV ФК при сочетании иАПФ с ПВД (нитраты, БМКК) и при назначении после обильного диуреза. Для избежания гипотензии первой дозы иАПФ следует назначать не менее чем через 24 часа после обильного диуреза, предварительно отменив вазодилатирующие средства.
В таблице 15 показаны дозы восьми наиболее исследованных в лечении и профилактике ХСН иАПФ, применяемых в России (не включены препараты, доказавшие эффективность у больных только с ОИМ).
Таблица 15. Дозировки иАПФ для лечения ХСН (в мг x кратность приема).
| Стартовая доза |
Терапевтическая доза |
Максимальная доза |
Стартовая доза (при гипотонии) |
|
| Эналаприл |
2,5 х 2 |
10 х 2 |
20 х 2 |
1,25 х 2 |
| Каптоприл |
6,25 х 3(2)** |
25 х 3(2) |
50 х 3(2) |
3,125 х 3(2) |
| Фозиноприл |
5 х 1(2) |
10-20 х 1(2) |
20 х 1(2) |
2,5 х 1(2) |
| Периндоприл |
2 х 1 |
4 х 1 |
8 х 1 |
1 х 1 |
| Лизиноприл |
2,5 х 1 |
10 х 1 |
20 х 1* |
1,25 х 1 |
| Рамиприл |
2,5 х 1 |
5 х 2 |
5 х 2 |
1,25 х 1 |
| Квинаприл |
5 х 1(2) |
10-20 х 1(2) |
40 х 1(2) |
2,5 х 1(2) |
| Спираприл |
3 х 1 |
3 х 1 |
6 х 1 |
1,5 х 1 |
| * В исседовании ATLAS лизиноприл назначался в дозаъ до 35 мг, но дополнительный эффект был минимальным и такие дозы не могут быть рекомендованы; |
||||
В дополнение к шести препаратам с доказанной эффективностью в международных исследованиях добавлены два иАПФ, применявшиеся в многоцентровых Российских программах ВНОК и ОССН – квинаприл и спираприл. Порядковый номер в таблице 15 характеризует степень доказанности эффектов каждого из иАПФ в лечении и профилактике ХСН.
В тех случаях, когда в скобках приведена цифра 2, это означает, что может иметь место как одно– (или трех– для каптоприла), так и двукратное назначение препарата.
Следует помнить, что при снижении почечной фильтрации ниже 60 мл / мин дозы всех иАПФ должны быть уменьшены вдвое, а при снижении ниже 30 мл / мин на 3/4 это же относится и к лечению пожилых больных с ХСН, у которых почечная функция, как правило, нарушена. Исключением из представленного списка является фозиноприл, дозу которого не нужно адаптировать при почечной недостаточности и у пожилых больных, т. к. он имеет два взаимокомпенсирующихся пути выведения из организма – почки и желудочно–кишечный тракт (степень доказанности В). Сбалансированный двойной путь выведения из организма имеет и спираприл, что также позволяет рекомендовать его больным с почечной недостаточностью (степень доказанности С) [163, 164, 174].
Ниже представлены подробные рекомендации по безопасному началу лечения ХСН препаратами группы иАПФ, которые целесообразно выполнять у всех больных ХСН, и особенно у проблемных пациентов с исходной гипотонией, нарушенной функцией почек, гиперкалиемией:
- еще раз оценить необходимость применения в используемых дозировках диуретиков и, особенно вазодилататоров;
- не допускать чрезмерного диуреза перед началом лечения. Отменить диуретики за 24 ч до первого применения иАПФ в случае их использования;
- целесообразно начинать терапию вечером, когда больной находится в горизонтальном положении, чтобы снизить до минимума возможное негативное влияние препарата
- начинать лечение с малых доз и увеличивать их до поддерживающих уровней, которые оказались эффективными в крупных исследованиях (табл. 15);
- при существенном ухудшении функции почек перевести больных на наиболее безопасные иАПФ (фозиноприл или спираприл). Если это не помогает, уменьшить дозы применяемых иАПФ вдвое. При отсутствии улучшения отменить иАПФ и попробовать терапию АРА (начать лучше всего с кандесартана). Если и это не помогает, приходится отказываться от терапии препаратами, влияющими на РААС. Однако при улучшении клинического состояния, устранения гипотонии и / или гипонатриемии следует повторить попытку назначения минимальных доз иАПФ.;
- избегать назначения калийсберегающих диуретиков в начале лечения иАПФ, особенно у больных с исходно высоким уровнем калия плазмы (выше 5,2 мкмоль / л). Однако это не противоречит рекомендациям по совместному применению иАПФ с высокими дозами альдактона в период декомпенсации сердечной деятельности и сочетанию иАПФ с малыми дозами антагонистов альдостерона при длительном лечении ХСН;
- избегать назначения НПВП;
- контролировать АД и содержание электролитов в крови через 2 недели после каждого последующего увеличения дозы.
За консультацией к специалисту–кардиологу следует направлять больных, у которых:
- Причина СН неизвестна
- САД100 мм рт. ст.
- Содержание в сыворотке креатинина 130 мкмол / л
- Содержание в сыворотке натрия 130 мкмол / л
- Содержание в сыворотке калия 6.0 мкмоль / л
- Тяжелая СН
- Клапанные пороки сердца как причина СН.
5.2. Блокаторы -адренергических рецепторов (БАБ)
Рациональным обоснованием к применению блокаторов -адренергических рецепторов в лечении ХСН является блокада симпатико–адреналовой системы (САС), которая находится в состоянии хронической гиперактивации у больных с декомпенсацией и определяет плохой прогноз (высокую смертность) этих пациентов [175]. Активность САС прогрессивно нарастает параллельно увеличению тяжести ХСН, причем начиная со II стадии болезни или со II ФК начинает преобладать негативные дезадативные свойства катехоламинов [176–179]. В связи с этим применение БАБ становится наиболее целесообразным и эффективным у пациентов с клинически выраженной тяжелой ХСН II–IV ФК. Доказано, что гиперактивация САС способствует достоверному увеличению как риска внезапной смерти, так и смерти от прогрессирования декомпенсации. Поэтому основная идея применения БАБ в лечении больных ХСН – это улучшение прогноза и снижение смертности.
В настоящее время доказано, что БАБ оказывают блокирующее действие и на некоторые другие нейрогормональные системы, ответственные за прогрессирование ХСН – РААС, эндотелиновую, систему цитокинов. Таким образом, нельзя однобоко представлять роль БАБ в лечении ХСН – это не только средства, блокирующие влияние катехоламинов на -адренергические рецепторы (хотя это очень важно), но комплексные нейрогормональные модуляторы, оптимально дополняющие эффекты иАПФ [177, 180].
Негативные последствия гиперактивации САС максимально проявляются в результате чрезмерной стимуляции 1 –рецепторов, поэтому применение 1 –селективных (часто применяется термин кардиоселективных) БАБ в лечении больных ХСН вполне обосновано и эффективно. Хотя имеются предположения, что использование БАБ с дополнительными свойствами, например 1 -2 -1 –блокатора карведилола может быть более эффективным за счет вазодилатирующих свойств (степень доказанности С) [181–183].
К положительным свойствам БАБ при ХСН относится способность:
- уменьшать дисфункцию и смерть кардиомиоцитов как путем некроза, так и апоптоза;
- уменьшать число гибернирующих (находящихся в спячке) кардиомиоцитов;
- при длительном применении за счет увеличения зон сокращающегося миокарда улучшать показатели гемодинамики;
- повышать плотности и афинность –адренорецепторов, которая резко снижена у больных с ХСН;
- уменьшать гипертрофию миокарда;
- снижать ЧСС, что является зеркалом успешного применения БАБ у больных с ХСН. Уменьшение ЧСС минимум на 15 % от исходной величины характеризует правильное лечение БАБ больных с ХСН;
- уменьшать степень ишемии миокарда в покое и особенно при физической активности;
- несколько уменьшать частоту желудочковых аритмий;
- оказывать антифибрилляторное действие, что снижает риск внезапной смерти.
Таким образом, наряду с улучшением прогноза БАБ уменьшают степень ремоделирования сердца, т. е. оказывают кардиопротекторное действие, позволяющее замедлять прогрессирование декомпенсации и число госпитализаций [184–188].
Главным же негативным свойством, в течение многих лет препятствующим включению БАБ в число основных препаратов для лечения ХСН, считался их отрицательный инотропный эффект, который, по мнению многих кардиологов и терапевтов, был способен стимулировать усугубление проявлений ХСН. В настоящее время доказана некая двухфазность влияния БАБ на центральную гемодинамику у больных с ХСН [177, 189, 190]:
- действительно, в первые две недели лечения этими препаратами сердечный выброс может снижаться (как за счет уменьшения собственно сократимости, так и в результате снижения ЧСС), а клинические проявления ХСН даже несколько нарастать;
- но затем в результате уменьшения тахикардии и потребления миокардом кислорода гибернированные кардиомиоциты восстанавливают свою сократимость и сердечный выброс начинает расти. Причем некоторые БАБ (карведилол) при длительном применении позволяют добиваться роста ФВ большего, чем номинальные положительные инотропные агенты (в частности, сердечные гликозиды) [191].
К настоящему времени завершено более 30 плацебо–контролируемых исследований, включивших больше 20000 больных ХСН, которые показали способность БАБ снижать смертность больных с декомпенсацией на 29 % (что даже больше, чем при применении иАПФ). Хотя, справедливости ради, нужно отметить, что в большинстве случаев БАБ применялись дополнительно к иАПФ [1–4].
Учитывая многочисленные вопросы и комментарии по поводу применения БАБ при лечении ХСН, ниже приводятся результаты основополагающих исследований, сформировавших концепцию использования этой группы препаратов для лечения ХСН:
- MDC с 1 –селективным БАБ метопрололом тартратом (около 400 больных с ХСН на почве дилатационной кардиомиопатии), не показавшее снижения смертности, хотя снижалась частота комбинированной конечной точки в виде числа смертей плюс пересадок сердца [192];
- CIBIS–II с 1 –селективным БАБ бисопрололом (более 2600 больных с ХСН III–IV ФК), показавшее снижение риска смерти на 34 % [186];
- MERIT–HF с 1 -селективным БАБ метопрололом сукцинатом замедленного высвобождения (почти 4000 больных с ХСН II–IV ФК), продемонстрировавшее снижение риска смерти также на 34 % [187];
- COPERNICUS с неселективным 1 - и 2 –, а также 1 –блокатором карведилолом (более 2200 больных с ХСН с исходной ФВ 25 %), позволившее снизить риск смерти на 35 % [188];
- Австралийско–Новозеландское исследование по применению карведилола у более чем 400 пациентов с ХСН II–III ФК ишемической этиологии, позволившее снизить риск смерти на 28 % [185];
- исследование COMET (более 3000 больных ХСН), напрямую сравнившее эффективность применения неселективного - и -блокатора карведилола и 1 -селективного короткодействующего БАБ метопролола тартрата и продемонстрировавшее достоверное преимущество карведилола по снижению риска смерти на 17 % [193];
- исследование SENIORS с 1 –селективным БАБ небивололом (более чем 2100 больных ХСН старше 70 лет), не показавшее достоверного снижения риска смерти, но продемонстрировавшее небольшое достоверное снижение суммы госпитализаций и смертей на 14 % [194];
- исследование CIBIS–III у 1050 больных с ХСН II–III ФК, доказавшее, что по эффективности и безопасности начало лечения с 1 –селективного БАБ бисопролола (в течение 6 месяцев) с последующим переводом на его комбинацию с эналаприлом не уступает общепринятому режиму – началу лечения с иАПФ эналаприла с последующим переводом на комбинацию иАПФ плюс БАБ [195].
Как видим, в трех наиболее успешных протоколах (CIBIS–II, MERIT–HF и COPERNICUS) три разных БАБ показали практически одинаковое снижение риска смерти больных с ХСН. Кроме того, и бисопролол, и метопролол–сукцинат замедленного выведения, и карведилол достоверно уменьшали как риск внезапной смерти, так и смерти от прогрессирования ХСН и снижали частоту госпитализаций.
После этих исследований и были сформулированы основные положения по лечению ХСН БАБ.
По крайней мере, два типа –адреноблокаторов - 1 –селективные (кардиоселективные): бисопролол и метопролол сукцинат с замедленным высвобождением препарата, а также некардиоселективный 1 - и 2 –блокатор с дополнительными свойствами 1 –блокатора, антиоксиданта и антипролиферативного средства – карведилол доказали эффективность и безопасность, способность улучшать прогноз больных с ХСН и уменьшать число госпитализаций (степень доказанности А).
Другие БАБ, включая атенолол, метопролол тартрат и небиволол, не показали способности улучшать прогноз больных ХСН. Применение атенолола и метопролола тартрата для лечения больных ХСН противопоказано (степень доказанности А).
Кроме трех рекомендованных БАБ, в лечении пожилых больных с ХСН (старше 70 лет) может применяться небиволол, который достоверно не снижает смертность, но уменьшает заболеваемость пациентов и число повторных госпитализаций (степень доказанности В). Хотя ретроспективный анализ показывает, что другие БАБ, рекомендованные для лечения ХСН – бисопролол, и метопролол сукцинат замедленного выведения – не только снижают риск госпитализаций, но и улучшают прогноз и снижают риск смерти больных ХСН старше 65 лет (степень доказанности С) [196–198].
По способности снижать риск заболеваемости и смерти декомпенсированных больных БАБ даже превосходят иАПФ.
Сегодня БАБ наряду с иАПФ являются главными средствами лечения ХСН. Их способность замедлять прогрессирование болезни, число госпитализаций и улучшать прогноз декомпенсированных больных не вызывает сомнений (уровень доказанности А). Иными словами, применение этого класса лекарств позволяет достигать, по крайней мере, трех из шести основных целей при лечении ХСН.
БАБ должны применяться у всех больных с ХСН, не имеющих противопоказаний (обычных для этой группы лекарств). Это очень важное положение, ставшее постулатом лишь в последние годы. Тяжесть декомпенсации, пол, возраст, уровень исходного давления (естественно, если САД исходно больше 85 мм рт. ст.) и исходная ЧСС не играют самостоятельной роли в определении противопоказаний к назначению БАБ. Хотя эффект от лечения более выражен у больных с исходной тахикардией (более 80 уд / мин) и достаточно высоком АД (систолическое более 100 мм рт. ст.) (степень доказанности В).
Тем не менее, при обычных клинических ситуациях БАБ должны применяться только сверху (т. е. дополнительно к иАПФ) и у больных, у которых достигнута стабилизация состояния. Важно помнить, что БАБ не относятся к числу средств скорой помощи и не могут выводить больных из состояния декомпенсации и гипергидратации.
В редких клинических ситуациях (преобладание выраженной тахикардии при невысоком АД, когда сочетание иАПФ и БАБ затруднено) можно начать терапию с 1 –селективного БАБ бисопролола с последующим присоединением иАПФ (степень доказанности В). Наиболее оправдан такой порядок лечения при низкой исходно ФВ28 % (степень доказанности В). Конечная цель в любом случае – максимально быстрый перевод больных ХСН на комбинацию иАПФ плюс БАБ [183, 195].
БАБ оказывают у женщин столь же выраженный эффект по снижению смертности, как и у мужчин (мета–анализ исследований CIBIS–II, MERIT–HF, BEST, COPERNICUS, US Carvedilol HF, а также данные исследования CIBIS–III, SENIORS) [199].
В таблице 16 представлены оптимальные дозы БАБ, применяющиеся в лечении ХСН.
Таблица 16. Дозы БАБ для лечения больных ХСН.
| Стартовая доза |
Терапевтическая доза |
Максимальная доза |
|
| Бисопролол |
1,25 мг х 1 |
10 мг х 1 |
10 мг х 1 |
| Метопролол сукцинат |
12,5 мг х 1 |
100 мг х 1 |
200 мг х 1 |
| Карведилол |
3,125 мг х 1 |
25 мг х 1 |
25 мг х 1 |
| Небиволол * |
1,25 мг х 1 |
10 мг х 1 |
10 мг х 1 |
| * – у больных старше 70 лет |
|||
Лечение БАБ при ХСН должно начинаться осторожно, начиная с 1/8 терапевтической дозы, которая показана в таблице 16 как стартовая. Дозы увеличиваются медленно (не чаще раза в две недели, а при сомнительной переносимости и чрезмерном снижении АД – раз в месяц) до достижения оптимальной, указанной как терапевтическая. Как и в случае с иАПФ, необходимо помнить, что у каждого больного – своя оптимальная дозировка БАБ.
Пример титрования дозы БАБ приведем для бисопролола: 1,25 мг – 2 недели; затем 2,5 мг до четвертой недели; 3,75 мг до 6 недели, 5 мг до 8 недели, 7,5 мг до 10 недели и затем, наконец – 10 мг к 12 неделе лечения. При сомнительной переносимости периоды титрования составят промежутки по 4 недели и оптимальная доза будет достигнута лишь к 24 неделе, то есть через полгода после начала терапии. Спешка при титровании дозы БАБ больным с ХСН не нужна.
Для метопролола сукцината (ЗОК) шаги титрования составят: 12,5 мг – 25 мг – 50 мг – 75 мг – 100 мг – 200 мг.
Для карведилола: 3,125 мг x 2 раза, затем 6,25 мг x 2 раза, затем 12,5 мг x 2 раза, затем 18,75 мг x 2 раза и, наконец, 25 мг x 2 раза.
В октябре 2006 г. ы США была зарегистрирована новая форма карведилола фосфат для однократного применения.
Для небиволола (у больных старше 70 лет): 1,25 мг, затем 2,5 мг, затем 5 мг, потом 7,5 мг и 10 мг.
Часть пациентов с ХСН в реальной практике уже может находиться на лечении не рекомендованными БАБ (чаще всего атенололом или метопрололом тартратом короткого действия). Перевод на рекомендованные препараты следует осуществлять в соответствии с данными, представленными в таблице 16.
Если больные получают очень малые дозы атенолола (25 мг / сут) или метопролола тартрата (25 мг / сут), то титрование доз рекомендованных БАБ необходимо начать с общепринятых стартовых доз. При условии, если пациенты принимали средние дозировки атенолола (25–75 мг / сут) или метопролола тартрата (25–75 мг / сут), то титрование рекомендованных БАБ можно начать сразу со второй ступени. Наконец, если пациенты успешно принимали высокие дозы атенолола (75 мг / сут) или метопролола тартрата (75 мг / сут), то титрование бисопролола, карведилола или метопролола сукцината можно начать с третьей ступени. Между последним приемом атенолола или метопролола сукцината и первым приемом рекомендованного БАБ, на который переводится больной, должно пройти 12 часов. В дальнейшем титрование доз рекомендованных БАБ проходит по обычным принципам – увеличение доз каждые 2 недели, а при гипотонии и нестабильном состоянии 1 раз в 4 недели.
В первые две недели лечения БАБ возможно снижение сердечного выброса и обострение симптомов ХСН, что требует тщательного контроля. В этих случаях рекомендуется:
- некоторое увеличение дозы диуретиков,
- увеличение (если возможно) дозы иАПФ,
- применение положительных инотропных препаратов (малых доз сердечных гликозидов или сенситизаторов кальция – левосимендана),
- более медленное титрование дозы БАБ.
В случаях обострения ХСН на фоне длительного приема БАБ, следует попытаться оптимизировать другую терапию (диуретики, иАПФ, сердечные гликозиды), снизить дозу БАБ, избегая его полной отмены. Отмена БАБ может приводить к ухудшению течения ХСН, поэтому должна производиться лишь при невозможности продолжить лечение, по принципам указанным выше [200]. После стабилизации состояния, лечение БАБ должно быть возобновлено, начиная с меньших доз [201].
Противопоказания к назначению -блокаторов при СН:
- Бронхиальная астма и тяжелая патология бронхов
- Симптомная брадикардия (50 уд / мин)
- Симптомная гипотония (85 мм рт. ст.)
- Блокады II и более степени
- Тяжелый облитерирующий эндартериит.
Наличие хронического бронхита, осложняющего течение ХСН, не является абсолютным противопоказанием к назначению БАБ. Во всех случаях необходимо сделать попытку к их назначению, начиная с малых доз и придерживаясь медленного титрования. Лишь при обострении симптомов бронхообструкции на фоне лечения БАБ от их применения придется отказаться. Средством выбора в такой ситуации является использование высокоселективного 1 –блокатора бисопролола (степень доказанности С) [202].
При сочетании ХСН и СД 2 типа назначение БАБ абсолютно показано. Все положительные свойства препаратов этого класса полностью сохраняются. Препаратом выбора в таких ситуациях является карведилол, который в отличие от всех других БАБ даже улучшает чувствительность периферических тканей к инсулину (степень доказанности А) [203].
В настоящее время при непереносимости БАБ у больных ИБС рекомендуется применение препаратов, изолированно снижающих ЧСС, или блокаторов If каналов (ивабрадин). Концепция изолированного снижения ЧСС для лечения ХСН представляется крайне перспективной и ивабрадин изучается в качестве препарата потенциально способного улучшить прогноз больных с дисфункцией ЛЖ и ХСН.
Таблица 17. Таблица перевода больных ХСН с атенолола и метопролола тартрата на рекомендованные БАБ.
| Уже назначенные БАБ |
Рекомендованные БАБ (стартовая доза) |
||
| Бисопролол |
Метопролола сукцинат |
Карведилол |
|
| Атенолол 25 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг х 2 р/д |
| Атенолол 25–75 мг/сут |
2,5 мг |
25 мг |
6,25 мг х 2 р/д |
| Атенолол 75 мг/сут |
5 мг |
50 мг |
12.5 мг х 2 р/д |
| Метопролола тартрат 25 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг х 2 р/д |
| Метопролола тартрат 25–75 мг/сут |
2,5 мг |
25 мг |
6,25 мг х 2 р/д |
| Метопролола тартрат 75 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг х 2 р/д |
Как и в случае с иАПФ, приводим подробные правила безопасного лечения БАБ больных ХСН, что позволяет максимально уменьшить риск осложнений:
- Пациенты должны находиться на терапии иАПФ (при отсутствии противопоказаний) или на лечении АРА (первый выбор – кандесартан).
- Пациенты должны находиться в относительно стабильном состоянии без внутривенной инотропной поддержки, без признаков выраженных застойных явлений на подобранных дозах диуретиков.
- Лечение следует начинать с небольших доз (табл. 16) с последующим медленным повышением до целевых терапевтических дозировок, применявшихся в крупномасштабных исследованиях. При условии хорошей переносимости терапии -блокатором доза препарата удваивается не чаще, чем один раз в 2 недели. Большинство пациентов, получающих БАБ, могут начинать лечение и наблюдаться в амбулаторных условиях.
- В начале терапии и в процессе титрования могут развиться преходящие нарушения: гипотония, брадикардия и / или ухудшение СН, что требует своевременного их выявления и устранения. С этой целью целесообразно придерживаться следующей тактики:
- контроль за симптомами СН, признаками застоя жидкости, уровнем АД, ЧСС;
- при нарастании симптомов СН в первую очередь следует увеличивать дозу диуретиков и иАПФ;
- при неэффективности этой меры – временное снижение дозы -адреноблокатора. После стабилизации состояния терапия БАБ возобновляется, вновь начиная со стартовой дозы;
- при возникновении брадикардии следует уменьшить дозу или прекратить прием препаратов, урежающих ЧСС; при необходимости возможно временное снижение дозы БАБ либо их полная отмена в случае крайней необходимости;
- по достижении стабильного состояния всегда старайтесь возобновить лечение и / или продолжить титрование дозы –блокаторов.
- Если при декомпенсации СН пациент нуждается в инотропной поддержке, то средством выбора следует считать сенситизаторы кальция (левосимендан), поскольку их гемодинамические эффекты не зависят от степени блокады -адренорецепторов [204].
Следующие категории больных с ХСН при лечении БАБ нуждаются в особом наблюдении специалиста–кардиолога:
- Тяжелая ХСН (III–IV ФК)
- СН неизвестной этиологии
- Наличие относительных противопоказаний: брадикардия, низкое АД, плохая переносимость низких доз –блокаторов, сопутствующий обструктивный бронхит
- Сведения об отмене -блокаторов в прошлом из–за побочных реакций или обострения симптоматики ХСН.
5.3. Антагонисты альдостерона
С середины 60–х годов, на протяжении почти 40 лет, спиронолактон в дозах 100–300 мг / сут успешно применяется в комплексной диуретической терапии тяжелой ХСН как калийсберегающий диуретик [20, 177, 205, 206]. Показанием к такому использованию препарата является наличие декомпенсированной ХСН, гипергидратации и необходимости лечения активными диуретиками. Именно в качестве надежного партнера тиазидных и петлевых диуретиков следует рассматривать назначение спиронолактона. В период достижения компенсации (особенно у пациентов с ХСН III–IV ФК) применение спиронолактона абсолютно необходимо и можно не бояться сочетания его высоких доз с иАПФ или АРА, если параллельно правильно используются активные диуретики и достигается положительный диурез. Однако после достижения состояния компенсации применение высоких доз спироналактона прекращается и рассматривается вопрос о длительном назначении невысоких доз препарата в качестве дополнительного нейрогормонального модулятора [20, 177].
Сложный период в жизни спиронолактона наступил после появления в практике иАПФ, которые в начальном периоде лечения снижают синтез альдостерона в организме. Поэтому появились рекомендации о нежелательном сочетании иАПФ и альдактона при лечении ХСН, т. к. это могло быть чревато развитием гиперкалиемии и ухудшением функции почек [207–209]. Однако сегодня эта комбинация реабилитирована и не рекомендуется лишь сочетание больших доз спиронолактона и высоких доз иАПФ при длительном лечении ХСН. Для достижения состояния компенсации при обострении ХСН и гипергидратации такая комбинация, как уже сказано выше, показана, но требует тщательного контроля уровня калия и креатинина [210, 211].
При обострении явлений декомпенсации спиронолактон используется в высоких дозах (100–300 мг или 4–12 таблеток, назначаемых однократно утром или в два приема утром и в обед) на период 1–3 недели до достижения компенсации. После этого доза спиронолактон должна быть уменьшена. Критериями эффективности применения спиронолактона в комплексном лечении упорного отечного синдрома являются:
- увеличение диуреза в пределах 20–25 %, это хотя и не много, но особенно важно при упорных, рефрактерных отеках;
- уменьшение жажды, сухости во рту и исчезновение специфического печеночного запаха изо рта;
- стабильная концентрация калия и магния в плазме (отсутствие снижения), несмотря на достижение положительного диуреза.
В дальнейшем для длительного лечения больных с выраженной декомпенсацией III–IV ФК рекомендуется использование малых (25–50 мг) доз спиронолактона дополнительно к иАПФ и БАБ в качестве нейрогуморального модулятора, позволяющего более полно блокировать РААС, улучшать течение и прогноз больных с ХСН (уровень доказанности А). В исследовании RALES было показано, что назначение 27 мг спиронолактона плюс к иАПФ и БАБ позволяло достоверно снижать риск смерти на 27 %, причем как внезапной, так и связанной с обострением декомпенсации [114]. На сегодня именно сочетание трех нейрогормональных модуляторов иАПФ+БАБ+антагонист альдостерона является наиболее рациональной схемой лечения больных с тяжелой ХСН.
Нужно помнить, что концентрация спиронолактона в плазме крови выходит на плато к третьему дню лечения и после отмены (или уменьшения дозы препарата) его концентрация и действие пропадает (снижается) через трое суток.
Вопрос о применении малых доз антагонистов альдостерона в комбинации с другими нейрогормональными модуляторами для лечения больных с начальными стадиями ХСН (I–II ФК) остается открытым. Хотя уже имеются данные, что у пациентов, перенесших ИМ, осложнившийся развитием ХСН II ФК, применение нового антагониста альдостерона эплеренона (в России не зарегистрирован) позволяло снижать риск смерти, в том числе и внезапной (степень доказанности В) [42]. Тем не менее, назначение малых доз спиронолактона больным с ХСН II ФК, даже больным, перенесшим ИМ, пока не может быть строго рекомендовано и остается на усмотрение врача.
Из основанных побочных реакций спиронолактона (кроме возможной гиперкалиемии и нарастания уровня креатинина) следует отметить развитие гинекомастии (до 10 % пациентов).
Следует помнить, что при наличии повышенного уровня креатинина сыворотки (130 мкмол / л), почечной недостаточности в анамнезе, гиперкалиемии, причем даже умеренной (5,2 мкмоль / л) сочетание антагонистов альдостерона с иАПФ, требует тщательного клинического и лабораторного контроля [210–212]. При таких ситуациях должен быть предусмотрен контроль уровней калия и креатинина плазмы, через 2 и четыре недели лечения, затем через 2 и 3 месяца лечения, а потом раз в 6 месяцев. Это позволяет минимизировать число побочных реакций [42, 114].
Несмотря на необходимость контроля за их применением антагонисты альдостерона по праву занимают место в списке 6 основных групп препаратов, применяемых для лечения ХСН. По результатам исследованиий EPHESUS и RALES различий в выраженности эффектов антагонистов альдостерона у больных ХСН разного пола не выявлено (степень доказанности С).
5.4 Диуретические (мочегонные) средства в лечении ХСН
Задержка жидкости в организме и формирование отечного синдрома является типичным и наиболее известным проявлением ХСН. Поэтому дегидратационная терапия представляет собой одну из важнейших составляющих успешного лечения больных с ХСН.
Однако необходимо помнить, что в развитии отечного синдрома задействованы сложные нейрогормональные механизмы и бездумная дегидратация вызывает лишь побочные эффекты и рикошетную задержку жидкости. То, что характеризуется как отеки, представляет собой накопление жидкости во внеклеточном пространстве. Поэтому для выделения этой жидкости из организма необходимо осуществление трех этапов:
- Избыточная жидкость сначала должна быть переведена из внеклеточной жидкости в сосудистое русло.
Для осуществления первого этапа используются активные мочегонные средства (диуретики), которые за счет снижения объема циркулирующей крови и гидростатического давления облегчают переход жидкости из внеклеточного пространства в сосудистое русло. На этом этапе эффективно применение гемодинамически активных препаратов (положительные инотропные средства), и особенно – нейрогормональных модуляторов (иАПФ, АРА). Важным подспорьем на этом этапе является повышение онкотического (введение препаратов плазмы или альбумина) и осмотического давления (применение антагонистов альдостерона, усиливающих ионообмен и уменьшающих выраженность гипонатриемии разведения).
- Необходима доставка этой избыточной жидкости к почкам и обеспечение ее фильтрации.
На этом этапе эффективно применение препаратов, усиливающих почечную фильтрацию. При мерцательной аритмии целесообразно использовать невысокие дозы дигоксина. При гипотонии и синусовом ритме используются положительные инотропные средства, из которых выделяется допамин. За счет влияния на допаминергические рецепторы этот препарат увеличивает долю почечного кровотока. При уровне САД выше 100 мм рт. ст. эффективно применение эуфиллина.
- При попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбция, что обеспечит избыточное выведение жидкости из организма.
Как раз в осуществлении этого этапа незаменимыми являются собственно диуретики.
Только при выполнении трех перечисленных условий удастся достичь положительного диуреза и начнется процесс дегидратации.
Следовательно, диуретики выполняют функцию лишь одного из компонентов дегидратационного лечения. Поэтому применение мочегонных препаратов должно быть строго обоснованным, обязательно сочетаться с использованием нейрогормональных модуляторов, таких как иАПФ и антагонисты альдостерона, а также препаратов, удерживающих жидкость в сосудистом русле и улучшающих почечный кровоток и фильтрацию.
Как это ни странно, но серьезных плацебо контролируемых исследований по применению диуретиков практически не проводилось (за исключением антагонистов альдостерона), поэтому все положения основываются на мнении экспертов. Формально это должно соответствовать степени доказанности С, однако эксперты Европейского общества кардиологов сделали исключение и, учитывая громадный практический опыт по лечению мочегонными, степень доказанности повышена до А (см. также табл. 18).
Таблица 18. Показания. Дозировки и продолжительность действия диуретиков при лечении больных с ХСН.
| Показания |
Стартовая доза |
Максимальная доза |
Длительность действия |
||
| Тиазидные |
Гидрохлоротиазид |
II–III ФК (СКФ30мл/мин) |
25 мг x 1-2 |
200 мг/сут |
6–12 час |
| Индапамид СР |
II ФК (СКФ30мл/мин) |
1,5 мг x 1 |
4,5 мг /сут |
36 час |
|
| Хлорталидон |
II ФК (СКФ30мл/мин) |
12,5 мг x 1 |
100 мг/сут |
24–72 часа |
|
| Петлевые |
Фуросемид |
II–IV ФК СКФ5 мл/мин |
20 мг x 1-2 |
600 мг/сут |
6–8 час |
| Буметанид |
II–IV ФК СКФ5 мл/мин |
0,5 мг x 1-2 |
10 мг/сут |
4–6 час |
|
| Этакриновая к–та |
II–IV ФК СКФ5 мл/мин |
25 мг x 1-2 |
200 мг/сут |
6–8 час |
|
| Торасемид |
II–IV ФК СКФ5 мл/мин |
10 мг x 1 |
200 мг/сут |
12–16 час |
|
| ИКАГ |
Ацетазоламид |
Легочно–сердечная недостаточность, апноэ сна, устойчивость к активным диуретикам (алкалоз) |
250 мг x 1 3–4 дня с перерывами 10–14 дней* |
750 мг/сут |
12 час |
| Калий-сберегающие |
Спиронолактон** |
Декомпенсация ХСН |
50 мг x 2 |
300 мг/сут |
До 72 час |
| Триамтерен*** |
Гипокалиемия |
50 мг x 2 |
200 мг/сут |
8–10 час |
|
| * – при выраженном апноэ сна ацетазаломид назначается в дозах 250–500 мг ежедневно, за 1 час до отхода ко сну. ** – имеется в виду применение спиронолактона при обострении ХСН вместе с петлевыми диуретиками в качестве калийсберегающего диуретика. *** – применении неуонкурентных антагонистов альдостерона должно ограничиаваться лишь случаями гипокалиемии на фоне активных диуретиков при непереносимости мс (или невозможности использования) спиронолактона |
|||||
Основные положения дегитратационной терапии, в том числе применения диуретиков, сводятся к следующему:
- Диуретики (мочегонные средства) применяются для устранения отечного синдрома и улучшения клинической симптоматики больных с ХСН. При правильном применении эти средства позволяют уменьшить число госпитализаций, что соответствует достижению двух из шести основных целей при лечении ХСН. Диуретики не замедляют прогрессирования ХСН и не улучшают прогноза больных. Их влияние на качество жизни при неправильном назначении (ударные дозы раз в 3–4–5–7 дней) может быть даже негативным. [20, 177, 205, 206, 213–215]
- Лечение мочегонными средствами, начинается лишь при клинических признаках застоя (II А стадия, II ФК по классификации ОССН). Впрок мочегонными не лечат, т. к. они, как сказано выше, не замедляют прогрессирования ХСН.
- Лечение мочегонными начинается с применения слабейшего из эффективных у данного конкретного больного препаратов. Предпочтение следует отдавать тиазидным диуретикам (гипотиазид) и лишь при их недостаточной эффективности переходить к назначению мощных петлевых диуретиков (фуросемид, этакриновая кислота, буметанид, торасемид)
- Лечение необходимо начинать с малых доз (особенно у больных, не получавших ранее мочегонных препаратов), в последующем подбирая дозу по принципу quantum satis
- Диуретики разделяются на группы, соответственно локализации действия в нефроне. На проксимальные канальцы действуют слабейшие из мочегонных – ингибиторы карбоангидразы (ацетозоламид). На кортикальную часть восходящего колена петли Генле и начальную часть дистальных канальцев – тиазидные и тиазидоподобные диуретики (гипотиазид, индапамид, хлорталидон). На все восходящее колено петли Генле самые мощные петлевые диуретики (фуросемид, этакриновая кислота, буметанид, торасемид). На дистальные канальцы – конкурентные (спиронолактон) и неконкурентные (триамтерен) антагонисты альдостерона, относящиеся к группе калийсберегающих мочегонных. [20, 177, 205, 206, 213–215]
- Основную роль в лечении отечного синдрома у больных с ХСН играют тиазидные и петлевые диуретики.
- Тиазидные диуретики (гипотиазид) нарушают реабсорбцию натрия в кортикальном сегменте восходящей части петли Генле и в начальной части дистальных канальцев. Повышают диурез и натрийурез на 30–50 %, эффективны при уровне фильтрации до 30–50 мл / мин. Поэтому при почечной недостаточности их применение бесполезно.
Гипотиазид – основной представитель класса тиазидных диуретиков, применяется, как правило, у больных с умеренной ХСН (II ФК), и должен рассматриваться как стартовый препарат для лечения отечного синдрома. Стартовая доза препарата 25 мг, максимальная 100 мг, т. к. при ее превышении, диуретический эффект увеличивается минимально, а риск типичных побочных явлений существенно возрастает. Как и у всех активных мочегонных салуретиков, в том числе и петлевых (действие основано на снижение реабсорбции натрия и осмотически связанной жидкости) основными недостатками являются гиперактивация РААС, приводящая к рикошетной задержке жидкости, а также электролитные расстройства (гипокалиемия и гипомагниемия). На третьем месте по значимости идут метаболические нарушения, вызываемые гипотиазидом за счет уменьшения циркулирующей крови (повышение уровня глюкозы и ХС).
Поэтому применение и тиазидных и петлевых диуретиков всегда должно сочетаться с блокаторами РААС (иАПФ, АРА, антагонисты альдостерона) и калийсберегающими препаратами (антагонисты альдостерона, реже триамтерен). Следует помнить, что гипотиазид, при всех своих положительных эффектах, препарат, требующий аккуратного и правильного применения, во избежании серьезных нежелательных явлений.
Индапамид по профилю безопасности существенно превосходит гипотиазид, однако данных по его применению в лечении ХСН в настоящее время недостаточно. Еще один представитель этого класса диуретиков – хлорталидон обычно используется в лечении больных с АГ, однако также как индапамид, может быть применен у пациентов с начальным стадиями ХСН при сохранной фильтрационной функции почек.
К сожалению, в России не зарегистрирован самый сильный из современных тиазидных диуретиков – метолазон (дозы от 2,5 до 10 мг), который в США рассматривается как основное дополнение к петлевым диуретикам при рефрактерном отечном синдроме.
- Петлевые диуретики (фуросемид, этакриновая кислота, буметанид, торасемид) самые эффективные мочегонные, блокирующие реабсорбцию натрия на всем протяжении восходящей части петли Генле и сохраняющие активность даже при ХПН и фильтрации 5 мл / мин. Иными словами, они эффективны даже при явлениях почечной недостаточности. На сегодня именно петлевые диуретики – основа лечения отечного синдрома при ХСН.
Безусловным лидером в лечении отечного синдрома на протяжении более 40 лет является фуросемид [216, 217]. Препарат применяется как в виде внутривенных инъекций, особенно при обострениях ХСН, так в виде таблеток для длительного поддерживающего лечения пацентов со II–IV ФК ХСН. Дозы фуросемида – стартовая обычно 20–40 мг, максимальная до 500–600 мг, хотя имеются сведения об использовании гораздо больших доз (до 1800 мг). Диуретический эффект препарата длится 6–8 часов, поэтому сегодня для лечения наиболее тяжелых пациентов может быть рекомендовано двукратное (а в критических состояниях и трехкратное) в сутки применение фуросемида, как альтернатива увеличению однократной дозы. [215, 218]. Применение фуросемида чревато теми же побочными реакциями, что и при использовании гипотиазида. Наиболее серьезными можно считать гипокалиемию и гипомагниемию, повышение активности РААС, гипергликемию и увеличение уровня ХС. Выход из положения – применение адекватных доз и сочетание с блокаторами РААС (иАПФ, АРА) и особенно с антагонистами альдостерона, позволяющими предотвращать электролитные нарушения [177, 215].
Этакриновая кислота (стартовая доза 25–50 мг / сут, максимальная до 250 мг) по диуретическим свойствам мало отличается от фуосемида, хотя по химической структуре это единственный диуретик не содержащий в молекуле остатков сульфомоильной кислоты. Поэтому при привыкании и снижении эффективности фуросемида может быть обоснован временный перевод диуретикзависимых больных на прием этакриновой кислоты. В поздних стадиях ХСН, при рефрактерном отечном синдроме возможно сочетание фуросемида и этакриновой кислоты.
Аналогичным с фуросемидом и этакриновой кислотой диуретическими свойствами обладает и буметанид – стартовая доза 0,5–1,0 мг, максимальная до 10 мг. Следует отметить, что в России буметанид обычно применяется в дозах, не превышающих 2 мг, что в тяжелых случаях, безусловно, мало, для достижения оптимального диуреза. Поэтому сложилось мнение, что буметанид слабее фуросемида, хотя это неверно.
В 2006 году в России зарегистрирован самый эффективный и безопасный петлевой диуретик торасемид . Стартовая доза препарата 5–10 мг, которая при необходимости может быть увеличена до 100–200 мг в сутки.
Торасемид типичный петлевой диуретик, блокирующий реабсорбцию натрия и воды в восходящей части петли Генле. По фармакокинетическим свойствам он превосходит фуросемид, Торасемид имеет лучшую и предсказуемую всасываемость, по сравнению с фуросемидом причем его биоусвояемость не зависит от приема пищи и почти вдвое выше, чем у фуросемида [214, 219].
При почечной недостаточности период полувыведения торасемида не изменяется (метаболизм в печени = 80 %) [220].
Но главным положительным отличием торасемида от других петлевых диуретиков являются его дополнительные эффекты, в частности связанные с одновременной блокадой РААС.
- Доказан дозозависимый блокирующий эффект торасемида на стимулируемый ангиотензинном II вход кальция в клетки [221].
- В многочисленных исследованиях показаны антиальдостероновые эффекты торасемида, сопровождающиеся улучшением диастолических свойств миокарда [222].
Таким образом, применение торасемида позволяет преодолевать основные недостатки активной диуретической терапии. Усиливается не только собственно мочегонное действие, но и блокируются побочные эффекты (электролитные нарушения и активация РААС) .
В сравнительных контролируемых исследованиях с фуросемидом, торасемид продемонстрировал более высокую клиническую эффективность и переносимость [223], а также способность уменьшать число повторных госпитализаций в связи с обострением ХСН [224]. В исследовании в TORIC торасемид продемонстрировал способность лучше влиять на прогноз больных с ХСН, что делает этот современный мочегонный препарат средством выбора, в особенности при длительном лечении клинически выраженной декомпенсации (уровень доказанности В ). [225]. Поэтому торасемид обосновано считается диуретическим препаратом первого выбора в лечении больных с ХСН, по мнению АКК / ААС [2].
- Ингибиторы карбоангидразы, как следует из названия, блокируют фермент карбоангидразу в области проксимальных почечных канальцев, что сопровождается незначительным диурезом (прирост до 10–15 %). Как самостоятельные диуретики ингибиторы карбоангидразы в лечении ХСН почти не применяются из–за недостаточного диуретического действия, однако усиливают загрузку натрием нижележащие отделы канальцев, что повышает эффективность более сильных диуретиков. При истощении фермента карбоангидразы через 3–4 дня непрерывного применения, активность ацетозаламида падает, что требует перерыва в лечении.
Поэтому – ацетоазоламид используется в качестве вспомогательного средства на фоне приема активных мочегонных (тиазидных и, или петлевых). Назначаемый в дозах по 0,25 мг трижды в день в течение трех – четырех дней с двухнедельным перерывом этот препарат подкисляет среду, что восстанавливает диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых типично развитие алкалоза. Обязательным считается сочетание активных диуретиков и ацетазоламида у больных с ХСН и сопутствующей легочной патологией (уровень доказанности В) [226].
Кроме того, имеются сведения, что применение ацетазоламида в дозе 0,25 мг за час до отхода ко сну позволяет уменьшить степень ночного апноэ, способного осложнять течение болезни у 40 % больных с ХСН (степень доказанности С) . [227, 228].
5.4.1. Общие вопросы дигитратационной терапии ХСН
В таблице 18 приведены основные показания к назначению, стартовые и максимальные дозировки а также продолжительность действия мочегонных препаратов наиболее часто используемых с в лечении ХСН. Пользуясь этой таблицей можно примерно определить выбор оптимального диуретика в различных клинических состояниях.
Дегитратационная терапия при ХСН имеет две фазы – активную (в период гипергидратации и застоя) и поддерживающую (для поддержания эуволюмического состояния после достижения компенсации).
В активной фазе превышение выделенной мочи над принятой жидкостью должно составлять 1–2 литра в сутки, при снижении веса ежедневно ~ по 1 кг. Никакая стремительная дегидратация не может быть оправданной и лишь приводит к чрезмерной гиперактивации нейрогормонов и рикошетной задержке жидкости в организме.
В поддерживающей фазе диурез должен быть сбалансированным и масса тела стабильной при регулярном (ежедневном) назначении мочегонных. Это наиболее частая ошибка в назначении диуретиков в России: попытка ударного диуреза – один раз в несколько дней. Более ошибочной тактики лечения, как с учетом качества жизни пациента, так и прогрессирования ХСН, трудно представить.
Алгоритм назначения диуретиков (в зависимости от тяжести ХСН) представляется следующим:
I ФК – не лечить мочегонными
II ФК (без застоя) – не лечить мочегонными
II ФК (застой) – тиазидные диуретики, только при их неэффективности можно назначать петлевые мочегонные
III ФК (декомпенсация) – петлевые (тиазидные) + антагонисты альдостерона, в дозах 00–300 мг / сут
III ФК (поддерживающее лечение) – тиазидные (петлевые) + спиронолактон (малые дозы) + ацетазоламид (по 0,25 x 3 раза / сут в течение 3–4 дней, раз в недели)
IV ФК – петлевые + тиазидные (иногда сочетание двух петлевых диуретиков, фуросемида и этакриновой кислоты) + антагонисты альдостерона + ингибиторы карбоангидразы (ацетазоламид по 0,25 x 3 раза / сут в течение 3–4 дней, раз в недели)
Придерживаясь указанных принципов, можно успешно лечить большинство пациентов с декомпенсацией сердечной деятельности и отечным синдромом. Однако в ряде случаев может развиваться толерантность к дегидратационному лечению, в частности, к использованию диуретиков.
Рефрактерность бывает ранняя (так называемое торможение эффекта) и поздняя.
Ранняя рефрактерность развивается в первые часы или дни после начала активного назначения мочегонных средств, зависит от гиперактивации нейрогормонов и тем сильнее, чем активнее дегидратация (тот самый нерекомендуемый обильный диурез). Преодолевается адекватным (не чрезмерным) диурезом плюс обязательным совместным применением иАПФ и / или спиронолактона.
Поздняя рефрактерность развивается спустя недели и месяцы постоянной диуретической терапии и связана с гипертрофией апикальных клеток почечных канальцев, где как раз и действуют диуретики. Бороться с этим видом рефрактерности сложнее. Требуется периодическая (раз в 3–4 недели) смена активных диуретиков и их комбинация с иАПФ. В этих случаях предпочтительно применение торасемида.
Как же поступать при рефрактерном отечном синдроме, когда пациенту требуется экстренная дегидратация? Существуют относительно простые приемы преодоления устойчивости к использованию мочегонных средств:
- Применение диуретиков (лучше предпочесть торасемид) только на фоне иАПФ и спиронолактона. Это главное условие успеха.
- Введение большой (вдвое большей, чем предыдущая неэффективная доза) дозы диуретика и только внутривенно. Некоторые авторы предлагают вводить фуросемид (лазикс) дважды в сутки и даже постоянно внутривенно капельно [218].
- Сочетание диуретиков с препаратами, улучшающими фильтрацию. При САД более 100 мм рт. ст. – эуфиллин (10 мл 2,4 % раствора внутривенно капельно и сразу после капельницы – внутривенно лазикс) или сердечные гликозиды, при более низком АД – допамин ( 2–5 мкг / мин).
- Применение диуретиков с альбумином или плазмой (можно вместе, что особенно важно при гипопротеинемии, но эффективно и у пациентов с нормальным уровнем белка плазмы).
- При выраженной гипотонии – комбинация с положительными инотропными средствами (левосимендан, добутамин, допамин) и, в крайнем случае, с глюкокортикоидами (только на период критической гипотонии).
- Сочетания диуретиков по тем принципам, что указаны выше.
- Механические способы удаления жидкости (плевральная, перикардиальная пункции, парацентез), используются лишь по витальным показаниям.
- Изолированная ультрафильтрация – эффективный способ лечения устойчивого к медикаментозному лечению отечного синдрома. Противопоказания – стенозы клапанных отверстий, низкий сердечный выброс, внутрисердечный выброс и гипотония. К сожалению, эти симптомы присутствуют у большинства пациентов с рефрактерными отеками, что препятствует более широкому использованию этого метода лечения. Однако результаты последних исследований с портативной системой для щадящей ИУФ (с минимальным объемом экстракорпорального объема крови) показали преимущества в сравнении с диуретиками по скорости достижения компенсации [229].
5.5. Сердечные гликозиды
Сердечные гликозиды остаются в числе основных средств лечения ХСН, хотя и не находятся (как 20 и более лет назад) во главе этого списка. Препараты этой группы не улучшают прогноза больных ХСН и не замедляют прогрессирования болезни, но улучшают клиническую симптоматику, качество жизни и снижают потребность в госпитализациях из–за обострения декомпенсации, причем не только при мерцательной аритмии, но и при синусовом ритме (уровень доказанности А) [230–233].
Гликозиды имеют три основных механизма действия – положительный инотропный, отрицательный хронотропный и нейромодуляторный эффекты. Хотя это хорошо и давно известный факт, однако повсеместно практические врачи считают главным именно положительное инотропное действие гликозидов, что совершенно не обосновано [234–237].
В настоящее время в клинической практике в подавляющем числе случаев используется дигоксин, обладающий оптимальными фармакодинамическими свойствами и доказанной клинической эффективностью (уровень доказанности А) [1–4]. Применение других гликозидов для длительного лечения больных ХСН (например, лантозида С), не имеет оснований. Этот препарат хуже всасывается в желудочно–кишечном тракте, а соответственно подбор его доз затруднен. Кроме того, не имеется исследований, подтверждающих его эффективность.
Применение короткодействующих сердечных гликозидов для внутривенного введения (Строфантин К) очень ограниченно: только в случаях обострения СН на фоне тахисистолической формы мерцания предсердий. И даже в этом случае предпочтительным выглядит восстановление синусового ритма.
Мощное положительное инотропное действие гликозидов проявляется при их применении в высоких дозах (для дигоксина более 0,375 мг / сут). Однако применение высоких (более 0,375 мг) доз дигоксина чревато развитием интоксикации и является предиктором негативного влияния на прогноз больных ХСН (уровень доказанности А) [237–239].
Поэтому дигоксин у больных ХСН всегда должен применяться в малых дозах: до 0,25 мг / сут (для больных с массой тела более 85 кг до 0,375 мг / сут, а при массе тела менее 55 кг до 0,125 мг / сут), когда он действует преимущественно как нейрогормональный модулятор, оказывает слабое положительное инотропное действие и не стимулирует развитие нарушений сердечного ритма [235–237].
При явлениях почечной недостаточности суточная доза дигоксина должна быть уменьшена, пропорционально снижению клиренса креатинина (в этих случаях возможно применение дигитоксина). У пожилых больных суточные дозы дигоксина должны быть снижены до 0,0625–0,125 мг (1/4 - 1/2 таблетки).
При мерцательной аритмии – дигоксин можно использовать в качестве средства первой линии благодаря его способности замедлять атрио–вентрикулярную проводимость и снижать ЧСС (а не из–за положительного инотропного действия).
При синусовом ритме дигоксин – лишь пятый препарат после иАПФ, БАБ, антагонистов альдостерона и мочегонных. Его применение требует осторожности, особенно у пациентов с коронарной патологией и стенокардией.
При применении сердечных гликозидов у женщин чаще возникает интоксикация и смертельные осложнения, что связано с более высокими концентрациями, в частности, дигоксина, создающимися в крови при приеме одинаковых доз, чем у мужчин (исследование DIG). Поэтому назначать более низкие дозы и контролировать уровень дигоксина в крови. [239].
Предикторами успеха лечения гликозидами больных с ХСН и синусовым ритмом является низкая ФВ (25 %), большие размеры сердца (кардиоторакальный индекс 55 %), неишемическая этиология СН. Выгодным является сочетание сердечных гликозидов с БАБ, при котором лучше контролируется ЧСС, снижается риск опасных для жизни желудочковых нарушений ритма сердца и уменьшается опасность обострения коронарной недостаточности.
5.6. Антагонисты рецепторов к АII
К этой группе лекарств относятся препараты, эффект которых при ХСН изучается более 10 лет. Однако в сравнительных с иАПФ протоколах не удавалось доказать полной эквивалентности этого альтернативного способа блокады ренин–ангиотензиновой системы. Кроме того, учитывая абсолютные показания к назначению иАПФ всем пациентам с ХСН, невозможно было организовать плацебо–контролируемые исследования с антагонистами рецепторов к АII (АРА) в эру иАПФ.
Ситуация поменялась лишь после завершения трех исследований, вошедших в программу CHARM, в которых изучалась эффективность и безопасность применения АРА кандесартана, у пациентов с ХСН и сниженной или сохранной ФВ ЛЖ [109–111]. В программе CHARM было продемонстрировано достоверное снижение смертности и сердечно–сосудистых госпитализаций. Снижение риска смерти составляло 33 % после первого, 20 % после второго и 12 % после третьего года наблюдения, что очень близко к показателям, полученным в исследовании SOLVD с эталонным иАПФ эналаприлом (23 % через год, 23 % через два и 16 % через три года терапии). Кроме этого, в исследовании CHARM alternative более 2000 пациентов принимали кандесартан в сравнении с плацебо без иАПФ (которые не могли быть назначены из–за наличия серьезных побочных реакций). И в этих условиях снижение риска достижения комбинированной конечной точки (смерти плюс госпитализации) составило 30 % [109]. Следует добавить, что кандесартан был поставлен в более сложные условия, чем иАПФ, которые применялись на фоне комбинации лишь двух препаратов – сердечных гликозидов и мочегонных. Эффект кандесартана доказан для больных ХСН, большинство из которых уже получали и гликозиды, и диуретики, и БАБ, и антагонисты альдостерона, а часть и иАПФ, но не достигли состояния компенсации. Поэтому на сегодня кандесартан может применяться в лечении больных с ХСН и сниженной ФВ наравне с иАПФ (степень доказанности А).
Титрование доз кандесартана проводится по тем же принципам, что и иАПФ. Стартовая доза – 4 мг однократно в сутки, которая при стабильном АД и отсутствии осложнении удваивается каждые 3–5 дней до достижения дозировки 16 мг однократно в сутки. У больных с высоким уровнем АД максимальная дозировка – 32 мг однократно в сутки. При исходной гипотонии (САД менее 100 мм рт. ст.) терапию безопасно начинать с дозы 2 мг в сутки.
В то же время нет убедительных доказательств в способности кандесартана предотвращать развитие ХСН и его эффективности в лечении пациентов с сохраненной систолической функцией ЛЖ [111]. Хотя число госпитализаций больных с сохранной систолической функцией ЛЖ на фоне лечения кандесартаном снижается, достоверного улучшения прогноза не наблюдается.
Очевидно, что кандесартан на сегодня наиболее обоснованный выбор для лечения больных с ХСН, если говорить о всем классе АРА. Из других представителей класса АРА, учитывая отличную переносимость препаратов этой группы при минимуме побочных эффектов, можно с успехом использовать лосартан и валсартан .
Стартовая доза лосартана – 25 мг x 1 р / сут, затем – 50 мг x 1 р / сут и, наконец, 100 мг x 1 р / сут. Порядок повышения дозировок такой же, как для иАПФ.
В исследовании ELITE II лосартан лишь незначительно и недостоверно уступал каптоприлу по влиянию на прогноз пациентов с декомпенсацией и имел лучший профиль переносимости [148]. Кроме того, лосартан может предупреждать развитие ХСН, в том числе у пациентов с диабетом и нефропатией, что выдвигает его в число препаратов для профилактики декомпенсации сердечной деятельности (степень доказанности В) [58].
В крупном исследовании Val–HeFT были продемонстрированы способности сочетания АРА валсартана с иАПФ в уменьшении числа госпитализаций больных с ХСН при отсутствии влияния на прогноз. [240].
Важное значение имеет анализ эффективности валсартана, у больных не получавших иАПФ [241]. В этом случае были впервые продемонстрированы способности АРА не только к уменьшению числа госпитализаций, но и снижению риска смерти больных с ХСН, в сравнении с плацебо. Валсартан на 33 % снижал риск смерти и на 44 % риск смерти плюс повторных госпитализаций у декомпенсированных больных, даже превосходя по этим показателям кандесартан. Кроме того, применение валсартана сопровождается клиническим улучшением и значительной блокадой процессов ремоделирования сердца [240, 242, 243]. По своей эффективности валсартан не уступает иАПФ и может применяться для лечения ХСН (степень доказанности В) [240–243].
Кроме того, валсартан является эффективным средством профилактики ХСН у больных с ОКС, не уступая по этому показателю иАПФ каптоприлу [41].
Дозы валсартана, соответственно – 40 мг x 2 р/д – 80 мг x 2 р/д – 160 мг x 2 р/д. Причем для валсартана показаны положительные эффекты именно высоких доз (степень доказанности В) . [41, 240, 241].
Для других АРА пока недостаточно данных для оценки их эффективности и безопасности в лечении ХСН. В таблице 19 представлены сведения о трех наиболее эффективных АРА, применяемых сегодня для лечения и профилактики ХСН.
Таблица 19. Показания к применению и дозировки АРА, рекомендуемых для профилактики и лечения ХСН.
| Препарат |
Показания |
Стартовая доза |
Терапевтическая доза |
Максимальная доза |
| Кандесартан |
ХСН I–IV ФК, диаст. ХСН |
4 мг x 1 р/д |
16 мг x 1 р/д |
32 мг x 1 р/д |
| Валсартан |
ХСН II–IV, после ОИМ |
20 мг x 2 р/д |
80 мг x 2 р/д |
160 мг x 2 р/д |
| Лосартан |
Непереносимость ИАПФ, профилактика ХСН |
25 мг x 1 р/д |
50 мг x 1 р/д |
100 мг x 1 р/д |
Исходя из имеющихся сегодня данных, АРА можно назначать дополнительно к иАПФ, хотя предпочтение всегда должно отдаваться сочетанию иАПФ с БАБ. Только при непереносимости БАБ следует переходить к комбинации иАПФ плюс АРА.
Показано, что комбинация иАПФ с АРА и нередко при дополнительном назначении БАБ способна в большей степени блокировать нейрогормоны и процессы ремоделирования, что показано для кандесартана [142] и валсартана [240, 243]. Однако тройная комбинация иАПФ + БАБ + АРА может приводить к чрезмерному снижению уровня АД и реактивации нейрогормональных систем, ответственных за прогрессирование ХСН. [244] Поэтому при хорошей переносимости комбинации иАПФ (АРА) + БАБ в качестве третьего нейро–гормонального модулятора лучше использовать антагонисты альдостерона а не АРА (иАПФ).
Не выявлено половых различий в эффективности АРА при ХСН (Val–HeFT, CHARM, ELITE–II), что выгодно отличает этот класс препаратов от иАПФ.
6. Дополнительные средства в лечении ХСН
6.1. Статины
Подтверждения эффективности статинов в лечении больных с ишемической этиологией ХСН получены как во многих ретроспективных анализах контролируемых протоколов, так и в популяционных и когортных (случай–контроль) исследованиях [46, 245, 246, 247–249]. Два крупных проспективных исследования, призванных подтвердить необходимость включения статинов в комплекс терапии больных с ХСН ишемической этиологии, включившие более 12000 пациентов (CORONA, GISSI–HF), пока не закончены [250, 251]. Поэтому формально степень доказанности необходимости применения статинов в комплексном лечении ХСН соответствует степени С. Однако многочисленность и абсолютная однонаправленность имеющихся данных позволяют предполагать способность дополнительного улучшения прогноза больных с ХСН ишемической этиологии при назначении статинов. [46, 245–247].
Результаты ретроспективных анализов, когортных исследований и протоколов по принципу случай – контроль демонстрируют, что статины могут как снижать риск развития ХСН [46–48, 246, 247], так и улучшать прогноз пациентов с уже развившейся декомпенсацией [248, 249, 252, 253].
Учитывая, что снижение уровня ЛПНП не является единственным механизмом положительного действия статинов у больных ХСН, и большое значение придается плейотропным эффектам этого класса лекарств, которые сопровождаются улучшением функции сердца при ХСН [254–257]. Поэтому обсуждается вопрос о возможности применения этого класса лекарств в лечении ХСН не только ишемической этиологии [248, 249, 252, 258].
Для практического использования рекомендуется применение терапевтических доз препаратов, без стремления достичь максимально переносимых дозировок:
- аторвастатиина 10–20 мг
- правастатина 20–40 мг
- розувастатина 5–10 мг
- симвастатина 10–40 мг
- флувастатина 40–80 мг
Названия даны в алфавитном порядке, т. к. на сегодня, не известно имеют ли какие–нибудь представители класса статинов преимущества именно в лечении ХСН
У больных с ХСН IIБ–III стадии, особенно при развитии кардиального цирроза печени, уровень ХС может снижаться, что является одним из предикторов неблагоприятного прогноза [259–261]. В этих случаях (при уровне общего ХС менее 3,2 ммоль / л) от применения статинов необходимо воздержаться [245]. Кроме того, в первые три месяца лечения статинами больных ХСН требуется регулярный контроль уровней печеночных трансаминаз, а также креатинфосфокиназы. При повышении уровня АСТ и АЛТ более чем в три раза от исходных или КФК в 10 раз выше нормы, а также при появлении мышечных болей, лечение статинами необходимо прервать. В остальном контроль за безопасностью терапии не отличается от пациентов, не имеющих симптомов ХСН, как изложено в Рекомендациях ВНОК по лечению атеросклероза [50].
6.2. Антитромботические средства в лечении ХСН (Непрямые антикоагулянты)
Учитывая, что ХСН – это состояние, при котором возрастает риск тромбоэмболий и инсультов, важную роль в терапии этого синдрома играют антикоагулянты [262, 263]. Причем, по мнению ряда исследователей, само наличие ХСН из–за стаза в полостях сердца, наблюдаемого при дилатации ЛЖ, является фактором, способствующим развитию внутривердечного тромбоза как источника будущих тромбоэмболий [264–267].
Доказано, что для предотвращения тромбозов и эмболий у пациентов с ХСН, находящихся на постельном режиме, эффективным может быть лечение низкомолекулярными гепаринами (эноксипарином) по 40 мг / сут в течение 2–3 недель [268, 269]. Аналогичные сведения имеются и для дальтепарина [270, 271], что позволяет считать уровень доказанности по применению этого класса лекарств равным А .
Оральные непрямые антикоагулянты (синкумар, варфарин) обязательны для лечения больных с мерцательной аритмией и повышенным риском тромбоэмболий. Повышенный риск регистрируется у пациентов, имеющих мерцательную аритмию в сочетании с одним из следующих факторов (степень доказанности А):
- пожилой возраст
- наличие тромбоэмболий в анамнезе
- сведения об инсультах и транзиторных нарушениях мозгового кровообращения
- наличие внутрисердечных тромбов
- резкое снижение ФВ (35 %) и расширение камер сердца (КДР6,5 см)
- наличие в анамнезе операций на сердце
Непрямые антикоагулянты при ХСН не могут быть заменены антитромботическими средствами (аспирин, клопидогрел или их комбинация), т. к. эффективность лечения достоверно снижается, а по риску осложнений (кровотечений) комбинация аспирина с клопидогрелом не отличается от варфарина (степень доказанности А) [129, 272–274].
Для уменьшения риска геморрагических осложнений антикоагулянты должны применяться при тщательном контроле (раз в месяц) международного нормализованного отношения (МНО). Известно, что риск тромбоэмболий и выживаемость больных с ХСН и мерцательной аритмией напрямую зависят от длительности и правильности (поддержание МНО в пределах 2,0–3,0) лечения антикоагулянтами [272, 275, 276]. В исследовании ACTIVEW было показано, что при назначении варфарина (1 таблетка в сутки) без контроля МНО, количество кровотечений не отличается от такового на фоне комбинации аспирина с клопидогрелом. При контроле за МНО и поддерживании его в пределах 2,0–3,0, количество кровотечений при лечении варфарином оказывается вдвое меньше, чем при назначении комбинации антиагрегантов (аспирин + клопидогрел).
Доказательств эффективности антикоагулянтов у больных с ХСН и синусовым ритмом (даже при дилатации сердца и наличии тромбов) в настоящее время нет, поэтому в этих случаях их применение остается в компетенции лечащего врача.
7. Вспомогательные средства в лечении ХСН
Препараты, входящие в эту группу, не являются средствами терапии собственно ХСН и должны применяться только при строгих показаниях.
7.1. Периферические вазодилататоры
В настоящее время ПВД не входят в число препаратов, используемых для лечения ХСН. На прогноз, количество госпитализаций, прогрессирование болезни они не влияют (уровень доказанности В).
Исключение составляет применение комбинации нитратов (венозных вазодилататоров) с гидралазином (артериолярными вазодилататорами) у пациентов негроидной расы. У этого контингента пациентов подобная комбинация (в дополнение к иАПФ, БАБ, диуретикам) может способствовать улучшению прогноза [112, 113, 277]. У лиц белой расы всегда предпочтительно использование иАПФ [141, 277]. Кроме того, применение комбинации нитратов с гидралазином стимулирует развитие побочных реакций (гипотония, тахикардия), которые затрудняют лечение больных ХСН.
Нитраты могут даже негативно влиять на прогноз больных с ХСН и затруднять применение иАПФ, т. е. снижать эффективность последних (уровень доказанности С) [123].
Нитраты могут назначаться при ХСН лишь при наличии доказанной ИБС и стенокардии, которая проходит именно (только) от нитропрепаратов. Во всех остальных случаях нитраты при ХСН не показаны.
В качестве артериолярных ПВД можно применять лишь дигидроперидины длительного действия (предпочтительно амлодипин), а не гидралазин.
Следует помнить, что сопутствующее лечение вазодилататорами лишь затрудняет использование абсолютно необходимых в терапии декомпенсации препаратов: иАПФ, АРА и БАБ из–за дополнительной способности к снижению АД. Кроме того, применение прямых ПВД сопровождается активацией нейрогормонов, что чревато прогрессированием ХСН [123, 178].
7.2. Блокаторы медленных кальциевых каналов
Блокаторы медленных кальциевых каналов (БМКК), замедляющие ЧСС (верапамил и дилтиазем), могут использоваться лишь у больных с начальными стадиями ХСН (I–II ФК без застойных явлений), особенно у пациентов с преимущественно диастолической ХСН. При прогрессировании декомпенсации использование дилтиазема и верапамила ухудшает клиническое течение ХСН (уровень доказанности В). Использование БМКК (обязательно в комплексе с иАПФ, БАБ, диуретиками, антагонистами альдостерона) может быть показано при ХСН, преимущественно вызванной диастолическими расстройствами (уровень доказанности С).
Короткодействующие дигидропиридины больным с ХСН противопоказаны.
Из группы длительнодействующих дигидропиридинов амлодипин (исследование PRAISE I и II) и фелодипин (исследование V–HeFT III) доказали способность не ухудшать прогноз больных с ХСН [115, 116, 279, 280]. При этом в некоторых случаях применение этих препаратов может улучшать клинику и уменьшать выраженность симптомов декомпенсации. Возможными показаниями к использованию амлодипина или фелодипина в лечении ХСН (на фоне основных средств лечения) являются:
- наличие упорной стенокардии
- наличие сопутствующей стойкой гипертонии
- высокая легочная гипертония
- выраженная клапанная регургитация.
Применение дигидропиридиновых кальциевых антагонистов, позволяет уменьшать степень клапанной регургитации (митральной и аортальной). Причем эффект дигидропиридинов сохраняется как при органической, так и относительной митральной недостаточности [65, 66].
К сожалению, применение дигидропиридинов у больных с АГ может способствовать задержке жидкости и развитию симптомов ХСН [27, 115, 123]. Поэтому БМКК с вазодилатирующими свойствами не применяются для профилактики ХСН.
Использование кальциевых антагонистов обязательно сочетается с лечением основными средствами терапии ХСН (иАПФ, антагонисты альдостерона, БАБ, диуретики), что может нивелировать негаивные эффекты, связанные с гиперактивацией нейрогормонов и задержкой жидкости.
7.3. Антиаритмические средства в лечении ХСН
Подавляющее число больных с ХСН имеют опасные для жизни желудочковые нарушения ритма сердца (III и выше градации по классификации Lown–Wolff) [281–283]. До 2/3 больных с начальными стадиями декомпенсации и до 1/3 пациентов даже с финальными стадиями ХСН умирают внезапно (скорее всего, из–за наличия аритмий) [187, 284–285]. Причем улучшение гемодинамики не предотвращает возможности развития опасных аритмий, которые могут потребовать специального лечения [286, 287].
- Основные позиции при лечении желудочковых аритмий у больных с ХСН сводятся к следующему:
- Лечения при ХСН требуют лишь опасные для жизни и симптомные желудочковые нарушения ритма сердца (уровень доказанности В) [1–4, 283, 288].
- Антиаритмики I (блокаторы натриевых каналов) и IV (БМКК) классов противопоказаны больным с ХСН (уровень доказанности А).
- Во всех случаях средством выбора в лечении больных с ХСН и желудочковыми нарушениями сердечного ритма являются БАБ, обладающие умеренным антиаритмическим, но выраженным антифибрилляторным действием, что позволяет им достоверно снижать риск внезапной смерти [186, 187, 195, 289]
- При неэффективности БАБ для антиаритмического лечения применяются препараты III класса (амиодарон, соталол, дофетилид) [2, 3].
- Средством выбора у больных с умеренно выраженной ХСН (I–II ФК) является амиодарон, хотя следует помнить, что не менее чем у 40 % больных он вызывает опасные побочные эффекты (чаще всего, особенно в России, нарушение функции щитовидной железы) [290, 291]. Амиодарон следует использовать в малых дозах – 100–200 мг/сут и всегда взвешивать соотношение польза / риск. Амиодарон может снижать риск внезапной смерти у декомпенсированных больных с желудочковыми аритмиями, в то время как риск общей смертности достоверно не меняется (уровень доказанности В) [290, 291]. К тому же эффект амиодарона проявляется максимально ярко лишь при сочетании с БАБ (уровень доказанности В) . [292].
- У больных с выраженной ХСН (III–IV ФК) применение амиодарона ассоциируется с достоверным ухудшением прогноза, поэтому его использование в этих случаях противопоказано (уровень доказанности А) [293]. Причем максимальное проявление неэффективности терапии амиодароном отмечается у пациентов с синусовым ритмом [294].
- Альтернативой амиодарону может быть соталол, антиаритмик III класса, имеющий дополнительные свойства БАБ. По влиянию на желудочковые нарушения ритма сердца соталол лишь немного уступает амиодарону [295, 296]. Соталол имеет существенно меньше внесердечных побочных реакций в сравнении с амиодароном, но чаще вызывает проаритмии, особенно у больных с тяжелым поражением миокарда [297]. Правда за счет наличия бета–блокирующих свойств соталол может улучшать функциональное состояние больных с декомпенсацией [296]. Доза соталола титруется подобно другим БАБ, начиная с 20 мг x два раза в сутки. Через 2 недели дозу увеличивают до 40 мг x два раза в сутки, еще через две недели до 80 мг x два раза в сутки и, наконец, еще через две недели до максисмальной – 160 мг x два раза в сутки. С увеличением дозы препарата и тяжести ХСН увеличивается опасность проаритмических осложнений, поэтому у больных с ХСН III–IV ФК нежелательно превышать суточную дозу 160 мг [297].
- Наиболее оправданным методом профилактики внезапной смерти у больных с ХСН и жизнеугрожающими аритмиями является постановка имплантируемого кардиовертера–дефибриллятора.
- Отдельного внимания заслуживает проблема мерцательной аритмии , которая в качестве основного ритма или пароксизмов регистрируется почти у 40 % пациентов с клинически выраженной ХСН. [298]. и может ухудшать прогноз больных с ХСН [299, 300], хотя на этот счет имеются и противоположные сведения [9]. Лечение мерцательной аритмии у больных с ХСН должно проводиться по принципам, изложенным в Совместном руководстве АКК / ААС и ЕОК по диагностике и лечению этого вида нарушения ритма [301].
- При мерцательной аритмии нет доказательств, что восстановление сердечного ритма превосходит терапевтическую тактику, предполагающую контроль ЧСС (уровень доказанности В) [302–304]. Поэтому целесообразность восстановления синусового ритма (электрическая дефибриляция или медикаментозное купирование) оставляется на усмотрение врача. Единственным независимым предиктором лучшей выживаемости больных с ХСН и мерцательной аритмией является постоянный прием антикоагулянтов при поддержании МНО в пределах от 2,0 до 3,0 (степень доказанности А) [276, 302, 305, 306]
- Из медикаментозных средств восстановления сердечного ритма сегодня в основном применяются антиаритмики III класса, из которых наиболее эффективным представляется амиодарон, превосходящий по эффективности соталол и антиаритмики I класса [307, 308]. Учитывая выраженную токсичность амиодарона, его применение требует строгих показаний [309, 310], хотя по способности провоцировать жизненно опасные нарушения сердечного ритма амиодарон выгодно отличается от соталола и дофетилида [311]. Антиаритмики I класса строго не рекомендованы у больных с дисфункцией ЛЖ, несмотря на наличие мерцательной аритмии.
- Эффективность электрической дефибриляции достигает 90 %, но в течение первого года синусовый ритм удерживается не более, чем у 30 % больных, что требует активной поддерживающей терапии [312].
К факторам, способствующим вероятному повторному срыву ритма и рецидивированию мерцательной аритмии, относятся:
- пожилой возраст (более 65 лет)
- давнее (более 6 месяцев) мерцание предсердий
- частые пароксизмы (рецидивы) мерцательной аритмии
- большие размеры левого предсердия (передне–задний размер более 4,2 см)
- наличие тромбов в полостях сердца (в том числе в ушке левого предсердия)
- низкая ФВ ЛЖ (35 %)
В этих случаях восстановление синусового ритма противопоказано.
- Одним из основных принципов лечения больных с ХСН и имеющейся (или угрожающей) мерцательной аритмией можно считать применение не антиаритмических средств, а препаратов, блокирующих активность РААС. Многочисленные ретроспективные анализы контролируемых многоцентровых исследований подтверждают способность иАПФ (эналаприл, каптоприл) и АРА (валсартан, ирбесартан, кандесартан, лосартан) снижать риск развития и рецидивирования мерцательной аритмии в пределах 28–29 % (степень доказанности В) [313]. Различий в эффективности иАПФ и АРА по данным ретроспективных исследований не выявлено, а наибольший эффект отмечен у больных с ХСН (44 % снижения риска возобновления мерцательной аритмии) и подвергшихся ангиопластике (48 % снижения риска, соответственно). В настоящее время проводится несколько проспективных исследований, посвященных оценке возможности блокады ремоделирования предсердия ингибиторами РААС для удержания синусового ритма у больных с ХСН и мерцательной аритмией (ACTIVE, GISSI–Atrial Fibrilation).
- Удержание синусового ритма после купирования мерцательной аритмии наиболее эффективно с помощью амиодарона, однако и в этих случаях рецидивы мерцания возникают не менее, чем у 30 % больных с фибрилляцией предсердий, да к тому же 25 % пациентов не в состоянии принимать амиодарон в течение длительного времени из–за побочных реакций [307, 311].
- Для контроля ЧСС при постоянной форме мерцательной аритмии наиболее эффективным может быть использование комбинации сердечных гликозидов и БАБ. В данном случае используются два аддититвных механизма. Дигоксин замедляет атриовентрикулярную проводимость уменьшает ЧСС покоя [314, 315]. В то же время БАБ за счет снижения симпатической стимуляции синусового узла потенцируют брадикардитические эффекты дигоксина и предотвращают появление тахикардии во время физических нагрузок [316, 317]. Комбинация дигоксина с БАБ (в том числе и соталолом, способном удерживать синусовый ритм у 40 % больных после кардиоверсии – [307, 311] позволяет эффективно контролировать ЧСС у пациентов с как с сохраняющимся мерцанием предсердий, так и синусовый ритм в межприступный период (cтепень доказанности В) [314–317].
- При не эффективности медикаментозного контроля ЧСС, на фоне отягощения течения ХСН может потребоваться проведение радиочастотной аблации в надежде восстановить синусовый ритм, однако эта процедура должна проводиться лишь при исчерпании всех других возможностей контроля ситуации.
7.4. Антиагреганты (в частности аспирин) в лечении ХСН
Вопрос о применении аспирина больным с ХСН остается не до конца решенным. Проблема в возможности блокады синтеза простациклина даже при использовании самых малых доз препарата 75 мг [127, 318]. Блокада фермента циклооксигеназы, определяющая механизм действия аспирина и других НПВП чревата одновременным ослаблением эффекта иАПФ, диуретиков, альдактона и даже БАБ с вазодилатирующими свойствами – карведилола (уровень доказанности В) [20, 126, 319–322].
С этой точки зрения применение антиагрегантов с другим механизмом действия (клопидогрел), которые позволяют достигать антиагрегационного эффекта без блокады фермента циклооксигеназы, выглядит теоретически более обоснованным [131, 132]. Однако клинических подтверждений этому нет [323, 324].
Следовательно, аспирин и другие антиагреганты должны применяться у больных с ХСН лишь при строгих показаниях. Поэтому позиции по применению антиагрегантов у пациентов с клинически выраженной ХСН сводятся к следующему.
- Убедительных данных о целесообразности применения антиагрегантов для лечения ХСН нет (за исключением острого периода ИМ). Использование аспирина в качестве средства вторичной профилактики у пациентов с давним (более 3–х месяцев) ОИМ позволяет снизить риск повторного ОИМ, но не смерти (уровень доказанности А) [137, 325]. Это положение не имеет никакой доказательности для пациентов с ХСН, не переносивших в прошлом ОИМ. [20, 326] При назначении антиагрегантов нарастает риск геморрагических осложнений, включая желудочно–кишечные кровотечения и геморрагические инсульты. (уровень доказанности А) [137, 325, 327].
- Комбинация даже малых доз аспирина с иАПФ у б–х с ХСН может быть неблагоприятной из–за блокады образования простациклина [аспирином], что ослабляет эффекты иАПФ, диуретиков, антагонистов альдостерона (уровень доказанности С). Это положение основывается в наибольшей степени на ретроспективном анализе крупных протоколов по применению иАПФ или аспирина. [129, 130, 328, 329].
- Назначение аспирина достоверно увеличивает число госпитализаций, связанных с обострением декомпенсации (уровень доказанности В) [44, 45].
- При необходимости использования аспирина, теоретически более оправданным выглядит его сочетание с АРА (а не с иАПФ). Хотя контролируемых клинических исследований, подтверждающих это положение нет (уровень доказанности С).
- Ингибиторы АПФ более обоснованно сочетать с дезаггрегантами, имеющими другой механизм действия (клопидогрель). Но и это положение не подтверждено клиническими исследованиями (уровень доказанности С).
- Эффективность и безопасность использования низких доз двух антиагрегантов аспирина (до 75 мг) и клопидогрела (до 75 мг), которое является абсолютно показанным для больных с перенесенным ОИМ, не может быть рекомендовано у пациентов с ХСН. [276].
- Однако большинство имеющихся на сегодня данных (это вновь результаты ретроспективных анализов, т. к. проспективные данные отсутствуют) позволяют констатировать, что хотя некий негативный момент во взаимодействии малых доз аспирина (75–100 мг!) и иАПФ присутствует, совместное использование этих препаратов у больных, перенесших ОИМ и имеющих ХСН возможно [135, 136, 330, 331].
- Тем не менее, вопрос о целесообразности применения антиагрегантов при ХСН до конца не решен и требует дальнейших специальных исследований. В настоящее время правильной является позиция о максимально редком (только при наличии прямых показаний) назначении минимально эффективных доз препаратов этого класса [2,3].
- По этой же причине нужно избегать назначения НПВП (включая дозы аспирина 325 мг) больным с ХСН, находящимся на лечении иАПФ, диуретиками и альдактоном. Особенно опасно применение НПВП в период декомпенсации и гипергидрпатации, что чревато ухудшением клинического состояния и задержкой жидкости вплоть до развития отека легких.
7.5. Негликозидные инотропные средства в лечении ХСН
Применение негликозидных инотропных средств, несмотря на кратковременное улучшение гемодинамики и клинического состояния больных с обострением декомпенсации [332, 333] при долгосрочном наблюдении повышает риск смерти больных с ХСН (уровень доказанности А). Поэтому эти препараты не могут быть рекомендованы для длительного лечения декомпенсации [334–336].
Более того, даже кратковременная инотропная поддержка в период обострения декомпенсации может негативно влиять на отдаленный прогноз больных с ХСН (уровень доказанности В). Поэтому сегодня эти препараты не рекомендованы для лечения ХСН [337–339].
При критическом состоянии (при обострении ХСН) лучше всего использовать сенситизатор кальция левосимендан (болюс 12 мкг / кг, затем внутривенно капельно 0,1–0,21 мкг / кг / мин). Этот препарат максимально улучшает показатели гемодинамики, не имеет негативных взаимодействий с бета– адреноблокаторами (в отличие от добутамина) и рекомендован ЕОК для лечения обострения ХСН [204, 340, ]. Впервые способность леавосимендана улучшать прогноз больных после ОИМ была продемонстрирована в исследовании RUSSLAN, проводившемся в России [341]. Мета–анализ сравнительных исследований добутамина и левосимендана показывает некоторые преимущества последнего по влиянию на риск смерти больных с ХСН.
Внутривенное введение добутамина (внутривенное капельное введение со скоростью 2,5–10 мкг / кг / мин) должно проводиться лишь при симптомной гипотонии по витальным показаниям, учитывая его негативное влияние на прогноз.
7.6. Препараты, не рекомендованные к применению при ХСН
Лекарственные средства, не имеющие показаний к использованию в комплексной терапии, не должны смешиваться с препаратами, противопоказанными для пациентов с декомпенсацией сердечной деятельности.
Метаболически активные препараты (цитопротекторы) при лечении ХСН
В качестве примера: на сегодняшний день нет убедительных доказательств эффективности применения цитопротекторов в лечении ХСН, хотя некоторые исследования в этой области запланированы. Однако никаких доказательств ухудшения течения декомпенсации при использовании этого класса препаратов нет. Более того, имеются отдельные исследования, демонстрирующие клиническую эффективность триметазидина при его использовании в комплексном лечении ХСН. Поэтому, хотя сегодня нельзя рекомендовать применение триметазидина для лечения ХСН, назначение этого препарата не вредит больным, если триметазидин назначается дополнительно к основным средствам лечения декомпенсации . Более жесткой должна быть позиция по отношению к препаратам с неясным механизмом действия и недоказанной клинической эффективностью, хотя многие из них позиционируются как кардиопротекторы или метаболически активные средства.
Поэтому использование таурина, карнитина, коэнзима Q10 иминдроната в лечении ХСН не показано.
В этот раздел включены препараты, применение которых может реально ухудшать течение ХСН. Другое отношение должно быть к препаратам, которые потенциально способны ухудшать течение болезни и стимулировать прогрессирование ХСН.
Средства не рекомендованные к применению при ХСН
Применение этих препаратов должно быть, по возможности, исключено при лечении декомпенсации. К ним относятся:
- НПВП (селективные и не селективные, включая дозы аспирина 325 мг). Особенно неблагоприятно их использование больным с ХСН, находящимся на лечении иАПФ, диуретиками и альдактоном. Особенно опасно применение НПВП в период декомпенсации и гипергидрпатации, что чревато ухудшением клинического состояния и задержкой жидкости вплоть до развития отека легких.
- Глюкокортикоды. Применение стероидных гормонов имеет чисто симптоматические показания в случаях упорной гипотонии и тяжелого отечного синдрома для облегчения начала лечения иАПФ, диуретиками и БАБ. С другой стороны, возможность опасных для жизни осложнений ограничивает использование этих препаратов.
- Трициклические антидепрессанты.
- Антиаритмики I класса.
- БМКК (верапамил, дилтиазем, коротко действующие дигидроперидины).
8. Медикаментозная терапия больных с ХСН и сохраненной систолической функцией ЛЖ или диастолической ХСН
Нижеприведенные рекомендации носят скорее предположительный характер в виду ограниченности имеющихся данных по вопросу лечения больных с СН–ССФ или ДСН, связанной с отсутствием достаточного количества рандомизированных проспективных исследований у этой категории больных.
Первым и обязательным условием является выявление и коррекция всех факторов и заболеваний, способствующих развитию диастолических расстройств, таких как АГ и ГЛЖ, ИБС, констриктивные поражения миокарда / перикарда, СД, ожирение и т. д. Следует принять адекватное решение и выбрать соответствующие меры по вопросу профилактики, восстановления и поддержания синусового ритма у больных с мерцательной тахиаритмией согласно принятым рекомендациям [16, 342]. При сохранении постоянной формы мерцания предсердий требуется добиться нормализации частоты желудочковых сокращений.
На сегодняшний день отсутствуют убедительные доказательства улучшения выживаемости при использовании какого– либо специфического медикаментозного лечения у пациентов с СН–ССФ или ДСН. Тем не менее, эффективность применения некоторых препаратов была показана в отдельных исследованиях (уровень доказательности В) и в настоящее время продолжает исследоваться.
Ингибиторы АПФ
Ингибиторы АПФ способны напрямую улучшать релаксацию и растяжимость миокарда, а также оказывать опосредованное действие на диастолические свойства ЛЖ за счет своего гипотензивного эффекта и способности уменьшать выраженность гипертрофии и фиброза миокарда. В раннем исследовании Philbin EF. и Rocco TA. [343] было показано, что терапия иАПФ больных с СН–ССФ достоверно продлевает время до вынужденной госпитализации из–за развития декомпенсации, но показывает лишь тенденцию к снижению смертности таких больных. Достоверное улучшение суррогатных конечных точек (функционального статуса, толерантности к нагрузке, качества жизни) у больных с ХСН и относительно сохраненной сократимостью (ФВ45 %) было показано в проспективном российском исследовании ФАСОН с иАПФ фозиноприлом [344]. Единственное завершившееся к настоящему времени плацебо–контролируемое исследование по оценке влияния иАПФ на выживаемость пожилых больных с ДСН (PEP–CHF), выполненное с периндоприлом, также не показало достоверного снижения общей или сердечно–сосудистой смертности на фоне лечения иАПФ [345]. Тем не менее, через 1 год после начала исследования терапия иАПФ ассоциировалась с достоверным снижением риска внеплановой госпитализации из–за декомпенсации (HR 0,63; CI 0,40–0,97; p=0.033). Таким образом, иАПФ пока не доказали своей способности улучшать прогноз больных СН–ССФ и ДСН, однако их применение у таких больных абсолютно оправдано, по крайней мере, в связи с улучшением функционального статуса пациентов и уменьшением риска вынужденных госпитализаций (уровень доказательности А.
Антагонисты рецепторов к АII
По степени положительного влияния на ГЛЖ и выраженность фиброза АРА не уступают иАПФ [346], а по способности устранять диастолические расстройства могут даже превосходить иАПФ. Так, в российском сравнительном исследовании ПИРАНЬя применение АРА ирбесартана у больных с СН–ССФ и тяжелыми диастолическими расстройствами ассоциировалось с более выраженным улучшением как гемодинамики, так и функционального статуса больных, чем терапия иАПФ периндоприлом [347]. Тем не менее, как и с иАПФ, в настоящее время закончено лишь одно многоцентровое плацебо–контролируемое исследование по оценке влияния АРА на выживаемость больных с СН–ССФ – это CHARM–preserved, выполненное с кандесартаном. Это исследование так же не выявило достоверного снижения риска сердечно–сосудистой смертности больных СН–ССФ при применении АРА. Но частота госпитализаций, связанных с обострением декомпенсации и число новых случаев СД в группе кандесартана было достоверно меньше, чем в группе плацебо. В настоящее время продолжаются еще несколько многоцентровых контролируемых исследований с АРА: (I–PRESERVE, HK–DHF, ONTARGET / TRANSCEND), в том числе с участием российских пациентов. Таким образом, АРА пока так же не доказали своей способности улучшать прогноз больных СН–ССФ и ДСН. Тем не менее, как показали итоги исследования CHARM–preserved, применение АРА кандесартана при диастолических расстройствах позволяет, по меньшей мере, снизить частоту госпитализаций и его использование в таких ситуациях обосновано, особенно при непереносимости иАПФ (уровень доказательности В).
Блокаторы –адренергических рецепторов
БАБ могут быть назначены с целью уменьшения ЧСС (увеличения периода диастолического наполнения ЛЖ) и выраженности ГЛЖ (уменьшения жесткости камеры ЛЖ). Исследование SWEDIC [348] показало, что a--адреноблокатор карведилол, помимо снижения ЧСС, оказывает положительное влияние на ДЭхоКГ показатели релаксации ЛЖ у больных с ДСН. Специальных работ по изучению влияния БАБ на выживаемость больных с СН–ССФ или ДСН не проводилось. Однако в исследовании SENIORS с небивололом, в которое было включено более 700 пожилых больных с незначительно сниженной сократимостью (ФВ ЛЖ 35 %), терапия этим БАБ ассоциировалась со снижением комбинированного показателя общей смертности или госпитализации по сердечно–сосудистым причинам (уровень доказательности С) [194].
Верапамил
С такой же целью, что и -блокаторы, может быть использован антагонист кальция верапамил. Однако, как показало исследование DAVIT II у больных в раннем постинфарктом периоде, назначение верапамила при наличии СН в анамнезе, малоэффективно [349]. Таким образом, назначение верапамила больному с ДСН для снижения ЧСС может быть рекомендовано только в случае непереносимости БАБ и при отсутствии выраженной СН, проявляющейся, например, задержкой жидкости (уровень доказательности С).
Диуретики
Диуретики могут быть необходимы в случае задержки жидкости в организме, но у пациентов с ДСН их следует использовать с осторожностью, чтобы не вызвать чрезмерного снижения преднагрузки на ЛЖ и падения сердечного выброса (уровень доказательности С). Среди других следует выделить новый для РФ петлевой диуретик торасемид. Помимо эффективного диуреза этот препарат имеет меньшее, чем у фуросемида, калийуретическое действие [225] и, что может быть особенно важно для больных с ДСН, обладает собственным антифибротическим влиянием на миокард [350]. Однако исследований по выживаемости с применением торасемида у больных с диастолическими расстройствами еще не проводилось.
Антагонисты альдостерона
Антагонисты альдостерона у больных с диастолическими расстройствами должны рассматриваться не столько как К+– сберегающие диуретики, сколько как антифибротические препараты. До настоящего времени не проводилось ни одного плацебо–контролируемого исследования по оценке влияния антагонистов альдостерона на выживаемость больных с диастолической СН. В настоящее время в США проходит первое многоцентровое контролируемое исследование (TOPCAT), целью которого является изучение влияния спиронолактона на выживаемость больных с начальной и умеренной стадиями ХСН и ФВ ЛЖ 45 %.
Сердечные гликозиды
Ритмоурежающее действие сердечных гликозидов (дигоксина) может быть полезно для больных с мерцательной аритмией, которая встречается примерно у 30 % больных с диастолической СН [7]. Однако результаты исследования DIG [230] показали, что даже вне зависимости от характера основного ритма, применение дигоксина ассоциируется с более чем 30 % снижением госпитализаций из–за декомпенсации ХСН у больных как со сниженной (45 %), так и относительно сохраненной (45 %) ФВ ЛЖ. Более того, субанализ этого исследования показал, что при низких концентрациях препарата в плазме крови (0,9 ng / ml) отмечается достоверное снижение риска смерти и госпитализаций по любым причинам, в т. ч. и у больных с сохраненной систолической функцией [351]. Тем не менее, следует воздержаться от рутинного использования дигоксина у этой категории больных, а при необходимости снижения ЧСС отдать предпочтение БАБ. При невозможности применения БАБ и выборе терапии в пользу дигоксина, доза препарата не должна превышать 0,25 мг / сут.
9. Хирургические и электрофизиологические методы лечения ХСН
9.1. Электрофизиологические методы лечения ХСН
сводятся на сегодняшний день к трем процедурам:
- постановке (имплантации) обычных электрокардиостимуляторов (ЭКС) , что актуально для пациентов с синдромом слабости синусового узла и атриовентрикулярными блокадами (см. рекомендации ВНОА по имплантации ЭКС, 2005) [352]. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а адаптируемой частотой стимуляции и прежде всего – двухкамерных.
Однако длительная стимуляция правого желудочка сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН, поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки справа.
- развитие этого направления привело к внедрению метода так называемой сердечной ресинхронизирующей терапии (СРТ) . Для этого используется схема трехкамерной стимуляции сердца – один электрод в правом предсердии, второй в правом и третий (через коронарный синус) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атриовентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции).
- наконец последней является постановка имплантируемого кардиовертера–дефибриллятора (ИКД) больным с ХСН и опасными для жизни желудочковыми нарушениями ритма сердца – желудочковой тахикардией или фибрилляцией желудочков сердца.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинаться только на фоне максимальной активной терапии при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуются больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройства.
Современные принципы электрофизиологического лечения ХСН включают в себя положения, как правило подтвержденные крупными контролируемыми исследованиями и имеют высокую степень доказанности.
- Сердечная ресинхронизирующая терапия (СРТ) (предсердно– двухжелудочковая стимуляция) показана больным с ХСН III–IV ФК, желудочковой диссинхронией (QRS120 мс и по данным ЭхоКГ) и сниженной ФВ ЛЖ, которые не могут быть компенсированы на максимальной медикаментозной терапии. Применение СРТ позволяет улучшать симптоматику больных (класс показаний I, степень доказанности А) , снижать число госпитализаций (класс показаний I, степень доказанности А) и снижать смертность (класс показаний I, степень доказанности В) [1, 2, 353–355]
- Имплантация ИКД с возможностью сердечной ресинхронизирующей терапии (СРТ) показана больным с ХСН III–IV ФК, сниженной ФВ ЛЖ и желудочковой диссинхронией (QRS120 мс и по данным ЭхоКГ), для улучшения течения заболевания и снижения смертности (класс показаний IIа, степень доказанности В) [1, 2, 353, 354].
- Больным с умеренно выраженной ХСН (II ФК), применение сердечной ресинхронизирующей терапии может быть показано при наличии желудочковой диссинхронии, причем при наличии показаний для ИКД, рекомендуется имплантация ИКД с возможностью сердечной ресинхронизирующей терапии (класс показаний II а, степень доказанности С) [356].
- Имплантация ИКД рекомендуется для улучшения прогноза всем больным, имевшим эпизод остановки сердца или ЖТ (вторичная профилактика ВСС) при наличии сниженной ФВ ЛЖ (менее 40 %) (класс показаний I, степень доказанности А) [352, 353, 356–358].
- Имплантация ИКД рекомендуется больным с целью первичной профилактики ВСС при ишемической систолической дисфункции ЛЖ, после перенесенного не менее 40 дней назад ИМ, ФВ ЛЖ менее или равной 30–40 %, ФК II или III (класс показаний I, степень доказанности А) , а также неишемической систолической дисфункцией ЛЖ и ФВ ЛЖ менее или равной 30–35 %, ФК II или III (класс показаний I, степень доказанности В) [1, 2, 353–357, 359–360].
- Постановка ИКД не показана пациентам с рефрактерной ХСН, у которых невозможно предполагать достижение компенсации и благоприятного прогноза (класс показаний III, степень доказанности А) [1, 2, 352, 353].
- Имплантация ИКД может быть рекомендована больным с ишемической дисфункцией ЛЖ (не менее чем через 40 дней после перенесенного ИМ), с ФВ ЛЖ менее или равной 30–35 %, находящихся в I ФК (класс показаний IIа, степень доказанности В) [1, 2, 352, 353, 356, 357, 360, 361].
- Изолированная имплантация ИКД имеет ограничения, связанные как со стимуляцией правого желудочка, так и с разрядами, как обоснованными, так и необоснованными. Причем в обоих случаях происходит ухудшение течения ХСН. Для устранения диссинхронии вследствие желудочковой стимуляции, необходимо использовать устройство, сочетающее функции ИКД и ресинхронизации сердца. Для минимизации количества разрядов необходимо назначение адекватной медикаментозной антиаритмической терапии (амиодарон, соталол, бетаадреноблокаторы или их комбинация) и программирор вание ИКД в режиме, так называемой безболевой терапии путем использования на первом этапе купирования желудочковых аритмий (до нанесения шокового разряда ИКД) метода антитахикардитической стимуляции (класс показаний I, уровень доказанности С) [2, 360, 362].
9.2. Хирургические методы лечения ХСН
При неэффективности терапевтического лечения ХСН и критическом обострении ситуации приходится прибегать к хирургическим и механическим методам лечения. Несмотря на их большое разнообразие, уровень доказательности эффективности и безопасности их применения, как правило, весьма низок и ограничивается отдельными эмпирическими наблюдениями. Кроме того, следует отметить, что проведение любых методов лечения подразумевает одновременное максимально эффективное медикаментозное лечение ХСН (по принципам, изложенным выше). То есть хирургия или электрофизиология не вместо, а вместе с медикаментозным лечением ХМН.
Хирургическое лечение ХСН
В первую очередь необходимо выделить как наиболее популярное вмешательство – операцию по реваскуляризации миокарда (аорто–коронарное или маммарно–коронарное шунтирование). Смертность больных в результате оперативных вмешательств прямо коррелирует с ФВ ЛЖ. Поэтому хирурги предпочитают отказываться от операций у пациентов с ФВ 35 %. В связи с этим доказательства эффективности реваскуляризации миокарда у больных с ХСН имеют лишь теоретическое обоснование и опыт разрозненных исследований. В настоящее время проводятся специальные крупномасштабные исследования по изучению этого вопроса (STICH).
Операция по коррекции митральной регургитации (вмешательства на клапане) позволяет улучшать симптомы ХСН у тщательной отобранной подгруппы больных (уровень доказанности В). Влияние на прогноз неизвестно.
Операция кардиомиопластики с использованием лоскута широчайшей мышцы спины не эффективна и не может быть рекомендована для лечения ХСН (класс рекомендаций I, уровень доказанности В).
Операция частичной вентрикулотомии (операция Батисты) или хирургическое ремоделирование сердца оказалось также неэффективным и в настоящее время не может быть рекомендовано для лечения ХСН (класс рекомендаций I, уровень доказанности В).
Операция трансплантации сердца традиционно считается средством выбора в лечении финальной стадии ХСН, не поддающейся эффективному терапевтическому воздействию. Однако какие–либо контролируемые исследования по оценке эффективности трансплантации сердца отсутствуют (уровень доказанности С). Вместе с тем эмпирические наблюдения подтверждают клиническую эффективность и хороший прогноз при правильном выборе показаний к оперативному лечению.
Главными ограничениями к эффективному использованию этого метода следует считать:
- отсутствие достаточного количества донорских сердец,
- проблему отторжения пересаженного сердца, требующую мощной и крайне дорогой иммуносупрессивной терапии,
- болезнь коронарных артерий пересаженного сердца, не имеющую эффективного лечения.
Суммируя вышесказанное, можно констатировать, что трансплантация сердца не имеет серьезного будущего и, как подтверждение тому – пик использования этой методики в США пришелся на 1994 год, после чего количество вмешательств неуклонно уменьшается.
Главной альтернативой трансплантации может быть использование аппаратов вспомогательного кровообращения, получивших название искусственных желудочков сердца.
Вначале эти устройства использовались у больных ХСН и критическим нарушением гемодинамики, ожидающих операции по пересадке сердца (мост к трансплантации). Однако затем выяснилось, что через несколько месяцев работы вспомогательного аппарата происходило частичное восстановление функций собственного сердца.
На сегодняшний день механические искусственные желудочки сердца стали весьма миниатюрными и достаточно надежными в техническом отношении. Они полностью имплантируются в полость тела пациента и через поверхность кожных покровов к ним подходит только провод, подающий электроэнергию от портативной аккумуляторной батареи, которую пациент носит на поясе.
Созданы и успешно применяются в клинической практике особо миниатюрные искусственные желудочки, представляющие собой микротурбину, приводимую в движение маленьким электродвигателем, делающим до 50.000 оборотов в минуту. Микротурбина и электромотор находятся на конце катетера, который путем пункции бедренной артерии проводится в аорту и устанавливается в полости ЛЖ. Подобная система способна перекачивать из полости ЛЖ в аорту до 6 литров крови в минуту, что обеспечивает полную гемодинамическую разгрузку желудочка и способствует восстановлению его сократительной способности.
На сегодня в специальных исследованиях доказано, что постановка искусственного ЛЖ улучшает прогноз больных с критической ХСН (уровень доказанности В). По своей эффективности (влиянию на выживаемость) метод постановки искусственного ЛЖ превосходит все терапевтические методы лечения [363].
Главным ограничением к использованию в России может оказаться высокая стоимость.
Другими ограничениями являются осложнения, главными из которых остаются вторичная инфекция, а также тромбоз аппарата и тромбоэмболические осложнения.
Для предотвращения прогрессирования ремоделирования желудочков применяется операция окутывания сердца эластичным сетчатым каркасом. Предварительные результаты использования этой методики показывают, что она предотвращает прогрессирование СН, нарастание дилатации сердца, развитие регургитации на клапанах, улучшает функциональное состояние больных и повышает действенность медикаментозной терапии. В случае использования на начальных стадиях дилатационной кардиомиопатии имплантация сетчатого каркаса во многих случаях обеспечивает обратное развитие процесса патологического ремоделирования желудочков. Вместе с тем, данная методика еще находится на этапе своего становления и для подтверждения ее эффективности необходимы результаты клинических исследований.
Механические методы лечения ХСН
Механические методы лечения ХСН на сегодняшний день сводятся, по сути, к использованию ограничительной наружной эластической сетки, ограничивающей дилатацию сердца. Первые клинические наблюдения показали безопасность этой процедуры, но до ее широкого внедрения в практику должны быть проведены тщательные клинические исследования. Рисунок 5 является обобщенным схематическим руководством по стратегии выбора препаратов и началу терапии больных ХСН. Сплошные линии подразумевают обязательность назначения препарата, пунктирные линии – специальные клинические ситуации, когда препарат может быть назначен. Отсутствие линии в графе той или иной стадии болезни означает, что препарат или манипуляция не имеют показаний для этих больных.
|
|
| Рисунок 5. |
Из таблицы видно, что иАПФ является обязательным препаратом, начиная с I ст. ХСН и их назначение является обязательной процедурой на всех этапах прогрессии болезни.
При необходимости терапия может начинаться и с АРА, предпочтительно с кандесартана. При непереносимости иАПФ кандесартан, также как лозартан и валсартан и являются препаратами выбора, кроме этого АРА могут использоваться вместе с иАПФ, хотя всегда предпочтительна комбинация одного из блокаторов РААС (иАПФ или АРА) с БАБ.
Бета–блокаторы при I ст. ХСН назначается только в случае, когда ИБС верифицирована, в первую очередь у больных после ИМ, со IIА стадии ХСН назначение бета–блокаторов является обязательным. К числу рекомендуемых препаратов относится бисопролол, карведилол и метопролола сукцинат ЗОК.
Спиронолактон является обязательным препаратом у больных с ХСН III–IV ФК, хотя у больных, перенесших ОИМ эта группа препаратов может назначаться и раньше (по крайней мере со II ФК).
Показанием к началу терапии диуретиками являются очевидные признаки застоя, как правило, начиная со II ФК, и лучшим выбором может быть торасемид.
СГ даже у больных I–IIА стадией болезни являются обязательными при наличии у пациента мерцательной аритмии. Синусовый ритм при сочетании с низкой ФВ (меньше 30 %) и у больных с упорной ХСН III–IV ФК являются показанием к началу терапии малыми дозами СГ (не более 0,25 мг / сут).
При мерцательной аритмии назначение антикоагулянтов является обязательной процедурой независимо от стадии болезни. При синусовом ритме, даже при наличии внутрисердечного тромбоза эффективность антикоагулянтов не доказана. Антиагреганты не могут адекватно заменить антикоагулянты в предотвращении риска тромбоэмболических осложнений.
Ишемический генез ХСН предполагает начало терапии статинами с I ст. ХСН. Более того, статины могут быть эффективными средствами профилактики ХСН.
Профилактика внезапной сердечной смерти у больных с ХСН с помощью медикаментозной терапии обычно не достаточно эффективна, хотя применение БАБ и их комбинации с амиодароном у пациентов высокого риска при умеренной ХСН (I–II ФК) является показанной. У пациентов с выраженной ХСН (III–IV ФК) применение амиодарона не показано.
Имплантация кардиовертера–дефибриллятора, как наилучшего средства профилактики внезапной сердечной смерти больных с ХСН показана на любой стадии болезни, после документированной остановки сердца и успешной реанимации. Это показание распространяется на тяжелых больных с ХСН, ишемической и неишемической этиологии, особенно пациентов с низкой ФВ (35 %) и неэффективной терапией. При тяжелой ХСН (III–IV ФК) имплантация кардиовертера–дефибрилятора, несмотря на предотвращение риска внезапной смерти, может стимулировать прогрессирование декомпенсации (из–за стимуляции правого желудочка и создании диссинхронии работы сердца), что требует подключение ресинхранизационного лечения.
Клинический эффект установки ресинхронизаторов (трехкамерная стимуляция сердца) доказан для пациентов, имеющих низкую ФВ и широкий комплекс QRS (больше 120 мс), что как правило соответствует поздним стадиям болезни (III–IV ФК). В настоящее время используются аппараты, объединяющие ресинхронизатор и имплантируемый кардиовертер–дефибрилятор.
В схеме лечения пациентов с поздними стадиями течения болезни, особенно при недостаточной эффективности медикаментозной терапии, могут рассматриваться хирургические методы лечения. Наибольшее распространение получили аппараты вспомогательного кровообращения (искусственный ЛЖ), доказавшие способность улучшать прогноз больных с ХСН. Несмотря на все трудности и недостатки пересадка сердца может быть последним резервом спасения жизни больных с терминальной ХСН. Эффективность и безопасность других хирургических методов лечения требует дальнейших исследований.
Клеточная терапия в настоящее время не может быть рекомендована к рутинному использованию, в связи с отсутствием убедительных данных о ее эффективности и безопасности.
Следует помнить, что на всех этапах развития болезни должны применяться не медикаментозные методы лечения, проводиться пропаганда здорового образа жизни и организовываться контроль за амбулаторным лечением больных с ХСН.
Классификация ХСН ОССН 2002 (с комментариями и приложениями)
| Стадии ХСН |
Функциональные классы ХСН |
||
| I ст |
Начальная стадия заболевания (поражения) сердца. Гемодинамика не нарушена. Скрытая сердечная недостаточность. Бессимптомная дисфункция ЛЖ. |
I ФК |
Ограничения физической активности отсутствуют: привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и/или замедленным восстановлением сил. |
| IIА ст |
Клинически выраженная стадия заболевания (поражения) сердца. Нарушения гемодинамики в одном из кругов кровообращения, выраженные умеренно. Адаптивное ремоделирование сердца и сосудов. |
II ФК |
Незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением. |
| IIБст |
Тяжелая стадия заболевания (поражения) сердца. Выраженные изменения гемодинамики в обоих кругах кровообращения. Дезадаптивное ремоделирование сердца и сосудов. |
III ФК |
Заметное ограничение физической активности: в покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов. |
| III ст |
Конечная стадия поражения сердца. Выраженные изменения гемодинамики и тяжелые (необратимые) структурные изменения органов–мишеней (сердца, легких, сосудов, головного мозга, почек). Финальная стадия ремоделирования органов. |
IV ФК |
Невозможность выполнить какую–либо физическую нагрузку без появления дискомфорта; симптомы СН присутствуют в покое и усиливаются при минимальной физической активности. |
| Пример: ХСН IIБ стадии, II ФК; ХСН II а стадии, IV ФК |
|||
Комментарии к классификации ХСН ОССН
Во-первых, касательно ХСН стадии 0. В классификации она отсутствует, т. к. при отсутствии симптомов и поражения сердца ХСН у больного просто нет. Бессимптомная дисфункция ЛЖ (см. определение в приложении 1) уже соответствует I–й стадии болезни или по выраженности симптомов – I–му ФК.
Вовторых, для определения стадии ХСН, как это было в классификации В. Х. Василенко и Н. Д. Стражеско, также как и для определения ФК ХСН, как это принято в классификации Нью–Йоркской Ассоциации сердца (NYHA), специальных процедур и исследований (например, велоэргометрии) не требуется.
Втретьих, для объективизации стадии ХСН приводится приложение 1, определяющее понятие бессимптомной дисфункции, адаптивного и дезадаптивного ремоделирования сердца.
Вчетвертых, для объективизации ФК ХСН приводятся приложение 2 (дистанция 6–мин ходьбы) и приложение 3.
Приложение 1. Характеристика функции, дисфункции, адаптивного и дезадаптивного ремоделирования сердца
Определение ремоделирования сердца (M. Pffefer в модификации Ю. Н. Беленкова)
Ремоделирование сердца – структурно–геометрические изменения ЛЖ, включающие в себя процессы гипертрофии миокарда и дилатации сердца, приводящие к изменению его геометрии и нарушению систолической и диастолической функции.
Бессимптомная дисфункция ЛЖ (соответствует I стадии)
- Симптомы ХСН в покое и при обычных нагрузках отсутствуют (см. соответствующее определение в I стадии).
- Систолическая дисфункция: ФВ ЛЖ45 % и/или конечно–диастолический размер (КДР) ЛЖ5,5 см (индекс конечного диастолического размера (ИКДР) ЛЖ3,3 см/м).
- Диастолическая дисфункция: ТМЖП (толщина межжелудочковой перегородки)+ТЗСЛЖ (толщина стенки ЛЖ) : 21,3 см и / или ТЗСЖ1,2 см и / или гипертрофический тип спектра трансмитрального допплеровского потока (ТМДП) (Е / А 1,0).
- При этом относительная толщина стенок ЛЖ ТМЖП + ТЗСЛЖ / КДР не отличается от нормы и составляет 0,45.
- Индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ) не отличается от нормы 0,70.
Адаптивное ремоделирование ЛЖ (соответствует II А стадии)
- Симптомы (см. соответствующее определение во II А стадии).
- Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ) 0,70 и / или относительная толщина стенок ЛЖ (ТМЖП+ТЗСЛЖ / КДР ЛЖ)0,30 и 0,45.
- Диастолическая дисфункция (см. в I стадии) + псевдонормальный тип спектра ТМДП :1,1 и 2,0.
Дезадаптивное ремоделирование ЛЖ (соответствует II Б стадии)
- Симптомы (см. соответствующее определение во II Б стадии).
- Систолическая дисфункция (см. в I стадии) + индекс сферичности ЛЖ в систолу (отношение короткой оси ЛЖ к длинной оси ЛЖ)0,80 и / или относительная толщина стенок ЛЖ (ТМЖП++ТЗСЛЖ / КДР ЛЖ)0,30.
- Диастолическая дисфункция (см. в I стадии) + рестриктивный тип спектра ТМДП2,0.
Приложение 2. Определение дистанции шестиминутной ходьбы
Этот метод широко используется в последние 4–5 лет в международной практике и позволяет оценить толерантность пациента к физическим нагрузкам, используя минимальные технические средства. Суть его заключается в том, что нужно измерить, какую дистанцию в состоянии пройти пациент в течение 6 минут. Для этого требуются лишь часы с секундной стрелкой и рулетка. Проще всего заранее разметить больничный или поликлинический коридор и попросить пациента двигаться по нему в течение 6 минут. Если пациент пойдет слишком быстро и вынужден будет остановиться, эта пауза, естественно, включается в 6 минут. В итоге вы определите физическую толерантность вашего больного к нагрузкам. Каждому ФК ХСН соответствует определенная дистанция 6–минутной ходьбы (табл. 1).
Таблица 1.
| Выраженность ХСН |
Дистанция 6-мин ходьбы (м) |
| Нет ХСН |
551 м |
| I ФК ХСН |
426–550 м |
| II ФК ХСН |
301–425 м |
| III ФК ХСН |
151–300 м |
| IV ФК ХСН |
150 м |
Приложение 3. Шкала оценки клинического состояния при ХСН (ШОКС) (модификация В. Ю. Мареева, 2000)
- Одышка: 0 – нет, 1 – при нагрузке, 2 – в покое
- Изменился ли за последнюю неделю вес: 0 – нет, 1 – увеличился
- Жалобы на перебои в работе сердца: 0 – нет, 1 – есть
- В каком положении находится в постели: 0 – горизонтально, 1 – с приподнятым головным концом (+2 подушки), 2 – 1+ночные удушья, 3 – сидя
- Набухшие шейные вены: 0 – нет, 1 – лежа, 2 – стоя
- Хрипы в легких: 0 – нет, 1 – нижние отделы (до 1/3), 2 – до лопаток (до 2/3), 3 – над всей поверхностью легких
- Наличие ритма галопа: 0 – нет, 1 – есть
- Печень: 0 – не увеличена, 1 – до 5 см, 2 – более 5 см
- Отеки: 0 – нет, 1 – пастозность, 2 – отеки, 3 – анасарка
- Уровень САД: 0 – 120, 1 – (100–120), 2 – 100 мм рт. ст.
Оценка ШОКС
- Во время осмотра больного врач задает вопросы соответственно пунктам от 1 до 10
- В карте отмечается число баллов, соответственно ответу, которое в итоге суммируется
- Всего максимально больной может набрать 20 очков (критическая ХСН)
- 0 очков – полное отсутствие признаков ХСН
По ШОКС баллы соответствуют:
I ФК – до 3,5 баллов
II ФК – 3,5–5,5 баллов
III ФК – 5,5–8,5 баллов
IV ФК – более 8,5 баллов
Список литературы
- Guidelines for the diagnosis and treatment of Chronic Heart Failure: full text (update 2005) The Task Force for the diagnosis and treatment of CHF of the European Society of Cardiology (European Heart Journal doi:10.1093/eurheartj/ehi205).
- ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). http: www.acc.org/qualityandscience/clinical/guidelines/failure/update/index.pdf
- HFSA 2006 Comprehensive Heart Failure Practice Guideline Journal of Cardiac Failure. 2006;12:e1–e122.
- Национальные рекомендации по диагностике и лечению ХСН (Утверждены съездом кардиологов РФ в октябре 2003 г.) Журнал Сердечная Недостаточность. 2003;4(6):276–297.
- Агеев Ф.Т., Даниелян М.О., Мареев В.Ю. и др. Больные с хронической сердечной недостаточностью в российской амбулаторной практике: особенности контингента, диагностики и лечения (по материалам исследования ЭПОХА–О–ХСН). Журнал Сердечная недостаточность. 2004;5(1):4–7.
- Cleland JG, Swedberg K, Follath F et al. The EuroHeart Failure survey programme a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur Heart J. 2003;24(5):442–463.
- Мареев В.Ю., Даниелян М.О., Беленков Ю.Н. От имени рабочей группы исследования ЭПОХА–О–ХСН. Сравнительная характеристика больных с ХСН в зависимости от величины ФВ по результатам Российского многоцентрового исследования ЭПОХА–О–ХСН. Журнал Сердечная Недостаточность. 2006. В печати.
- Owan TE, Hodge DO, Herges RM et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med. 2006;355:251–9
- Даниелян М.О. Прогноз и лечение хронической сердечной недостаточности (данные 20–и летнего наблюдения). Автореф. дис. канд. мед. наук. Москва. 2001
- Hogg K, Swedberg K, McMurray J. Heart Failure with preserved left ventricular systolic function. Epidemiology, Clinical Characteristics, and Prognosis J Am Coll Cardiol. 2004;43:317–27,
- Cowie MR, Fox KF, Wood DA et al. Hospitalization of patients with heart failure: a population–based study. Eur Heart J. 2002;23:877–85.
- McAlister FA, Teo KK, Taher M et al. Insight into the contemporary epidemiology and outpatient management of congestive heart failure. Am Heart J. 1999;138:87–94.
- Агеев Ф.Т. Влияние современных медикаментозных средств на течение заболевания, качество жизни и прогноз больных с различными стадиями хронической сердечной недостаточности. Автореф. Дисс. Докт., Москва, 1997.
- The Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. Increasing awareness and improving the management of heart failure in Europe: the IMPROVEMENT of HF initiative. Eur J Heart Failure. 1999;20:139–144.
- Zile MR, Gaasch WH, Carroll JD et al. Heart failure with a normal ejection fraction: is measurement of diastolic function necessary to make the diagnosis of Diastolic Heart Failure? Circulation. 2001;104;779–782
- ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation–executive summary. EHJ. 2006;27:1979–2030.
- Cleland JG, Swedberg K, Follath F et al. The EuroHeart Survey programme – a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur Heart J. 2003;24:442–463.
- Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Даниелян М.О. Первые результаты национального эпидемиологического исследования – эпидемиологическое обследование больных ХСН в реальной клинической практике (по обращаемости) – ЭПОХА–О–ХСН. Журнал Сердечная Недостаточность. 2003;4(3):116–121.
- Агеев Ф.Т., Даниелян М.О., Мареев В.Ю., Беленков Ю.Н. Больные с хронической сердечной недостаточностью в российской амбулаторной практике: особенности контингента, диагностики и лечения (по материалам исследования ЭПОХА–О–ХСН). Журнал Сердечная Недостаточность. 2004;5(1):4–7
- Беленков Ю.Н.Б Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. Медиа Медика, Москва, 2000, 266 стр.
- Yusuf S, Hawken S, Ounpuu S, on behalf of the INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case–control study. Lancet. 2004;364:937–952
- Wilhelmsen L, Rosengren A, Eriksson H, Lappas G. Heart failure in the general population of men: morbidity, risk factors and prognosis. J Intern Med. 2001;249:253–61.
- Effects of treatment on morbidity in hypertension, II: results in patients with diastolic blood pressure averaging 90 through 114 mm Hg. JAMA. 1970;213:1143–52.
- Kostis JB, Davis BR, Cutler J, et al, for the SHEP Cooperative Research Group. Prevention of heart failure by antihypertensive drug treatment in older persons with isolated systolic hypertension. JAMA. 1997;278:212–216.
- Baker DW. Prevention of heart failure. J Card Fail. 2002;8:333–46.
- Chobanian AV, Bakris GL, Black HR et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension. 2003;42:1206–52.
- Staessen JA, Wang JG, Thijs L. Cardiovascular protection and blood pressure reduction: a meta–analysis. Lancet. 2001;358:1305–15.
- Major outcomes in high–risk hypertensive patients randomized to angiotensin–converting enzyme inhibitor or calcium channel blocker vs diuretic: the Antihypertensive and Lipid–Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). JAMA. 2002;288:2981–97.
- Hansson L, Zanchetti A, Carruthers SG, et al, for the HOT Study Group. Effects of intensive blood–pressure lowering and low–dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet 1998;351:1755–1762.
- UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ. 1998;317(7160):703–713
- PROGRESS Collaborative Group – Randomized trial of a perindopril – based blood –pressure–lowering regimen among 6105 individuals with previous stroke or transient ischemic attack Lancet. 2001;358:1033–1041.
- Izzo JL Jr, Gradman AH. Mechanisms and management of hypertensive heart disease: from left ventricular hypertrophy to heart failure. Med Clin North Am. 2004;88:1257–71.
- Национальные рекомендации по профилактике, диагностике и лечению артериальной гипертонии (Рекомендации разработаны экспертами Всероссийского научного общества кардиологов в 2001 году и утверждены на Российском национальном конгрессе кардиологов 11 октября 2001 г., второй пересмотр Рекомендаций осуществлен в 2004 г.) http: www.cardiosite.ru/medical/recom–artgip.asp
- Fox KM. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double–blind, placebo–controlled, multicentre trial (the EUROPA study). Lancet. 2003;362:782–788.
- Yusuf S, Sleight P, Pogue J et al for the Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin–converting–enzyme inhibitor, ramipril, on cardiovascular events in high–risk patients. N Engl J Med. 2000;342:145–153.
- Timolol–induced reduction in mortality and reinfarction in patients surviving acute myocardial infarction. N Engl J Med. 1981;304:801–807.
- Chadda K, Goldstein S, Byington R, Curb JD. Effect of propranolol after acute myocardial infarction in patients with congestive heart failure. Circulation. 1986;73:503–510.
- Pfeffer MA, Braunwald E, Moye LA et al, for the SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the Survival And Ventricular Enlargement Trial. N Engl J Med. 1992;327:669–677.
- Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico. GISSI–3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6–week mortality and ventricularfunction after acute myocardial infarction. Lancet. 1994;343:1115–1122.
- ISIS–4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS–4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. Lancet. 1995;345:669–685.
- Pfeffer MA, McMurray JJ, Velazquez EJ et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med. 2003;349:1893–906.
- Pitt B, Remme W, Zannad F et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 2003;348(14):1309–1321.
- Vantrimpont P, Rouleau JL, Wun CC, et al, for the SAVE Investigators. Additive beneficial effects of beta–blockers to angiotensin–converting enzyme inhibitors in the Survival and Ventricular Enlargement (SAVE) Study. J Am Coll Cardiol. 1997;29:229–236.
- Jones CG, Cleland JG. Meeting report: the LIDO, HOPE, MOXCON and WASH studies: Heart Outcomes Prevention Evaluation. The Warfarin/Aspirin Study of Heart Failure. Eur J Heart Fail. 1999;1:425–431.
- Massie B. – Final results of the warfarin and antiplatelet trial in chronic heart failure (WATCH): a randomized comparison of warfarin, aspirin and clopidogrel. J Card Fail. 2004;10:101–112.
- Kjekshus J, Pedersen TR, Olsson AG et al. The effects of simvastatin on the incidence of heart failure in patients with coronary heart disease. J Card Fail. 1997;3(4):249–254
- Lewis SJ, Moye LA, Sacks FM et al. Effect of pravastatin on cardiovascular events in older patients with myocardial infarction and cholesterol levels in the average range: Results of the Cholesterol and Recurrent Events (CARE) trial. Ann Intern Med. 1998;129:681–689.
- Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long–Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med. 1998;339:1349–1357.
- Диагностика и лечение стабильной стенокардии. Российские рекомендации (Разработаны Комитетом экспертов Всероссийского научного общества кардиологов) http: www.cardiosite.ru/medical/recom–stabsten.asp
- Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза (Разработаны Комитетом экспертов Всероссийского научного общества кардиологов) http: www.cardiosite.ru/medical/recom–lipid.asp.
- Levy D, Larson MG, Vasan RS, Kannel WB, Ho KK. The progression from hypertension to congestive heart failure. JAMA. 1996;275:1557–1562.
- Мареев В. Ю., Беленков Ю. Н. Хроническая сердечная недостаточность и инсулиннезависимый сахарный диабет: случайная связь или закономерность? Тер. Архив. 2003;75(10): 5–10
- Ильина А.В., Мареев В.Ю., Герасимова В.В. и соавт. Эффективность терапии ИАПФ фозиноприлом больных с ХСН в сочетании с сахарным диабетом II типа (по материалам исследования ФАСОН) Журнал Сердечная Недостаточность. 2005;6(5):181–185.
- Krumholz HM, Chen YT, Wang Y et al. Predictors of readmission among elderly survivors of admission with heart failure. Am Heart J. 2000;139:72–7.
- Shindler DM, Kostis JB, Yusuf S et al. Diabetes mellitus, a predictor of morbidity and mortality in the Studies of Left Ventricular Dysfunction (SOLVD) Trials and Registry. Am J Cardiol. 1996;77:1017–1020.
- Lewis EJ, Hunsicker LG, Bain RP, Rohde RD, for the Collaborative Study Group. The effect of angiotensin–convertingenzyme inhibition on diabetic nephropathy. N Engl J Med. 1993;329:1456–1462.
- Heart Outcomes Prevention Evaluation Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO–HOPE substudy. Lancet. 2000;355:253–259.
- Brenner BM, Cooper ME, de Zeeuw D et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001;345:861–869.
- Berl T, Hunsicker LG, Lewis JB et al. Cardiovascular outcomes in the Irbesartan Diabetic Nephropathy Trial of patients with type 2 diabetes and overt nephropathy. Ann Intern Med. 2003;138:542–549.
- U.K. Prosprctive Diabetes Study (UKPDS) Group – Effect of intensive blood glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) Lancet. 1998;352:854–865.
- Barzilay JI, Pressel S, Davis BR, et al, for the ALLHAT Collaborative Research Group. Risk and impact of incident glucose disorders in hypertensive older adults treated with an ACE inhibitor, a diuretic, or a calcium channel blocker: a report from the ALLHAT trial. Am J Hypertens. 2004;17(5, part 2 of 2):1A.
- Bonow RO, Carabello B, de Leon AC Jr et al. Guidelines for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients With Valvular Heart Disease). Circulation. 1998;98:1949–1984.
- Bach DS, Bolling SF. Improvement following correction of secondary mitral regurgitation in end–stage cardiomyopathy with mitral annuloplasty. Am J Cardiol. 1996;78:966–969.
- Greenberg B, Massie B, Bristow JD et al. Long–term vasodilator therapy of chronic aortic insufficiency: a randomized doubleblinded, placebo–controlled clinical trial. Circulation. 1988;78:92–103.
- Scognamiglio R, Rahimtoola SH, Fasoli G, Nistri S, Dalla VS. Nifedipine in asymptomatic patients with severe aortic regurgitation and normal left ventricular function. N Engl J Med. 1994;331:689–694.
- Мареев В.Ю., Даниелян М.О. Недостаточность митрального клапана в терапевтической клинике. Русский медицинский журнал. 1999;7(15):706–722
- Беленков Ю.Н., Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. Медиа–Медика, Москва, 200. 266 с
- Kenchaiah S, Evans JC, Levy D et al. Obesity and the risk of heart failure. N Engl J Med. 2002;347:305–513.
- Мареев В.Ю. Основные достижения в области понимания, диагностики и лечения ХСН в 2003 г (часть 1) Журнал Сердечная Недостаточностью 2004,5(1):25–31
- Walsh CR, Larson MG, Evans JC et al. Alcohol consumption and risk for congestive heart failure in the Framingham Heart Study. Ann Intern Med. 2002;136:181–91.
- Abramson JL, Williams SA, Krumholz HM, Vaccarino V. Moderate alcohol consumption and risk of heart failure among older persons. JAMA. 2001;285:1971–1977.
- Мареев В.Ю. Фармако–экономическая оценка использования ИАПФ в амбулаторном лечении больных с сердечной редостаточностью (ФАСОН) Журнал Сердечная Недостаточность. 2002;3(1):38–39
- American Heart Association. Heart Disease and Stroke Statistics: 2005 Update. Dallas, Tex;American Heart Association;2005.
- Ho KK, Anderson KM, Kannel WB et al. Survival after the onset of congestive heart failure in Framingham Heart Study subjects. Circulation. 1993;88(1):107–115
- Anker SD, Pomkowski P, Varney S. Wasting as independet risk factor of survival in chronic heart failure. Lancet. 1997;349:1050–1053.
- Anker SD, Codts AJS. Cachexia in heart failure is bad for you. Eur Heart J. 1998;19:191–193
- Anker SD, von Haehling S. Inflammatory mediators in chronic heart failure: an overview. Heart. 2004;90:464–470.
- Von Haehling S, Genth–Zotz S, Anker SD, Volk HD. Cachexia: a therapeutic approach beyond cytokine antagonism. Int J Cardiol. 2002 Sep;85(1):173–183.
- Cicoira M et al. Growth hormone resistance in chronic heart failure and its therapeutic implications. J Card Fail. 2003;9(3):219–226.
- Pasini E, Aquilani R, Gheorghiade M, Dioguardi FS. Malnutrition, muscle wasting and cachexia in chronic heart failure: the nutritional approach. Ital Heart J. 2003;4(4):232–235.
- Heymsfield SB, Casper K. Congestive heart failure: clinical management by use of continuos nasoenteric feeding. Am J Clin Nutr. 1989;50:539–544.
- Paccagnella A, Cali MA, Caenaro G et al. Cardiac cachexia: preoperative and postoperative nutrition management. J Parenter Enteral Nutr. 1994;18(5):409–416.
- Шестопалов А.Е., Матраева Ю.С., Дьяков А.Ю. и др. Нутритивная поддержка и коррекция метаболических нарушений у больных с ишемической болезнью сердца и дефицитом тощей массы тела при хирургической реваскуляризации миокарда. Сердечная Недостаточность. 2001;2;3.
- Арутюнов Г.П., Костюкевич О.И. Питание больных с хронической сердечной недостаточностью, проблемы нутритивной поддержки, решенные и нерешенные аспекты. Журнал Сердечная Недостаточность. 2002;3(5):245–248.
- Руководство по парентеральному и энтеральному питанию под редакцией Хорошилова И.Е., Санкт–Петербург, 2001г, стр.179–181.
- Арутюнов Г.П., Костюкевич О.И., Рылова Н.В. Применение сбалансированной смеси Пептамен для энтерального питания в лечении больных с ХСН. Журнал Сердечная Недостаточность. 2002;3(5):221–225.
- Freeman LM, Roubenoff R. The nutrition implication of cardiac cachexia. Nutr Rev. 1994;52(10):340–347.
- Paccagnella A, Cali MA, Caenaro G et al. Cardiac cachexia: preoperative and postoperative nutrition management. J Parent Enter Nutr. 1994;18(5):409–416.
- Smith J, Redd S, Enteral formulation designed for cardiac cachexia. J Parent Enter Nutr. 1980;4:595A.
- Yagi M, Taenaka N. Nutritional support in cardiac cachexia. Nippon Rinsho. 2001;59 Suppl:434–437.
- Арутюнов Г.П., Костюкевич О.И., Влияние энтерального питания на толерантность к физическим нагрузкам и клиническую картину у больных с ХСН III–IV функционального класса. Кардиология. 2003;5.
- Арутюнов Г.П., Костюкевич О.И., Рылова Н.В. Питание больных с ХСН: проблемы нутритивной поддержки (решенные и нерешенные аспекты) Терапевтический архив. 2003;8:88–92.
- Fukui K, Suzuki S. Nutritional support in cardiac cachexia. Nippon Rinsho. 2001;59 Suppl:438–41.
- Sole MJ, Jeejeebhoy KN. Conditioned nutritional requirements and the patogenesus and treatment of myocardial failure. Curr Opin Clin Nutr Metab Care. 2000;3(6):417–424.
- Осипова И.В., Ефремушкин Г.Г., Березенко Е.А. Длительные физические тренировки в комплексном лечении пожилых больных с хронической сердечной недостаточностью. Журнал Сердечная Недостаточность. 2002;3(5):218–221.
- Арутюнов Г.П. Вопросы немедикаментозного лечения пациентов, страдающих сердечной недостаточностью. Сердечная недостаточность. 2001;2(1):35–36.
- Осипова И.В. Свободный выбор нагрузки физических тренировок – эффективный метод лечения хронической сердечной недостаточности. Сердечная недостаточность. 2001;2(4):176–180.
- Exercise Standards. A statement for health professionals from the American Heart Association. Special Report. Circulation. 1990;82(6):2291.2292.
- Gibbons RJ, Balady GJ, Beasley JW et al. ACC/AHA Guidelines for exercise testing: Executive summary. Circulation. 1997;96:345.354.
100. Аронов Д.М. Кардиологическая реабилитация на рубеже веков. Сердце. 2002;1(3):123–125.
101. Осипова И.В. Длительные физические тренировки в комплексном лечении пожилых больных с хронической сердечной недостаточностью. Журнал Сердечная Недостаточность. 2002;3(5):218–220.
102. Sullivan MJ, Higginbotham MB, Cobb F.R. Exercise training in patients with severe left ventricular dysfunction: hemodynamic and metabolic effects. Circulation. 1988;78:506.515.
103. Cowie MR, Mosterd A, Wood DA et al. The epidemiology of heart failure. Eur Heart J. 1997;18:208.255.
104. Spencer FA, Meyer TE, Goldberg RJ. Twenty years trends (1975.1995) in the incidence, in.hospital and long.term death rates associated with heart failure complicating acute myocardial infarction. J Am Coll Cardiol. 1999;34;1378.1387.
105. Khand A, Gemmel I, Clark AL, Cleland JGF. Is the prognosis of heart failure improving? J Am Coll Cardiol. 2000;36(7):2284.2286.
106. Jong P, Vowinckel E, Liu PP et al. Prognosis and determinants of survival in patients newly hospitalized for heart failure: a population.based study. Arch Intern Med. 2002;162:1689.94.
107. Stromberg A. The crucial role of patient education in heart failure. Eur J Heart Fail. 2005;7:363.369.
108. Агеев Ф.Т., Мареев В.Ю., Середенина Е.М., Беленков Ю.Н. Перспективы внедрения специализированных форм активного амбулаторного ведения больных с сердечной недостаточностью: структура, методика и предварительные результаты Российской программы ШАНС. Сердечная недостаточность. 2004;5(6):268–271.
109. Granger CB, McMurray JJ, Yusuf S et al. Effects of candesartan in patients with chronic heart failure and reduced left. ventricular systolic function intolerant to angiotensin.converting.enzyme inhibitors: the CHARM.Alternative trial. Lancet. 2003;362:772.6.
110. McMurray JJ, Ostergren J, Swedberg K et al. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function taking angiotensin.convertingenzyme inhibitors: the CHARM.Added trial. Lancet. 2003;362:767.71.
111. Yusuf S, Pfeffer MA, Swedberg K et al. Effects of candesartan in patients with chronic heart failure and preserved left. ventricular ejection fraction: the CHARM Preserved Trial. Lancet. 2003;362:777.81.
112. Cohn JN, Archibald DG, Ziesche S et al. Effect of vasodilator therapy on mortality in chronic congestive heart failure: results of a Veterans Administration Cooperative Study. N Engl J Med. 1986;314:1547.52.
113. Taylor AL, Ziesche S, Yancy C et al. Combination of isosorbide dinitrate and hydralazine in blacks with heart failure. N Engl J Med. 2004;351:2049.57.
114. Pitt B, Zannad F, Remme WJ, et al, for the Randomized Aldactone Evaluation Study Investigators. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med. 1999;341:709.17.
115. Cohn JN, Ziesche S, Smith R et al. Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril. V.HeFT III Circulation. 1997;96:856.863
116. Thackray S, Witte K, Clark AL, Cleland JG ..Clinical trials update: OPTIME.CHF, PRAISE.2, ALL.HAT. Eur J Heart Fail. 2000;2(2):209.12
117. Фомин И.В. Как мы лечим АГ и ХСН в реальной практике: уроки Российского исследования ЭПОХА Журнал Сердечная недостаточность. 2004;5(2):53–54
118. The Study Group on Diagnosis of the Working Group on Heart Failure of the European Society of Cardiology. Increasing awareness and improving the management of heart failure in Europe: the IMPROVEMENT of HF initiative. Eur J Heart Failure. 1999;20:139.144.
119. Komajda M, Follath F, Swedberg K et al. The EuroHeart Failure Survey programme..a survey on the quality of care among patients with heart failure in Europe. Part 2: treatment. Eur Heart J. 2003;24(5):464.74
120. EUROASPIRE. A European Society of Cardiology survey of secondary prevention of coronary heart disease: principal results. EUROASPIRE Study Group. European Action on Secondary Prevention through Intervention to Reduce Events. Eur Heart J. 1997;18(10):1569.82
121. Lifestyle and risk factor management and use of drug therapies in coronary patients from 15 countries;principal results from EUROASPIRE II Euro Heart Survey Programme. Eur Heart J. 2001;22(7):554.72
122. Garg R, Yusuf S, for the Collaborative Group on ACE Inhibitor Trials. Overview of randomized trials of angiotensin. converting enzyme inhibitors on mortality and morbidity in patients with heart failure JAMA. 1995;273(18):1450.1456.
123. Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. – Медикаментозные пути улучшения прогноза больных с хронической сердечной недочстаточностью. Москва, Инсайт, 1997, 77с
124. NSAIDS and heart failure. Review. Prescire Int. 2001;10:182.183
125. Bank AJ, Kubo SH, Rector TS, Heifetz SM, Williams RE. Local forearm vasodilation with intra.arterial administration of enalaprilat in humans. Clin Pharmacol Ther. 1991;50:314.21.
126. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и соавт., – Применение диклофенака и целебрекса у пациентов с артериальной гипертонией и болями в нижней части спины на фоне гипотензивной терапии аккупро или норваском (исследование ДОЦЕНТ). Журнал Сердечная недостаточность. 2005;6(33):204–208
127. Hall D, Zeitler H, Rudolph W. Counteraction of the vasodilator effects of enalapril by aspirin in severe heart failure. J Am Coll Cardiol. 1992;20:1549.55.
128. Мареев В.Ю. Взаимодействие лекарственных средств при лечении больных с сердечно–сосудистыми заболеваниями. 1. Ингибиторы АПФ и аспирин. Есть ли повод для тревоги? Сердце. 2002;1(4):161–168
129. Al Khadra AS, Salem DN, Rand WM et al. Antiplatelet agents and survival: a cohort analysis from the Studies of Left Ventricular Dysfunction (SOLVD) trial. J Am Coll Cardiol. 1998;31:419.25.
130. Nguyen KN, Aursnes I, Kjekshus J. Interaction between enalapril and aspirin on mortality after acute myocardial infarction: subgroup analysis of the Cooperative New Scandinavian Enalapril Survival Study II (CONSENSUS II). Am J Cardiol. 1997;79:115.119.
131. Kindsvater S, Leclerc K, Ward J. Effects of coadministration of aspirin or clopidogrel on exercise testing in patients with heart failure receiving angiotensin.converting enzyme inhibitors. Am J Cardiol. 2003;91:1350.2.
132. Spaulding C, Charbonnier B, Cohen.Solal A et al. Acute hemodynamic interaction of aspirin and ticlopidine with enalapril: results of a double.blind, randomized comparative trial. Circulation. 1998;98:757.65.
133. Лопатин Ю.М. Совместное применение аспирина и ингибиторов АПФ при ХСН: позиция За. Журнал Сердечная недостаточность. 2003;4(19):149–152
134. Мареев В.Ю. Аспирин при хронической сердечной недостаточности. Взаимодействие аспирина с основными средствами лечения декомпенсации. Журнал Сердечная недостаточность. 2003;4(19):153–157
135. Teo KK, Yusuf S, Pfeffer M et al. Effects of long.term treatment with angiotensin.converting.enzyme inhibitors in the presence or absence of aspirin: a systematic review. Lancet. 2002;360:1037.1043.
136. Harjai KJ, Solis S, Prasad A, Loupe J. Use of aspirin in conjunction with angiotensin.converting enzyme inhibitors does not worsen long.term survival in heart failure. Int J Cardiol. 2003;88:207.14.
137. Antithrombotic TrialistsЎЇ Collaboration . Collaborative meta.analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients¬р BMJ. 2002;324:71.86
138. Shekelle PG, Rich MW, Morton SC. Efficacy of angiotensin.converting enzyme inhibitors and beta.blockers in the management of left ventricular systolic dysfunction according to race, gender, and diabetic status. A meta.analysis of major clinical trials. J Am Coll Cardiol. 2003;41:1529.1538.
139. The SOLVD investigators . Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl. J Med. 1992;327:685.691
140. The SOLVD investigators . Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl. J Med. 1991;325:293.302
141. Cohn Jn, Johnson G, Ziesche S et al. A comparison of enalapril with hydralazine.isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med. 1991;325:303.310
142. McKelvie RS, Rouleau J.L, White M et al. Comparative impact of enalapril, candesartan or metoprolol alone or in combination on ventricular remodelling in patients with congestive heart failure. Eur Heart J. 2003;24:1727.1734
143. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med. 1987;316:1429.35.
144. Dickstein K, Kjekshus J and OPTIMAAL steering committee. Effects of losartan and captopril on mortality and morbidity in high risk patients after acute muocardial infarction: the OPTIMAAL randomized trial. Lancet. 2002;360:752.760
145. Kleber FX, Doering W. Prognosis of mild chronic heart failure: effects of the ACE inhibitor captopril. Herz. 1991;16 Spec No 1:283.293
146. Kleber FX, Niemoller L. . Long.term survival in the Munich Mild Heart Failure Trial (MHFT). Am J Cardiol. 1993;71(13):1237.1239
147. Captopril Multicenter Research Group. A placebo.controlled trial of captopril in refractory chronic congestive heart failure. J Am Coll Cardiol. 1983;2:755.63.
148. Pitt B, Poole.Wilson PA, Segal R et al. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial: the Losartan Heart Failure Survival Study ELITE II. Lancet. 2000;355:1582.7.
149. Borghi C, Marino P, Zardini P et al..Short. and long.term effects of early fosinopril administration in patients with acute anterior myocardial infarction undergoing intravenous thrombolysis: results from the Fosinopril in Acute Myocardial Infarction Study. FAMIS Working Party. Am Heart J. 1998;136(2):213.225
150. Erhardt L, MacLean A, Ilgenfritz J, Gelperin K, Blumenthal M, for the Fosinopril Efficacy/Safety Trial (FEST) Study Group. Fosinopril attenuates clinical deterioration and improves exercise tolerance in patients with heart failure. Eur Heart J. 1995;16:1892.1899.
151. Brown EG, Cheu PH, MacLean A et al. Effects of fosinopril on exercise tolerance and clinical deterioration in patients with chronic congestive heart failure not taking digitalis. Am J Cardiol. 1995;75:596.600
152. Zannad F, Chati Z, Guest M et al. Differential effect of fosinopril end enalapril in patients with mild to moderate CHF. Am Heart J. 1998;136:672.680
153. Cleland JG, Tendera M, Adamus J et al. PEP.CHF Investigators The perindopril in elderly people with chronic heart failure (PEP.CHF) study Eur Heart J. 2006;27(19):2338.45.
154. Massie BM, Armstrong PW, Cleland JG et al. Toleration of high doses of angiotensin.converting enzyme inhibitors in patients with chronic heart failure: results from the ATLAS trial: the Assessment of Treatment with Lisinopril and Survival. Arch Intern Med. 2001;161:165.71.
155. Giles TD, Katz R, Sullivan JM, et al, for the Multicenter Lisinopril.Captopril Congestive Heart Failure Study Group. Short. and long.acting angiotensin.converting enzyme inhibitors: a randomized trial of lisinopril versus captopril in the treatment of congestive heart failure. J Am Coll Cardiol. 1989;13:1240.7.
156. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet. 1993;342:821.8.
157. Riegger GA. Effects of quinapril on exercise tolerance in patients with mild to moderate heart failure. Eur Heart J. 1991;12(6):705.11
158. Pflugfelder PW, Baird MG, Tonkon MJ et al. for the Quinapril Heart Failure Trial Investigators. Clinical consequences of angiotensin.converting enzyme inhibitor withdrawal in chronic heart failure: a double.blind, placebo.controlled study of quinapril. J Am Coll Cardiol. 1993;22:1557.63.
159. Beynon JH, Pathy MS. . An open, parallel group comparison of quinapril and captopril, when added to diuretic therapy, in the treatment of elderly patients with heartfailure. Curr Med Res Opin. 1997;13(10):583.92
160. Скворцов А.А., Насонова С.Н., Сычев А.В. И соавт. – Комбинированное применение ингибитора ангиотензинпревращающего фермента квинаприла и блокатора рецепторов 1–го типа к ангиотензину II валсартана у больных с умеренной хронической сердечной недостаточностью: возможно ли повышение степени нейрогормональной блокады и улучшение параметров суточной вариабельности ритма сердца по сравнению с действием монотерапии (по результатам исследования САДКО–ХСН) Тер архив, 2005;77:34–43
161. Widimsky J, Kremer HJ, Jerie P et al. . Czech and Slovak spirapril intervention study (CASSIS). A randomized, placebo and active.controlled, double.blind multicentre trial in patients with congestive heart failure. Eur J Clin Pharmacol. 1995;49:95.102
162. Мареев В.Ю., Ольбинская Л.И., Мартынов А.И. – Проспективное, многоцентровое, открытое исследование эффективности и переносимости КВАдроприла у больных с Недостаточностью Кровообращения, обусловленной ишемической болезнью сердца и дилатационной кардиомиопатией (Исследование КВАНК) Журнал Сердечная Недостаточность. 2006;7 (в печати)
163. Sica DA, Cutler RE, Parmer RJ et al. Comparison of the steady.state pharmacokinetics of fosinopril, lisinopril and enalapril in patients with chronic renal insufficiency. Clin Pharmacokinet. 1991;20(5):420.427
164. Greenbaum R, Zucchelli P, Caspi A et al.,Comparison of the pharmacokinetics of fosinopril with enalaprilat and lisinopril in patients with CHF and chronic renal insufficiency. Br.J.Clin.Pharmacol., 2000:49, 23.31
165. Ferrari R, Effects of angiotensin.converting enzyme inhibition with perindopril on left ventricular remodeling and clinical outcome: results of the randomized Perindopril and Remodeling in Elderly with Acute Myocardial Infarction (PREAMI) Study. Arch Intern Med. 2006;166(6):659.66
166. Braunwald E, Domanski MJ, Fowler SE et al. Angiotensin.converting.enzyme inhibition in stable coronary artery disease. N Engl J Med. 2004;351(20):2058.68
167. Мареев В.Ю. Ингибиторы ангиотензин превращающего фермента в лечении больных с коронарной болезнью сердца. Взгляд 2003 года. Кардиология. 2003;42(12):3–10
168. Packer M, Lee WH, Medina N et al. Functional renal insufficiency during long.term therapy with captopril and enalapril in severe chronic heart failure. Ann Intern Med. 1987;106:346.54.
169. Packer M, Lee WH, Kessler PD et al. Identification of hyponatremia as a risk factor for the development of functional renal insufficiency during converting enzyme inhibition in severe chronic heart failure. J Am Coll Cardiol. 1987;10:837.44.
170. David D, Jallad N, Germino W et al. A comparison of the cough profile of fosinopril and enalapril in hypertensive patients with history of ACE inhibitor . associated cough. Am. J Theraputic. 1995;2 :806.813
171. Mac Fadyen RJ, Lees KR, Reid JL . Differences in first.dose response of angiotenzine converting enzyme inhibition in congestive heart failure. Br Heart J. 1991;66:206.211.
172. Navookarasu NT, Rahman A, Abdullah I et al. First.dose responce to angiotensin converting enzyme inhibition in chronic cardiac failure: a Malaysian experience. Int J Clin Pract. 1999 ;53(1):25.30
173. The NETWORK Investigators. Clinical outcome with enalapril in symptomatic chronic heart failure: a dose comparison. Eur Heart J. 1998;19:481.489.
174. Noble S, Sorkin EM. Spirapril. A preliminary review of its pharmacology and therapeutic efficacy in the treatment of hypertension. Drugs. 1995;49(5):750.66
175. Cohn JN, Levine TB, Olivari MT et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med. 1984;311(13):819.23
176. Francis GS, Benedict C, Johnstone DE et al. Comparison of neuroendocrine activation in patients with left ventricular dysfunction with and without congestive heart failure. A substudy of the Studies of Left Ventricular Dysfunction (SOLVD). Circulation. 1990;82(5):1724.1729
177. Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. – Хроническая сердечная недостаточность. Избранные лекции по кардио-логии. – М.: ГЭОТАР–Медиа, 2006 – 432 стр.
178. Мухарлямов Н.М, Наумов В.Г., Орлова А.И – Сочетаное применение бета – адреноблокаторов в комбинации с сердечными гликозидами для лечения больных с дилатационными кардиомиопатиями и сердечной недостаточностью. Бюлл. ВКНЦ, 1978;1:78–82
179. Communal C, Singh K, Pimentel DR, Colucci WS. Norepinephrine stimulates apoptosis in adult rat ventricular myocytes by activation of the beta.adrenergic pathway. Circulation. 1998;98:1329.1334.
180. Беленков Ю.Н., Мареев В.Ю., Скворцов А.А. и др. Клинико–гемодинамические и нейрогуморальные эффекты длительной терапии бета–адреноблокатором бисопрололом больных с тяжелой хронической сердечной недостаточностью. Кардиология. 2003;10:11–22.
181. Metra M, Nardi M, Giubbini R, Dei CL. Effects of short. and long.term carvedilol administration on rest and exercise hemodynamic variables, exercise capacity and clinical conditions in patients with idiopathic dilated cardiomyopathy. J Am Coll Cardiol. 1994;24:1678.87.
182. Olsen SL, Gilbert EM, Renlund DG et al.. Carvedilol improves left ventricular function and symptoms in chronic heart failure: a double.blind randomizedstudy. J Am Coll Cardiol. 1995;25:1225.31.
183. Беленков Ю.Н., Мареев В.Ю., Скворцов А.А. и соавт. Эналаприл против Карведилола. Сравнительное рандо- мизирован–ное исследование у больных с хронической сердечной недостаточностью (ЭКСТАЗ) Сердечная Недостаточность. 2001;2(2):84–91
184. Packer M, Bristow MR, Cohn JN et al, for the U.S. Carvedilol Heart Failure Study Group. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med. 1996;334:1349.55.
185. Australia/New Zealand Heart Failure Research Collaborative Group. Randomised, placebo.controlled trial of carvedilol in patients with congestive heart failure due to ischaemic heart disease. Lancet. 1997;349:375.80.
186. The Cardiac Insufficiency Bisoprolol Study II (CIBIS.II): a randomized trial. Lancet. 1999;353:9.13.
187. MERIT.HF Study Group. Effects of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomized International Trial in Congestive Heart Failure (MERIT.HF). . Lancet. 1999;353:2001.2007
188. Packer M, Coats AJ, Fowler MB et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med. 2001;344:1651.1658.
189. Mareev V, Yu.Lopatin Yu, Pervez Gh. Possible mechanisms of positive beta.blocker effects in the treatment of dilated cardiomyopathy. Eur Heart J. 1993;14:94
190. Gaffney TE, Braunwald E. Importance of the adrenergic nervous system in the support of circulatory function in patients with congestive heart failure. Am J Med. 2000;34:320.4.
191. Cleland JG, Pennell DJ, Ray SG et al. Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS trial): randomised controlled trial. Lancet. 2003;362:14.21.
192. Waagstein F, Bristow MR, Swedberg K, et al, for the Metoprololin Dilated Cardiomyopathy (MDC) Trial Study Group. Beneficialeffects of metoprolol in idiopathic dilated cardiomyopathy. Lancet. 1993;342:1441.6.
193. Poole.Wilson PA, Swedberg K, Cleland JG et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet. 2003;362:7.13.
194. Flather MD, Shibata MC, Coats AJ et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure(SENIORS). Eur Heart J. 2005;26(3):215.25
195. Willenheimer R, van Veldhuisen DJ, Silke B et al. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III Circulation. 2005;112(16):2426.2435
196. Erdmann E, Lechat P, Verkenne P, Wiemann H.Results from post.hoc analyses of the CIBIS II trial: effect of bisoprolol in high.risk patient groups with chronic heart failure. Eur J Heart Fail. 2001;3(4):469.79
197. Deedwania PC, Gottlieb S, Ghali JK et al. Efficacy, safety and tolerability of beta.adrenergic blockade with metoprolol CR/XL in elderly patients with heart failure. Eur Heart J. 2004;25(15):1300.9
198. Middeljans.Tijssen CW, Jansen RW. Elderly heart failure patients and the role of beta.blockertherapy. Tijdschr Gerontol Geriatr. 2006;37(2):67.77
199. Ghali JK; Pina IL;. Gottlieb SS et al. Metoprolol CR/XL in Female Patients With Heart Failure Analysis of the Experience in Metoprolol Extended.Release Randomized Intervention Trial in Heart Failure (MERIT.HF). Circulation. 2002;105:1585. 1591
200. Waagstein F, Caidahl K, Wallentin I, Bergh CH, Hjalmarson A. Long.term beta.blockade in dilated cardiomyopathy: effects of short. and long.term metoprolol treatment followed by withdrawal and readministration of metoprolol. Circulation. 1989;80:551.563.
201. Gattis WA, OЎЇConnor CM, Leimberger JD et al. ,.. Clinical outcomes in patients on beta.blocker therapy admitted with worsening chronic heart failure. Am J Cardiol. 2003;91:169.74.
202. Dorow P, Thalhofer S, Bethge H et al. ,Long.term treatment of angina pectoris with bisoprolol or atenolol in patients with chronic obstructive bronchitis: a randomized, double.blind crossover study. J Cardiovasc Pharmacol. 1990;16 Suppl 5:S36.44
203. Bakris GL, Fonseca V, Katholi RE et al. Differential effects of beta.blockers on albuminuria in patients with type 2 diabetes., Hypertension. 2005;46(6):1309.15
204. Follath F, Cleland JGF, Just H et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low.output heart failure (The LIDO study): A randomizes double.blind trial. Lancet. 2002, 360:196.202
205. Виноградов А.В. Мочегонные средства в клинике внутренних болезней. М. – Медицина, 1969. 151 с.
206. Мухарлямов Н.М., Мареев В.Ю. Лечение хронической сердечной недостаточности. М. – Медицина, 1985, 207 с
207. Kjekshus J, Swedberg K. . Tolerability of enalapril in congestive heart failure. Am J Cardiol. 1988;62(2):67A.72A
208. Swedberg K, Eneroth P, Kjekshus J, Wilhelmsen L. Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality.CONSENSUS Trial Study Group. Circulation. 1990;82(5):1730.6
209. Ljungman S, Kjekshus J, Swedberg K. . Renal function in severe congestive heart failure during treatment with enalapril (the Cooperative North Scandinavian Enalapril Survival Study [CONSENSUS] Trial).Am J Cardiol. 1992;70(4):479.87
210. Svensson M, Gustafsson F, Galatius S, Hildebrandt PR, Atar D. How prevalent is hyperkalemia and renal dysfunction during treatment with spironolactone in patients with congestive heart failure? J Card Fail. 2004;10:297.303.
211. Juurlink DN, Mamdani MM, Lee DS et al. Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study. N Engl J Med. 2004;351:543.51.
212. McMurray JJV, OЎЇMeara E. Treatment of Heart Failure with Spironolactone . Trial and Tribulations. N Engl J Med. 2004;351:526.528
213. Cody RJ, Kubo SH, Pickworth KK. Diuretic treatment for the sodium retention of congestive heart failure. Arch Intern Med. 1994;154:1905.14.
214. Patterson JH, Adams KF Jr, Applefeld MM et al. for the Torsemide Investigators Group. Oral torsemide in patients with chronic congestive heart failure: effects on body weight, edema, and electrolyte excretion. Pharmacotherapy. 1994;14:514.21.
215. Brater DC. Diuretic therapy. N Engl J Med. 1998;339:387.95.
216. Brater DC, Chennavasin P, Seiwell R. Furosemide in patients with heart failure: shift in dose.response curves. Clin Pharmacol Ther. 1980;28:182.6.
217. Vasko MR, Cartwright DB, Knochel JP, Nixon JV, Brater DC. Furosemide absorption altered in decompensated congestive heart failure. Ann Intern Med. 1985;102:314.8.
218. Dormans TP, van Meyel JJ, Gerlag PG et al. Diuretic efficacy of high dose furosemide in severe heart failure: bolus injection versus continuous infusion. J Am Coll Cardiol. 1996;28:376.82.
219. Vargo DL, Kramer WG, Black PK et al.. Bioavailability, pharmacokinetics, and pharmacodynamics of torsemide and furosemide in patients with congestive heart failure. Clin Pharmacol Ther. 1995;57:601.9.
220. Brater D. Torasemid: pharmacokinetic and clinical efficacy Eur J Heart Fail. 2001;3(Suppl G):19.24
221. Fortuno A, Muniz P, Ravassa S et al. Torasemide inhibits angiotensin II.induced vasoconstriction and intracellular calcium increase in the aorta of spontaneously hypertensive rats. Hypertension. 1999;34(1):138.43
222. Yamato M, Sasaki T, Honda K et al. Effects of torasemide on left ventricular function and neurohumoral factors in patients with chronic heart failure. Circ J. 2003;67(5):384.390
223. Muller K, Gamba G, Jaquet F, Hess B. . Torasemide vs. furosemide in primary care patients with chronic heart failure NYHA II to IV..efficacy and quality of life. Eur J Heart Fail. 2003;5(6):793.801
224. Stroupe KT, Forthofer MM, Brater DC, Murray MD.Healthcare costs of patients with heart failure treated with torasemide or furosemide. Pharmacoeconomics. 2000;17(5):429.440.
225. Cosin J, Diez J,Torasemide in chronic heart failure: results of the TORIC study. Eur J Heart Fail. 2002;4(4):507.13
226. Jones PW, Greenstone M. . Carbonic anhydrase inhibitors for hypercapnic ventilatory failure in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2001;(1):CD002881
227. Philippi H, Bieber I, Reitter B. . Acetazolamide treatment for infantile central sleep apnea. Drugs.2001;61(2):237.51.
228. Javaheri S ..Acetazolamide improves central sleep apnea in heart failure: a double.blind, prospective study. Am J Respir Crit Care Med. 2006;173(2):234.7
229. Cleland JG, Coletta AP, Nikitin NP et al. Clinical trials update from the American College of Cardiology: Darbepoetin alfa, ASTEROID, UNIVERSE, paediatric carvedilol, UNLOAD and ICELAND. Eur J Heart Fail. 2006;8(3):326.9
230. The effect of digoxin on mortality and morbidity in patients with heart failure. The Digitalis Investigation Group. N Engl J Med. 1997;336(8):525.33
231. Uretsky BF, Young JB, Shahidi FE et al. for the PROVED Investigative Group. Randomized study assessing the effect of digoxin withdrawal in patients with mild to moderate chronic congestive heart failure: results of the PROVED trial. J Am Coll Cardiol. 1993;22:955.62.
232. Packer M, Gheorghiade M, Young JB et al. Withdrawal of digoxin from patients with chronic heart failure treated with angiotensin.converting.enzyme inhibitors: RADIANCE Study. N Engl J Med. 1993;329:1.7.
233. Gheorghiade M, Adams KF Jr, Colucci WS. Digoxin in the management of cardiovascular disorders. Circulation. 2004;109:2959.64.
234. Akera T, Baskin SI, Tobin T, Brody TM. Ouabain: temporal relationship between the inotropic effect and the in vitro binding to, and dissociation from, (Na + + K + ).activated ATPase. Naunyn Schmiedebergs Arch Pharmacol. 1973;277:151.62.
235. Ferguson DW, Berg WJ, Sanders JS et al. Sympathoinhibitory responses to digitalis glycosides in heart failure patients: direct evidence from sympathetic neural recordings. Circulation. 1989;80:65.77.
236. Gheorghiade M, Ferguson D. Digoxin: a neurohormonal modulator in heart failure? Circulation. 1991;84:2181.2186.
237. Нарусов О.Ю., Мареев В.Ю., Скворцов А.А. и др. – Клинические, гемодинамические и нейрогормональные эффекты дигоксина у больных с ХСН Серд. Недостаточность, 2000, т.1,№1, с. 26–30
238. Rathore SS, Curtis JP, Wang Y et al. ,Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA. 2003;289(7):871.8
239. Adams KF, Patterson JH, Gattis WA et al. , Relationship of serum digoxin concentration to mortality and morbidity in women in the digitalis investigation group trial: a retrospective analysis. J Am Coll Cardiol. 2005;46(3):497.504
240. Cohn JN, Tognoni G. A randomized trial of the angiotensin.receptor blocker valsartan in chronic heart failure. N Engl J Med. 2001;345:1667.75.
241. Maggioni A¬І, Anand I, Gottlieb SO et al. Effects of Valsartan on Morbidity and Mortality in Patients With Heart Failure Not Receiving Angiotensin.Converting Enzyme Inhibitors JACC. 2002;40,:1414.21
242. Wong M, Staszewsky L, Latini R et al. Valsartan benefits left ventricular structure and function in heart failure: Val.HeFT echocardiographic study. J Am Coll Cardiol. 2002;40:970.5.
243. Скворцов A.A., Насонова С.Н., Сычев AВ и др. Эффекты длительной терапии ингибитором ангиотензинпревращающекго фермента квинаприлом, антагонистом рецепторов к ангиотензину II и комбинацией квинаприла и валсартана у больных с умеренной хронической сердечной недостаточности. Основные результаты исследования САДКО–ХСН. Кардиология 2006;46:33–51
244. Скворцов A.A., Мареев В.Ю., Насонова С.Н. и др Рекомендована ли тройная комбинация нейрогормолнальных модуляторов для лечения умеренной и т тяжелой ХСН? (результаты исследования САДКО–ХСН). Терю архив, 2006;78(8):14–20
245. Haehling S, Okonko DO, Anker SD. Statins: a treatment option for chronic heart failure? . Heart Fail Monit,2004;4:90.97
246. Sacks FM, Pfeffer MA, Moye LAet al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. New Engl J Med, 1996;335:1001 . 1009
247. D.P.Mikhailidis AS.Werzbicki. The Greak atorvastatin and coronary heart disease evaluation (GREACE) study . CurrMed Res and Opin. 2002;18(4):220.228
248. D.Nul, A.Fernandez, C.Zambrano et al. Statins and mortality in congestive heart failure: benefit beyond cholesterol reduction? . JACC. 2005;45(suppl A):851.4
249. Jaganmohan S, Khurana V. Statins improve survival in patients with congestive heart failure: a study on 32000 US veterans. JACC. 2005;45(suppl A):854.7
250. Kjekshus J, Dunselman P, Blideskog M et al. A statin in the treatment of heart failure? Controlled rosuvastatin multinational study in heart failure (CORONA): Study design and baseline characteristics. The Eur J Heart Fail. 2005;7:1059.1069
251. Tavazzi L, Tognoni G, Franzosi MF et al. Rationale and design of the GISSI heart failure trial: a large trial to assess the effects of n.3 polyunsaturated fatty acids and rosuvastatin in symptomatic congestive heart failure. Eur J Heart Fail. 2004;6:635.641.
252. Horwich TB, MacLellan R, Fonarow GC. Statin therapy is associated with improved survival in ischemic and non.ischemic heart failure. J Am Coll Cardiol. 2004;43:642.648.
253. Ray GR, Gong Y, Sykora K, Tu JV. Statin use and survival outcomes in elderly patients with heart failure. Arch Intern Med. 2005;165:62.67.
254. J LiaoK. Statin therapy for cardiac hypertrophy and heart failure. J Investig Med. 2004;52:248.253
255. Gao L, Wang W, Li YL et al. Simvastatin therapy normalizes sympathetic neural control in experimental heart failure: roles of angiotensin II type 1 receptors and NAD(P)H oxidase. Circulation. 2005;112(12):1763.1770
256. R. U. Pliquett, K. G. Cornish, J. D. Peuler et al. Simvastatin Normalizes Autonomic Neural Control in Experimental Heart Failure. Circulation. 2003;107:2493.2498
257. S. Von Haehling, S.D.Anker, E.Bassrnge . Statins and role of nitric oxide in chronic heart failure. Heart Fail Rev. 2003;8:99.106
258. Node K, Fujita M, Kitakaze M, Hori M, Liao JK. Short.term statin therapy improves cardiac function and symptoms in patients with idiopathic dilated cardiomyopathy. Circulation. 2003;108:839.843.
259. Thomas H, Muhlestein JB, Carlquist JF et el.A cholesterol paradox in congestive heart failure survival? JACC. 2005;45(su¬вpl A):851.5
260. Horwich B, Hamilton MA, Maclellan WR, Fonarow GC. Low serum total cholesterol is associated with marked increase in mortality in advanced heart failure. J Card Fail. 2002;8:216.224.
261. Rauchhaus M, Clark AL, Doehner W et al. The relationship between cholesterol and survival in patients with chronic heart failure. J Am Coll Cardiol. 2003;42:1933.1944.
262. Dunkman WB, Johnson GR, Carson PE et al. for the V.HeFT VA Cooperative Studies Group. Incidence of thromboembolic events in congestive heart failure. Circulation. 1993;87:VI94.101.
263. Dunkman WB. Thromboembolism and antithrombotic therapy in congestive heart failure. J Cardiovasc Risk. 1995;2:107. 17.
264. Katz SD. Left ventricular thrombus and the incidence of thromboembolism in patients with congestive heart failure: can clinical factors identify patients at increased risk? J Cardiovasc Risk. 1995;2:97.102.
265. Cioffi G, Pozzoli M, Forni G et al. Systemic thromboembolism in chronic heart failure: a prospective study in 406 patients. Eur Heart J. 1996;17:1381.9
266. Fuster V, Gersh BJ, Giuliani ER et al. The natural history of idiopathic dilated cardiomyopathy. Am J Cardiol. 1981;47:525.31.
267. Stratton JR, Nemanich JW, Johannessen KA, Resnick AD. Fate of eft ventricular thrombi in patients with remote myocardial infarction or idiopathic cardiomyopathy. Circulation. 1988;78:1388.93.
268. Samama MM, Cohen AT, Darmon JY et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. Prophylaxis in Medical Patients with Enoxaparin Study Group. N Engl J Med. 1999;341(11):793.800
269. Turpie AG.Thrombosis prophylaxis in the acutely ill medical patient: insights from the prophylaxis in MEDical patients with ENOXaparin (MEDENOX) trial. Am J Cardiol. 2000;86(12B):48M.52M
270. Leizorovicz A, Cohen AT, Turpie AG. G et al. randomized placebo controlled trial of dalteparin for the prevention of venous thromboembolism in 3706 acutely Ill medical patients: the PREVENT medical thromboprophylaxis study Supplement to the Journal of Thrombosis and Haemostasis July. 2003(ISSN 1740 3340). Abstract OC396
271. Ageno W, Turpie AG. Clinical trials of deep vein thrombosis prophylaxis in medical patients. Clin Cornerstone. 2005;7(4):16.22
272. Al Khadra AS, Salem DN, Rand WM et al. Warfarin anticoagulation and survival: a cohort analysis from the Studies of Left Ventricular Dysfunction. J Am Coll Cardiol. 1998;31:749.53.
273. Connolly S, Pogue J, Hart R et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet. 2006;367(9526):1903.12
274. Cleland JG, Coletta AP, Lammiman M et al. Clinical trials update from the European Society of Cardiology meeting 2005: CARE.HF extension study, ESSENTIAL, CIBIS.III, S.ICD, ISSUE.2, STRIDE.2, SOFA, IMAGINE, PREAMI, SIRIUS.II and ACTIVE. Eur J Heart Fail. 2005;7(6):1070.5
275. Baker DW, Wright RF. Management of heart failure, IV: anticoagulation for patients with heart failure due to left ventricular systolic dysfunction. JAMA. 1994;272:1614.1618.
276. Dries DL, Domanski MJ, Waclawiw MA et al. Effect of antithrombotic therapy on risk of sudden coronary death in patients with congestive heart failure. Am J Cardiol. 1997;79:909.13
277. Carson P, Ziesche S, Johnson G, Cohn JN, for the Vasodilator.Heart Failure Trial Study Group. . Racial differences in response to therapy for heart failure: analysis of the vasodilator.heart failure trials. J Card Fail. 1999;5:178.87.
278. Шарашидзе М.Л., Мареев В.Ю., Суворов Ю.И. и др. Влияние изосорбида динитрата на водные пространства орга- низма при хронической недостаточности кровообращения. Тер. архив. 1989;61(6):119–122
279. Packer M, OЎЇConnor CM, Ghali JK et al. Effect of amlodipine on morbidity and mortality in severe chronic heart failure. Prospective Randomized Amlodipine Survival Evaluation Study Group. N Engl J Med. 1996;335(15):1107.14
280. Connor CM, Carson PE, Miller AB et al. Effect of amlodipine on mode of death among patients with advanced heart failure in the PRAISE trial. Prospective Randomized Amlodipine Survival Evaluation. Am J Cardiol. 1998;82(7):881.7
281. W.B.Kanel, J.F.Plehn, L.A.Cupples. Cardiac failure and sudden death in the Framingham Study. Am. Heart J.,1988;v.115: p.869.875
282. Luu M, Stevenson WG, Stevenson LW et al. Diverse mechanisms of unexpected cardiac arrest in advanced heart failure. Circulation. 1989;80:1675.80.
283. Мареев В.Ю. Сердечная недостаточность и желудочковые нарушения ритма сердца: проблема лечения. Кардиология. 1996;36,(12):.4–12
284. Hjalmarson A, Goldstein S, Fagerberg B, et al, for the MERIT.HF Study Group. Effects of controlled.release metoprolol on total mortality, hospitalizations, and well.being in patients with heart failure: the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT.HF). JAMA. 2000;283:1295.302.
285. Poole.Wilson PA, Uretsky BF, Thygesen K et al. Mode of death in heart failure: findings from the ATLAS trial. Heart. 2003;Vol. 89:p. 42.48
286. Казей Д.В., Мареев В.Ю., Мухарлямов Н.М. Влияние изменений гемодинамики на нарушения ритма сердца: опыт длительного внутривенного введения раствора нитроглицерина больным с сердечной недостаточностью. Бюлл. Всесоюзн.кардиол. научн. центра, 1989;2:20–25
287. Казей Д.В., Мареев В.Ю., Агеев Ф.Т. и др. Влияние периферических вазодилататоров на нарушения ритма сердца у больных с хрони–ческой сердечной недостаточ–ностью. Кардиология.1992;32,(4):30–34
288. Myerburg RJ, Mitrani R, Interian A et al. Interpretation of outcomes of antiarrhythmic clinical trials: design features and population impact. Circulation. 1998;97:1514.1521.
289. CIBIS III trial: bisoprolol treatment for CHF leads to 46% reduction in sudden death after one year. Cardiovasc J S Afr. 2006;17(5):278
290. Amiodarone Trials Meta.Analysis Investigators. Effect of prophylactic amiodarone on mortality after acure myocardial infarction and in congestive heart failure: meta . analysis of individual data from 6500 patients in randomized trials. Lancet. 1997;359:1417.1424.
291. Мареев В.Ю. Возможно ли успешное предотвращение внезапной смерти у больных с хронической сердечной недо- статочностью и дисфункцией левого желудочка. Препараты или аппараты? Кардиология. 2004;42(12):4–15.
292. Boutitie J.P/ Boissel, SJ. Connolly et al. Amiodarone Interaction With Ґв.Blockers. Analysis of the Merged EMIAT (European Myocardial Infarct Amiodarone Trial) and CAMIAT (Canadian Amiodarone Myocardial Infarction Trial) Databases. Circulation. 1999;99:2268.2275
293. Bardy GH, Lee KL, Mark DB et al. Amiodarone or an implantable cardioverter.defibrillator for congestive heart failure. N Engl J Med. 2005;352(3):225.237
294. Singh SN, Poole J, Anderson J et al. Role of amiodarone or implantable cardioverter/defibrillator in patients with atrial fibrillation and heart failure. Am Heart J. 2006;152(5):974.e7.11
295. Kovoor P, Eipper V, Byth K et al. Comparison of sotalol with amiodarone for long.term treatment of spontaneous sustained ventricular tachyarrhythmia based on coronary artery disease. Eur Heart J. 1999;20:364.374
296. Беленков Ю.Н., Сангонова Д.Ф., Агеев Ф.Т., Мареев В.Ю. Сравнительное исследование длительного применения соталола, метопролола и амиодарона у больных с тяжелой сердечной недостаточностью и прогностически опасными желудочковыми нарушениями ритма сердца. Кардиология,1996;36:37–48.
297. MacNeil JH. Review of Sotalol safety in 3257 patients with arrhythmias after 15 June. 1991. Bristol Myers Squibb report, 1993. Data on file.
298. Stevenson WG, Stevenson LW. Atrial fibrillation in heart failure. N Engl J Med. 1999;341:910–1.
299. Dries DL, Exner DV, Gersh BJ, et al, – Atrial fibrillation is associated with an increased risk for mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular systolic dysfunction: a retrospective analysis of the SOLVD trials: Studies of Left Ventricular Dysfunction. J Am Coll Cardiol. 1998;32:695–703.
300. Pardaens K, Van Cleemput J, Vanhaecke J, Fagard RH. Atrial fibrillation is associated with a lower exercise capacity in male chronic heart failure patients. Heart. 1997;78:564–8.
301. Fuster V, Ryden LE, Asinger RW et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Eur Heart J. 2001;22:1852–923
302. Wyse DG, Waldo AL, DiMarco JP et al. The Atrial Fibrillation Follow–up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med. 2002;347:825–33
303. Van Gelder IC, Hagens VE, Bosker HA et al. Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation (RACE) Study Group. N Engl J Med. 2002;347:1834–40.
304. Boos CJ, Carlsson J, More RS. Rate or rhythm control in persistent atrial fibrillation? QJM. 2003;96:881–92
305. Hylek EM, Skates SJ, Sheehan MA and Singer DE. An analysis of the lowest effective intensity of prophylactic anticoagulation in for patients with nonrheumatic atrial fibrillation. N Engl J Med. 1996;335:540–546
306. Hart RG, Benavente O, McBride R, Pearce LA. Antithrombotic treatment to prevent stroke in patients with atrial fibrillation: a meta–analysis. Ann Intern Med. 1999;131:492–501
307. Maintenance of sinus rhythm in patients with atrial fibrillation: an AFFIRM substudy of the first antiarrhythmic drug. AFFIRM First Antiarrhythmic Drug Substudy Investigators. J Am Coll Cardiol. 2003;42:20–29
308. Letelier LM, Udol K, Ena J, Weaver B, Guyatt GH. Effectiveness of amiodarone for conversion of atrial fibrillation to sinus rhythm. Arch Intern Med. 2003;163:777–785
309. Naccarelli GV, Rinkenberger RL, Dougherty AH, Fitzgerald DM. – Adverse effects of amiodarone: pathogenesis, incidence and management. Med Toxicol Adverse Drug Exp. 1989;4:246–253.
310. Greene HL, Graham EL, Werner JA et al. Toxic and therapeutic effects of amiodarone in the treatment of cardiac arrhythmias. J Am Coll Cardiol. 1983;2:1114–1128.
311. Roy D, Talajic M, Dorian P, Connolly S et al.. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of atrial Fibrillation Investigators. N Engl J Med. 2000;342:913–920
312. Lundstrom T, Ryden L. Chronic atrial fibrillation. Long–term results of direct current cardioversion. Acta Med Scand. 1988;223:53–59
313. Healey JS, Baranchuk A, Crystal E et al. Prevention of atrial fibrillation with angiotensin–converting enzyme inhibitors and angiotensin receptor blockers: a meta–analysis. J Am Coll Cardiol. 2005;45(11):1832–1839
314. Matsuda M, Matsuda Y, Yamagishi T et al. Effects of digoxin, propranolol, and verapamil on exercise in patients with chronic isolated atrial fibrillation. Cardiovasc Res. 1991;25:453–7.
315. David D, Segni ED, Klein HO, Kaplinsky E. Inefficacy of digitalis in the control of heart rate in patients with chronic atrial fibrillation: beneficial effect of an added beta adrenergic blocking agent. Am J Cardiol. 1979;44:1378–82.
316. Farshi R, Kistner D, Sarma JS, Longmate JA, Singh BN. Ventricular rate control in chronic atrial fibrillation during daily activity and programmed exercise: a crossover open–label study of five drug regimens. J Am Coll Cardiol. 1999;33:304–10.
317. Khand AU, Rankin AC, Martin W,et al. Carvedilol alone or in combination with digoxin for the management of atrial fibrillation in patients with heart failure? J Am Coll Cardiol. 2003;42:1944–51.
318. Davie AP, Love MP, McMurray JJ. Even low – dose aspirin inhibits arachidonic acid – induced vasodilation in heart failure. Clin.Pharmacol.Ther. 2000;67:530–537
319. Guazzi M, Pontone G, Agostoni P. Aspirin worsens exercise performance and pulmonary gas exchange in patients with heart failure who are taking angiotensin – converting enzyme inhibitors. Am.Heart.J. 1999;138:254–260
320. Атауллаханова Д.М., Мареев В.Ю. Влияние лазикса на центральную гемодинамику у больных с сердечной недостаточностью. Тер. Арх. 1980;11:109–112
321. Jhunds PS, Davie AP, McMurray JJ. Aspirin inhibits the acute venodilator response to furosemide in patients with chronic heart failure. J Am Coll Cardiol. 2001;37:1234–1238
322. Lindfeld J.A, Robertson A.D, Lowes B.D et al. Aspirin impairs reverse myocardial remodeling in patients with heart failure treated with beta – blockers. J.Am.Coll.Cardiol. 2001;38:1950–1956
323. CAPRIE Steering Committee. A randomized, blinded, trial of clopidogrel vs aspirin in patients at risk of ischemic events(CAPRIE). Lancet. 1996;348:1329–1339
324. Yusuf S, Zhao F, Mehta S.R et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST–segment elevation. N Engl J Med. 2001;345:494–502
325. Antiplatelet Trialists’ Collaboration. Collaborative overview of randomised trials of antiplatelet therapy, I: prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. BMJ. 1994;308(6921):81–106.
326. Cleland JGF. Aspirin: does it have a role in the treatment of heart failure due to ischemic heart disease? In book.: Coats A. (ed) Controversies in the management of heart failure. Churchill Livingstone. 1997:69–82
327. Hayden M, Pigone M, Phillips et al. Aspirin for primary prevention of cardiovascular events: a summary of the evidence for U.S. Preventive Services Task Force. Ann.Intern.Med. 2002;136:161–172
328. Peterson JG, Topol EJ, Sapp SK et al. Evaluation of the effect of aspirin combined with angiotensin – converting enzyme inhibitors in patients with coponary artery disease. Am J Med. 2000;109:371–377
329. Latini R, Tognioni G, Maggioni A.P et al. Clinical effects of early angiotensin – converting enzyme inhibitor treatment for acute myocardial infarction are similar in presence ana absence of aspitin: systematic overview of individual data from 96712 randomized patients. Angiotensin – converting Enzyme Inhibitor Myocardial Infarction Collaborative Group. J.Am. Coll.Cardiol. 2000;35:1801–1807
330. Flather MD, Yusuf S, Kober L et al. Long – term ACE – inhibitor therapy in patients with heart failure or left ventricular dysfunction: a systematic overview of data from individual patients. ACE – inhibitor Myocardial Infarction Collaborative Group. Lancet. 2000; 355:1575–1581
331. Takkouche, Etminan M, Caamano F. et al Interaction between aspirin and ACE inhibitors: resolving discrepancies using a meta– nalysis. Drug Saf. 2002;25:373–378
332. Anderson JL. Hemodynamic and clinical benefits with intravenous milrinone in severe chronic heart failure: results of a multicenter study in the United States. Am Heart J. 1991;121:1956–64.
333. Hatzizacharias A, Makris T, Krespi P et al. Intermittent milrinone effect on long–term hemodynamic profile in patients with severe congestive heart failure. Am Heart J. 1999;138:241–6.
334. Uretsky BF, Jessup M, Konstam MA, et al, for the Enoximone Multicenter Trial Group. Multicenter trial of oral enoximone in patients with moderate to moderately severe congestive heart failure: lack of benefit compared with placebo. Circulation. 1990;82:774–80.
335. Feldman AM, Bristow MR, Parmley WW, et al, for the Vesnarinone Study Group. Effects of vesnarinone on morbidity and mortality in patients with heart failure. N Engl J Med. 1993;329:149–55.
336. Packer M, Carver JR, Rodeheffer RJ, et al, for the PROMISE Study Research Group. Effect of oral milrinone on mortality in severe chronic heart failure. N Engl J Med. 1991;325:1468–75.
337. Applefeld MM, Newman KA, Sutton FJ et al. Outpatient dobutamine and dopamine infusions in the management of chronic heart failure: clinical experience in 21 patients. Am Heart J. 1987;114:589–95.
338. Elis A, Bental T, Kimchi O, Ravid M, Lishner M. Intermittent dobutamine treatment in patients with chronic refractory congestive heart failure: a randomized, double–blind, placebo–controlled study. Clin Pharmacol Ther. 1998;63:682–5.
339. Caffe M.S, Califf R.M,Adams K.F et al. Short–term inthavenous milrinone for acute exacerbation of chronic heart failure. A randomized controlled trial. JAMA. 2002;287:1541–1547.
340. Swedberg K, Cleland J, Dargie H et al. Guidelines for the diagnosis and treatment of chronic heart failure. Eur Heart J.2005,26,1115–1140
341. Moiseev VS, Poder P, Andrejevs N. et al. Safety and efficacy of a novel calcium sansitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. Eur Heart J. 2002;23:1422–1432
342. Диагностика и лечение фибрилляции предсердий. Российские рекомендации. Разработаны Комитетом экспертов ВНОК. Москва. 2005.
343. Philbin EF, Rocco TA. Use of angiotensin–converting enzyme inhibitors in heart failure with preserved ventricular systolic function. Am Heart J. 1997;134:188–95
344. Карпов Ю.А., Мареев В.Ю., Чазова И.Е.. Российские программы оценки эффективности лечения фозиноприлом больных с артериальной гипертонией и сердечной недостаточностью. Проект ТРИ Ф (ФЛАГ,ФАСОН,ФАГОТ). Журнал Сердечная Недостаточность. 2003;5:261–265.
345. Cleland JGF. The perindopril in elderly people with chronic heart failure (PEP–CHF) study. Hot Line I Session on XVth World Congress of Cardiology, Barcelona, 03 September 2006.
346. Klingbeil AU et al. A meta–analysis of the effects of treatment on left ventricular mass in essential hypertension. Am J Med. 2003;115:41–46.
347. Мареев В.Ю., Овчинников А.Г., Агеев Ф.Т., Беленков Ю.Н.. Влияние ингибиторов АПФ и антагонистов рецепторов к ангиотензину–II на диастолическую функцию левого желудочка у пациентов с относительно сохранной систоли- ческой функцией левого желудочка: результаты исследования Периндоприл,ИРбесартан и АмлодипиН у болЬных с ХСН и сохраненной систолической функцией левого желудочка (ПИРАНЬя). Журнал Сердечная Недостаточность. 2005;1:4–14.
348. Bergstrom A, Anersson B, Ender M et al Effect of carvedilol on diastolic function in patients with diastolic heart failure and reserved systolic function. Results of Swedish Doppler–echocardiographic study. Eur J Heart Failure. 2004;6:453–462
349. The Danish Study Group on Verapamil in Myocardial Infarction. Secondary prevention with verapamil after myocardial infarction. Am J Cardiol. 1990;66:331–401
350. Lopez B, Querejrta R, Gonzalez A et al. Effects of loop diuretics on myocardial fibrosis and collagen type I turnover in chronic heart failure. J Am Coll Cardiol. 2004;43:2028–2035
351. Ali Ahmed, Rich MW, Love TE et al. Digoxin and reduction in mortality and hospitalization in heart failure: a comprehensive post hoc analysis of the DIG trial. Eur Heart J. 2006;27:178–186
352. Рекомендации Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции по проведению клинических электрофизиологических исследований, катетерной абляции и имплантации антиаритмических устройств. – Москва. 2005, 238 с.
353. Zipes D, Camm J et al. ACC/AHA/ESC 2006 guidelins for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death–executive summary. JACC. 2006;48:1064–1108.
354. Bristow M, Saxon L, Boehmer J et al. Comparison of Medical Therapy, Pacing and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac–resynchrozation therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med. 2004;350:2140–2150.
355. Cleland J, Daubert J, Erdmann E et al. Cardiac Resynchronization – Heart Failure (CARE–HF) Study Investigators. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med. 2005; 352:1539–1549.
356. Abraham W, Young J, Leon A et al. Multicenter InSync ICD II Study Group. Effects of cardiac resynhronization on disease progression in patients with left ventricular systolic dysfunction, an indication for an implantable cardioverter– defibrillator, and mildly symptomatic chronic heart failure. Circulation. 2004;110:2864–2868.
357. Lee D, Green L, Liu P et al. Effectivenes of implantable defibrillators for preventing arrhythmic events and death: a meta–analysis. JACC. 2003;41:1573–1582.
358. The Antiarrhytmics versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic–drug therapy with implantable defibrillators in patients resuscited from near–fatal ventricular arrhythmias. N Engl J Med. 1997;337:1576–1583.
359. Kadish A, Dyer A, Daubert J et al. Prophylactic defibrillator implantation in patients with nonishemic dilated cardiomyopathy. N Engl J Med. 2004; 350: 2151–2158.
360. Moss A, Hall W,Cannom D et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med. 1996;335:1933–1940.
361. Buxton A, Lee K, Fisher J et al. A randomized study of prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia Trial Investigators. N Engl J Med. 1999;341:1882–1890.
362. Moss A, Zareba W, Hall W et al. Prophylactic implantation of a defiblirillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med. 2002;346:877–883.
363. Rose EA, Gelijns AC, Moskowitz AJ. Long–term mechanical left ventricular assistance for end–stage heart failure. N Engl J Med. 2001;345(20):1435–1443.
Источник: www.cardiosite.ru