Незримое одеяние голых тварей
СОДЕРЖАНИЕ: В природе и в самом деле есть существа, одетые в невидимую для нас одежду, ее замечают только те, для чьего “взора” она предназначена. Незримое одеяние подобных существ “соткано” из так называемых активных форм кислорода (АФК).Юлий Александрович Лабас, кандидат биологических наук, ведущий научный сотрудник Института биохимии им.А.Н.Баха РАН.
Анна Викторовна Гордеева, младший научный сотрудник того же института.
Лена Григорьевна Наглер, старший научный сотрудник Института биохимической физики им.Н.М.Эммануэля РАН.
Все мы помним сказку Г.-Х.Андерсена “Новый наряд короля”. Король, будучи голым, думал, что просто не видит своего платья, а когда это поняли все его подданные, не нашел в себе сил признать их правоту. Но в природе и в самом деле есть существа, одетые в невидимую для нас одежду, ее замечают только те, для чьего “взора” она предназначена. Незримое одеяние подобных существ “соткано” из так называемых активных форм кислорода (АФК). В этой статье мы расскажем, что это за твари, для чего им нужна невидимая одежда, как ее “шьют” и кому дано “видеть” ее. Но вначале рассмотрим подробнее, что собой представляют эти активные формы кислорода*.
* Об этом см. также: Скулачев В.П. Кислород в живой клетке: добро и зло // Природа. 1997. №11. С.26-35.
Все активные формы кислорода - это продукты неполного восстановления молекулы O2. Среди АФК есть и радикалы, например супероксид ·O2-, гидроксильный радикал ·ОН, и молекулы - перекись водорода Н2O2, хлорноватистая кислота НClO (ее анион СlO- называется гипохлоритом).
Существует несколько путей образования АФК в организме. Они появляются в качестве побочного продукта в процессах аэробного метаболизма, если в дыхательной цепи митохондрий (энергетических станций клетки) кислород восстанавливается не полностью. Образуются АФК и за счет работы некоторых цитозольных ферментов, например ксантиноксидазы, и тоже как побочный продукт [1]. Однако существуют ферменты, единственное назначение которых - генерация активных форм кислорода.
Среди таких ферментов особенного внимания заслуживает NADPH (никотинамидадениндинуклеотидфосфат)-оксидаза плазматической мембраны (NADPH-oxidase - NOX). Она восстанавливает молекулярный кислород во внеклеточном пространстве до супероксида ·O2-, окисляя при этом цитозольный NADPH до NADP+. У животных найдено пять изоформ (изозимов) этого фермента, выполняющих разные функции в разных тканях и органах [2].
Из числа других ферментов, генерирующих АФК, назовем еще два. Это миелопероксидаза (myeloperoxidase - MPO) и ее природный гибрид с NADPH-оксидазой. Первый фермент отвечает за образование хлорноватистой кислоты HСlO из перекиси водорода и хлорид-аниона [3], а гибрид, т.е. двойная оксидаза (dual oxidase - DUOX), сразу превращает супероксид ·O2- в перекись водорода, которая затем окисляет различные внеклеточные субстраты [4].
NADPH-оксидаза и миелопероксидаза впервые были обнаружены в белых кровяных тельцах - макрофагах и нейтрофилах. При встрече с патогенными микроорганизмами эти клетки либо “обстреливают” их супероксидом ·O2-, либо подвергают “химической атаке” перекисью водорода Н2O2 и хлорноватистой кислотой НClО, либо поглощают микроорганизмы, загоняя в “газовые камеры” - специальные пузырьки-фагосомы, где и обрабатывают перекисью и супероксидом [5].
В последние 10 лет ферменты, подобные NADPH-оксидазе белых кровяных телец, найдены в большинстве тканей и органов высших животных, в том числе человека, и растений [2]. В желудочно-кишечном тракте изозим NOX1 выполняет защитную функцию; NOX2 регулирует процессы старения в головном мозге; NOX3 - образование слуховых камешков-отолитов во внутреннем ухе, NOX4 - формирование красных кровяных телец (эритроцитов) в почках посредством регуляции выработки специальных веществ, эритропоэтинов, а в сосудах контролирует кровяное давление, управляя их тонусом. NOX5 обеспечивает оплодотворяющую способность мужских половых клеток (сперматозоидов), контролирует пролиферацию лимфоцитов. В легких тоже есть изозим NADPH-оксидазы, он регулирует вентиляцию.
Изозимы NOX различаются по своей структуре, поэтому механизмы их активации тоже разные. Так, NOX белых кровяных телец активируется только при участии протеинкиназ - ферментов, “пришивающих” к NOX остатки ортофосфорной кислоты. NOX1 слизистой желудка устроен так, что для его работы не требуется фосфорилирование - он работает самостоятельно и постоянно. А для запуска работы NOX5 в сперматозоидах протеинкиназы не нужны, зато необходимы свободные ионы кальция Ca2+.
У растений изозимы NADPH-оксидазы служат для защиты от инфекций, участвуют в биосинтезе фитогормонов, формировании клеточных стенок плодов, регулируют ионные потоки, обеспечивают гравитропизм корней. Так же, как и в случае с NOX5, для активации растительных изозимов в фосфорилировании нет необходимости, но нужны катионы Са2+.
Двойная оксидаза DUOX, природный гибрид NOX и МРО, обеспечивает биосинтез тироксина - гормона щитовидной железы. Барьерные свойства слизистых оболочек полости рта, прямой кишки, гениталий, а также трахеи и бронхов в значительной мере обусловлены этой оксидазой. У круглых червей (в частности, могильного червя Caenorhabditis elegans, одного из любимых объектов генетики) двойная оксидаза обеспечивает правильное формирование кутикулы. У морского ежа активация DUOX сопровождает кортикальную реакцию (отслоение желточной оболочки) в яйцеклетке, предотвращающую проникновение лишних сперматозоидов.
Таким образом, генерация АФК “на экспорт” широко распространена. Сами активные формы кислорода выполняют при этом весьма разные функции: от защитной (макрофаги, нейтрофилы, эпителий слизистых оболочек) до строительной (кутикула круглых червей, клеточные стенки растений).
Интенсивная продукция активных форм кислорода способна вызвать гибель клетки [5]. Для защиты от окислительного стресса, вызываемого АФК, существуют два фермента - супероксиддисмутаза и каталаза. Первый из них превращает супероксид ·O2- в перекись водорода, а второй расщепляет Н2O2 до воды. Помимо этих ферментов, каждая клетка снабжена запасом низкомолекулярных антиоксидантов, которые перехватывают токсичные радикалы, не позволяя им повреждать структурные клеточные элементы. Среди антиоксидантов можно назвать трипептид глутатион, a-токоферол (витамин Е), ретинол (витамин А). В клетках они часто связаны со специальными белками, связывающими антиоксиданты. Перечисленные защитные ферменты и низкомолекулярные вещества вместе формируют антиоксидантную систему [1].
В 1995 г. один из авторов этой статьи, Ю.А.Лабас, изучая биолюминесцию (яркое импульсное или статическое свечение, хорошо заметное в темноте) водных организмов, предположил, что все биолюминесцентные системы произошли от антиоксидантных систем *, защищающих клетку от генерируемых ею же самой АФК [6]. Чтобы проверить это предположение, требовалось выяснить, генерируют ли АФК светящиеся клетки (фотоциты) биолюминесцентного животного. Объектом исследований мы выбрали беломорского гребневика Bolinopsis infundibulum, дальнего родственника медуз и кораллов. Для выявления продукции АФК фотогенной тканью использовали водорастворимый краситель нитросиний тетразолий (НСТ), который при взаимодействии с супероксидом переходит в нерастворимую форму (диформазан).
* Лабас Ю.А., Гордеева А.В. Неразгаданная Дарвином биолюминесценция // Природа. 2003. №2. С.25-31.
Каково же было наше удивление, когда мы увидели, что диформазановый осадок окрасил не только фотогенную ткань, но и всю поверхность тела животного! Тогда мы стали окунать в раствор красителя кого попало - губок, актиний, морских и пресноводных гидроидных полипов, моллюсков, офиур (близких родственников морских звезд) и даже личинок рыб и амфибий. Морских животных нам любезно предоставляли аквариумные фирмы “Атолл”, “Аква-Лого” и “Коралл-Аквариум”, а пресноводных - кафедра эмбриологии биологического факультета МГУ.
В результате оказалось, что фактически все животные без наружного скелета или кутикулы генерируют активные формы кислорода наружными поверхностями. Однако характер диформазановой окраски у разных животных был неодинаков. Вся поверхность тела окрашивалась только у губок и гребневиков (правда, у последних наибольшее скопление диформазана наблюдалось на меридиональных рядах гребных пластинок). У кишечнополостных (актиний, медуз, пресноводной гидры) окрашивались только щупальца и ротовой аппарат. У животных, имеющих раковину или щитки (у моллюсков, офиур), диформазан окрашивал открытые участки тела - подошву и область рта моллюска, межщитковую поверхность офиуры. Морские гидроидные полипы на первый взгляд представляли исключение: у них диформазановый осадок выпал именно на наружном покрове - перисарке. Но так как перисарк не задерживает ионы, этот случай нельзя считать из ряда вон выходящим. Беспозвоночные с кутикулой или наружным скелетом - многощетинковые и плоские черви, рачки-бокоплавы, личинки комара коретры - не окрашивались диформазаном. Так же было с икрой и личинками рыб [7].
Данные, полученные с помощью окрашивания нитросиним тетразолием, требовали подтверждения другими методами исследования. Такими методами стали электронный парамагнитный резонанс (ЭПР) и хемилюминесценция. Генерация супероксида наружной поверхностью губок была подтверждена и тем, и другим методом [7, 8], а актиний - только хемилюминесценцией (по неизвестным причинам ЭПР не выявил генерацию ими ·O2-). Икра и личинки костистой рыбы вьюна Misgurnus fossilis и африканской шпорцевой лягушки

Влияние стимулятора протеинкиназы С форбол-12-миристат-13-ацетата (ФМА, 10 нМ) на хемилюминесценцию актинии Aiptasia pulchella.
Здесь и далее стрелкой обозначено добавление агента.
К - результат контрольного эксперимента, т.е. хемилюминесценция самого животного без добавления ФМА.

Усиление хемилюминесценции губки Sycon sp. под действием иономицина (0.3 мкМ).
Морские и пресноводные беспозвоночные, наружные поверхности которых окрашиваются диформазаном - восстановленным продуктом взаимодействия АФК с нитросиним тетразолием (НСТ). Каждое животное показано дважды: каким оно бывает в природе (слева) и после часового пребывания в растворе (0.01%) красителя НСТ. Видно, что вся поверхность тела окрашивается только у морской губки Sycon sp., не имеющей ни наружного скелета, ни кутикулы. У других животных окраску приобретают разные структуры: у гребневика Bolinopsis infundibulum - меридиональные ряды гребных пластинок; у морских гидроидных полипов Оbelia longissima, Gonothyrea loveni - перисарки; у прочих кишечнополостных (у сцифомедузы Aurelia aurita, актиний Аiptasia pulchella и Мetridium senile) - щупальца и гипостом; у брюхоногого моллюска Diodora sp. - мантийный край и область рта; у офиуры Amphipholis squamata - межщитковая поверхность.
Xenopus laevis, не дававшие реакции с нитросиним тетразолием, тем не менее, обладали хемилюминесценцией [7]. Это навело нас на мысль, что они генерируют не супероксид, а перекись водорода. Наше предположение косвенно подтвердилось: группа бразильских ученых обнаружила, что жабрами взрослой пресноводной рыбы пецилии секретируется именно Н2O2 [9].
Исследование механизмов обнаруженного нами явления требовало дополнительных усилий. Решено было испытать, как действуют на продукцию АФК наружными поверхностями животных агенты, которые стимулируют или подавляют синтез этих форм белыми кровяными тельцами. Теперь опыты проводились специально на наиболее примитивных из уже исследованных нами животных, т.е. на губках Sycon sp. и актиниях Aiptasia pulchella. Выявляли генерацию АФК все тем же методом - хемилюминесценцией.
Чтобы вызвать продукцию АФК макрофагами или нейтрофилами, часто применяются вещества, которые стимулируют протеинкиназу С (фермент, активирующий NADPH-оксидазу за счет фосфорилирования), повышают проницаемость клеточной мембраны для ионов Са2+ (ионофоров) или вызывают фагоцитоз. Мы использовали вещества всех трех направлений действия. В качестве стимулятора протеинкиназы С применили форбол-12-миристат-13-ацетат (ФМА), а ионофором Са2+ нам служил иономицин. Оба эти вещества вызывали взрыв хемилюминесценции [7, 10]. Зимозан (фрагменты сухих клеточных стенок дрожжей), которым мы стимулировали фагоцитоз, усиливал хемилюминесценцию только губок, но не актиний [10]. Следовательно, лишь у губок продукция АФК наружной поверхностью связана с фагоцитозом.
Реакция актиний на иономицин и ФМА была связана, вероятнее всего, с NADPH-оксидазой в их амебоцитах (клетках между экто- и энтодермой), на так называемых мезентериальных нитях, выполняющих ту же роль, что и наши макрофаги и нейтрофилы. Зимозан, в отличие от ФМА и иономицина, не проникал через наружные покровы актиний, поэтому не оказывал на них влияния.
В качестве ингибиторов NADPH-оксидазы и миелопероксидазы мы избрали азид натрия NaN3 и ацетованиллон. Азид натрия подавляет активность всех ферментов, содержащих гем (комплексное соединение порфирина). К ним относятся и ферменты белых кровяных телец, образующие АФК. Ацетованиллон - это специфический ингибитор NADPH-оксидазы. В экспериментах азид натрия подавлял хемилюминесценцию и губок, и актиний, а ацетованиллон гасил свечение губок (на актиниях опыты не проводились) [7, 10].

Влияние зимозана (0.2 мг/мл), стимулятора фагоцитоза, на хемилюминесценцию губки Sycon sp.

Изменение хемилюминесценции актинии Aiptasia pulchella после добавления азида натрия (1 мМ) - ингибитора гемсодержащих ферментов.
Полученные результаты позволили нам предположить, что по крайней мере механизмы генерации активных форм кислорода наружной поверхностью губок и белыми кровяными тельцами сходны. Каким образом организовано производство АФК актиний, оставалось до конца не понятным. Чтобы все-таки выяснить это, мы решили идентифицировать ферменты, образующие АФК, непосредственно измеряя их активность. Так как у актиний генерация супероксида наружной поверхностью не была подтверждена методом ЭПР, мы решили, что скорее всего это не NADPH-оксидаза. “Подозрение”, таким образом, пало на миелопероксидазу и двойную оксидазу.
Первый фермент проявляет две активности: пероксидазную (способность окислять разные субстраты с помощью Н2O2) и хлорирующую. В измельченных тканях (гомогенатах) актиний нам удалось обнаружить только первую. Следовательно, мы имели дело с некой пероксидазой, не имеющей хлорирующей активности. Мы склоняемся к тому, что это может быть двойная оксидаза [10].
Поскольку ксантиноксидаза - тоже кальций-зависимый фермент [1] и теоретически могла бы активироваться иономицином, мы решили выяснить ее причастность к генерации АФК у актиний и губок. Ни у тех, ни у других мы не обнаружили ксантиноксидазную активность; по крайней мере, используемый нами метод не выявил каких-либо ее следов [10].
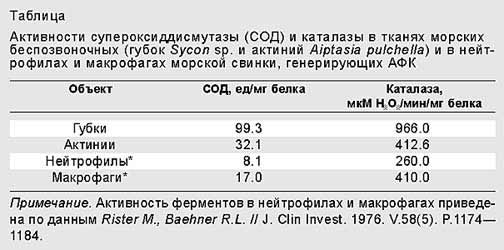
Теперь необходимо было убедиться в том, что генерация АФК морскими беспозвоночными представляет собой активный процесс, а не пассивную утечку вследствие слабой активности каталазы, как происходит у пресноводной рыбы пецилии [9]. Поэтому мы измеряли активности основных антиоксидантных ферментов - супероксиддисмутазы (СОД) и каталазы в гомогенатах актиний и губок. Подобно нейтрофилам и макрофагам, эти животные обладают антиоксидантными ферментами, которые защищают их от повреждающего действия АФК. Однако с генерированием АФК наружными поверхностями актиний и губок такая защита не сбалансирована. У этих беспозвоночных животных активности таких ферментов довольно высоки в сравнении с теми, которые характерны для “профессионально” генерирующих АФК клеток млекопитающего - макрофагов и нейтрофилов морской свинки. Следовательно, можно было исключить пассивную утечку АФК в качестве единственного способа их удаления (таблица) [10].
Итак, механизмы генерации активных форм кислорода наружными поверхностями водных организмов в принципе те же, что слизистыми оболочками, клетками крови, лимфой и спермой высших животных, в том числе человека. Сходство механизмов позволяет предполагать и сходство функций: вероятно, оболочка из кислородных радикалов и Н2O2 защищает “голых” обитателей водоемов от патогенных микроорганизмов. Обладатели же кутикулы, раковины, наружного скелета или ороговевающего эпидермиса не нуждаются в дополнительной защите наружной поверхности посредством АФК. У таких организмов эти формы служат лишь для поддержания постоянного состава внутренней среды (гомеостаза) и для защиты открытых участков тела, непосредственно граничащих с внешней средой (например, жабр у пецилии [9]).
Голые твари, одетые в незримую “одежду” из АФК, могут приносить пользу не только самим себе, но и всему водному биоценозу в целом: генерируемые ими активные формы кислорода освежают воду, препятствуя развитию гнилостной микрофлоры. Для нее, возможно, АФК служат неким “опознавательным знаком”, позволяющим отличать живые организмы от мертвых и не поедать живых - иначе она рисковала бы остаться в конце концов без питания.
Вероятно, такие отношения между животными и бактериями-сапрофитами, которые расплодились в изобиловавшем органическими остатками теплом первичном океане, сложились еще на заре эволюции органического мира, в докембрии. Для большинства животных, по-видимому, этот способ оказался слишком энергоемким (возможно, из-за повышения концентрации растворенного в океанической воде кислорода - продукта оксигенного фотосинтеза древних синезеленых водорослей), и они “прикрыли” свою поверхность осязаемым наружным скелетом из хитина, известняка или целлюлозы. Результатом этого стала так называемая “кембрийская скелетная революция”. До нее же, как известно, все найденные в ископаемом виде животные были голыми. Для тех, кто дерзнул после этой “революции” остаться нагим, вырабатываемые всей поверхностью тела АФК служили и служат невидимым покровом, защищающим от болезнетворных и гнилостных бактерий.

Влияние апоцинина (25 мкМ) на хемилюминесценцию губки Sycon sp.
Этот селективный ингибитор NADPH-оксидазы быстро гасит свечение губки.
В процессе эволюции анатомия живых организмов усложнялась. В слабо упорядоченных сгустках клеток, каковые фактически представляют собой губки, дифференцировались вначале настоящие ткани, затем - органы. Возникали приспособления, позволяющие выходить из водной среды на сушу. Но принципы организации неспецифической защиты организма оставались прежними: участки тела, непосредственно граничащие с внешней средой и не имеющие плотных покровов, оказались защищены невидимым облаком из АФК. У высших позвоночных и человека это желудочно-кишечный тракт, дыхательные пути, гениталии, т.е. органы, которые открыты для внешней среды, но как бы “ввернуты” внутрь тела. Об их защите природа позаботилась, снабдив их способностью генерировать АФК в нужный момент и в необходимом количестве. Интересно, что и нервная ткань, некогда в ходе эволюции граничившая с внешней средой, но у высших организмов “провалившаяся” внутрь тела по ходу индивидуального развития, также сохранила способность к генерации АФК. Так что невидимое одеяние, защищавшее в глубокой древности голых обитателей океана, у одних организмов сохранилось в том же виде и поныне, у других - только в отдельных тканях и органах.
Работа выполнена при поддержке Российского фонда фундаментальных исследований. Проект 05-04-49316.
Список литературы
1. Гордеева А.В., Звягильская Р.А., Лабас Ю.А. // Биохимия. 2003. Т.68. №10. С.1318-1322.
2. Geiszt M. // Cardiovasc. Res. 2006. V.71. №2. P.289-299.
3. Arnold J. // Биохимия. 2004. Т.69. №1. С.8-15.
4. Ris-Stalpers C. // Antioxid Redox Signal. 2006. V.8. №9-10. P.1563-1572.
5. Park J. -B. // Exp. Mol. Med. 2003. V.35. №5. P.325-335.
6. Лабас Ю.А., Гордеева А.В. Как возникла биолюминесценция? // Материалы международной конференции “Водные экосистемы и организмы - 4”.Ред. В.Д.Федоров, С.А.Остроумов. М., 2003. С.76-80.
7. Гордеева А.В., Лабас Ю.А. // Цитология. 2003. Т.45. №3. С.284-289.
8. Peskin A.V., Labas Y.A., Tikhonov A.N. // FEBS Lett. 1998. V.434. №1-2. P.201-204.
9. Wilhelm-Filho D., Gonzalez-Flecha B., Boveris A. // Braz. J. Med. Biol. Res. 1994. V.27. №12. P.2879-2882.
10. Гордеева А.В., Наглер Л.Г., Лабас Ю.А. // Журн. эволюционной биохимии и физиологии. 2006. Т.42. №3. С.201-207.