Опытническая работа школьников по экологии
СОДЕРЖАНИЕ: Преподавание экологии в школах сопряжено со значительными трудностями, которые определяются рядом факторов, таких, как отсутствие единого подхода к рассмотрению многих направлений этой комплексной науки, неразработанность ряда положений.Опытническая работа школьников по экологии
М. З.Федорова, О. В.Устюкова
Преподавание экологии в школах сопряжено со значительными трудностями, которые определяются рядом факторов, таких, как отсутствие единого подхода к рассмотрению многих направлений этой комплексной науки, неразработанность ряда положений, недостаточное количество и качество учебников и учебных пособий и др. Особые сложности связаны с проведением занятий по экологии человека. Здесь можно ограничиться проведением лишь небольшого количества исследований по изучению влияния на функциональное состояние организма некоторых естественных и антропогенных факторов среды (например, биоритмологическая организация функций, изменение умственной работоспособности и продуктивности интеллектуальной деятельности в условиях шума и т.п.) и некоторыми работами гигиенической направленности. К числу последних относится изучение загрязнения окружающей среды для здоровья человека и других живых существ химическими веществами. Предлагается два направления исследовательской работы школьников: 1) изучение содержания нитратов в сельскохозяйственных продуктах и питьевой воде; 2) контроль за выпадением кислотных дождей. Участниками исследования могут быть несколько учеников, работающих в разных районах (например, на своих дачных участках).
Перед проведением исследований учащиеся должны получить теоретические знания об источниках загрязнения данными веществами, путях миграции и трансформации в экологических системах, познакомиться с санитарно-гигиенической и токсикологической характеристикой вещества, мерах профилактики и средствах защиты.
Определение нитратов риванольным методом
Основными источниками поступления нитратов в организм человека являются продукты растениеводства (80-85%) и питьевая вода. Токсическое действие нитратов обусловлено как их прямым влиянием (гипоксия тканей за счет угнетения ферментных систем, участвующих в тканевом дыхании), так и действием нитритов (гемическая гипоксия, обусловленная образованием метгемоглобина), образующихся в организме из нитратов под воздействием микрофлоры кишечника и тканевых ферментов. В свою очередь, нитриты взаимодействуют с аминами, образуя канцерогенные вещества - нитрозамины (один из факторов злокачественных опухолей).
В недозревших овощах содержание нитратов всегда выше, чем в созревших.
Метод нитратного контроля
(предложен 1-м Московским медицинским институтом имени И. М. Сеченова)
Для работы необходимо: риванол (можно приобрести в аптеках), 0,9% раствор хлорида натрия, соляная кислота (плотность 1,038-1,041), порошок цинка.
I. Определение нитритов в воде.
К 1 мл воды прибавляют 2 мл 0,9% раствора хлорида натрия. Затем 2 мл приготовленной таким образом воды смешивают с 1 мл риванольного реактива (таблетку растворяют при нагревании в 200 мл аптечной соляной кислоты). Если появляется бледно-розовая окраска, значит, уровень нитритов в питьевой воде недопустим.
II. Определение нитратов в воде.
К 1 мл воды добавляют 2,2 мл 0,9% раствора хлорида натрия. Затем отбирают 2 мл приготовленного раствора, добавляют 1 мл солянокислого раствора риванола и немного порошка цинка (на кончике ножа). Если в течение 3-5 мин желтая окраска риванола исчезнет и раствор окрасится в бледно-розовый цвет, то содержание нитратов в питьевой воде недопустимо.
III. Определение нитратов в продуктах.
Нитрат в продуктах восстанавливают до нитрит-ионов, которые диазотируют риванолом с образованием окрашенного соединения.
Исходно предполагается, что содержание нитратов в продукте - предельно допустимое. Поэтому разбавляют пробу так, чтобы концентрация нитрата в ней сравнялась с пределом обнаружения данным методом. Если концентрация превышена, то раствор окрасится в бледно-розовый цвет. Количество разбавлений можно вычислить по формуле:
Х = ГОСТ + 1, где
М х К
Х - количество разбавлений, ГОСТ - норма нитратов для исследуемого продукта, М - предел обнаружения данным методом, К - табличный коэффициент содержания влаги в продукте.М = 20 мг/л
К: для огурцов, томатов, редиса, салата, баклажанов, капусты, перца, кабачков, щавеля, дынь, арбузов, свеклы - 0,9; картофеля, моркови, зеленого горошка и фруктов - 0,8; мяса - 0,5 (см.табл. 1 и 2)
Таблица 1
Примеры расчета количества разбавлений

2 мл разведенного продуктового сока смешивают с 1 мл солянокислого раствора риванола и добавляют на кончике ножа цинковый порошок. Если в растворе содержится более 20 мг/л нитратов, то желтая окраска раствора постепенно обесцвечивается и сменяется розовой. Это означает, что нормы нитратов в этом продукте превышены.
(Нитриты определяют как в воде: разбавляют сок по приведенной выше формуле).
! Температура для анализа не должна превышать 18оС !
! При содержании даже небольшого количества аскорбиновой кислоты реакция нитрозирования, сопровождающаяся образованием окрашенных веществ, не идет !
То же самое происходит и в организме. Не случайно аскорбиновая кислота рекомендована Всемирной Организацией Здравоохранения (ВОЗ) как обязательный компонент диеты для людей, принимающих аминосодержащие лекарственные препараты, и просто при опасности нитратного отравления.
Овощи и фрукты, содержащие большое количество витамина С, нельзя анализировать на нитраты и нитриты без предварительной обработки. Аскорбиновая кислота устраняется с помощью метода предельных разбавлений. Для большей уверенности разбавленные соки капусты, лимона и осенних яблок перед анализом следует хорошо прокипятить 5-10 мин., а затем довести водой до прежнего объема. Аскорбиновая кислота при нагревании разрушается.
Таблица 2
Допустимые уровни мг нитрат-иона/кг
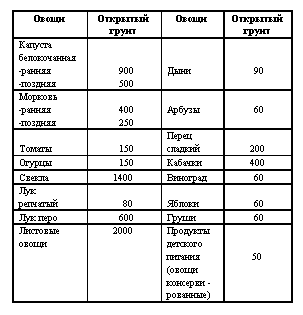
Допустимая суточная доза нитратов для человека - 300 - 325 мг. Предельно допустимая концентрация нитратов в воде - 45 мг/л, при среднем количестве потребляемой воды - 2 л в сутки.
Контроль за выпадением кислотных осадков
Кислотными называют любые осадки: дожди, туманы, снег, росы - кислотность которых выше нормальной. Промышленные и транспортные загрязнения ведут к выбросам в атмосферу оксидов серы и азота. Они реагируют с парами воды, образуют серную и азотную кислоты, которые возвращаются на землю с осадками, из-за чего последние становятся ненормально кислыми. Их влияние на экосистемы многообразно (см. список рекомендованной литературы).
В отсутствие загрязнителей у дождевой воды обычно слабокислая реакция (pH = 5,6), поскольку в ней легко растворяется углекислый газ из воздуха с образованием слабой угольной кислоты. Кислотными называют осадки с pH 5,5 и ниже. Значение pH легко измерить с помощью индикаторной бумаги, которая есть в любой лаборатории. Полоску индикаторной бумаги опускают в раствор и сверяют ее цвет с прилагаемым эталоном.
Кислотные осадки снижают урожай, вызывая повреждение, а иногда и гибель растений, уничтожают жизнь в пресных водоемах.
Участие школьников в несложных исследованиях подобного рода имеет важное значение, т.к. способствует распространению экологических знаний не только по вертикали (образовательные учреждения - население), но и по горизонтали, т.к. ученик делится своими знаниями и результатами опытов с родственниками, друзьями и знакомыми.
Список литературы
По нитратам:
[1] Дерягина В.П. Ах, нитраты! И кто же вас выдумал? // Здоровье. 1989. №9.
[2] Мугниев А.Ф., Посмитная И.В. Содержание нитратов в овощах можно регулировать // Картофель и овощи. 1989. №1.
[3] Рычков А.Л. Нитратная кухня // Химия и жизнь. 1989. №7.
[4] Соколов О.А. Особенности распределения нитратов в овощах // Картофель и овощи. 1987. №6.
[5] Чапкявичене Э.С. Как уменьшить содержание нитратов и нитритов в овощах // Здоровье. 1988. №3.
[6] Эвенштейн З. Нитраты, нитриты, нитрозамины // Общественное питание. 1989. №3.
По кислотным осадкам:
[1] Грин Н., Стаут У., Тейлор Д. Биология: В 3-х т. Т.3. М.: Мир, 1990.
[2] Небел Б. Наука об окружающей среде: Как устроен мир: В 2-х т. Т.1. М.: Мир, 1993.