Производство этанола методом сернокислотной гидратации
СОДЕРЖАНИЕ: Особенности технологии производства этанола методом сернокислотной гидратации. Составление материального баланса процесса. Произведение расчета показателей пропускной способности установки, конверсии этилена и коэффициентов выхода на поданное сырье.Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра Общей Химической Технологии
КУРСОВАЯ РАБОТА
по предмету: Технология химических производств
на тему: Производство этанола методом сернокислотной гидратации
Выполнила:
студентка гр. 3141-84
Валиуллина А.
Проверил:
Ремизов А. Б.
Казань 2008
Содержание
Технологическая схема производство этанола методом сернокислотной гидратации
Практическая часть
Реклама
Список литературы
ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВО ЭТАНОЛА МЕТОДОМ СЕРНОКИСЛОТНОЙ ГИДРАТАЦИИ
Этиловый спирт— (этанол) кипит при 78,3 °С; смесь C2 H5 ОН [30% (об.)] с воздухом взрывоопасна; с водой спирт образует азеотропную смесь, содержащую 95,6% C2 H5 OH; кипящую при 78,1 °С. Этиловый спирт широко применяется в пищевой и медицинской промышленности, является компонентом жидкостного ракетного топлива, антифризом и т. д. Особенно широко этанол используется как полупродукт органического синтеза, и, в частности, для получения сложных эфиров, хлороформа, хлораля, ацетальдегида, уксусной кислоты, бутадиена и других продуктов. По объему производства синтетический этиловый спирт занимает первое место среди других органических соединений. Ранее этиловый спирт получали из пищевого сырья — картофельного крахмала и некоторых зерновых культур, однако этот способ связан с большими затратами пищевого сырья. Кроме того, его получают гидролизом древесины (гидролизный спирт). Этанол получают сернокислотной и прямой гидратацией этилена. При сернокислотном способе получения этанола (рисунок 1) этилен под давлением 1,5—2,5 МПа поступает в абсорбер барботажного типа, орошаемый 97%-ной серной кислотой. Температура в абсорбере 65—75 °С. Серная кислота в этом процессе является катализатором и реагентом, Этилен взаимодействует с серной кислотой с образованием моноэтилсульфата C2 H5 OSO3 H и диэтилсульфата (C2 H5 O)2 SO2
C2 H4 + H2 SO4 С2 H5 OSO3 H + Q
2C2 H4 + H2 SO4 (C2 H5 O)2 SO2 + Q
Газы, не поглощенные в абсорбере 1, проходят водяной 2 и щелочной 3 скрубберы и далее могут быть использованы как топливо.
Рисунок 1. Схема производства этилового спирта сернокислотной гидратацией этилена
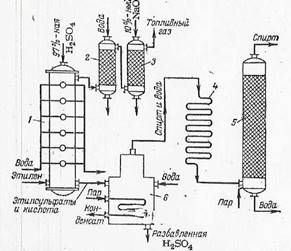
1— тарельчатый абсорбер; 2, 3 — скрубберы; 4 — холодильник; 5 — колонна; 6 — гидролизер.
Этилсульфаты и серная кислота из абсорбера 1 поступают в гидролизер 6, в который подается вода. В гидролизере при давлении 1 МПа и температуре 70—90 °С происходит гидролиз этилсульфатов
С2 Н5 ОSO3 H + H2 O С2 Н5 ОН + H2 SO4
(С2 Н5 О)2 SO2 + 2H2 O 2С2 Н5 ОН + H2 SO4
Пары спирта и воды далее проходят холодильник 4, где они конденсируются; конденсат поступает в ректификационную колонну 5 для разгонки и очистки от примесей. Разбавленная кислота (50%) выводится из гидролизера, направляется на концентрирование и снова возвращается в процесс. При ректификации концентрация этилового спирта достигает 95—96%. По этому способу из 1 т этилена получают 1,2 т этанола и около 100 кг этилового эфира.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Задание:
1. Составить и описать технологическую схему производства этанола методом сернокислотной гидратации
2. Составить материальный баланс процесса
3. Рассчитать технологические и технико-экономические показатели
4. Реклама
В основу расчета принять следующие реакции:
C2 H4 +H2 O C2 H5 OH
2C2 H5 OH (C2 H5 )2 O + H2 O
Исходные данные:
| Пропускная способность этан-этиленовой фракции, кг/ч | 300 |
| Потери этанола в побочной реакции, % масс | 7 |
| Конверсия этилена, % | 97 |
Состав этан-этиленовой фракции, % мас. 1. этилен 2. этан |
67 33 |
| Мольное соотношение этилен – водяной пар | 1 : 1.5 |
| Потери этилена, % масс | 0,5 |
Расчет:
Материальный баланс:
Схема потоков:
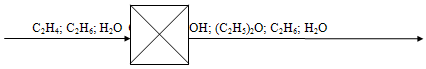

| Приход | Расход | |||
| кг/час | кмоль/час | кг/час | кмоль/час | |
| C2 H4 | 201 | 7.18 | 6 + 1потери | 0,21 + 0,04потери |
| C2 H5 OH | 0 | 0 | 296.41 | 6.44 |
| (C2 H5 )2 O | 0 | 0 | 18.13 | 0,245 |
| С2 Н6 | 99 | 3.3 | 99 | 3.3 |
| H2 O (1) | 193.86 | 10.77 | 69.12 | 3.84 |
| H2 O (2) | 0 | 0 | 4.41 | 0,245 |
| 1 =493.86 | 2 =494.07 | |||
Mr(C2 H4 )=12*2+1*4=28 кг/кмоль
Mr(C2 H6 )=12*2+6*1=30 кг/кмоль
Mr(C2 H5 ОН)=12*2+1*6+16*1=46 кг/кмоль
Mr((C2 H5 )2 О)=12*4+1*10+16*1=74 кг/кмоль
Mr(H2 О)=1*2+16*2=18 кг/кмоль
m(фракции)=300 кг/ч;
Масса этилена поданного на реакцию:
m (С2 H4 ) – 67%
300 – 100%
mвсего (С2 H4 )=300*67/100=201 кг/ч
wвсего (С2 H4 )=201/28=7.18 кмоль/ч
m(С2 Н6 )= m(фракции) - m (С2 H4 ) = 300 – 201 = 99 кг/ч
w(С2 Н6 )=99/30 = 3.3 кмоль/ч
Поданный водяной пар:
w( H2 O(1)) = 1.5wвсего (С2 H4 ) =10.77 кмоль/ч
m( H2 O(1))= 10.77*18=193.86 кг/ч
Поданный этилен, учитывая потери:
mпод (С2 H4 ) – 100 %
mп (С2 H4 ) – 0.5%
mпотери (С2 H4 ) = 201*0,5/100 = 1 кг/ч
wпотери (С2 H4 ) = 1/28 = 0,04 кмоль/ч
mобщ (С2 H4 ) = mвсего (С2 H4 ) - mпотери (С2 H4 ) = 201 - 1 = 200 кг/ч
Прореагировавший этилен:
mпрор (С2 H4 ) – 97 %
200 – 100%
mпрор (С2 H4 ) = 200*97/100 = 194 кг/ч
wпрор (С2 H4 ) = 194/28 = 6.93 кмоль/ч
Непрореагировавший этилен:
mнепр (C2 H4 ) = mобщ (C2 H4 ) – mпрор (C2 H4 ) = 200 – 194 = 6 кг/ч
wнепр (C2 H4 ) = 6/28 = 0,21 кмоль/ч
Количество и масса этанола:
wвсего (C2 H5 ОН) = wпрор (C2 H4 ) = 6.93 кмоль/ч
mвсего (С2 H5 ОН) = 6.93*46 = 318.78кг/ч
Прореагировало этанола:
mпрор (C2 H5 ОН) – 5 %
192,05–100 %
mпрор (C2 H5 ОН) = 192,05*5/100 = 9,603 кг/ч
wпрор (C2 H5 ОН) = 9,603/46 = 0,209 кмоль/ч
Непрореагировавшего этанола:
mост (C2 H5 ОН) = mвсего (C2 H5 ОН) – mпрор (C2 H5 ОН) = 192,05 - 9,603 = 182,447 кг/ч
wост (C2 H5 ОН) = 182,447/46= 3,966 кмоль/ч
Количество воды пошедшей на образование этанола:
wпрор ( H2 O(1)) = wвсего (C2 H5 ОН) = 6.93 кмоль/ч
Количество не прореагировавшей воды:
wост ( H2 O(1)) = wпод ( H2 O(1)) – wпрор ( H2 O(1)) = 10.77 – 6.93 = 3.84 кмоль/ч
mост ( H2 O(1)) = 3.84 * 18 = 69.12 кг/ч
Масса и количество этанола, пошедшее на образование диэтилового эфира:
mпрор (C2 H5 ОН) – 7 %
mвсего (C2 H5 ОН) – 100 %
mпрор (C2 H5 ОН) = 318.78 * 7/100 = 22.31 кг/ч
wпрор (C2 H5 ОН) = 2.31/46 = 0.49 кмоль/ч
Масса и количество не прореагировавшего этанола:
mост (C2 H5 ОН) = mвсего (C2 H5 ОН) - mпрор (C2 H5 ОН) = 318.48 – 22.31 = 296.41 кг/ч
wост (C2 H5 ОН) = 296.41/46 = 6.44 кмоль/ч
Полученно диэтилового эфира: на 2 моль (C2 H5 ОН) – 1 моль (С2 Н5 )2 О
wпрор (C2 H5 ОН) - w ((C2 H5 )2 О)
w ((C2 H5 )2 О) = 0.49*1/2 = 0,245 кмоль/ч
m ((C2 H5 )2 О) = 0,245 * 74 = 18.13 кг
Найдем количество и массу воды, образовавшейся во второй реакции:
w( H2 O(2)) = w((С2 Н5 )2 О) = 0,245 кмоль/ч
m( H2 O(2) ) = 0,245 * 18 = 4.41 кг/ч.
Технологические и технико-экономические показатели процесса
1. Пропускная способность установки: 493.86 кг/ч
2. Конверсия этилена : 97 %
3. Выход на поданное сырье:
1) Фактический выход:
QФ = m(C2 H5 ОН) = 296.41 кг;
2) Теоретический выход:
Mr(СН2 ) Mr(C2 H5 ОН), 28 46,
m(C2 H4 ) QТ ; 201 QТ ;
QТ = 330.21 кг;
ВыходC2 H5 ОНпоC2 H4
bСН 3 СОН = QФ / QТ * 100%= 89.76 %
4. Теоретический выход на превращенное сырье:
Mr(C2 H4 ) Mr(C2 H5 ОН), 28 46,
mпр (C2 H4 ) QТ ; 194 QТ ;
QТ = 318.71 кг;
b СН 3 СОН = QФ / QТ * 100%= 93 %
5. Теоретические расходные коэффициенты по сырью:
по C2 H4 :
sт = Mr(C2 H4 ) / Mr(C2 H5 ОН) = 28 / 46 = 0,61 кг/кг;
по Н2 О:
sт := Mr(Н2 О) / Mr(C2 H5 ОН) = 18/46 = 0.39 кг/кг.
6. Фактические расходные коэффициенты:
по C2 H4 :
sф = mтехн (C2 H4 ) / m(C2 H5 ОН) = 300/296.41 = 1.01 кг/кг;
по Н2 О:
sф = mтехн (C2 H4 ) / m(C2 H5 ОН) = 193/296.41 = 0.65 кг/кг.
РЕКЛАМА
СПИСОК ЛИТЕРАТУРЫ
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., Химия, 2005, 736 с.
2. Юкельсон И.И. Технология основного органического синтеза. М.: Химия, 2008, 846 с.
3. Общая химическая технология /Под ред. А.Г.Амелина. М.: Химия, 2007, 400 с.
4. Расчеты химико-технологических процессов /Под ред. И.П.Мухленова. Л.:Химия, 2008, 300 с.