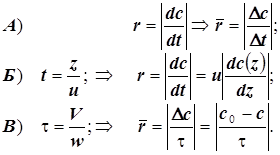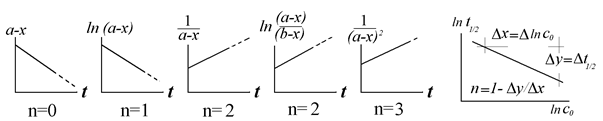Простейшие кинетические уравнения Кинетические кривые
СОДЕРЖАНИЕ: Простейшие кинетические уравнения. Кинетические кривые. 3) Односторонняя реакция 2-го порядка и её стехиметрическое уравнение: Представим текущий материальный баланс для этой реакции в виде таблице:Простейшие кинетические уравнения. Кинетические кривые.
3) Односторонняя реакция 2-го порядка и её стехиметрическое уравнение:
![]() Представим текущий материальный баланс для этой реакции в виде таблице:
Представим текущий материальный баланс для этой реакции в виде таблице:
| Реагенты и продукты |
A |
B |
= |
E |
F |
|
| Концентрации веществ в ходе реакции |
Вначале |
a |
B |
0 |
0 |
|
|
Во времени |
a-x(t) |
b-x(t) |
x(t) |
x(t) |
||
3.1) Если текущие концентрации реагентов различны, то удобно ввести лишь одну переменную x:
![]()
![]()
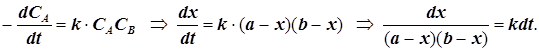 (2.1)
(2.1)
![]() Если кинетика реакции исследуется от начального момента времени t=0, и в исходной смеси отсутствовал конечный продукт: x=0, то искомая функция концентрации продукта от времени выражается в виде:
Если кинетика реакции исследуется от начального момента времени t=0, и в исходной смеси отсутствовал конечный продукт: x=0, то искомая функция концентрации продукта от времени выражается в виде:
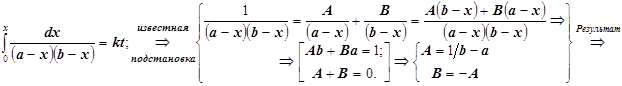
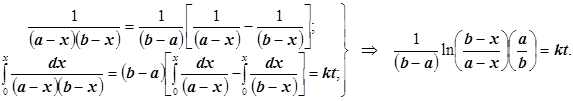
(2.2)
Полученную зависимость x(t) удобно оставить в виде неявной функции, которая хорошо приспособлена для обработки экспериментальных данных:
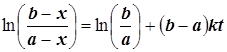 ; (2.3)
; (2.3)
Используя обозначения ![]() , придаём уравнению (2.3) линейный вид
, придаём уравнению (2.3) линейный вид ![]() . (2.4)
. (2.4)
3.2) Односторонняя реакция 2-го порядка:
- если начальные концентрации с обоих реагентов равны a, то до самого окончания реакции равными останутся и их текущие концентрации a- x (у продуктов x), и получаем:
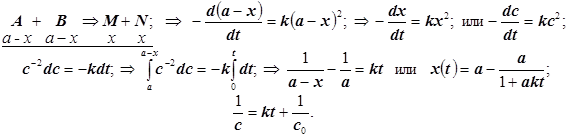 (2.5)
(2.5)
Аналогичное выражение имеет место и для одного реагента, превращающегося по реакции второго порядка, но в этом случае скорость исчезновения реагента возрастает вдвое:
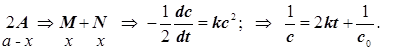 (2.6)
(2.6)
Идеальный лабораторный пример, прямо-таки стандарт, химического превращения 2-го порядка представляет собою щелочное омыление сложных эфиров, и не случайно эту превосходно воспроизводимую реакцию с очень доступными, недорогими реагентами находим в ассортименте обязательного лабораторного студенческого практикума в любом химическом вузе мира...
![]() .
.
4) Односторонняя реакция 3-го порядка и её возможные кинетические варианты:
4.1) – начальные концентрации все различны:
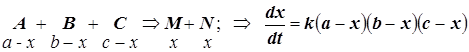
4.2) – начальные концентрации равны у двух реагентов:
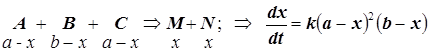
4.3) – все начальные концентрации равны:
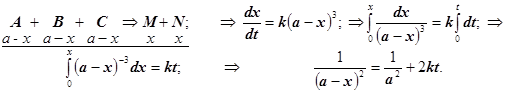 (2.7)
(2.7)
5) Односторонняя реакция произвольного n-го порядка при (с0=a):
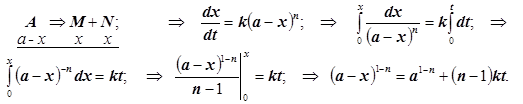 (2.8)
(2.8)
т.е. ![]() . (2.9)
. (2.9)
Последнее уравнение (2.8) справедливо для любой реакции, но с некоторыми обязательными оговорками. Так в случае реакции 1-го порядка возникает неопределённость, устраняемая с помощью правила Лопиталя. Для этого порядок реакции n считаем дифференцируемым параметром, представим формулу (2.9) дробью ![]() и получим обычное выражение... :
и получим обычное выражение... :
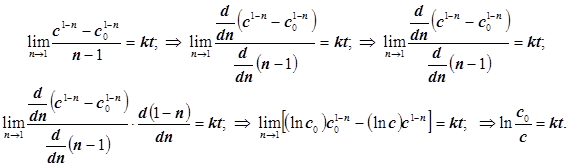 (2.10)
(2.10)
Примечание: Производная степенной функции вычисляется по формуле: ![]()
6) Период полупревращения. Это время t1/2, в течение которого концентрация вещества изменяется вдвое: ![]() . Это один из удобных формально-кинетических крите-риев... . Для реакции произвольного n-го порядка из формулы (2.9) получаем:
. Это один из удобных формально-кинетических крите-риев... . Для реакции произвольного n-го порядка из формулы (2.9) получаем:
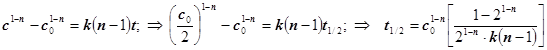 .
.
Используя обозначение ![]()
получаем ![]() (2.11)
(2.11)
Проводят серию экспериментов, изменяя начальную концентрацию одного из реагентов. Определяют время убыли его концентрации вдвое, и обрабатывают данные в спрямляющих переменных согласно уравнению![]() (2.12)
(2.12)
Отсюда можно найти порядок реакции по данному реагенту. Методы кинетических измерений (очень разнообразны! ..см. книги Н.М. Эмануэля):
химические (Это основа основ! Важен исчерпывающий качественный и количественный анализ системы),физико-химические, включая: спектроскопические: ИКС, оптическая электронная спектроскопия (УФ, видимая), ЯМР, ЭПР и др., электрохимические: -полярография, кондуктометрия,
потенциометрия (ионометрия, pH-метрия,...), дилатометрия – кинетика изменения объёма (особенно в кинетике полимеризации!),манометрия – кинетика изменения давления (в газах),рефрактометрия –измерение показателя преломления, поляриметрия - кинетика изменения угла вращения плоско-поляризованого светового луча во время превращений оптически-активных (хиральных) соединений),калориметрия - кинетика температурных изменений - в рапидных процессах..., а также любые методы, в которых измеряемое свойство непосредственно и однозначно связано с материальным балансом в реагрирующей системе...
Успех кинетического эксперимента полностью определяется научным уровнем исследовательской ла-боратории: тщательностью химической подготовки, качеством физико-химического и приборного оформления, достоверностью и корректностью измерений... Уже созданы огромные современные химические производства (в США и Германии - заводы DUPON и BASF), проектирвание которых целиком построено на основе компью-терного моделирвания всех без исключения физико-химических процессов (и кинетических !!! тоже).
Для подобных целей исходные лабораторные данные должны быть безукоризненными.
Оптимизация условий и критерии постановки кинетического эксперимента:
Подбор диапазона концентраций, удобного для регистрации,
Понижение порядка по отдельным реагентам. Для этого почти все реагенты вводятся в реакцию в большом избытке по отношению к одному – исследуемому. Его концентрация значительно меняется на фоне почти неизменных прочих, и возникает возможность измерения кинетики именно по недостаточному реагенту. По нему и определяется частный порядок реакции. Возможность серийных экспериментов и воспроизводимость данных. Эти критерии в большой степени экономические. Стоимость пионерских измерений обычно значительна.
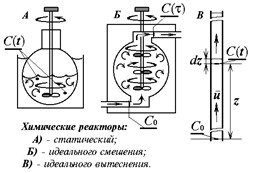
Химические реакторы. Кинетика и диффузия.
Устройства, предназначенные для кинетических измерений, называют химическими реакторами. Реактором может служить любой сосуд или его фрагмент, в том числе и такой, которому приданы какие-либо специальные геометрические формы. Различают реакторы статические и проточные. В свою очередь идеальные проточные бывают идеального смешения и идеального вытеснения. Концентрации веществ в реакторе во времени могут изменяться за счёт: а) химического превращения, б) массопереноса. Химическая реакция это переход системы в термодинамически - равновесное состояние за счёт перестройки молекулярно-атомной структуры её компонентов. Неравновесное распределение концентраций в реакционном пространстве является причиной массопереноса, и возникает диффузия. В гомогенной среде с однородным распределеним концентраций в статическом реакторе градиент концентраций отсутствует, и диффузии нет, но в проточных реакторах необходимо специально предусмотреть условия для количественного разделения концентрационных изменений чисто кинетической и диффузионной природы. Примеры химических реакторов показаны на рисунке. Эффективное (а в статическом реакторе полное) устранение градиента концентрации достигается искусственно механическим перемешиванием реакционной среды.
|
|||
|
|||
|
|||
t -время; c0 –стартовая (начальная) концентрация... и c(t) –текущая концентрация реагента;
z- линейное смещение фронта гидродинамического потока (расстояние от стартового сечения);
u- модуль линейной скорости потока в реакторе идеального вытеснения; w- объёмная скорость потока в реакторе идеального смешения ; V- объём реактора идеального смешения; - время контакта в реакторе идеального смешения; r - скорость химической реакции;
Способы математической обработки кинетических данных различают графические и
численные статистические (компьютерные).
Методы определения порядков и констант скоростей химических реакций :
(см. учебник Краснова, стр. 540-541; кафедральный практикум МИТХТ; семнарские занятия)
-графический и статистический подбор оптимальных спрямляющих координат;.
-прямая подстановка в кинетические уравнения и оптимизация постонных (k, n);
-установление взаимосвязи времени полупревращения и начального содержания;
-метод начальных скоростей;
-метод графического дифференцирования (ограниченно и лишь для простых реакций);
-понижение порядка реакции (одно из условий оптимального эксперимента см. выше).
Некоторые полезные сведения о кинетических признаках реакций первого порядка:
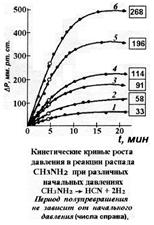
1) Время полупревращения не зависит от начального содержания реагента (парциального
давления или концентрации) (см. рис. на предыдущей странице).
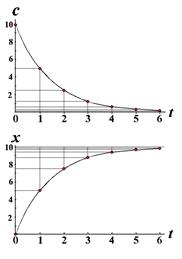
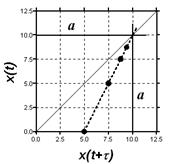
Ещё одно свойство не столь явное, но очень полезное выясняется после некоторых преобразований (рис.). Текущая концентрация реагента равна c=c0e-kt, а накопившегося продукта x(t)= c0 - c(t)= c0(1- e-kt). (2.13) По окончании реакции получаем ![]()
Преобразуем (2.13) к виду e-kt =1- [x(t)/ c0]. (2.14)
Через интервал времени временная переменная равна уже t+и получается
e-kt+ =1- [x(t+)/ c0] (2.15)
или e-ke-k t=1- [x(t+)/ c0]. Разделив почленно (2.14) на (2.15), получаем выражения 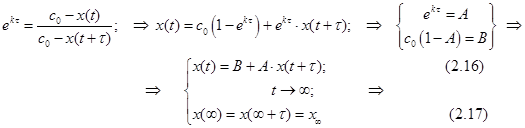
Согласно формуле (2.13) значение x = c0, а согласно (2.17) эта величина лежит на биссектрисе угла между осями декартовых координат (если их масштабы равны) на пересечении с графиком функции (2.16). Так получается один из способов экстраполяционного определения начального содержания реагента. Это особенно важно в тех случаях, когда по каким-то причинам измерить точно эту величину затруднительно. Для этой цели кинетические данные измеряют или представляют через равные интервалы времени. Вся процедура определения x = c0 = a показана ниже на модельном примере.
|
|
|
![]()
![]()
|
В завершение главы приведём рисунок-сводку (формулы см. в тексте).
Рис.7. Спрямляющие координаты для простых односторонних реакций разных порядков
|