Разработана кластерная восемнадцатигрупповая система химических элементов до
СОДЕРЖАНИЕ: Периодической системе элементов, но и дополнительно по кластерам химических элементов, определять прогнозные свойства новых элементов и создавать новые кластерные материалы и изделияКластерная система химических элементов
Хорошавин Лев Борисович
Докт. техн. наук
Реферат
Разработана кластерная восемнадцатигрупповая система химических элементов до N 220, в основу которой положен кластерный принцип строения электронных оболочек элементов с сохранением известной зависимости их свойств от атомной массы. Кластерная система химических элементов позволит изучать изменение свойств элементов не только по периодам и группам в Периодической системе элементов, но и дополнительно по кластерам химических элементов, определять прогнозные свойства новых элементов и создавать новые кластерные материалы и изделия.
Существующая длиннопериодная Периодическая система химических элементов Д.И.Менделеева исследована крайне недостаточно. Хотя и существуют более 500 производных систем от Периодической системы, но все они до сих пор не систематизированы, не проанализированы и недостаточно практически используются [1].
Автором для разработки новых систем химических элементов использовано два фундаментальных положения:
1. Строгой неизменности существующей Периодической системы химических элементов Д.И.Менделеева, недопустимости внесения в нее каких-либо изменений, кроме добавления новых элементов. Главная особенность Периодической системы – неизвестность впередистоящих до водорода элементов и последних элементов. Можно предполагать, что до водорода могут стоять элементарные частицы, объединенные в кластеры-изотопические мультиплеты, с массой и зарядом менее 1 с уменьшающимися размерами в данное время до иокточастиц -10-24 м, а в конце – бесконечное количество новых элементов с переходом их количества в новое качество по волновым функциям. Это предположение основано на том, что в данное время известно только около 5% материи, а 95% материи неизвестна до сих пор – в этой темной материи может быть всё, в т.ч. и новые элементы с новой структурой и новой периодичностью.
Следовательно, Периодическая система химических элементов Д.И.Менделеева бесконечна в начале системы до водорода и в конце с определенными условиями стабильности новых элементов.
2. Целесообразности разработок новых производных систем элементов для исследования взаимосвязи между свойствами элементов, прогнозирования новых элементов и решения конкретных практических задач. Для этих целей авторами создан ряд новых производных систем химических элементов, в т.ч. и с разделением элементов на нечетные и четные по атомным номерам [2-12].
Два положения о неизменности Периодической системы химических элементов Д.И.Менделеева и целесообразности разработок новых производных систем элементов полностью соответствуют объективным диалектическим законам познания Природного мира.
Известна зависимость свойств элементов от их атомной массы и электронной конфигурации в Периодической системе химических элементов Д.И.Менделеева по периодам и группам. Предлагается дополнительно рассматривать изменение свойств элементов по их кластерам (группировкам), основанным на количестве внешних электронов в каждой электронной конфигурации с целью:
- определить зависимости изменения свойств элементов в каждом кластере и между ними от четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml ) и спинового (ms );
- рассчитывать прогнозные свойства новых элементов на основе кластеров и электронных ячеек для их экспериментальной проверки;
- создать новые кластерные материалы и изделия по микро-, нано- и пикотехнологиям.
Постановка задачи в данной работе – определить кластеры химических элементов по количеству внешних электронов в каждой электронной конфигурации s-, p-, d-, f-, g-элементов (орбитальному квантовому числу l) при неизменности порядка их атомных масс и атомных номеров, равных количеству протонов в ядре и, соответственно, электронов в оболочках. Систематизировать кластеры химических элементов, определить электронные ячейки в кластерной системе элементов и изучить свойства ячеек.
Ранее авторами статьи установлены кластеры (группировки) химических элементов по структуре их внешних электронных оболочек и количеству в них внешних электронов [13].
Химическое взаимодействие элементов определяется преимущественно внешними электронами элементов, т.е. их количеством и структурой внешних электронных оболочек элементов. Также строение внешних электронных оболочек и связанные с ними большинство химических и физических свойств элементов определяются электромагнитным взаимодействием электронов с ядром – в основном кулоновскими силами и в меньшей степени друг с другом.
Количество внешних электронов и структура оболочек изменяются по группам элементов с определенным их чередованием в виде группировок, названных кластерами элементов.
Известно, что относительно небольшие группы частиц, объединенных теми или иными силами, относительно слабыми, называются кластерами (кластер, англ. cluster – группировка, скопление, сгусток, связка, пучок, группа атомов или других структурных элементов, агрегаты и др.). Виды кластеров многочисленны: нанокластеры (группировки, агрегаты ионов, атомов, молекул и отдельных частиц), металлические, магнитные, молекулярные, углеродные, водные, кластеры благородных газов и др.
Кластеры химических элементов – это группировки элементов с одинаковой электронной конфигурацией, с одинаковым интервалом изменения количества внешних электронов и границами между ними, определенными постоянным количеством внешних элементов в каждой группировке.
Кластерная система химических элементов (табл.1) основана на их разделении на s, p, d, f, g-элементы и кластеры.
Таблица 1. Кластерная система химических элементов
| Атомная масса – Удельная атомная масса – Распределение внешних электронов - |
6,94 3 2,31 Li литий 2s1 1 |
-Атомный номер - Название элемента - Количество внешних электронов |
Количество элементов в одном кластере: |
2- s-элементы 6- p-элементы 10- d-элементы 14- f-элементы 18- g-элементы |
|||||||||
| Ряды |
Группы элементов |
||||||||||||
| I |
II |
III |
IV |
V |
VI |
VII |
VIII |
IX |
|||||
| 1 |
1,0 1 1,0 H водород 1s1 1 |
4,0 2 2,0 He гелий 1s2 2 |
6,94 3 2,31 Li литий 2s1 1 |
9,01 4 2,25 Be бериллий 2s2 2 |
10,81 5 2,16 B бор 2s2 2p1 3 |
12,01 6 2,0 C углерод 2s2 2p2 4 |
14,00 7 2,0 N азот 2s2 2p3 5 |
15,99 8 1,99 О кислород 2s2 2p4 6 |
18,99 9 2,99 F фтор 2s2 2p5 7 |
||||
| 2 |
39,09 19 2,05 К калий 4s1 1 |
40,07 20 2,0 Са кальций 4s2 2 |
44,95 21 2,14 Sc скандий 3d1 4s2 3 |
47,88 2 2 2,17 Ti титан 3d2 4s2 4 |
50,94 23 2,21 V ванадий 3d3 4s2 5 |
51,99 24 2,16 Cr хром 3d4 4s2 6 |
54,93 25 2,19 Mn марганец 3d5 4s2 7 |
55,84 26 2,14 Fe железо 3d6 4s2 8 |
58,93 27 2,18 С o кобальт 3d7 4s2 9 |
||||
| 3 |
85,47 37 2,31 Rb рубидий 5s1 1 |
87,62 38 2,0 Sr стронций 5s2 2 |
88,90 39 2,27 Y иттрий 4d1 5s2 3 |
91,22 40 2,28 Zr цирконий 4d2 5s2 4 |
92,90 41 2,26 Nb ниобий 4d4 5s1 5 |
95,94 42 2,28 Mo молибден 4d5 5s1 6 |
97,90 43 2,27 Tc технеций 4d5 5s2 7 |
101,07 44 2,29 Ru рутений 4d7 5s1 8 |
102,9 4 5 2,28 Rh родий 4d8 5s1 9 |
||||
| 4 |
132,9 55 2,41 Cs цезий 6s1 1 |
137,32 56 2,45 Ba барий 6s2 2 |
138,95 57 2,43 La лантан 5d1 6s2 3 |
140,12 58 2,41 Ce церий 4f1 5d1 6s2 4 |
140,9 59 2,38 Pr празеодим 4f3 6s2 5 |
144,24 60 2,40 Nd неодим 4f4 6s2 6 |
145,0 61 2,45 Pm прометий 4f5 6s2 7 |
150,4 62 2,42 Sm самарий 4f6 6s2 8 |
151,96 63 2,41 Eu европий 4f7 6s2 9 |
||||
| 5 |
180,94 73 2,47 Ta тантал 5d3 6s2 5 |
183,85 74 2,48 W вольфрам 5d4 6s2 6 |
186,2 75 2,48 Re рений 5d5 6s2 7 |
190,2 76 2,50 Os осми 5d6 6s2 8 |
192,22 77 2,49 Ir иридий 5d7 6s2 9 |
195,09 78 2,50 Р t платина 5d8 6s2 10 |
196,96 79 2,50 Au золото 5d10 6s1 11 |
200,59 80 2,50 Hg ртуть 5d10 6s2 12 |
204,38 81 2,52 Tl таллий 6s2 6p1 3 |
||||
| 6 |
231,03 91 2,53 Pa протактиний 5f2 6d1 7s2 5 |
238,02 92 2,58 U уран 5f3 6d1 7s2 6 |
237,04 93 2,54 Np нептуний 5f4 6d1 7s2 7 |
244,06 94 2,59 Pu плутоний 4f1 5d1 6s2 4 |
243,06 95 2,55 Am америций 5f7 7s2 9 |
247,07 96 2,57 Cm кюрий 5 f 7 6 d1 7 s2 10 |
247,07 97 2,54 Bk берклий 5f8 6d1 7s2 11 |
251,08 98 2,56 Cf калифорний 5f1 0 7s2 12 |
252,08 9 9 2,54 Es эйнштейн 5f1 1 7s2 13 |
||||
| 7 |
266,0 109 2,44 Mt мейтнерий 6d7 7s2 9 |
267,14 110 2,42 Ds дармштадтий 6d8 7s2 10 |
268,14 111 2,41 -
6d10 7s1 11 |
269,15 112 2,40 - 6d10 7s2 12 |
270,15 113 2,39 - 7s2 7p1 3 |
271,16 11 4 2,37 - 7s2 7p2 4 |
272,16 11 5 2,36 - 7s2 7p3 4 |
273,17 11 6 2,35 - 7s2 7p4 5 |
274,17 117 2,34 - 7s2 7p5 7 |
||||
| 8 |
284,42 127 2,23 - 9 |
285,25 128 2,22 - 10 |
286,26 129 2,22 - 11 |
287,27 130 2,20 - 12 |
131 -
13 |
132 -
14 |
133 -
15 |
134 -
16 |
135 -
17 |
||||
| 9 |
145 -
9 |
146 -
10 |
147 -
11 |
148 -
12 |
149 -
13 |
150 -
14 |
151 -
15 |
152 - 16 |
153 - 3 |
||||
| 10 |
163 -
3 |
164 -
4 |
165 -
5 |
166 -
6 |
167 -
7 |
168 -
8 |
169 -
1 |
170 -
2 |
171 -
3 |
||||
| 11 |
181 -
13 |
182 -
14 |
183 -
15 |
184 -
16 |
185 - 17 |
186 -
18 |
87 -
19 |
88 -
20 |
189 - 3 |
||||
| 12 |
199 -
13 |
200 -
14 |
201 -
15 |
202 -
16 |
203 -
3 |
204 -
4 |
205 -
5 |
206 - 6 |
207 - 7 |
||||
| 13 |
217 -
7 |
218 -
8 |
219 -
1 |
220 -
2 |
-
|
-
|
-
|
- |
- |
||||
| 14 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
||||
Продолжение таблицы 1
| Ряды |
Группы элементов |
||||||||
| X |
XI |
XII |
XIII |
XIV |
XV |
XVI |
XVII |
XVIII |
|
| 1 |
20,17 1 0 2,01 Ne неон 2s2 2p6 8 |
22,99 11 2,09 Na натрий 3s1 1 |
6,94 12 2,02 Mg магний 3s2 2 |
26,98 13 2,07 Al алюминий 3s2 3p1 3 |
28,08 14 2,0 Si кремний 3s2 2p2 4 |
30,97 15 2,06 P фосфор 3s2 3p3 5 |
32,06 16 2,0 S сера 3s2 3p4 6 |
35,45 17 2,08 Cl хлор 3s2 3p5 7 |
39,94 18 2,21 Ar аргон 3s2 3p6 8 |
| 2 |
58,34 28 2,08 Ni никель 3d8 4s2 10 |
63,54 2 9 2,19 С u медь 3d10 4s1 11 |
65,39 30 2,17 Zn цинк 3d10 4s2 12 |
69,72 31 2,24 Ga галлий 4s2 4p1 3 |
72,61 32 2,26 Ge германий 4s2 4p2 4 |
74,92 33 2,27 As мышьяк 4s2 4p3 5 |
78,96 34 2,32 Se селен 4s2 4p4 6 |
79,90 3 5 2,28 Br бром 4s2 4p5 7 |
83,8 36 2,32 К r криптон 3s2 4p6 8 |
| 3 |
106,4 46 2,31 Pd палладий 4d10 5s0 10 |
107,86 47 2,29 Ag серебро 4d10 5s1 11 |
112,41 48 2,34 Cd кадмий 4d10 5s2 12 |
114,81 49 2,34 In индий 5s2 5p1 3 |
118,71 50 2,37 Sn олово 5s2 5p2 4 |
121,75 51 2,38 Sb сурьма 5s2 5p3 5 |
127,6 52 2,45 Te теллур 5s2 5p4 6 |
126,9 53 2,39 I йод 5s2 5p5 7 |
131,29 54 2,43 Xe ксенон 5s2 5p6 8 |
| 4 |
157,25 64 2,45 Gd гадолиний 4f7 5d1 6s10 |
153,92 65 2,36 Tb тербий 4f9 6s2 11 |
162,5 66 2,46 Dy диспрозий 4f1 0 6s2 12 |
164,93 67 2,46 Ho гольмий 4f1 1 6s2 13 |
167,26 68 2,46 Er эрбий 4f12 6s2 14 |
168,93 69 2,44 Tm тулий 4f13 6s2 15 |
173,04 70 2,47 Yb иттербий 4f14 6s2 16 |
174,97 71 2,46 Lu лютеций 5d1 6s2 3 |
178,49 72 2,47 Hf гафний 5d2 6s2 4 |
| 5 |
207,2 82 2,52 Pb свинец 6s2 6p2 4 |
208,98 83 2,51 Bi висмут 6s2 6p3 5 |
208,98 84 2,48 Po полоний 6s2 6p4 6 |
209,98 85 2,47 At астат 6s2 6p5 7 |
221,01 86 2,58 Rn радон 6s2 6p2 8 |
223,02 87 2,56 Fr франций 7s1 1 |
226,02 88 2,56 Ra радий 7s2 2 |
227,02 89 2,55 Ac актиний 6d1 7s2 3 |
232,03 90 2,57 Th торий 6d2 7s2 4 |
| 6 |
257,09100 2,57 Fm фермий 4f12 7s2 14 |
258,09 101 2,55 Md менделеевий 5 f 3 6 d1 7 s2 15 |
259,1 102 2,54 No нобелий 5f14 7s2 16 |
260,1 103 2,52 Lr лоуренсий 6d1 7s2 3 |
261,11 104 2,51 Rf резерфордийий 6d2 7s2 4 |
262,11 105 2,49 Db дубний 6d3 7s2 5 |
263,12 106 2,48 Sg сиборгий 6d4 7s2 6 |
264,1 107 2,46 Bh борий 6d5 7s2 7 |
265,13 108 2,45 Hs хассий 6d6 7s2 8 |
| 7 |
275,18118 2,33 - 7s2 7p6 8 |
276,18 11 9 2,32 -
8s1 1 |
277,19 1 20 2,30 -
8s2 2 |
278,19 1 21 2,29 - 3 |
279,2 1 22 2,28 - 4 |
280,2 1 23 2,27 - 5 |
281,21 1 24 2,26 - 6 |
282,22 1 25 2,25 - 7 |
283,23 1 26 2,24 - 8 |
| 8 |
1 36 - 18 |
1 37 -
19 |
1 38 -
20 |
1 39 -
3 |
1 40 -
4 |
1 41 -
5 |
142 -
6 |
1 43 -
7 |
1 44 -
8 |
| 9 |
1 54 -
4 |
1 55 -
5 |
1 56 -
6 |
1 57 -
7 |
1 58 -
8 |
15 9 -
9 |
1 60 -
10 |
1 61 - 11 |
162 - 12 |
| 10 |
1 72 -
4 |
1 73 -
5 |
1 74 -
6 |
1 75 -
6 |
1 76 -
8 |
1 77 -
9 |
1 78 -
10 |
17 9 -
11 |
1 80 -
12 |
| 11 |
19 0 -
4 |
191 -
5 |
192 -
6 |
193 -
7 |
194 -
8 |
195 -
9 |
196 -
10 |
197 -
11 |
198 -
12 |
| 12 |
2 08 -
8 |
2 09 -
9 |
21 0 -
10 |
2 11 -
11 |
212 -
12 |
213 -
3 |
214 -
4 |
215 - 5 |
216 - 6 |
| 13 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
| 14 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Таблица 2. Разделение химических элементов на
s
,
p
,
d
,
f
,
g
-элементы и кластеры
в кластерной системе химических элементов
| s- элементы |
p- элементы |
d- элементы |
f- элементы |
g- элементы |
|||||||||||||||||
| Но-мер |
Сим-вол |
К-во внешних электронов |
Но-мер |
Сим-вол |
К-во внешних электронов |
Но-мер |
Сим-вол |
К-во внешних электронов |
Но-мер |
Сим-вол |
К-во внешних электронов |
Но-мер |
Сим-вол |
К-во внешних электронов |
|||||||
| 1 |
H |
1 |
5 |
B |
3 |
21 |
Sc |
3 |
57 |
La |
3 |
121 |
- |
3 |
|||||||
| 2 |
He |
2 |
6 |
C |
4 |
22 |
Ti |
4 |
58 |
Ce |
4 |
122 |
- |
4 |
|||||||
| 3 |
Li |
1 |
7 |
N |
5 |
23 |
V |
5 |
59 |
Pr |
5 |
123 |
- |
5 |
|||||||
| 4 |
Be |
2 |
8 |
O |
6 |
24 |
Cr |
6 |
60 |
Nd |
6 |
124 |
- |
6 |
|||||||
| 11 |
Na |
1 |
9 |
F |
7 |
25 |
Mn |
7 |
61 |
Pm |
7 |
125 |
- |
7 |
|||||||
| 12 |
Mg |
2 |
10 |
Ne |
8 |
26 |
Fe |
8 |
62 |
Sm |
8 |
126 |
- |
8 |
|||||||
| 19 |
K |
1 |
13 |
Al |
3 |
27 |
Co |
9 |
63 |
Eu |
9 |
127 |
- |
9 |
|||||||
| 20 |
Ca |
2 |
14 |
Si |
4 |
28 |
Ni |
10 |
64 |
Gd |
10 |
128 |
- |
10 |
|||||||
| 37 |
Rb |
1 |
15 |
P |
5 |
29 |
Cu |
11 |
65 |
Tb |
11 |
129 |
- |
11 |
|||||||
| 38 |
Sr |
2 |
16 |
S |
6 |
30 |
Zn |
12 |
66 |
Dy |
12 |
130 |
- |
12 |
|||||||
| 55 |
Cs |
1 |
17 |
Cl |
7 |
39 |
Y |
3 |
67 |
Ho |
13 |
131 |
- |
13 |
|||||||
| 56 |
Ba |
2 |
18 |
Ar |
8 |
40 |
Zr |
4 |
68 |
Er |
14 |
132 |
- |
14 |
|||||||
| 87 |
Fr |
1 |
31 |
Ga |
3 |
41 |
Nb |
5 |
69 |
Tm |
15 |
133 |
- |
15 |
|||||||
| 88 |
Ra |
2 |
32 |
Ge |
4 |
42 |
Mo |
6 |
70 |
Yb |
16 |
134 |
- |
16 |
|||||||
| 119 |
- |
1 |
33 |
As |
5 |
43 |
Tc |
7 |
89 |
Ac |
3 |
135 |
- |
17 |
|||||||
| 120 |
- |
2 |
34 |
Se |
6 |
44 |
Ru |
8 |
90 |
Th |
4 |
136 |
- |
18 |
|||||||
| 169 |
- |
1 |
35 |
Br |
7 |
45 |
Rh |
9 |
91 |
Pa |
5 |
137 |
- |
19 |
|||||||
| 170 |
- |
2 |
36 |
Kr |
8 |
46 |
Pd |
10 |
92 |
U |
6 |
138 |
- |
20 |
|||||||
| 219 |
- |
1 |
49 |
In |
3 |
47 |
Ag |
11 |
93 |
Np |
7 |
171 |
- |
3 |
|||||||
| 220 |
- |
2 |
50 |
Sn |
4 |
48 |
Cd |
12 |
94 |
Pu |
8 |
172 |
- |
4 |
|||||||
| 10 кластеров |
51 |
Sb |
5 |
71 |
Lu |
3 |
95 |
Am |
9 |
173 |
- |
5 |
|||||||||
| 52 |
Te |
6 |
72 |
Hf |
4 |
96 |
Cm |
10 |
174 |
- |
6 |
||||||||||
| 53 |
I |
7 |
73 |
Ta |
5 |
97 |
Bk |
11 |
175 |
- |
7 |
||||||||||
| 54 |
Xe |
8 |
74 |
W |
6 |
98 |
Cf |
12 |
176 |
- |
8 |
||||||||||
| 81 |
Tl |
3 |
75 |
Re |
7 |
99 |
Es |
13 |
177 |
- |
9 |
||||||||||
| 82 |
Pb |
4 |
76 |
Os |
8 |
100 |
Fm |
14 |
178 |
- |
10 |
||||||||||
| 83 |
Bi |
5 |
77 |
Ir |
9 |
101 |
Md |
15 |
179 |
- |
11 |
||||||||||
| 84 |
Po |
6 |
78 |
Pt |
10 |
102 |
No |
16 |
180 |
- |
12 |
||||||||||
| 85 |
At |
7 |
79 |
Au |
11 |
139 |
- |
3 |
181 |
- |
13 |
||||||||||
| 86 |
Rn |
8 |
80 |
Hg |
12 |
140 |
- |
4 |
182 |
- |
14 |
||||||||||
| 113 |
- |
3 |
103 |
Lr |
3 |
141 |
- |
5 |
183 |
- |
15 |
||||||||||
| 114 |
- |
4 |
104 |
Rf |
4 |
142 |
- |
6 |
184 |
- |
16 |
||||||||||
| 115 |
- |
5 |
105 |
Db |
5 |
143 |
- |
7 |
185 |
- |
17 |
||||||||||
| 116 |
- |
6 |
106 |
Sg |
6 |
144 |
- |
8 |
186 |
- |
18 |
||||||||||
| 117 |
- |
7 |
107 |
Bh |
7 |
145 |
- |
9 |
187 |
- |
19 |
||||||||||
| 118 |
- |
8 |
108 |
Hs |
8 |
146 |
- |
10 |
188 |
- |
20 |
||||||||||
| 163 |
- |
3 |
109 |
Mt |
9 |
147 |
- |
11 |
2 кластера |
||||||||||||
| 164 |
- |
4 |
110 |
Ds |
10 |
148 |
- |
12 |
|||||||||||||
| 165 |
- |
5 |
111 |
- |
11 |
149 |
- |
13 |
|||||||||||||
| 166 |
- |
6 |
112 |
- |
12 |
150 |
- |
14 |
|||||||||||||
| 167 |
- |
7 |
153 |
- |
3 |
151 |
- |
15 |
|||||||||||||
| 168 |
- |
8 |
154 |
- |
4 |
152 |
- |
16 |
|||||||||||||
| 213 |
- |
3 |
155 |
- |
5 |
189 |
- |
3 |
|||||||||||||
| 214 |
- |
4 |
156 |
- |
6 |
190 |
- |
4 |
|||||||||||||
| 215 |
- |
5 |
157 |
- |
7 |
191 |
- |
5 |
|||||||||||||
| 216 |
- |
6 |
158 |
- |
8 |
192 |
- |
6 |
|||||||||||||
| 217 |
- |
7 |
159 |
- |
9 |
193 |
- |
7 |
|||||||||||||
| 218 |
- |
8 |
160 |
- |
10 |
194 |
- |
8 |
|||||||||||||
| 8 кластеров |
161 |
- |
11 |
195 |
- |
9 |
|||||||||||||||
| 162 |
- |
12 |
196 |
- |
10 |
||||||||||||||||
| 203 |
- |
3 |
197 |
- |
11 |
||||||||||||||||
| 204 |
- |
4 |
198 |
- |
12 |
||||||||||||||||
| 205 |
- |
5 |
199 |
- |
13 |
||||||||||||||||
| 206 |
- |
6 |
200 |
- |
14 |
||||||||||||||||
| 207 |
- |
7 |
201 |
- |
15 |
||||||||||||||||
| 208 |
- |
8 |
202 |
- |
16 |
||||||||||||||||
| 209 |
- |
9 |
4 кластера |
||||||||||||||||||
| 210 |
- |
10 |
|||||||||||||||||||
| 211 |
- |
11 |
|||||||||||||||||||
| 212 |
- |
12 |
|||||||||||||||||||
| 6 кластеров |
|||||||||||||||||||||
| Итого: s - 20 |
p - 48 |
d - 60 |
f - 56 |
g - 36 |
|||||||||||||||||
| Всего: 220 элементов |
|||||||||||||||||||||
Так, в кластерной системе внешние электроны образуют в s-, p-,d-,f-, g-элементах следующие кластеры (табл.2, рис.1):
| - по 2 -s-элементов, - по 6 –р-элементов, - по 10 -d-элементов |
- по 14 –f-элементов, - по 18-g-элементов. |
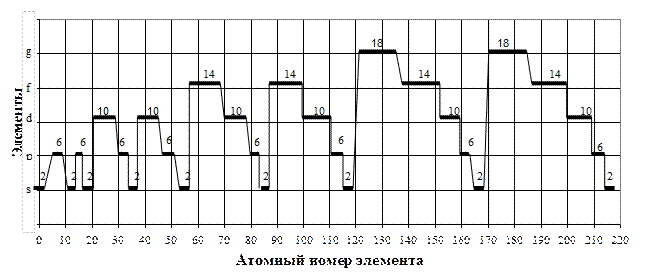
Рис.2. Распределение s-, p-, d-, f-, g-элементов и кластеров по атомным номерам в кластерной системе химических элементов. Цифра – количество элементов в кластере:2,6,10,14,18 с разностью между ними по 4 элемента и парностью по 2 элемента
При этом разность между каждым кластером равна 4 элементам (2-6-10-14-18) и парностью по 2 элемента.
В каждом элементе количество внешних электронов изменяется так:
- в s – элементах внешние электроны изменяются от 1 до 2;
| - в р -элементах -3-8; - в d -элементах -3-12; |
- в f –элементах – 3-16; -в g –элементах – 3-20; |
Количество пар элементов в s-,p-,d-,f-,g-группах и кластеров элементов в кластерной системе приведено в табл.3
Таблица 3. Количество пар элементов s -, p -, d -, f -, g -группах и кластеров в кластерной системе
| Группы элементов |
Общее количество элементов |
Количество пар элементов |
Количество кластеров элементов |
| s – элементы |
20 |
10 |
10 |
| р – элементы |
48 |
24 |
8 |
| d – элементы |
60 |
30 |
6 |
| f – элементы |
56 |
28 |
4 |
| g – элементы |
36 |
18 |
2 |
| Всего: |
220 |
110 |
30 |
В системе количество пар нечетных - четных элементов сначала возрастает в группах от s – элементов к d – элементам, а затем снижается к g – элементам. Количество кластеров уменьшается от s к g- элементам.
Границы кластеров элементов повторяются через определенное количество атомных номеров N:
- по первичной разности Nп между конечным номером Nк одного кластера и начальным номером Nн другого кластера по группам s-,p-,d-,f-,g-элементов - Nп = Nк - Nн ;
- по вторичной разность Nв между первичной разностью соседних кластеров - Nв =Nп1 -Nп2 (Табл.4)
Таблица 4. Первичная и вторичная разность между
кластерами элементов
| s-элементы |
p-элементы |
d-элементы |
f-элементы |
g-элементы |
||||||||||
| Nк -Nн |
Nп |
Nв |
Nк -Nн |
Nп |
Nв |
Nк -Nн |
Nп |
Nв |
Nк -Nн |
Nп |
Nв |
Nк -Nн |
Nп |
Nв |
| 2-3 |
1 |
- |
10-13 |
3 |
- |
30-39 |
9 |
- |
70-89 |
19 |
- |
138-171 |
33 |
0 |
| 4-11 |
7 |
6 |
18-31 |
13 |
10 |
48-71 |
23 |
14 |
102-139 |
37 |
18 |
188- |
||
| 12-19 |
7 |
0 |
36-49 |
13 |
0 |
80-103 |
23 |
0 |
152-189 |
37 |
0 |
|||
| 20-37 |
17 |
10 |
54-81 |
27 |
14 |
112-153 |
41 |
18 |
202- |
|||||
| 38-55 |
17 |
0 |
86-113 |
27 |
0 |
162-203 |
41 |
0 |
||||||
| 56-87 |
31 |
14 |
118-163 |
45 |
18 |
212- |
||||||||
| 88-119 |
31 |
0 |
168-213 |
45 |
0 |
|||||||||
| 120-169 |
49 |
18 |
218- |
|||||||||||
| 170-219 |
49 |
0 |
||||||||||||
| 220- |
||||||||||||||
Примечание. Исходные данные табл.2, жирным шрифтом – прогнозные данные. Nк , Nн - атомные номера элементов соответственно конечного и начального кластера; Nп - первичная разность между кластерами; Nв - вторичная разность между первичной разностью соседних кластеров. Так, например, Nп =Nк -Nн =[2-3]=1; Nв =7-1=6 и т.д.
Обращают на себя внимание двойственная однотипность первичной разности элементов Nп между кластерами и строгая последовательность изменения вторичной разности Nв : 6-0-10-0-14-0-18-0. Эти закономерности позволили привести прогнозные данные по группам s-,p-,d-,f-,g-элементов и количеству внешних электронов до №220 (табл.1,2, рис.2)
При этом количество внешних электронов в системе распределяется одинаково по отдельным областям.
В дальнейшем целесообразно исследовать изменение свойств химических элементов по кластерам с целью познания и созидания новых химических соединений и веществ – новых кластерных материалов и изделий.
Действительно, если фундаментальным принципом построения Периодической системы элементов является выделение в ней периодов (горизонтального ряда) и групп (вертикальные столбцы) элементов с изучением изменения в них свойств элементов, то в кластерной системе (производной от Периодической системы) рассматриваются кластеры элементов. При этом Периодическая система носит расчетный характер по периодам и группам, а кластерная система – тоже расчетный характер по кластерам элементов и электронным ячейкам.
В данное время известно 118 элементов. В кластерной системе содержится пока 220 элементов, в т.ч. 20-s-элементов, 48-р-элементов, 60-d-элементов, 56-f элементов и 36-g-элементов.
Известно, что любой элемент в Периодической системе имеет свойства, промежуточные между свойствами соседних с ним элементов по горизонтали, вертикали, и диагонали [14].
Кластерная система химических элементов имеет одинаковую, ячеистую, электронную структуру - разность между количеством электронов любых близлежащих элементов в разных частях системы одинакова. Так, в любых электронных ячейках 2х2 элемента разность между количеством электронов, равного атомному номеру элемента, всегда равна (рис.2,а):
| - по горизонтали – 1 - по вертикали - 18 |
- по диагонали сверху виз – 19; - по диагонали снизу вверх – 17. |
Аналогично изменяется количество электронов в любых электронных ячейках 3х3, 4х4 и т.д. в разных частях системы (рис.2,б).
Следовательно, кластерная система химических элементов имеет ячеистую структуру, состоящую из одинаковых электронных ячеек. Свойства электронных ячеек следующие (рис.1,в):
 а б в
а б в
Рис.2.
Электронные ячейки кластерной
системы химических элементов
- противоположные стороны электронных ячеек всегда равна между собой: А=С; D=B; а=с; d=b. Поэтому и сумма или разность противоположных сторон ячеек равна между собой А±С=D±B; а±с=d±b;
- суммы диагональных номеров элементов (количество электронов) всегда равна между собой : Е1 =Н+Х; F1 =R+L; Е1 = F1 ; е1 =0+х; f1 =S+P; е1 = f1 ;
- сумма или разность диагональных номеров элементов равна сумме или разности соответствующих сторон треугольников в ячейках – их общей гипотенузе:
Е=А± B=D±С; е=а±b=d±с; Е=D±А=С±B; f=d±а=с±b;
- сумма диагоналей, поделена на 2, равна вертикальным сторонам ячеек: (Е+F)/2=B=D;
- разность диагоналей ячеек, поделена на 2, равна горизонтальным сторонам ячеек: (Е-F)/2=A=C;
- каждый атомный номер элемента, т.е. количество электронов у элемента, равен сумме двух противоположных диагональных элементов с минусом другого диагонального элемента: Х= (R+L)-H; О=(M+J)-H; S=(R+O)-M; Р=(О+L)-J и т.д.
Поэтому, зная свойства любых трех соседних элементов в прямоугольной ячейке можно по формуле Х=(R+L)-H определить свойства четвертого (нового) элемента.
Эти закономерности электронных ячеек при постановке электронов в ячейки, являются точными и могут быть использованы для расчета электронов новых элементов без поправочных коэффициентов.
Однако, при постановке в ячейки вместо электронов различных свойств элементов (атомной массы, атомных радиусов, плотности и др.) для расчета свойств новых элементов в закономерности ячеек требуется введение поправочных коэффициентов. Это вероятно, обусловлено неодинаковой удельной атомной массой в элементах (атомная масса элемента приходящаяся на 1 электрон) и недостаточной объективностью существующих показателей свойств элементов (в разных справочниках свойства элементов различны).
Другой особенностью кластерной системы химических элементов является то, что все элементы в ней связаны по парам, т.е все они парные – нечетные с четными. Парность (двоичность) элементов наглядно подтверждается в s-,p-,d-,f-,g-группах, в которых все элементы располагаются по парам: H с He, Li с Be, B с C,N с O и т.д. Это положение широко распространено в Природном и техногенном мире.
В данной работе использовано положение геохимии о распространенности и устойчивости нечетных и четных элементов в земной коре и метеоритах.
Д.И.Менделеев первым отметил сложение вещества земной коры в основном легкими элементами по Fe включительно, а элементы, стоящие в Периодической системе после Fe , в сумме составляют лишь доли процента. «Наибольшим распространением в Природе пользуются элементы лишь малого атомного веса» (1895 г.).
При этом четные элементы более устойчивы, чем нечетные, что определяется структурой ядер и электронных оболочек. Это положение подтверждается в геохимии правилом Оддо-Гаркинса, которые установили сильное преобладание четных элементов над нечетными на Земле и в метеоритах, возраст которых составляет 4,5 млрд.лет. Так, в земной коре четные элементы составляют 86,5% общей массы коры. В железных метеоритах четные элементы составляют 92,22%, а в каменных – 97,69% [2].
Правило Оддо-Гаркинса проявляется и в составе двух главнейших магм Земли: в кислой магме присутствуют преимущественно нечетные элементы: H(1), Li93), B(5), F(9), Na(11), Cl(17), K(19), а в основной магме преобладают четные элементы: Mg(12), Ca(20), Ti(22), Cr(24), Fe(26), Ni(28). В скобках приведены порядковые номера элементов в Периодической системе элементов Д.И.Менделеева, которые неизменны. В целом распространенность элементов и их устойчивость уменьшается от более легких к более тяжелым почти по экспоненциальному закону, различному для элементов с нечетными и четными атомными номерами.
Кроме того, в работе использовано положение диалектики о том, что раздвоение единого целого является сущностью теории познания [15]. Для этого Периодическая система элементов Д.И.Менделеева была разделена на нечетные и четные элементы с определением по отдельности их свойств с использованием компьютерной программы искусственного интеллекта [3,4]. Установлены следующие зависимости изменения свойств нечетных и четных элементов:
1. Атомный радиус. Общей закономерностью является уменьшение атомного радиуса в ряду s p d f–элементов. При этом у четных элементов атомный радиус меньше, чем у нечетных (кроме р-элементов). Средний атомный радиус нечетных и четных элементов следующий (пм):
элементы нечетные четные
s – 203,12 176,00
p – 132,77 144,72
d – 148,05 142,20
f – 178,33 176,20
среднее: 165,56 159,78
2. Плотность. В целом плотность в ряду s p d f–элементов имеет тенденцию к возрастанию, особенно у четных элементов.
3. Температура плавления элементов. В целом температура плавления элементов в ряду s p d f возрастает, особенно у четных элементов.
4. Температура плавления оксидов. Наиболее высокую температуру плавления имеют четные s, p, d, f-элементы, особенно после №100.
Таким образом, в зависимости от электронного строения внешних оболочек свойства элементов в общем зависят скачкообразно, но с тенденцией уменьшения атомного радиуса, увеличения плотности и температуры плавления оксидов. Анализ этих данных показывает, что, например, для техногенных материалов – огнеупоров – целесообразно использовать оксиды из четных s, p и d-элементов до №56 – бария, а для сверхпроводников – четные элементы в кластерах [17-19].
В целом изучение кластерной системы химически элементов позволит дополнительно расширить определение взаимосвязи свойств существующих и прогнозных элементов с использованием впервые кластеров элементов и электронных ячеек с целью создания новых кластерных содинений, веществ, материалов и изделий: кластерных сверхпроводников, топливных элементов, кластерных огнеупоров, спецкерамики и др.
Создание кластерных изделий необходимо производить по микро-, нано- и пикотехнологиям с использованием компьютерных программ искусственного интеллекта.
Выводы
1. Приведена кластерная система химических элементов до атомного номера №220. В ней определены свойства кластерных элементов и электронных ячеек.
2. Использование кластеров химических элементов и электронных ячеек открывает новые возможности дополнительного изучения взаимосвязи свойств элементов, расчета прогнозных свойств новых элементов и создания новых кластерных материалов и изделий.
Литература
1. Волков А.И. Строение атомов и Периодический закон/-М.: Новое знание,2006.-196с.
2. Хорошавин Л.Б. Оптимальная область огнеупоров в Периодической системе химических элементов/. Объединенный научный журнал.2005, №5, с.64-70. Сайт: http://refractoriesl.narod.ru
3. Хорошавин Л.Б., Щербатский В.Б. Исследование взаимосвязи между свойствами химических элементов на основе Периодического закона./. Объединенный научный журнал. 2005, №5, с.71-81. Сайт: http://refractoriesl.narod.ru
4. Хорошавин Л.Б., Щербатский В.Б. Исследование зависимости свойств химических элементов от их электронного строения на основе Периодического закона/. Объединенный научный журнал. 2005, №11, с.62-76. . Сайт: http://refractoriesl.narod.ru
5. Хорошавин Л.Б., Щербатский В.Б. Элементы, стоящие до Периодической системы химических элементов Д.И.Менделеева/. Объединенный научный журнал. 2005, №12, с.77-85. Сайт: http://refractoriesl.narod.ru
6. Хорошавин Л.Б., Щербатский В.Б . Управление электронами – основа изменения свойств химических элементов, соединений и веществ/. Объединенный научный журнал. 2005, №20, с.71-81. . Сайт: http://refractoriesl.narod.ru
7. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В. Компьютерная гибридная модель расчета свойств химических элементов/. Объединенный научный журнал. 2005, №20, с.81-86. . Сайт: http://refractoriesl.narod.ru
8. Хорошавин Л.Б., Щербатский В.Б. Электронная технология огнеупоров на основе Периодического закона/Журнал «Новые огнеупоры». 2005, №10, с.75-83. Сайт: http://refractoriesl.narod.ru
9. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В. Октайдная и десятичная системы химических элементов/. Объединенный научный журнал. 2005, №30, с.60-67. . Сайт: http://refractoriesl.narod.ru
10. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В. Никитина Н.Ю. От систем химических элементов до нанотехнологии материалов и изделий/. Объединенный научный журнал. 2005, №32, с.67-76. . Сайт: http://refractoriesl.narod.ru
11. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В. Сопоставление различных систем химических элементов/. Объединенный научный журнал. 2006, №3, с.88-100. . Сайт: http://refractoriesl.narod.ru
12. Хорошавин Л.Б., Щербатский В.Б. Якушина Е.В. Ячеистая структура десятичной системы химических элементов/. Объединенный научный журнал. 2006, №9, с.64-72. . Сайт: http://refractoriesl.narod.ru
13. Хорошавин Л.Б., Щербатский В.Б. Электронные ячейки и кластеры химических элементов./Объединенный научный журнал. 2008, №6, с.55-63. Сайт: http://refractoriesl.narod.ru
14. Егоров В.В. Теоретические основы неорганической химии. СПб.: Изд-во «Лань», 2005.- 192с.
15. Хорошавин Л.Б. Диалектика огнеупоров./ Л.Б.Хорошавин. Екатеринбург: Изд-во Екатеринбургская Ассоциация Малого бизнеса, 1999. -359с.
16. Хорошавин Л.Б., Щербатский В.Б. Гармоничные кварки в электронах и протонах./Объединенный научный журнал. 2008, №10, с.51-53. Сайт: http://refractoriesl.narod.ru
17. Хорошавин Л.Б., Щербатский В.Б., Якушина Е.В. Исследование свойств сверхпроводников на основе компьютерных программ/ Объединенный научный журнал. 2006, №24, с.62-69. . Сайт: http://refractoriesl.narod.ru
18. Хорошавин Л.Б., Щербатский В.Б., Якушина Е.В. Мультиэлектрон – основа сверхпроводимости./ Объединенный научный журнал. 2007, №2, с.68-76. . Сайт: http://refractoriesl.narod.ru
19. Хорошавин Л.Б., Щербатский В.Б., Якушина Е.В., Дьячкова Т.В. Мультиэлектронная теория сверхпроводимости./ Объединенный научный журнал. 2007, №17, с43-56. . Сайт: http://refractoriesl.narod.ru
20. Дерунов В. Отзыв на мультиэлектронную теорию сверхпроводимости. . Сайт: http://refractoriesl.narod.ru

Уважаемая редакция!
 Прошу опубликовать мою статью: «Кластерная система химических элементов».
Прошу опубликовать мою статью: «Кластерная система химических элементов».
С уважением Л.Б.Хорошавин
Тел. 8-922-13-33-862