Развития нейрона, момент времени
СОДЕРЖАНИЕ: Взаимосвязь между временем образования нейронов и судьбой клеток. Генетические аномалии строения коры у мышей линии reeler. Влияние локальных сигналов на корковую архитектуру. Гормональный контроль за развитием нервной системы. Стволовые нервные клетки.РАЗВИТИЯ НЕЙРОНА, МОМЕНТ ВРЕМЕНИ
Взаимосвязь между временем образования нейронов и судьбой клеток
Существен ли для развития нейрона момент времени, когда его клетка-предшественница прекращает делиться и мигрирует прочь от вентрикулярной зоны? На данный вопрос можно ответить при помощи маркировки нейронов в то время, когда они переходят в постмитотическое состояние, или «рождаются». В этой технике, впервые разработанной Ангевином и Сидманом, производится однократное введение [3 Н]-тимидина либо внутриматочно, либо внутривенно в определенный день развития. Эта метка захватывается и встраивается в ДНК клетки, находящейся в стадии деления в данный момент. Невстроившийся тимидин быстро исчезает из кровотока. Таким образом, клетки, находящиеся в постмитотической стадии, не содержат метки. В клетке, которая продолжает делиться после введения метки (глиальные клетки и клетки-предшественницы, которые остаются в вентрикулярной зоне), метка может уменьшаться в концентрации во время удвоения ДНК и следующего за ним деления клетки. Однако, если клетка делится во время пика концентрации [3 Н]-тимидина и одна или обе дочерние клетки прекращают деление, мигрируя прочь от вентрикулярной зоны и дифференцируясь в нейроны, тогда эти нейроны имеют очень высокую концентрацию [3 Н]-тимидина. Таким образом, путь развития нейрона, образовавшегося в определенный день развития, может быть визуализован путем однократного введения эмбриону [3 Н]-тимидина в данный день, после чего продолжается нормальное развитие эмбриона, и в дальнейшем ауторадиография используется для обнаружения помеченных клеток.
Использование этой техники позволило выявить, что в головном мозге (ГМ) млекопитающих имеется систематическая взаимосвязь между временем образования нейрона и местом его окончательного расположения в коре ГМ; развитие происходит по принципу «наоборот» (inside-out fashion) 1)
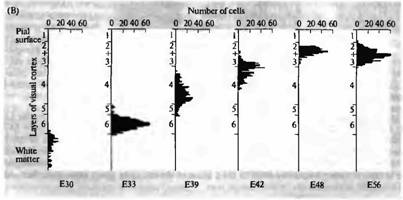
Рис. 1. Нейрогенез первичной зрительной коры кошки. (А) Ауторадиограмма срезов коры взрослого животного с [3 Н]-тимидином, введенным эмбриону на 33-й (ЕЗЗ) и 56 (Е56) день. Микрофотография этих же срезов в светлом поле, окрашенных крезил виолетом, показывает, что наиболее окрашенные клетки расположены в слое 6 коры после введения в возрасте ЕЗЗ и в слоях 2 и 3 после введения в возрасте Е56. (В) Гистограмма, показывающая распределение клеток, помеченных в разные сроки между Е30 и Е56, иллюстрирует inside-out паттерн развития зрительной коры. |
 |
Нейроны самых глубоких кортикальных слоев образуются в первую очередь. Нейроны самых поверхностных слоев образуются позднее и мигрируют через клетки более глубоких слоев к месту своего окончательного расположения в коре. Схожее соответствие между временем образования и окончательным расположением нейрона наблюдается и в других отделах нервной системы, хотя и не во всех.
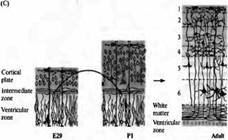
Каким образом мигрируют нейроны? Происходит ли этот процесс спонтанно в направлении изнутри наружу, пока они не достигнут поверхности развиваюшейся коры, или мигрирующий нейрон способен распознавать определенный слой, куда он должен мигрировать? Эксперименты на развивающихся хорьках показали, что кортикальные нейроны способны мигрировать в строго определенную позицию (рис. 2). Клетки, в том числе эмбриональные предшественники нейронов слоя 5 и 6, извлекались из вентрикулярной зоны эмбрионов на ранних стадиях и трансплантировались в вентрикулярную зону эмбрионов на более поздних сроках, в область клеток, являющихся предшественниками более поверхностных слоев 2 и 3. Клетки-предшественники, которые были трансплантированы в ранней S фазе клеточного цикла (когда происходит синтез ДНК), изменяли свое развитие: нейроны, образовавшиеся из них, мигрировали в слои 2 и 3.
 |
|
| Рис. 2. Слой определяет направление дифференциров ки в коре хорька. (А) Ней роны, образовавшиеся на сроке Е29, мигрируют и образуют слой 6 кортикальной пластинки у взрослых. (В) Нейроны, образовавшиеся в первый день постнатального развития (Р1) мигрируют и образуют слой 2/3 кортикальной пластинки взрослых. (С) Клетки, пересаженные из вентрикулярной зоны Е29 эмбриона в вентрикулярную зону Р1 новорожденных, следуют одним из двух возможных путей развития. Клетки, пересаженные на поздних стадиях своего последнего клеточного цикла или уже как постмитотические нейроны, еще не мигрировавшие из вентрикулярной зоны (показано черным), сохраняют свою исходную дифференцировку и мигрируют в слой 6. |
Клетки, пересаженные во время фазы S клеточного цикла (показано серым), меняют свою дифференцировку и мигрируют в слой 2/3. |
Однако, если клетки были трансплантированы на более поздних стадиях их последнего клеточного цикла или уже являлись постмитотическими нейронами, мигрировавшими из вентрикулярной зоны, они сохраняли свою исходную дифференцировку. Они мигрировали только в пределах слоя 6, где останавливались и образовывали связи, характерные для своего типа дифференцировки. Таким образом, область, куда будет мигрировать кортикальный нейрон определяется, пока он находится в вентрикулярной зоне, непосредственно перед финальными митозом клетки.
Генетические аномалии строения коры у мышей линии reeler
Другой пример того, как определяется дальнейшее развитие нейрона до того, как он достигнет своего окончательного расположения, обнаружен у мутантных мышей линии reeler (названных так из-за своей неровной походки). В развивающейся коре мышей reeler более молодые нейроны не мигрируют сквозь слои других клеток. Таким образом, их расположение друг относительно друга у взрослых противоположное: нейроны, образованные раньше, располагаются в более поверхностных слоях, а нейроны, рожденные позже, — в более глубоких. Несмотря на аномальное расположение, нейроны имеют правильную исходную морфологию (определяемую моментом рождения) и образуют между собой связи в зависимости от времени образования. Получается, что морфология корковых нейронов и природа их синаптических взаимодействий определяются в момент рождения нейрона и могут проявляться независимо от его расположения. Такой reeler фенотип является результатом большого количества мелких изменений в результате мутации в коре и других областях мозга.
Продуктом экспрессии гена reeler является большой гликопротеин внеклеточного матрикса, называемый reelin. Он не экспрессируется в кортикальных клетках, не мигрирующих правильным образом, а в основном экспрессируется в клетках Кахаля—Ретциуса в краевой зоне коры. Нарушения экспрессии других генов в кортикальных клетках могут приводить к сходным с reeler фенотипам проявления. Например, мутация цитоплазматического белка, содержащего фосфотирозин (cytoplasmic phosphotyrosine-containing protein), названного Disabled-1, также приводит к reeler фенотипу, как и генетическое выключение (knock-out) рецептора липопротеинов низкой плотности вместе с рецепторами 2 типа к аполипопротеину Е. На основании этого можно судить о том, что эти три белка являются частью внутриклеточного механизма, который позволяет кортикальным клеткам распознавать сигнал с reelin-белка, передающийся через внеклеточный матрикс, и использовать этот сигнал для установления правильной структуры слоев коры. Большое количество других генетических мальформаций в коре ГМ человека связано с нарушением миграции нейронов.
Влияние локальных сигналов на корковую архитектуру
Примером способности корковых нейронов изменять свое строение после того, как они мигрировали прочь от вентрикулярной зоны, является эксперимент, в котором кусочек развивающейся зрительной коры был пересажен в область представления вибрисс соматосенсорной коры крысы, . Нейроны в трансплантанте реорганизовались и сформировали четко различимую колончатую структуру, характерную для их нового месторасположения, образуя фенотип, не характерный для зрительной коры. Таким образом, внутренние влияния могут определять особенности фенотипов корковых нейронов.
Гормональный контроль за развитием нервной системы
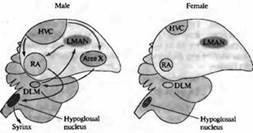
В некоторых областях ЦНС развитие нейронов находится под гормональным контролем. Это особенно заметно в областях мозга, определяющих сексуальное поведение. Например, у таких певчих птиц, как канарейки, ядро высшего вокального центра (ВВЦ, high vocal center, HVC) играет ключевую роль в приобретении и запоминании песни — что является исключительно мужским поведением. Эта зона мозга больше развита у самцов, чем у самок (рис. 3.). Однако пение можно вызывать даже у взрослых самок введением тестостерона, в результате чего ядро ВВЦ и другие структуры, связанные с воспроизведением песни, увеличиваются.
Ядра ВВЦ у взрослых самцов и самок канарейки являются особенными центрами, так как там происходит постоянный кругооборот нейронов) . Образование (recruitment) новых нейронов ВВЦ у самцов происходит максимально осенью и весной, сразу после пика гибели старых нейронов. Таким образом, в это время происходит модификация их песен для нового брачного сезона. Период гибели нейронов совпадает с падением уровня тестостерона, а образование новых — с его пиком. Назначение тестостерона самкам приводит к увеличению образования новых нейронов в ВВЦ, которые, как их предшественники, получают определенные синаптические сигналы и посылают свои аксоны к определенным мишеням. Эти удивительные наблюдениям показывают, что в зрелом мозге возможно не только образование новых нейронов, но также их включение в сложно устроенную и функционирующую систему, что приводит к перемоделированию такого свойственного птицам поведения, как их песни.
Стволовые нервные клетки
ВВЦ певчих птиц является не единственным примером того, когда новые нейроны включаются в состав нервной системы взрослых животных.
Рис. 3.. Половой диморфизм в головном мозге птиц. Схематическая диаграмма основных зон мозга и путей, участвующих в формировании песни у певчих птиц. Высший вокальный центр (HVC), крепкое ядро архистриатума (RA) и подъязычное ядро формируют задний вокальный моторный путь (показано черным). HVC, зона X, медикальное дорзолатеральное ядро тала муса (DLM) и латеральное магноцеллюлярное ядро переднего неостриатума (LMAN) образуют передний путь (показано серым). HVC, подъязычное ядро и RA имеют значительно большие размеры у самцов; зона X не обнаруживается в мозге самок зябликов. Fig. 23.14. Sexual Dimorphism in the Avian Brain. Schematic diagram of the major brain areas and pathways involved in production of song in songbirds. |
|
Нейроны также постоянно обновляются в гиппокампе и обонятельной луковице у взрослых млекопитающих. Однако как образуются эти клетки? Нервные стволовые клетки, которые обладают способностью к самообновлению, были выделены из стенок желудочков и из гиппокампа взрослого мозга и было прослежено их размножение in vitro . Эти клетки могут дифференцироваться в нейроны, олигодендроциты и астроциты. Нейроны, постоянно добавляющиеся в обонятельной луковице in vivo, происходят из медленно делящихся стволовых клеток самого внутреннего, эпендимального слоя стенок боковых желудочков (остаток начальной вентрикулярной зоны). Один из потомков каждого клеточного деления направляется в субэпендимальную зону, чтобы стать там клеткой-предшественницей. Клетка-предшественница быстро делится, образуя незрелые нейроны, которые мигрируют в ростральном направлении в область луковицы, где они дифференцируются в интернейроны и интегрируются в имеющиеся сети. При повреждении ЦНС клетка-потомок стволовых клеток становится астроцитом, а не нейроном, мигрирует в область повреждения и принимает участие в образовании рубца в области повреждения. Таким образом, судьба потомка стволовой клетки у взрослых может быть изменена под влиянием внешних сигналов.
Стволовые нервные клетки, таким образом, представляют собой популяцию клеток, способных размножаться в культуре и подвергаться дифференцировке либо в глиальные клетки, либо в нейроны. Это обеспечивает возможность использования этих клеток в качестве резерва нейронов или глиальных клеток при лечении заболеваний нервной системы, при которых наблюдается гибель клеток ГМ или их дисфункция .
Контроль за фенотипом нейронов в ПНС
Сходны ли механизмы, определяющие судьбу клеток в ПНС позвоночных с механизмами, определяющими развитие ЦНС? Например, какую роль играют происхождение клеток, время их образования и локальные сигналы в определении пути развития периферических нейронов и глиальных клеток? Запрограммированы ли клетки-предшественницы на формирование клеток определенного типа, например клеток автономной, а не сенсорной системы, или на использование этими клетками ацетилхолина, а не норадреналина, в качестве трансмиттера?
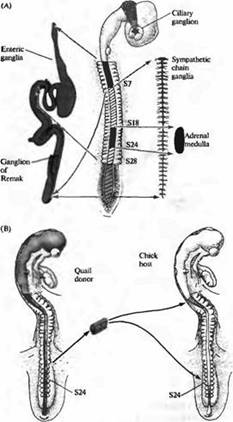
Подобные вопросы изучались в нервной системе цыплят и перепелок Ле Дуарином, Вестоном и другими. В эмбрионе позвоночных клетки нервного гребня, расположенные в разных местах вдоль нервной оси, образуют различные типы клеток ПНС (рис. 5А). Для изучения того, определен ли фенотип клеток, развивающихся из нервно го гребня, уже на ранних стадиях развития или он может изменяться при перемещении клеток в другое место вдоль нервной оси, Ле Дуарин пересаживал клетки из одного региона нервного гребня в другой регион эмбрионахозяина и затем исследовал развитие пересаженных клеток. В этих экспериментах клетки доноры брались из эмбриона перепелки и затем имплантировались в эмбрион-хозяин цыпленка таким образом, чтобы пересаженные клетки можно было различить по очевидным цитологическим отличиям между клетками перепелки и цыпленка (рис. 5В). После пересадки клетки куропатки развивались согласно своему новому расположению. Например, клетки, взятые из области, которая при нормальном развитии образовывала надпочечник, вместо этого образовывали иннервацию кишечника.
Рис. 5. Судьба клеток нервного гребня определяется окружением. (А) Клетки нервного гребня образуют большое количество различных периферических ганглиев. Ресничный ганглий образован клетками из мезенцефального нервного гребня. Ганглий Ремака и кишечные ганглии тонкой кишки образуются из клеток вагальной (сомиты 1-7) и люмбосакральной (каудальнее S28) областей нервного гребня. Ганглии симпатической цепочки происходят из всех областей нервного гребня каудальнее S5. Надпочечник заселяется клетками нервного гребня из S18-S24. (В) Если клетки нервного гребня из S18-S24, которые должны образовать надпочечник, пересадить от донора-перепелки в вагальную или люмбосакральную область эмбриона цыпленка, они будут следовать пути развития, характерному для своего нового положения и заселят ганглий Ремака или кишечный ганглий тонкой кишки. |
 |
Близким вопросом является то, определен ли фенотип клеток нервного гребня до того, как клетки мигрируют прочь от нервной трубки или после того, как они достигнут своего окончательного месторасположения на периферии. Ответ на этот вопрос получен в исследованиях клеток нервного гребня, выделенных из одного периферического месторасположения: предшественника (primordiurn) надпочечника эмбриона млекопитающих. В культуре эти клетки образуют либо хромаффинные клетки, либо клетки мозгового вещества надпочечников, либо адренергические симпатические нейроны. Глюкокортикоиды (синтезируемые клетками коры надпочечника) вызывают экспрессию ферментов, специфических для хромаффинных клеток (рис. 6). И наоборот, два белка, присутствующие в местах образования симпатических ганглиев, называемые основной фактор роста фибробластов (basic fibroblast growth factor, bFGF) и фактор роста нерва (nerve growth factor, NGF), в культуре клеток вызывают дифференцировку клеток-предшественниц в симпатические нейроны.
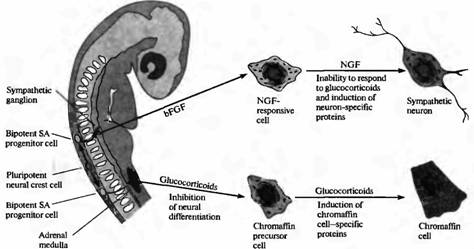 |
| Рис. 6. Определение направления развития клеток нервного гребня, образующих симпатоадреналовую (SA) систему. Плюрипотентные клетки нервного гребня образуют бипотентные SA клетки-предшественники. Судьба SA клеток-предшественников зависит от сигналов извне. SA клетки-предшественники, которые мигрируют в область надпочечника, подвергаются влиянию глюкокортикоидов, ингибирующих нервную дифференцировку и способствующих дифференцировке их в хромаффинные клетки. Альтернативным образом, SA клетки-предшественницы, которые мигрируют в область развивающейся симпатической цепочки, подвергаются воздействию основного фактора роста фибробластов, который приводит к экспрессии ФРН в SA предшественниках. Последующее действие ФРН приводит к тому, что клетки, нечувствительные к дифференцировке в ответ на глюкокортикоиды, начинают дифференцироваться в симпатические нейроны. |
Таким образом, фенотип клеток нервного гребня может быть определен после того, как они мигрировали прочь от нервной трубки, при помощи факторов, находящихся на периферии.
Выбор трансмиттера
При пересаживании клеток нервного гребня в относительно раннем периоде их дальнейшее развитие может изменяться вплоть до того, что они могут в дальнейшем использовать абсолютно другой трансмиттер, например ацетилхолин, вместо норадреналина. В некоторых случаях такая смена медиатора происходит в ходе нормального развития. Например, симпатические нейроны, иннервирующие потовые железы, изначально синтезируют норадреналин, но в период между второй — третьей неделями постнатального развития факторы, выделяемые железой, приводят к тому, что они начинают вырабатывать ацетилхолин. На более поздних стадиях клетки нервного гребня становятся уже слишком зрелыми и теряют способность менять свою дифференцировку в соответствии с изменениями окружающей среды.
Изучение механизма смены трансмиттера проводилось на культурах клеток симпатических ганглиев. Когда нейроны выделялись из верхнего шейного ганглия новорожденного крысенка и вырашивались в культуре в отсутствие клеток других типов, они все содержали фермент тирозингидроксилазу, синтезировали и образовывали запасы катехоламинов.
| Рис. 7. Отдельные нейроны симпатических ганглиев способны выделять как ацетилхолин, так и норадреналин в синапсах на культуре клеток сердца. (А) Микрокультура, содержащая отдельные симпатические нейроны, выращенные на островке клеток сердечной мышцы. (В) Короткая серия импульсов в нейроне (10 Гц, показано в виде отклонений нижней записи) вызывает ингибирование спонтанной активности миоцита из-за высвобождения АХ (верхняя запись). (С) Добавление атропина (10--7 М) блокирует тормозный холинергический ответ, что приводит к проявлению возбуждающего эффекта, вызванного высвобождение норадреналина. |
|
Однако, если нейроны вырашивались в присутствии определенных типов ненейрональных клеток, таких как клетки сердечной мышцы или потовых желез, нейроны постепенно переставали синтезировать катехоламины и начинали синтезировать вместо этого фермент холинацетилтрансферазу и ацетилхолин. Для того, чтобы окончательно установить, что подобные изменения возможны в одиночных нейронах, они культивировались на микроостровках клеток миокарда (рис. 7). Нейроны быстро вытягивали свои отростки и образовывали синаптические контакты с клетками миокарда. Сначала эти синапсы были чисто адренергическими, затем, по прошествии нескольких дней, клетки начинали выделять вместе норадреналин и ацетилхолин. В конечном счете передача становилась полностью холинергической.
Фактор, который вызывал холинергическую дифференцировку симпатических нейронов, был выделен из среды клеток сердца и клонирован. Оказалось, что это фактор ингибирующий развитие лейкемии (leukemia inhibitory factor, LIF), белок, который ранее был описан по его способности индуцировать дифференцировку клеток иммунной системы. Два других близких цитокина, цилиарный нейротрофический фактор (ciliary neurotrophic factor, CNTF) и кардиотрофин-1, как было обнаружено, вызывают сходные эффекты в культуре нейронов. Все эти три фактора активируют рецепторный комплекс (называемый LlFR/3-gpl30 рецептор), блокирование которого угнетает развитие холинергических свойств нейронов, культивируемых вместе с клетками потовых желез. Однако иннервация потовых желез у мутантных мышей, не имеющих L1F и CNTF, формируется нормально, а результаты других экспериментов заставляют предположить, что кардиотрофин-1 не является фактором, который может вызывать переключение в клеточной иннервации потовых желез in vivo. Хотя еще не описано генетическое выключение всех трех генов, вполне возможно, что скоро будет описан новый, еще не идентифицированный фактор потовых желез, являющийся лигандом для LIFR-gpl30 рецептора.
Литература :
1. Rekling, J. C., and Feldman, J. L. 1998. Pre-Botzinger complex and pacemaker neurons: Hypothesized site and kernel for respiratory rhythm generation. Ann. Rev. Physiol 60: 385-405.
2. Thach, W.T., Goodkin, H.G., and Keating, J.G. 1992. The cerebellum and the adaptive coordination of movement. Annu. Rev. Neurosci. 15: 403-442.
3. Wichmann, T., and DeLong, M.R. 1996. Functional and pathophysiological models of the basal ganglia. Curr. Opin. Neurobiol. 6: 751-758.