Реализация вариативного подхода при изучении темы Соли аммония на уроках химии
СОДЕРЖАНИЕ: Сущность, химические и физические свойства солей аммония. Анализ возможностей вариативного построения урока химии на тему Соли аммония. Методика проведения урока химии на тему: Аммиак. Соли аммония с применением лабораторных опытов и экспериментов.Введение
В настоящее время остро ощущается дефицит программ учебных курсов вариативного компонента. Это является значительным препятствием в их реализации.
Учебные курсы вариативного компонента базируются на знаниях и умениях школьников, сформированных при изучении соответствующих общеобразовательных предметов, а также могут дополнять возможности базового или профильного курса в удовлетворении образовательных потребностей старшеклассников, реализуя внутрипрофильную специализацию.
Глава 1. Вариативный подход в обучении химии
Разработка учебных курсов вариативного компонента учебного плана, как и любого учебного предмета, предполагает определение его содержания и структуры. Для решения этой задачи, прежде всего, необходимо выявить систему положений, определяющих роль оснований, учет которых позволит отобрать учебный материал курса.
Процедура отбора содержания образования представляет собой установление соотношений деятельностей, извлекаемых из социального опыта, и функций, к выполнению которых надо готовить учащихся, системы ценностей, которую предстоит освоить [1,2,3].
Считаем, что в условиях вариативности образовательного процесса на первый план выходят принципы, отражающие сущность профильного обучения: принцип интегративности; принцип продуктивности обучения; принцип вариативности; принцип единства содержательного и процессуального компонента обучения, а также принципы комплексности, непрерывности и преемственности, согласованности и профильной направленности.
Принцип интегративности заключается во взаимосвязанном получении учениками профильных классов подготовки по профильному предмету и прикладному курсу.
Принцип вариативности направлен на обеспечение уровневой дифференциации содержания обучения, а также создание условий обучаемым для индивидуального темпа продвижения по различным программам учебных курсов. Принцип вариативности при обучении прикладным курсам вариативного компонента обеспечивает не только уровневую дифференциацию, но и профильную. Так как прикладной курс вариативного компонента представляет собой блок информации, обустроенный методическим обеспечением, то он выполняет функции управления учебным процессом и предполагает использование системы всевозможных форм, методов и средств обучения, их целесообразный выбор и оптимальное сочетание.
Принцип непрерывности и преемственности характеризуется стремлением создать у учащихся профильных классов необходимую базу для продолжения образования в специальном среднем или высшем учебном заведении. Таким образом, в выбранном учебном заведении на основе содержания учебных предметов будет строиться не только обучение соответствующим дисциплинам, но профессионально-ориетированная подготовка обучающихся.
Принцип комплексности предполагает выделение основных комплексов знаний и умений по предмету, соответствующих выбранным учебным курсам вариативного компонента.
Принцип согласованности означает необходимость четкого соответствия занятий прикладного курса и уроков по предметам по содержанию и времени изучения. Это необходимо для того, чтобы ученик, получивший на занятиях прикладного курса первоначальные методические знания и умения, мог на ближайшем же уроке по предмету воспользоваться ими, выполняя роль проктора.
Принцип профильной направленности – системообразующий. Он взаимосвязан со всеми остальными принципами и управляет ими. Именно принцип профильной направленности определяет специфичность содержания прикладного курса непосредственно для классов данного профиля.
Принцип доступности определяется подготовленностью учащихся к восприятию содержания вариативного компонента. При этом учитываются связи данного содержания с уже имеющимися у учащихся знаниями и умениями по предмету, первоначальными знаниями по педагогике и психологии, а также его соответствие возрастным особенностям учащихся.
Частнометодические принципы связаны с дидактическими принципами и обусловлены как закономерностями обучения учебному предмету, так и особенностями рассматриваемой науки. Их происхождение связано со спецификой изучаемой науки, отражает ее логику и структуру, а также методы познания и их взаимосвязь. Частнометодические принципы регулируют как отбор содержания образования, так и процесс обучения. Например, в методике преподавания физики к таким принципам относятся принцип ступенчатого построения курса, цикличности, генерализации, гуманизации.
Дидактические функции принципа генерализации сводятся к выделению в материале главного и подчинению ему остального материала; обобщению содержания главных элементов; отбору самых необходимых опытных фактов; выстраиванию такой логико-структурной схемы изложения темы, которая была бы относительно замкнутой и отражала необходимые связи между ее частями на основе физической идеи или принципа, отбору приемов и методов работы, которые способствуют усвоению главных элементов содержания: использованию методов, которые формируют такие качества знаний как обобщенность, системность и пр. Именно методологические и дидактические функции принципа генерализации позволяют рассматривать его как принцип отбора учебного материала вариативного компонента. Группировка материала вокруг стержневых идей способствует профессиональному самоопределению старшеклассника, обеспечить преемственность между школьным и профессиональным образованием.
В соответствии с принципом гуманизации в содержание учебных курсов вариативного компонента могут быть включены материалы, позволяющие осмыслить связь развития предмета с развитием общества, исторический материал, материал мировоззренческого и экологического характера.
При отборе содержания вариативного компонента должны быть взяты за основу общедидактические критерии, сформулированные Ю.К.Бабанским [4]:
1. Критерий выделения главного и существенного в содержании образования, то есть отбор наиболее необходимых, универсальных, перспективных элементов.
2. Критерий соответствия возрастным возможностям обучающихся.
3. Критерий соответствия выделенному учебным планом времени на изучение данного содержания.
4. Критерий учета отечественного и международного опыта формирования содержания программ.
5. Критерий соответствия содержания имеющейся учебно-материальной и методической базе учебного заведения [3, с. 419]. Кроме общедидактических критериев, при отборе содержания должны быть учтены критерии конкретизирующие содержание того или иного принципа и позволяющие соответствующим образом отобрать учебный материал. В связи с этим рассмотрим содержание некоторых дидактических принципов и выделим соответствующие им критерии. Например, принцип вариативности предполагает учет в обучении способностей, интересов и профессиональных намерений учащихся. Принцип непрерывности и преемственности требует учета познавательных возможностей учащихся, их предшествующей подготовки, содержания других предметов. Реализация принципа интегративности предполагает согласованное изучение теорий, законов, формирование общих видов деятельности и системы отношений. Выделенные критерии так же, как и принципы отбора содержания учебного курса, связаны между собой; в ряде случаев одни и те же критерии используются при реализации разных принципов.
Для отбора содержания образования особое значение имеет выделение целей обучения как ожидаемых результатов. Цели обучения являются стержневой дидактической категорией, связывающей в единую систему все компоненты учебно-воспитательного процесса. Цели определяют общую направленность всей системы подготовки выпускника школы, она всегда порождается и определяется объективными условиями. Цель существует во взаимосвязи со средствами, необходимыми для того, чтобы процесс мог совершиться, т.е. цель это результат и процесс.
Итак, для подготовки цели обучения как ожидаемых результатов при обучении конкретных учебных курсов будет необходимо:
1. Выбрать глагол, который лучше всего передает желаемое поведение учащегося (исполнение).
2. Определить условия, при которых должно выполняться желаемое поведение.
3. Уточнить:
- насколько адекватно получившееся определение описывает условия, исполнение и критерии?
- в какой мере это определение поможет в разработке адекватного учебного материала?
- в какой мере это определение диктует выбор способов оценки желаемого исполнения учащегося?
Глава 2. Соли аммония
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 NH4 NO3 (нитрат аммония)
2NH4 OH + H2 SO4 (NH4 )2SO4 (cульфат аммония) + 2Н2 O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4 Cl NH4 + + Cl-
2. Разложение при нагревании.
a) если кислота летучая
NH4 Cl (t) NH3 + HCl
NH4 HCO3 NH3 + Н2 O + CO2
b) если анион проявляет окислительные свойства
NH4 NO3 –t N2 O + 2Н2 O
(NH4 )2Cr2 O7 –t N2 + Cr2 O3 + 4Н2 O
3. С кислотами и солями (реакция обмена)
a) (NH4 )2 CO3 + 2НCl 2NH4 Cl + Н2 O + CO2
2NH4 + + CO32 - + 2H+ + 2Cl- 2NH4 + + 2Cl- + Н2 O + CO2
CO32 - + 2H+ Н2 O + CO2
b) (NH4 )2 SO4 + Ba(NO3 )2 BaSO4 + 2NH4 NO3
2NH4 + + SO42 - + Ba2 + + 2NO3 - BaSO4 + 2NH4 + + 2NO3 -
Ba2 + + SO42 - BaSO4
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4 Cl + Н2 O NH4 OH + HCl
NH4 + + Н2 O NH4 OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4 Cl + NaOH (t) NaCl + NH3 + Н2 O
Глава 3. Возможности вариативного построения урока «Соли аммония»
Одно из современных направлений педагогического творчества оптимизация учебно-воспитательного процесса и нормализация нагрузки учащихся. Для того чтобы повысить эффективность урока, учителю при подготовке к нему необходимо правильно оценить познавательные возможности класса, затем на этом основании сформулировать общие и специфические для данного класса цели и задачи урока, выбрать оптимальный методический путь для их достижения.
Для иллюстраций возможностей вариативного построения урока выбрана тема «Соли аммония». Это самый обычный, рядовой урок, каких много в школьном курсе химии. Его содержание в основном отвечает тексту § и в учебнике IX класса, а не требует значительных дополнений.
Урок «Соли аммония» завершает первую часть темы «Подгруппа азота», где описаны азот и его соединения со степенью окисления —3. При изучении материала урока учащиеся опираются на недавно приобретенные знания о составе, строении и свойствах аммиака, об образовании и строении иона аммония, закрепляют эти знания и используют их в новых связях. Кроме того, необходимо привлечь теоретические знания о типах химических реакций, о строении вещества, процессе электролитической диссоциации, условиях течения реакций обмена между электролитами в растворах до конца и опорные понятия: соль, кристаллическая решетка, ион, катион, анион, электролит, полное и краткое ионные уравнения, обратимая химическая реакция, качественная реакция, возгонка, окислительно-восстановительный процесс. I. Цели образования. Расширить представления учащихся о солях, ознакомив их с солями катиона — аммония;
Ш. Цели развития. Совершенствовать умения обобщать, конкретизировать, делать выводы, различать сущность и ее внешние проявления, применять теоретические знания для составления прогнозов и объяснений, пользоваться известными алгоритмами деятельности.
Основным принципом методики проведения урока должна стать реализация внутрипредметных связей, т. е. привлечение теоретических (в том числе и мировоззренческих) знаний школьников для прогнозирования фактов, или объяснения их сущности. Следовательно, все методические варианты урока в той или иной степени должны включать самостоятельные работы учащихся. Это определяется в первую очередь уровнем познавательной самостоятельности, достигнутым большинством учеников класса. Кроме того, важны и другие условия. Так, организованность и творческие возможности класса зависят от того, в начале или конце учебного дня проводится урок, какой ему предшествовал и т. п. Все эти факторы учителю необходимо учитывать при выборе методики проведения конкретного урока.
Основной метод — беседа с демонстрацией ,6пытов, включающая индивидуальное или групповое выполнение лабораторных опытов.
В начале урока можно провести опрос, для того чтобы обобщить уже известный учащимся материал о соединениях азота; повторить сведения о происхождении (генезисе) иона аммония и механизме его образования; выявить признаки сходства между аммиаком и ионом аммония пo составу и строению, взаимосвязь между ними. Два ученика выполняют у доски следующие задания: 1. Запишите уравнения химических реакций, при которых образуется ион аммония, и схему механизма образования этого иона. 2. Сравните состав и строение аммиака я иона аммония; определите, возможно ли наличие у них общих свойств (окислителя или восстановителя).
Пока учащиеся готовятся к ответу, учитель проводит фронтальный опрос: сколько электронов образует внешний электронный слой атома азота?
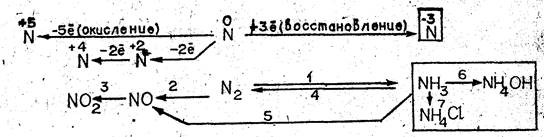
Какие предельные степени окисления азота вам известны? Назовите промежуточные степени окисления азота 1. На основе ответов учащихся учитель записывает на доске схему взаимосвязи соединений азота, а ниже — другую схему, соответствующую первой, используя формулы соединений азота и отражая в ней свойства уже изученных веществ. Порядок записи показывают номера над стрелками в схеме (см. рис. 1).
Затем учитель предлагает следующим двум учащимся записать уравнения реакций, соответствующие превращениям 1—3 и 4, 5, отметив условия их протекания и рассмотрев как окислительно-восстановительные процессы (превращения 6, 7 будут описаны первым учеником, вызванным к доске).
Из ответов первых двух учащихся следуют выводы: 1. Катион аммония образуется при соединении молекулы аммиака с протоном молекулы кислоты; новая ковалентная связь возникает, по донорно-акцепторному механизму. 2. Аммиак и ион аммония имеют одинаковый качественный и близкий количественный состав, следовательно, между ними возможна взаимосвязь; азот в этих соединениях имеет степень окисления —3, значит, они могут проявить только восстановительные свойства.
Из записей на доске учитель оставляет те, которые относятся к генезису и строению иона аммония, а также правую часть схемы превращений и продолжает беседу. Учащиеся прогнозируют состав соединений, содержащих катион аммония, и приводят в качестве примера гидроксид и соли аммония. На доске записываются тема урока и формулы галогенидов, сульфата, нитрата, карбоната аммония. На основе анализа общей формулы учащиеся прогнозируют проявление у изучаемых соединений общих свойств солей, особенных — характерных только для солей аммония (причина — наличие катиона. NH) и единичных (индивидуальных), свойств, отсутствующих у других солей. Эти свойства обусловлены сочетанием иона аммония с определенным анионом.
Учащиеся прогнозируют сходство в свойствах солей калия и аммония, указывают на ионный характер кристаллической решетки, хорошую растворимость солей в воде. Рассмотрение образцов солей подтверждает выводы. Необходимо подчеркнуть различие: соли аммония, имеют сложный катион, состоящий из двух элементов, поэтому кроме сходных свойств должны быть и отличительные.
По заданию учителя учащиеся перечисляют общие свойства солей: 1) соли — электролиты, в водных растворах диссоциируют на ионы; 2) для солей характерны реакции обмена, идущие в направлении образования практически нерастворимых соединений, газов, малодиссоциирующих веществ. Если ученики назову» третье общее свойство — способность к гидролизу, можно позднее кратко рассмотреть; его особенности и выявить отличие солей аммония от солей калия.
Учащиеся записывают уравнения реакций электролитической диссоциации, отмечают наличие одинакового катиона (NH) — причину общности свойств солей аммония. Затем она называют варианты реакций обмена: соль кислота, соль — соль, соль — щелочь. Приводя конкретные примеры для реакций первого варианта, учащиеся учитывают, что сильная кислота вытесняет слабую из соли, а практически нелетучая, летучую. Учитель может продемонстрировать опыт взаимодействия твердого хлорида аммония с концентрированной серной кислотой. Записывая уравнение реакции, отмечаем, что ион аммония сохраняется, следовательно, эта реакция не является характерной именно для солей аммония.
Затем учащиеся, пользуясь таблицей растворимости солей, обсуждают возможные варианты реакций «соль — соль». Подчеркивают, что такие реакции должны привести к образованию практически нерастворимых солей, содержащих анион исходной соли аммония. Следовательно, это могут быть качественные реакции на хлорид-анион, сульфат-анион. Запись уравнений реакций лучше начать краткого ионного, отражающего, сущность процесса, а затем представить соответствуют ему уравнения в молекулярной форме (от сущности к явлению). Катион аммония сохраняется и в этих реакциях, поэтому они, как и предыдущие, могут быть рассмотрены как общая для солей (по типу).
Учащиеся проводят фронтально лабораторные опыты или выполняют групповые задания по двум или более вариантам. Рассматривая вариант реакции обмена «соль — щелочь», ohi называют предполагаемые продукты .реакция определяют, почему она может идти до конца, какие условия этому способствуют. Oни прогнозируют образование гидроксида аммония отмечают его неустойчивость и подчеркнет, что разложению этого вещества на аммиак и воду будет способствовать нагревание смещение химического равновесия). Ион аммония при этом разрушается, так как он имеет сложный состав и строение в отличие от ионов щелочных металлов. По краткому ионному уравнению видно, что данное свойство — особенное, характерное для всех солей аммонии. Учитель предлагает конкретизировать краткое ионное уравнение.
Затем обсуждаются способы доказательства и выделения аммиака. Учитель отмечает практическое значение реакции.
Рассмотрение следующего особенного свойства солей аммония можно начать с проблемной постановки опыта разложения хлорида аммония. Учитель показывает опыт в обычной г пробирке, дает задание учащимся описать наблюдаемые явления и провести аналогию с процессом возгонки иода (VIII класс). Явления сходны внешне, но будет ли одинаковой их сущность? Учитель демонстрирует опыт разложения хлорида аммония с последующим разделением аммиака и хлороводорода. Учащиеся убеждаются в различии сущности процессов возгонки иода и нашатыря. Первый — физическое явление, второй — химическая реакция, так как хлорид аммония подвергается термической диссоциаций, образуя новые вещества. Отсюда следует вывод: различная сущность может одинаково проявляться внешне, поэтому важно познавать именно сущность явлений. Разложение при нагревании—особенность солей аммония, обусловленная сложным составом и строением катиона, но природа аниона не влияет на этот процесс. Так, при разложении соли летучей кислоты (NH4C1) обратится два газа, которые затем вновь соединяются. Соль нелетучей кислоты (МН4)зР04 выедет один газ — аммиак. Важно отметить применение в практике термического разложения солей аммония: хлорид-нитрата и гидрокарбоната.
По мере изучения свойств солей аммония важно дополнять схему превращений соединяй азота.
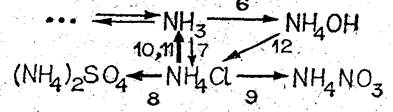
В задание необходимо включить запись уравнений соответствующих реакций.
Закрепление можно провести при выполнении заданий 2 а За к § 17. Задания 1, 36, 5 и 4 учащиеся выполнят дома. Очень важно разъяснить им домашнее задание, кратко ознакомить с планом изложения материала в § 17, подчеркнуть соответствие его логике объяснения на уроке.
Если класс пришел на урок после контрольной работы по другому предмету или в нем имеется значительное число слабоуспевающих учеников, учителю не приходится рассчитывать на высокий уровень познавательной самостоятельности учащихся, и тогда изучение нового материала можно начать без предварительного опроса. Рассмотрение нового материала может быть организовано как индивидуальная или групповая работа с учебником, сопровождаемая выполнением демонстрационных и лабораторных опытов.
Планируя урок, необходимо учитывать, что слабоуспевающие школьники успешнее усваивают объяснение учителя в том случае, если оно построено в логике соответствующего параграфа учебника и с его текстом на уроке проведена работа. Поэтому второй методический вариант урока конструируют на основе плана изложения, принятого в учебнике, в логике «от явления к сущности», учитывая необходимость постоянного руководства учебным процессом со стороны учителя.
Учитель может разделить текст параграфа на отдельные последовательно изучаемые фрагменты и предложить учащимся задания, направляющие работу. После выполнения каждого задания они должны продумать запись в тетради.
I. Прочтите абзац 1. Рассмотрите образцы кристаллических солей аммония и калия, а также их растворы. Перечислите черты сходства; укажите их причины.
И. Прочтите абзацы 2, 3, 4. Проведите реакцию взаимодействия хлорида аммония с нитратом серебра и сульфата аммония с хлоридом бария. Назовите общие свойства солей, характерные для солей аммония. Изменяется ли при этих реакциях ион аммония?
III. Прочтите с. 39 до конца и абзацы 1, 2 на с. 40. В чем особенность, взаимодействия солей аммония со щелочами? Как доказать выделение аммиака? Почему эта реакция может применяться как качественная на катион аммония? Как доказать, что свойство реагировать со щелочами с образованием аммиака и воды является особенным, т. е. характерным для всех солей аммония? Какое применение оно находит в лаборатории? Экспериментально докажите наличие катиона аммония в растворах хлорида и сульфата аммония.
V. Составьте схему превращений, связывающую аммиак, гидроксид аммония и соли аммония.
Каждое задание учащиеся вначале выполняют самостоятельно, затем учитель проводит необходимые демонстрационные опыты и обсуждает с учениками запись в тетради — фрагмент общего конспекта параграфа, вносит некоторые дополнения. В окончательном виде конспект урока может быть примерно таким:
1. Соли аммония сходны с солями щелочных металлов (калия): в твердом состоянии имеют ионную кристаллическую решетку, хорошо растворяются в воде. Причины сходства: одинаковый заряд и близкий радиус ионов аммония и калия.
2. Общие для всех солей свойства солей аммония: способны к электролитической диссоциации в водном растворе, вступают в реакции обмена «соль — кислота», «соль — соль» (приводятся уравнения реакций). Ион аммония при этих реакциях не изменяется.
3. При взаимодействии солей аммония со щелочами также идет реакция обмена, но ион аммония разрушается- образуется аммиак, вода и новая соль. Эго свойство характерно для всех солей аммония и является особенным для них. Реакцию используют в лаборатории как качественную на ион аммония и для получения аммиака. (Уравнения реакций.)
4. Хлорид аммония при нагревании возгоняется: разлагается на аммиак и хлороводород, которые вновь соединяются на холодных стенках пробирки (химическое явление). Термическая диссоциация — разложение солей аммония при нагревании — особенное свойство, характерное для всех солей аммония. При этом ион аммония разрушается.
5. Полная характеристика свойств соли аммония включает как общие, так и особенные свойства.
Рассмотрим вариант проведения урока для класса, где учащиеся уже могут самостоятельно творчески работать. В этом случае можно провести урок в форме диспута. Учащимся объявляют тему урока и предлагают составить план исследования свойств солей аммония, выделить опорные знания. Обычно они начинают с анализа названия темы, составляют общую формулу солей аммония и строят дальнейшие рассуждения на основе цепочки причинно-следственных связей состава, строения, свойств, получения и применения веществ. Во многом повторяется логика первого описанною методического варианта. Нередко учащиеся сначала записывают уравнения реакций, характеризующих каждое свойство солей аммония в общем видь, а потом переходят к их конкретизации и лабораторным опытам. Учитель руководит поиском, дает задания для выполнения лабораторных опытов и проводят демонстрационный эксперимент.
Сущность и специфику взаимодействия солей аммония со щелочами учащиеся замечают сразу, на основании записи уравнения реакции в общем виде. А вот о разложении солей аммония при нагревании сообщает сам учитель, организуя обсуждение примерно так, как уже было описано в первом методическом варианте урока. В таких классах учащиеся, как правило, сами ставят вопрос о способах получения солей аммония, обсуждают их и просят учителя подробнее осветить области применения этих веществ.
Для закрепления нового материала можно предложить следующие задания:
1. Запишите уравнение реакции, характеризующее общее свойство растворов нитрата и сульфата аммония. Ответ: краткое ионное уравнение реакции взаимодействия этих солей со щелочью.
2. Проведите опыты и запишите уравнения реакций, характеризующих свойства карбоната аммония, отметьте среди них общие для всех солей и особенные.
3. С помощью одного реактива проведите реакцию, доказывающую качественный состав (катион и анион) сульфата аммония.
4. Гидрокарбонат аммония разлагается уже при 60 °С. Объясните, почему его применяют в кондитерском производстве и предпочитают гидрокарбонату натрия, который разлагается при нагревании, образуя карбонат.
Еще один методический вариант изучения свойств солей аммония возможен, если учитель ведет объяснение материала укрупненными блоками. Тогда на уроке-лекции на тему «Соединения азота со степенью окисления —3» можно рассмотреть в единстве три темы: «Взаимодействие азота с водородом» (§ 14), «Аммиак» (§ 16), «Соли аммония» (§ 17). Обсуждается связывание молекулярного азота водородом и свойства соединений азота со степенью окисления —3. В домашнее задание можно включить творческую работу по конструированию прибора для доказательства образования аммиака и хлороводорода.
Программы, по которым учащиеся работают на втором уроке (закрепление и развитие знаний), могут содержать такие задания:
1. Усложненный вариант — задания 1—4 для закрепления знаний (см. выше).
2. Вариант средней трудности: а) какие особенные свойства присущи солям аммония? Запишите уравнения реакций, отметьте их общие черты; б) как различить нитрат и сульфат аммония? Как доказать, что вам предложены именно соли аммония? Проведите опыты, запашите уравнения реакций; в) запишите уравнения реакции разложения фосфата аммония при нагревании.
3. Облегченный вариант: а) проведите опыты, доказывающие наличие в растворе сульфата аммония соответствующего катиона s аниона, запишите уравнения реакций; б) распознать хлориды калия и аммония? Запишите уравнения реакций, дайте объяснение: в) чем отличается возгонка иода от возгонки хлорида аммония? Дайте доказательный ответ.
Глава 4. Методические разработки по теме: Аммиак. Соли аммония
Урок разработан в форме исследования с целью получения новых знаний с использованием проблемного и дифференцированного подхода. Форма урока выбрана не случайно. Проблема использования аммиака и солей аммония, их свойств достаточно сложна, но посильна для девятиклассников. Учитель направляет с помощью вопросов, заданий мысль учащихся, приводит к осуществлению вывода о необходимости теоретических знаний для объяснений различных природных явлений.
Основная цель урока – научить школьников получать аммиак в лаборатории, объяснять его свойства на основе знаний о строении атома азота и молекулы аммиака, дать представление о роли аммиака и его производных в жизни человека.
Особое внимание уделяется тому, чтобы ребята научились работать с опорными конспектами и учебно-инструктивными (технологическими) картами (Приложение 1).
Содержание урока включает не только химический, но и исторический, биологический, эстетический компоненты, которые соотнесены с интересами и возрастными особенностями детей.
На уроке планируется продолжить развитие умений и навыков проведения химического эксперимента, познавательного интереса к предмету. Для решения этой задачи на уроке запланировано проведение лабораторного эксперимента (Приложение 2).Урок должен продолжить формирование бережного отношения к окружающей среде.
В процессе проведения урока учитель использует демонстрационный эксперимент:
Демонстрационный эксперимент:
№ 1. «Дым в стакане».
№ 2. Получение аммиака из хлорида аммония и гидроксида кальция. № 3. Испытание индикатором раствора аммиака в воде. № 4. Взаимодействие аммиака с соляной кислотой. № 5. Аммиак – огнетушитель.
№ 6. Качественная реакция на ион аммония (взаимодействие с раствором медного купороса или сульфата кобальта (II)).
Лабораторный эксперимент:
№ 1. Изучение физических свойств раствора аммиака. № 2. Взаимодействие оксида меди (II) с нашатырем.
Оборудование: технологическая карта к уроку, учебно-инструктивная карта, тесты для контроля знаний учащихся;
Прибор для получения аммиака, сосуд с водой, сухая маленькая колба для сбора аммиака, нашатырь, гидроксид кальция, раствор фенолфталеина, большая колба, две стеклянные палочки, карбонат калия, раствор аммиака 10%-ный, раствор соляной кислоты, растворы сульфата меди (II) и сульфата кобальта (II);
Для лабораторной работы:
Нашатырь, медная проволочка, спиртовка, спички, склянка с раствором аммиака.
Место проведения урока: кабинет химии.
Девиз урока: «Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков» (Л. К. Полинг)
«Можно не любить химию, но прожить без неё сегодня и завтра нельзя» (О.М. Нефёдов)
План урока
I. Мотивационно-ориентировочный этап
Актуализация знаний, полученных на предыдущем уроке
Постановка целей урока
II. Операционно-исполнительский этап
Прогнозирование свойств аммиака
Изучение свойств аммиака
Физические свойства
Химические свойства
Знакомство с солями аммония
Области применения аммиака и его производных
Способы получения аммиака
III. Оценочно-рефлексивный этап
Контроль и самоконтроль: работа с тестами (Приложение 3), работа с опорным конспектом
Выводы
Домашнее задание
I. Мотивационно-ориентировочный этап
Актуализация знаний, полученных на предыдущем уроке, создание проблемной ситуации
Вводное слово учителя
На прошлом уроке мы познакомились с основной характеристикой подгрупп кислорода и азота. Мы видели, что теоретические знания могут позволить предсказать свойства вещества, как физические, так и химические.
Сегодня я хочу познакомить вас с удивительным веществом, которое, на мой взгляд, имеет необыкновенные свойства. Девизом сегодняшнего урока я предлагаю взять известные высказывания Л. К. Полинга и О.М. Нефедова:
«Я думаю, что химики – это те, кто на самом деле понимает мир. Этот огромный мир – удел химиков» (Л. К. Полинг)
«Можно не любить химию, но прожить без неё сегодня и завтра нельзя» (О.М. Нефёдов)
Подумайте, ребята, преувеличили ли значение химии эти ученые или они абсолютно правы?
Сегодня на уроке мы будем пользоваться не только привычными для вас карточками-подсказками, но и опорным конспектом (он включает технологическую карту и вопросы к уроку) – все это вы видите на столах.
Итак, начнем знакомиться с удивительнейшим веществом!
Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля.
Демонстрационный опыт № 1. «Дым в стакане»
Вещество, о котором пойдет речь, имеет древнюю историю. Вас взволновало то, что вы сейчас увидели, как густой дым наполнил колбу и начал выливаться на стол? А представьте, как были взволнованы алхимики, когда имели дело с этим веществом!
Посредине ливийской пустыни стоял храм, посвященный богу Амону Ра. В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак».
В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт».
Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия.
Формула аммиака – NH3, т.е. это водородное соединение азота.
1. Пользуясь опорным конспектом, планом характеристики элемента, охарактеризуйте строение атома азота (1s22s22p3, валентность азота равна 3, может быть 4, это типичный неметалл, ОЭО = 3,0) (Приложение 4).
2. Сколько ковалентных связей может образовать атом азота? (3 по обменному механизму и четвертую связь атом азота может образовать по донорно-акцепторному механизму)
3. Учитывая ОЭО азота, скажите, какие типы связей можно наблюдать в молекуле аммиака? (Связи N-H ковалентные полярные, электронная плотность смещена от водорода к азоту, поэтому на атоме азота возникает частичный отрицательный заряд)
4. Рассмотрите модель молекулы аммиака. Какую геометрическую фигуру напоминает молекула аммиака? (Пирамиду, в вершинах которой находятся 3 атома водорода и неподеленная пара электронов азота)
II. Операционно-исполнительский этап
1. Прогнозирование свойств аммиака
Как вы думаете, будет ли аммиак растворяться в воде.
Подсказка: обычно в воде растворяются те вещества, молекулы которых могут притягиваться к молекулам воды.
Ответ: да, аммиак должен растворяться в воде, так как его молекула полярна.
2. Давайте получим аммиак так же, как его получали алхимики. Справедливости ради, надо сказать, что лабораторный способ получения аммиака с тех пор практически не изменился.
Демонстрационный опыт № 2
Получение аммиака взаимодействием нашатыря и гашеной извести
Демонстрационный опыт 3
Испытание индикатором раствора аммиака в воде
Беседа по вопросам:
Легче или тяжелее аммиак воздуха?
Растворяется ли он в воде?
Как вы думаете, почему это вещество имеет такой едкий запах?
Используют ли люди это свойство аммиака?
Раньше барышни, склонные к обморокам, носили с собой «нюхательную соль». Как вы думаете, что это за вещество?
Лабораторная работа 1
Знакомство с физическими свойствами аммиака (Приложение 5)
3. Охарактеризуйте физические свойства аммиака по опорному конспекту (Приложение 1) по плану:
Агрегатное состояние
Цвет
Вкус
Запах
Растворимость в воде
Плотность
4. Переходим к характеристике химических свойств аммиака (Приложение 1)
Мы уже заметили, что аммиак хорошо растворяется в воде, что он имеет очень резкий запах, наконец, вспомните, ведь его ещё в средние века называли «щелочной воздух».
Беседа по вопросам:
Как образуется донорно-акцепторная связь?
Какие частицы могут предоставить аммиаку пустую атомную орбиталь (АО), да ещё и притягиваться к молекуле? (Ион Н+)
Посмотрите, как образуется ион аммония и сделайте окончательный вывод о валентных возможностях азота.
Может ли азот проявлять валентность, равную 5?
Откуда в растворе аммиака берутся ионы ОН-? Не может ли именно этот факт объяснить едкий запах и вкус аммиака?
Будет ли аммиак реагировать с кислотами? Почему? (В растворах кислот много ионов Н+).
Демонстрационный эксперимент 4.
Взаимодействие аммиака с соляной кислотой
Опыт проводят, потирая друг о друга две стеклянные палочки, одна из которых смочена раствором аммиака, а другая – раствором соляной кислоты.
Теперь бы вы смогли объяснить англичанам, почему между их кораблем и судном противника появился едкий «дым»? (Конечно, это была реакция образования хлорида аммония).
Объясните, какие факты позволили детскому поэту написать такие строчки:
Добрый старый аммиак, Он богач, и он бедняк, Богат неподеленными своими электронами, Но только, вот беда, ему В растворе скучно одному. Он погулять готов всегда: Там кислота, а тут вода… Потом, обобранный до нитки, Он плачет: «Где мои пожитки? Какое это беззаконие: Стал катионом я аммония!»
Вывод: растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул аммиака связывать ионы водорода. Причина этого – наличие у атома азота свободной пары электронов, которая «перетягивает» протон водорода Н+ из молекул воды Н2О и соляной кислоты HCl.
Ребята, у меня в руках учебник химии за 1927 год. Его авторы советуют всегда держать дома склянку с нашатырным спиртом: «и для нейтрализации кислот, и для выведения жирных пятен, и в качестве самого дешевого и верно действующего огнетушителя».
Демонстрационный опыт 5
Аммиак – огнетушитель
В склянку с раствором аммиака опускаем горящую лучинку – наблюдаем, как она гаснет.
Итак, аммиак не горит!
А что такое горение? (Это окисление, процесс потери, отдачи электронов. У азота в молекуле аммиака электронов много, следовательно, сильный окислитель, такой, как кислород, может их отнять. Т. о., аммиак гореть должен!)
Решение проблемы:
Аммиак не горит в воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется.
Найдите в опорном конспекте уравнения химических реакций, иллюстрирующие данное свойство аммиака. Какие продукты образуются при горении аммиака без катализатора и в присутствии катализатора (губчатого железа). В каком случае аммиак теряет больше электронов и почему?
Греческий историк Страбон (64-20 годы до н.э.) писал о родственных друг другу порошках красного и черного цвета, которые «умелый ремесленник прокаливает в горне с углем и в красный металл превращает». Конечно, порошки эти – оксиды меди, а сам металл – медь. Интересно другое. Оказывается, любой современный мастер знает, что очистить медь паяльника от черного налета оксида меди (II) CuO можно с помощью нашатыря.
Лабораторный опыт № 2
Взаимодействие оксида меди (II) с нашатырем
Какое химическое превращение можно ожидать в данном случае?
При нагревании нашатырь разлагается с выделением аммиака, а уже аммиак (очень хороший восстановитель) взаимодействует с оксидом меди. Найдите в опорном конспекте уравнение этой химической реакции и запишите его в тетрадь.
Ребята, а как узнать аммиак, отличить его, не спутав при этом с другими веществами?
Конечно, по запаху. А ещё можно, как настоящий химик, провести качественные реакции. Качественные реактивы на аммиак знали ещё алхимики – это растворы сульфата меди (II) и сульфата кобальта (II).
Демонстрационный опыт 6
Качественные реакции на аммиак
При взаимодействии солей меди с аммиаком наблюдается васильковое окрашивание, а при взаимодействии солей кобальта с аммиаком – розовый цвет сначала переходит в синий, а потом в коричнево-желтый. Вещества, которые образуются при этом, имеют сложное строение, мы будем их изучать в старших классах.
В течение всего урока мы постоянно говорили и имели дело не только с самим аммиаком, но и с его солями, например, с хлоридом аммония (нашатырем). Соли аммония человек широко использует в быту и в технике. С одним способом их использования мы познакомились – очистка медных изделий (паяльников). Но есть и другие:
Бабушка всегда посоветует приложить к месту ожога крапивой или укуса насекомого примочку из нашатыря, потому что он нейтрализует кислоты;
Растения скажут вам «спасибо», если вы их подкормите раствором солей аммония;
Ваша мама печет пирожки, используя пекарский порошок, который содержит карбонат аммония.
Пользуясь опорным конспектом и Приложением 6, назовите другие области применения аммиака и его солей.
Оценочно-рефлексивный этап
Работа с тестами
Выводы по уроку
Домашнее задание: пользуясь материалами учебника и опорным конспектом, изучите строение молекулы аммиака и его свойства;
Творческое задание: придумайте рассказ-задачу по материалам урока.
Литература
1. Аликберова Л. Ю. Занимательная химия: Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 1999.
2. Алексинский В.Н. Занимательные опыты по химии: Книга для учителя. – М.: Просвещение, 1995.
3. Ахметов Н.С. Химия. 9 кл. – М.: Просвещение, 2002.
4. Иванова Р.Г. Химия. 8-9 кл. – М.: Просвещение, 2002-2003.
5. Книга для чтения по химии. Часть первая. Составили Парменов К.Я. и Сморгонский Л.М. – М.: Просвещение, 1955.
6. Лисичкин Г.В., Бетанели В.И. Химики изобратают: Кн. для учащихся. М.: Просвещение, 1990.
7. Инж. В.В. Рюмин. Занимательная химия: Опыты и развлечения из области химии. – Ленинград: Издательство «Время», 1927.
8. Сорокин В.В., Злотников Э.Г. Проверь свои знания: Тесты по химии: Книга для учащихся. – М.: Просвещение: Учеб. лит., 1997.
9. Что мы знаем о химии? Вопросы и ответы: Справ. пособие / Ю.Н. Кукушкин, В.Ф. Буданова, Р.А. Власова и др.: Под ред. Ю.Н. Кукушкина. – М.: Высш. школа, 1993.