Синтез изоамилового эфира уксусной кислоты реакцией этерификации (гидролиза) сложных эфиров
СОДЕРЖАНИЕ: Свойства изоамилацетата. Практическое применение в качестве растворителя в различных отраслях промышленности. Методика синтеза (уксусная кислота и уксуснокислый натрий). Реакция этерификации и гидролиз сложных эфиров. Механизм реакции этерификации.Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ИЗОАМИЛОВОГО ЭФИРА УКСУСНОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1. Свойства изоамилацетата
1.2. Практическое применение
1.3.Методика синтеза
Способ 1 (исходя из уксусной кислоты)
Способ 2 (исходя из уксуснокислого натрия)
2.Литературный обзор.
2.1. Реакция этерификации и гидролиз сложных эфиров
2.2.Механизм реакции этерификации
3. Выводы
Список литературы
1. Введение
1.1. Свойства изоамилацетата
Изоамилацетат(изоамиловый эфир уксусной кислоты) (СН3 )2 СНСН2 СН2 ОСОСН3 , молекулярная масса 130,18; бесцветная жидкость с резким фруктовым запахом, напоминающим запах груш (порог запаха 6.10-7 г/л); температура плавления – 78,5°С, температура кипения 142°С; d4 20 = =0,8719; nD 20 =1,4053; давление пара 733,3 Па (20°С); C0 p =250,27 кДж/моль (20 °С); растворим в органических растворителях, растворимость в воде 2% по массе (25 °С). Образует азеотропную смесь с водой (63,7% изоамилацетата; температура кипения 93,6 °С). Обладает всеми химическая свойствами эфиров сложных. Получают взаимодействия изоамилового спирта с уксусной кислотой в присутствии концентрированной H2 SO4 . Температура вспышки 36 °С, температура самовоспламенения 430 °С, КПВ 0,2-4,4%, температурные пределы взрываемости 3-57°С. Оказывает вредное действие на центр. нервную систему; ЛД50 5 г/кг (кролики, перорально); ПДК 100 мг/м3 .
1.2. Практическое применение
Изоамилацетат широко применяется в качестве растворителя для нитроцеллюлозы в лакокрасочной, кожевенной и других отраслях промышленности, в производстве кинопленки, целлулоида и так далее; очень широкая область применения изоамилацетата в пищевой промышленности (ранее был известен как грушевая эссенция) в производстве фруктовых вод, карамели и др.
Хотя до сих пор до конца не раскрыта природа запахов, сегодня трудно представить парфюмерно-косметическую и пищевкусовые отрасли без применения душистых веществ и ароматизаторов. В настоящее время в мире выпускается около 850 наименований душистых веществ, получаемых либо синтетическим путем, либо выделяемых из натуральных масел. И несмотря на предвзятое отношение к синтетике, их потребление в парфюмерии и косметике в 5-6 раз превышает потребление натуральных продуктов.
Современная ситуация на Российском рынке синтетических душистых веществ (СДВ) сложилась таким образом, что львиная доля всей продукции поступает из-за рубежа и, учитывая тот факт, что в стране практически отсутствует конкуренция, для отечественных производителей сложилась весьма благоприятная ситуация.
Калужский комбинат СДВ, созданный в 1948 году, в свое время был монополистом по производству СДВ и прочих сопутствующих продуктов. К 1967 году это уже крупнейшее в Европе предприятие по производству душистых веществ, различных ингредиентов для парфюмерно-косметического производства, предприятий бытовой химии, кондитерской, медицинской, фармацевтической промышленности и т.д. Кроме поставок СДВ на внутренний рынок (75% душистых веществ производимых в стране), комбинат экспортировал около 30 наименований продукции в 15 стран мира в количестве более 200 т/год. К 1991 году, при численности работающих около 2300 человек, выпускалось более 4 тыс.т/год продукции восьмидесяти наименований. Анализируя ситуацию, которая сложилась в настоящее время, напрашивается вывод, что основной (в техническом плане) причиной остановки и закрытия большинства производств на комбинате в постперестроечный период явилось то, что ни один процесс не представлял собой полную технологическую цепочку, которая основывалась бы на каком-либо базовом сырье (то есть базовом продукте основного органического или нефтехимического синтеза). Иными словами все процессы представляли собой либо специальную очистку какого-нибудь технического продукта или же, в лучшем случае, какие-то отдельные стадии сложных органических производств, а иногда и просто процессы смешения нескольких отдельно взятых компонентов. Такая система производства идеально подходила для плановой системы хозяйства, когда существовала четкая интеграция в рамках всей страны. После развала всей этой громадной структуры, естественно, все эти процессы, а точнее сказать, полупроцессы, оказались просто неконкурентоспособными. Также необходимо отметить, что практически все технологические цепочки (во всяком случае на момент апреля месяца 2004 года) оказались, мягко говоря, разукомплектованными.
Исходя из вышеизложенного, стояла задача создать ситуацию, при которой появилась бы возможность реанимации или частичного восстановления предприятия. Она заключалась в быстром внедрении или восстановлении тех производств, которые, во-первых, не требуют особых капиталовложений, во-вторых, продукция которых реально востребована на рынке и, в третьих, являются технически приемлемыми в данных условиях.
Изоамилацетат – находит применение в качестве растворителя в лакокрасочной промышленности, применяется также в пищевой промышленности и при производстве отдушек (высший сорт). Производится этерификацией уксусной кислоты изоамиловым спиртом. Мощность производства на ОАО «Аромасинтез» около 50 т/год.
Таким образом, обобщая вышесказанное, можно констатировать, что, используя новые подходы и технологии, существует возможность возрождения хотя бы части производств СДВ, имеющих массовое потребление, что станет основой весьма перспективного направления малотоннажной химии.
1.3. Методика синтез а
Способ 1 (исходя из уксусной кислоты)
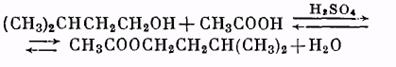
Реактивы:
Уксусная кислота ледяная ……….............20 мл (0,35 г-мол)
Изоамиловый спирт....................................30 г (0,34 г-мол)
Серная кислота ( d 1,84). Сода 10%-ный раствор. Сернокислый натрий
Виды приборов для синтезов с азеотропной отгонкой воды: а – с холодильником Либиха, б – с шариковым холодильником, 1 – реакционная колба, 2 – двурогий форштосс, 3 – капельная воронка, 4 – «ловушка» для воды, 5 – обратный холодильник.
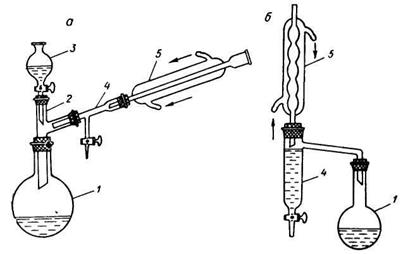
Синтез проводят в приборе, изображенном на рисунке. В круглодонную колбу емкостью 100 мл помещают смесь из 20 мл ледяной уксусной кислоты (или соответствующее количество 80%-ной кислоты) и 30 г изоамилового спирта, прибавляют 2 мл концентрированной серной кислоты (катализатор). Колбу соединяют посредством двурогого форштоса с обратным холодильником, между ними помещают «ловушку» для воды, образующейся при реакции. Смесь нагревают на песчаной бане. В «ловушке» собираются вода и спирт, которые образуют два слоя. Верхний спиртовый слой должен свободно переливаться через края ловушки, возвращаясь в сферу реакции. Когда воды в ловушке накопится столько, что появится опасность ее попадания в реакционную колбу, воду сливают в мерный цилиндр и измеряют ее объем. Реакция считается законченной, когда количество воды в «ловушке» перестанет увеличиваться. Полученный эфир охлаждают до комнатной температуры и промывают (в делительной воронке) сначала водой, затем раствором соды до нейтральной реакции по лакмусу и вновь водой. Отделив эфир от водного слоя, высушивают его прокаленным сернокислым натрием и перегоняют из колбы с дефлегматором. Главную фракцию собирают при 138° С.
Выход около 30 г (70% теоретического). Чистый уксусноизоамиловый эфир имеет т. кип. 142°С, ![]() .
.
Способ 2 (исходя из уксуснокислого натрия)
Реактивы:
Изоамиловый спирт .................25 г (0,28 г-мол)
Уксуснокислый натрий безводный...........25 г (0,30 г-мол)
Серная кислота ( d 1,84) Сода 10%-ный раствор. Хлористый кальций.
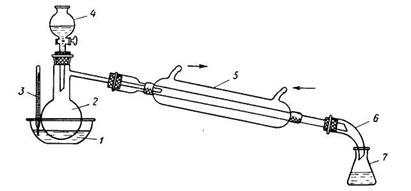
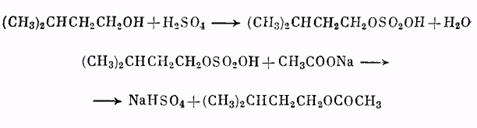
1 — баня; 2 — реакционная колба; 3 — термометр; 4 — капельная воронка; 5 —холодильник; 6 — алонж; 7 — приемник.
Синтез проводят в приборе, изображенном на рис. 41. В колбу Вюрца емкостью 150 мл, снабженную капельной воронкой и соединенную с нисходящим холодильником, помещают 25 г растертого в порошок безводного уксуснокислого натрия (примечание 1). Из капельной воронки понемногу приливают смесь из 25 г изоамилового спирта и 25 г (13,5 мл) концентрированной серной кислоты (примечание 2). При этом колбу непрерывно нагревают на масляной бане при 150°С (термометр опущен в баню). По окончании реакции и прекращении отгонки дистиллята верхний слой (смесь уксусноизоамилового эфира и изоамилового спирта) отделяют в делительной воронке, промывают раствором соды, затем два раза водой, высушивают хлористым кальцием и перегоняют из колбы с дефлегматором, отбирая фракции: 1) до 138°С, 2) 138—142°С. 2-я Фракция представляет собой уксусноизоамиловый эфир. Выход 24 г (67% теоретического). Чистый уксусноизоамиловый эфир имеет т. кип. 142°С, ![]() .
.
ПРИМЕЧАНИЯ.
1. Для получения безводного уксуснокислого натрия нагревают 50 г кристаллической соли в плоской железной чашке. Сначала соль плавится в кристаллизационной воде, а после испарения воды затвердевает. При дальнейшем нагревании безводную соль расплавляют, несколько охлаждают, вынимают из чашки затвердевшую и еще теплую соль, растирают ее в порошок и ссыпают в склянку с притертой пробкой. Если имеется продажная безводная соль, то ее переплавляют еще раз.
2. При смешении изоамилового спирта с серной кислотой образуется изоамилсерная кислота; серную кислоту приливают постепенно к спирту при размешивании.
2. Литературный обзор .
2.1. Реакция этерификации и гидролиз сложных эфиров
Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров:
![]()
В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего бедный электронами углеродный атом карбонильной группы.
Реакции этерификации обратимы и, следовательно, ограничены состоянием равновесия. Превращение эквимолекулярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира по причине обратимости реакции невозможно. В результате реакции образуется некоторое максимальное количество эфира (которое всегда ниже теоретического) и остаются непрореагировавшие спирт и кислота. Например, при нагревании с обратным холодильником эквимолекулярных количеств уксусной кислоты и этилового спирта в реакцию вступает лишь 2/3 г-мол каждого компонента, поэтому максимальный выход эфира в этих условиях составляет лишь 2/3 теоретического, т. е. 66,7%.
![]()
По мере того как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (эфира и воды), скорость обратной реакции, вначале незначительная, возрастает. При этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько же молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Одинаковой скоростью этих противоположно протекающих процессов обусловлен постоянный состав системы. Поскольку скорость бимолекулярной реакции пропорциональна произведению концентраций реагирующих веществ, мы можем для скоростей прямой и обратной реакций написать уравнения:
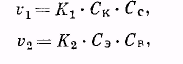
где v 1 — скорость реакции этерификации; v 2 — скорость реакции гидролиза; К1 и К2 — константы скорости обеих реакций; Ск , Сс , Сэ и Св — концентрации реагирующих и получающихся веществ (кислоты, спирта, эфира, воды).
В состоянии равновесия скорости реакций, протекающих в противоположных направлениях, равны, т. е. V 1 = V 2 . Тогда К1 Ск Сс = Кг Сэ Св или:
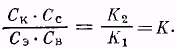
Частное К2 /К1 является константой равновесия и обозначается буквой К.
Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому
![]()
Однако можно изменить состояние равновесия и повысить выход сложного эфира, увеличивая концентрацию спирта (или кислоты). Например, если взять уксусную кислоту и спирт в молярном отношении, равном 1:2, выход эфира (из расчета на кислоту) повышается до 85%. Действительно, пусть концентрация эфира в состоянии равновесия (в молях) будет равна х, т. е. Сэ = х. Тогда и Св = х. Концентрация кислоты Ск = 1—х, концентрация спирта Сс = 2 — х. Следовательно,
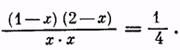
После решения этого уравнения находим, что х = 0,85 моля, то есть выход эфира равен 85% теоретического.
Часто применяется и другой способ смещения равновесия в сторону большего выхода сложного эфира — удаление сложного эфира или воды из сферы реакции. Легко можно видеть, что уменьшение концентраций эфира или воды влечет уменьшение концентраций спирта и кислоты, поскольку величина константы равновесия К при данной температуре неизменна. Так, в случае получения низкокипящих сложных эфиров (например, уксусно-этилового с температурой кипения 77°С) в ходе реакции отгоняют эфир из реакционной колбы. При получении высококипящих сложных эфиров (например, уксуснобутилового с температурой кипения 125°С или уксусноизоамилового с температурой кипения 142°С) удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропа с парами соответствующего спирта. При конденсации паров в холодильнике происходит расслоение этих ограниченно смешивающихся жидкостей и вода, как более тяжелая, собирается на дне поставленной на пути конденсата «ловушки» (см. рис. 27). Азеотропную отгонку воды можно использовать и в случае этерификации кислот этиловым или пропиловым спиртом, которые в жидкой фазе смешиваются с водой во всех отношениях. В этом случае для отделения воды от сконденсировавшегося в холодильнике спирта в реакционную смесь приходится добавлять третий компонент, образующий с водой и спиртом нераздельно кипящую смесь, но в жидкой фазе с водой не смешивающийся. Его роль состоит в том, что он экстрагирует из конденсата спирт и возвращает его в реакционный сосуд. В качестве такого компонента могут использоваться бензол, хлороформ, четыреххлористый углерод и некоторые другие жидкости, но из перечисленных только бензол можно использовать в «ловушках». Хлороформ и четыреххлористый углерод обладают большей плотностью, чем вода, и для отделения воды от реакционной смеси в случае использования этих жидкостей требуется «ловушка» другой конструкции.
При комнатной температуре реакция протекает очень медленно. При смешении эквимолярных количеств спирта и кислоты для достижения равновесных концентраций требуется до 16 лет. Повышение температуры ускоряет реакцию (так, в случае взаимодействия этилового спирта с уксусной кислотой при 110° С равновесие достигается через 10 дней, а при (155° С — через несколько часов).
Особенно сильное ускорение реакции этерификации достигается применением катализаторов — водородных ионов, получающихся при диссоциации сильных минеральных кислот. В качестве катализаторов чаще всего используются концентрированная серная кислота или сухой хлористый водород, ток которого пропускается через реакционную смесь. Найдено, что скорость реакции возрастает с увеличением количества катализатора; однако известно также, что добавка 0,01% серной кислоты достаточна для образования этилацетата из спирта и уксусной кислоты. Следует иметь в виду, что катализаторы повышают скорость реакции этерификации, но не могут вызывать сдвига равновесия.
Карбоновые кислоты, как видно из вышесказанного, реагируют со спиртами относительно медленно. Это объясняется слабой активностью карбонильной группы в кислотах по отношению к нуклеофильным агентам по сравнению с активностью той же группы в ангидридах и хлорангидридах кислот, поскольку +М -эффект гидроксильной группы приводит к уменьшению положительного заряда карбонильного углерода
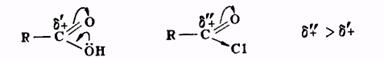
Скорость этерификации карбоновой кислоты тем выше, чем больше положительный заряд карбонильного углерода. Величина + на углероде карбоксильной группы зависит от характера радикала кислоты. Электронодонорные группы, связанные с карбоксилом, понижают дробный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем препятствуют взаимодействию кислоты с нуклеофилом; электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной. Поэтому кислоты типа трихлоруксусной, щавелевой, муравьиной быстро реагируют со спиртами даже без добавок минеральной кислоты-катализатора, а ароматические кислоты, особенно те, которые в ароматическом ядре содержат электронодонорные заместители, взаимодействуют со спиртом значительно труднее и требуют больших количеств катализатора.
Сильное влияние на скорость реакции этерификации оказывают также пространственные факторы. С увеличением объема связанных с карбоксилом углеводородных радикалов и с повышением объема этерифицируемых спиртов скорость этерификации уменьшается. Среди спиртов одного молекулярного веса быстрее всего взаимодействуют с кислотами первичные, медленнее — третичные спирты.
Реакцию этерификации можно проводить и в паровой фазе над твердыми катализаторами. Пары спирта и кислоты при 280—300° С пропускают через трубку с катализатором (ThO2 или TiO2 ). Выходы сложных эфиров в этом случае такие же, как и при реакциях в гомогенной фазе.
Аминокислоты образуют сложные эфиры при взаимодействии со спиртами в присутствии сухого хлористого водорода. Роль хлористого водорода здесь не ограничивается катализом реакции или сдвигом равновесия за счет связывания воды. В присутствии хлористого водорода аминокислота, находившаяся ранее в форме внутренней соли, превращается в хлористоводородную соль аминокислоты, причем карбоксильная группа из неактивной формы аниона переходит в реакционноспособную форму —СООН:
![]()
В результате этерификации в этих условиях эфиры также получаются в виде солей. Например, из аминоуксусной кислоты (гликоколя) и абсолютного этилового спирта образуется хлористоводородная соль эфира гликоколя
![]()
Свободный эфир из соли можно получить, удаляя хлористый водород окисью серебра:
![]()
2.2. Механизм реакции этерификации
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
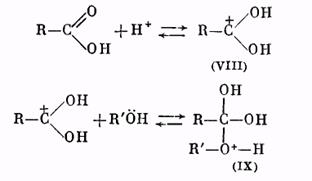
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
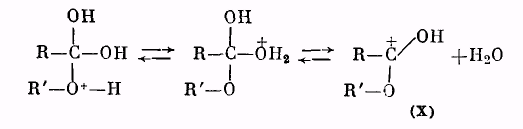
Катион (X) в результате отщепления протона образует молекулу сложного эфира:
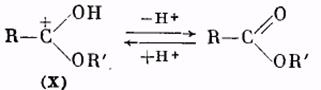
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18 . Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2 О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
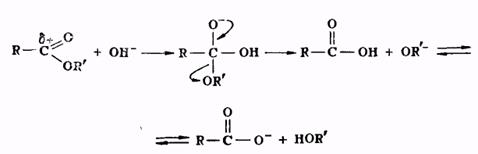
Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2 , Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
Список литературы
1. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
2. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
3. Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4. Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6. Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7. Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8. Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9. Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
11. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
12. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13. Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.